黄芪甲苷新型给药系统的研究进展
2023-09-13罗开沛江英杰徐梦涵杨文博
罗开沛,江英杰,徐梦涵,杨文博,杨 露
黄芪甲苷新型给药系统的研究进展
罗开沛1,江英杰2,徐梦涵2,杨文博2,杨 露3*
1. 成都中医药大学 西南特色中药资源国家重点实验室,四川 成都 611137 2. 成都中医药大学药学院,四川 成都 611137 3. 成都中医药大学中医药创新研究院,四川 成都 611137
黄芪甲苷是“补气之圣药”黄芪的活性成分之一,具有抗炎、抗纤维化、抗氧化应激、抗哮喘、抗糖尿病、抗肿瘤、调节免疫和保护心脏等多种药理作用。然而,黄芪甲苷水溶性差、生物利用度低及病灶组织靶向性不足,极大地限制了开发应用。相较于传统制剂,新型递药系统能延长药物循环时间、控制药物释放、增加药物在病变部位的富集量,进而提高生物利用度,改善靶向性,增强疗效。通过对黄芪甲苷新型给药系统(单一给药系统及复合给药系统)的研究进展进行综述,并阐述其对多种疾病的治疗作用,探讨递药系统目前存在的问题及可能的应对策略,为黄芪甲苷新型制剂的开发及临床应用提供思路。
黄芪甲苷;新型给药系统;生物利用度;溶出度;治疗效果;临床转化
黄芪甲苷又称黄芪皂苷IV,是从豆科黄芪属植物黄芪中分离提取的天然皂苷类化合物(图1),也是黄芪发挥药效的主要物质基础[1]。研究表明,黄芪甲苷可调节信号传导途径发挥多种药理作用,包括抗炎、抗纤维化、抗氧化应激、抗哮喘、抗糖尿病、抗肿瘤、调节免疫和保护心脏等药理作用[2-4]。但黄芪甲苷在水中溶解度仅有0.05 mg/mL,水溶性差;此外,口服给药后,生物利用度为7.4%[5-6],而静脉注射后,比格犬的半衰期为50.2~68.8 min,生物利用度低,并且在肾脏、肺、脾脏、肝脏、十二指肠、肌肉、皮肤等部位均有分布,无特定的组织靶向性[7],这些缺陷限制了黄芪甲苷的开发应用。
图1 黄芪甲苷的化学结构
新型递送系统能提高药物生物利用度、增加药物在病变组织的积聚、控制药物释放等,从而增强治疗效果[8-11]。研究者相继开发了不同的黄芪甲苷递送系统(图2),包括单一给药系统如纳米混悬剂、聚合物胶束、静电纺丝纳米纤维、金属有机框架、外泌体等,及由2种及以上系统组成且能充分发挥各系统优势而进一步提高疗效的复合给药系统[12-13],如纳米粒-凝胶、脂质体-静电纺丝纤维、介孔硅-黑磷纳米片等,有效提高了黄芪甲苷的生物利用度和治疗效率。本文对黄芪甲苷新型递送系统的研究进展进行综述,同时总结其在不同疾病中的应用,为黄芪甲苷的深入研究和临床应用提供有益参考。
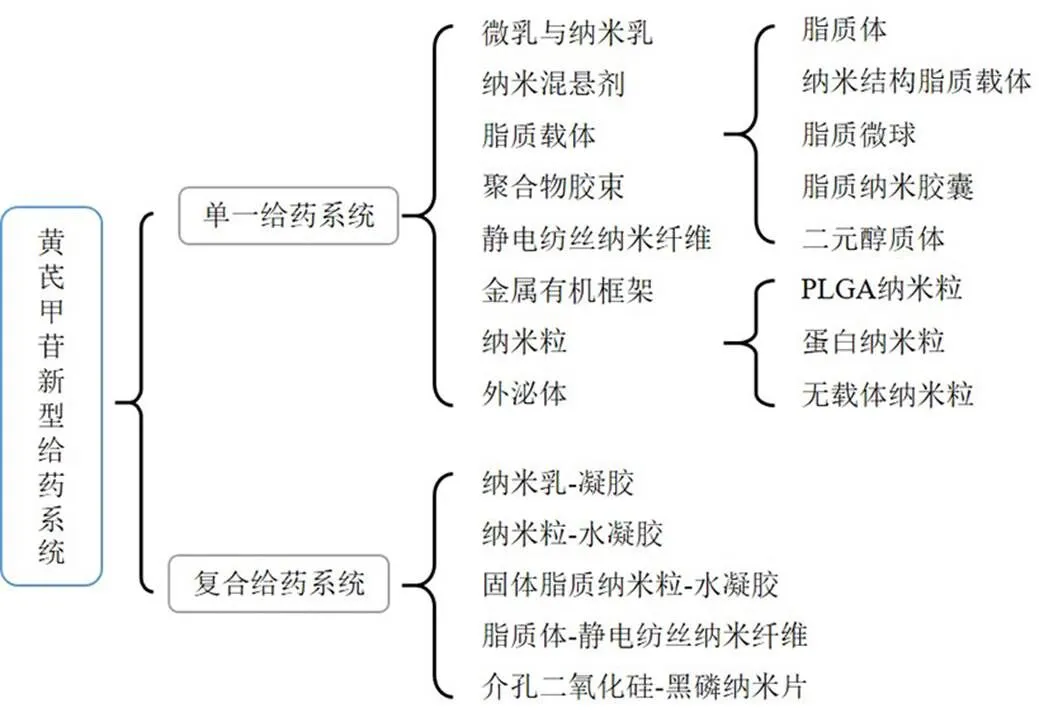
图2 不同类型的黄芪甲苷新型给药系统
1 黄芪甲苷单一给药系统
1.1 微乳与纳米乳
微乳是由水相、油相和乳化剂混合后自发形成的透明且热力学稳定的胶体体系,可用于亲脂性药物的递送,改善其溶解度[14]。李霞等[15]将微乳作为载体,构建了丹参酮IIA-黄芪甲苷微乳。在细胞实验中,药物质量浓度为15.6~250.0 μg/mL时,丹参酮ⅡA-黄芪甲苷微乳处理的小鼠血管内皮bEnd.3细胞存活率可达80%,而在质量浓度为500 μg/mL时,对小鼠肝癌H22细胞产生了明显抑制作用。
根据乳滴的粒径大小,微乳可分为亚微乳和纳米乳,其中纳米乳粒径为10~200 nm,稳定性和生物利用度较高[16]。郁梅[17]利用伪三元相图法优化了黄芪甲苷纳米乳处方,最终确定处方比例为卵磷脂-聚山梨酯80-无水乙醇-肉豆蔻酸异丙酯-水为4.8∶19.2∶12.0∶4.0∶60.0,为后续药理学和药动学研究奠定了基础。陈筱瑜等[18]以平均粒径、多分散指数和载药量为指标,采用单纯形网格法优化黄芪甲苷纳米乳处方。透皮实验发现,该纳米乳的皮肤滞留量是黄芪甲苷混悬水溶液的8.8倍,表明纳米乳能有效提高黄芪甲苷的皮肤滞留量,延缓皮肤光老化。
1.2 纳米混悬剂
纳米混悬剂是将药物分散于液体形成的胶态分散体系。由于较大的表面积和较小的粒径,纳米混悬剂可提高药物的溶出度和生物利用度[19]。姜佳琦等[20]利用高压均质结合高速均质法制备了黄芪甲苷纳米混悬剂。在药效学实验中,黄芪甲苷纳米混悬剂抗胃黏膜损伤作用优于原料药,其原因可能是纳米混悬剂易于透过黏膜屏障及易黏附于胃黏膜,延长了药物在体内的停留时间。
1.3 脂质载体
1.3.1 脂质体 脂质体是由类脂质双分子定向排列而成的微型泡囊体,能增加药物在靶组织中的蓄积量,实现药物控释等。贺艳[21]构建了奥希替尼-黄芪甲苷共载脂质体,透射电镜观察呈球形结构,并具有较好的稳定性和明显的缓释作用,共载脂质体可显著抑制人肺腺癌NCI-H1975细胞和奥希替尼耐药NCI-H1975/OSIR细胞的增殖,及荷瘤小鼠肿瘤的生长。
阿霉素是抗肿瘤一线化疗药物,但存在多药耐药性问题[22]。研究发现,黄芪甲苷既能逆转肿瘤细胞对阿霉素的耐药性,还能产生协同治疗作用[23-24]。王成祥等[25]优化了共载阿霉素-黄芪甲苷脂质体处方工艺,测得阿霉素和黄芪甲苷的载药量分别为(4.62±0.02)%和(14.45±0.04)%。岳贵娟等[26]构建了阿霉素-黄芪甲苷共载脂质体,并评价了其对人乳腺癌阿霉素耐药MDA-MB-231/DOX细胞的逆转作用,结果表明游离阿霉素/黄芪甲苷的半抑制浓度(half maximal inhibitory concentration,IC50)为(0.277±0.003)μmol/L,而共载脂质体的IC50下降为(0.238±0.007)μmol/L,表明共载脂质体可有效逆转耐药细胞对阿霉素的耐药性。
与传统脂质体相比,配体修饰的脂质体具有更优的靶向性。由于叶酸受体在肿瘤细胞表面高表达,因此小分子叶酸可作为配体增强脂质体的肿瘤靶向性[27]。八精氨酸多肽是一种具有跨膜性的细胞穿透肽,可促进细胞摄取,实现药物高效递送[28]。基于此,Yue等[29]构建了叶酸和八精氨酸双修饰的新型靶向脂质体,用于共递送阿霉素和黄芪甲苷。这种设计提高了脂质体的肿瘤靶向能力和细胞摄取能力,显著抑制了MDA-MB-231/DOX细胞的增殖及体内肿瘤的生长。杨婉露[30]通过乙醇注入法构建了乳铁蛋白修饰的黄芪甲苷脂质体,表现出良好的缓释性能。药动学研究表明,与游离黄芪甲苷相比,修饰脂质体延长了黄芪甲苷在体内的循环时间,有效提高了生物利用度。
1.3.2 纳米结构脂质载体 纳米结构脂质载体是由固体脂质和液体脂质组成的脂质给药系统。除了具有药物溶解度增加、机体滞留时间延长等优点,还具有灵活的药物释放调节性[31]。陈敏燕等[32]发现,黄芪甲苷原料药在3 h内即达到了溶出平衡(累计释放率为31.4%),而构建的黄芪甲苷纳米结构脂质体的释放延长至36 h,累积释放率达72.8%。在药效学实验中,黄芪甲苷纳米结构脂质体增强了黄芪甲苷的抑瘤效果。
1.3.3 脂质微球 脂质微球是将药物溶于脂肪油,经磷脂膜包被,再乳化分散于水相制成的微粒分散体系。刘爱娜等[33-34]先用磷脂分子制成黄芪甲苷磷脂复合物,再制备了黄芪甲苷脂质微球注射液,结果发现磷脂用量为1.2%时,黄芪甲苷脂质微球的包封率达到80%以上,黄芪甲苷脂质微球在40 ℃避光放置10 d、4 ℃避光放置6个月均稳定。
1.3.4 脂质纳米胶囊 脂质纳米胶囊是由“核”油相和“壳”表面活性剂组成的新型系统[35]。Sun等[36]制备了粒径为19.88、49.39、92.89 nm的黄芪甲苷脂质纳米胶囊,用于老年性黄斑变性治疗,结果发现,不同粒径的黄芪甲苷脂质纳米胶囊在48 h内药物释放率均达到80%,但粒径最小的脂质纳米胶囊治疗作用最强,能将细胞凋亡率从对照组的5.12%降至0.53%,并可保护视网膜的形态和功能。
1.3.5 二元醇质体 醇质体是一种含有高浓度低分子醇,呈囊泡结构的给药载体。与之不同的是,二元醇质体还含有胆固醇和赋予脂质双层膜弹性的增塑剂,能增加药物透皮深度和皮肤内的药物滞留量[37]。吴少媛等[38]采用星点设计-响应面法优化了黄芪甲苷二元醇质体处方,结果发现黄芪甲苷二元醇质体呈球形或类球形,在4 ℃稳定性良好。
1.4 聚合物胶束
聚合物胶束是由高分子材料组装而成的两亲性聚合物,可负载疏水性药物,以增强药物稳定性和主动靶向性,并降低药物不良反应[39]。黄昭峰等[40]将Pluronic F127和-α-维生素E聚乙二醇琥珀酸酯形成的复合胶束为载体,构建了黄芪甲苷纳米胶束,在人结直肠腺癌Caco-2细胞单层渗透性实验中,黄芪甲苷原料药易被外排,而黄芪甲苷纳米胶束能促进药物吸收,减少药物外排。杨珂等[41]将黄芪甲苷负载于三苯基膦修饰的聚乙二醇-聚丙交酯乙交酯纳米胶束中,构建了线粒体靶向的黄芪甲苷胶束,并考察了药物的释放特性和治疗作用。发现黄芪甲苷靶向胶束在72 h释放率达到80%,实现“心脏-线粒体”的双重靶向,提高了黄芪甲苷的生物利用度和心脏保护活性。Xi等[42]制备了阿仑膦酸盐修饰的黄芪甲苷骨靶向胶束,药动学结果显示,与游离黄芪甲苷相比,骨靶向胶束的相对生物利用度提高至233.9%。此外,骨靶向胶束具有良好的骨组织靶向能力,且能降低血清骨代谢相关指标水平,恢复骨微结构,显示出优异的骨质疏松症治疗作用。
1.5 纳米粒
1.5.1 聚乳酸羟基乙酸共聚物[poly(,-lactide- co-glycolic acid),PLGA] 纳米粒 质量源于设计(quality by design,QbD)是通过药品的设计与研发来预测确定药品质量来达到优化药物输送系统效果的一种方法[43]。PLGA是一种具有生物降解性、安全性与生物相容性的高分子聚合物,可形成纳米粒延长药物的作用时间,增强药物稳定性等[44]。李姿锐等[45]基于QbD理念,通过乳化溶剂挥发法制备了黄芪甲苷纳米粒。研究发现其体外释药行为符合Riger-Peppas释药方程模型,有望提高对缺血性心脏病的疗效。
1.5.2 蛋白纳米粒 自然界中存在大量的植物蛋白,部分蛋白如提取过程中的中药蛋白可自发组装形成纳米颗粒[46-47]。Zhou等[48]研究发现,甘草经提取后可形成粒径为(74.1±0.7)nm的蛋白纳米粒,可作为天然药物载体。因此研究者进一步构建了黄芪甲苷蛋白纳米粒,发现其粒径与甘草蛋白纳米粒接近,使黄芪甲苷的溶解度提高了5倍。
1.5.3 无载体纳米粒 Chen等[49]基于超临界反溶剂法制备了无载体黄芪甲苷纳米粒,纳米粒中药物的状态由结晶形式变为无定形形式。药物释放研究表明,无载体黄芪甲苷纳米粒的释放度明显提高,可能是由于粒径减小和结晶度改变所致。体外抗肿瘤实验发现,黄芪甲苷纳米粒比游离药物表现出更有效的细胞增殖抑制作用。
1.6 静电纺丝纳米纤维
静电纺丝是近年来制备纳米纤维材料的一种新技术,已被广泛应用于各大领域,尤其是生物医学工程和药物传递[50]。丝素蛋白是从蚕丝中提取的天然蛋白,具有良好的生物相容性和生物降解性[51]。明胶是一种天然可降解的水溶性蛋白质,因其降解速度快而应用于生物医用领域[52]。单颖慧[53]以丝素蛋白和明胶为载体,利用静电纺丝技术制备了黄芪甲苷纳米纤维敷料。该纳米纤维敷料可抑制成纤维细胞中α平滑肌肌动蛋白的表达,抑制疤痕增生。Shan等[54]优化了丝素蛋白和明胶的比例25∶75,制备的黄芪甲苷静电纺纳米纤维可显著促进细胞黏附和增殖,加速伤口愈合,抑制体内瘢痕形成。在此基础上,Zhang等[55]进一步研究发现,黄芪甲苷静电纺纳米纤维能促进伤口愈合,并可通过调节胶原蛋白的排列、促进血管生成、增加伤口免疫功能而抑制瘢痕形成。
1.7 金属有机骨架
金属有机骨架是一类二维或三维多孔晶体材料,具有多孔结构和均匀催化位点,可实现多种药物的负载[56]。李霞等[15]制备了丹参酮IIA-黄芪甲苷金属有机骨架,并研究其对血管内皮细胞、T淋巴细胞和肝癌细胞增殖能力的影响,结果发现丹参酮IIA-黄芪甲苷金属有机骨架3.9 μg/mL时,可显著抑制bEnd.3细胞的增殖,而在3.9~62.5 μg/mL,可促进小鼠T细胞CTLL-2细胞的生长。
1.8 外泌体
外泌体是由细胞分泌的一种生物细胞外囊泡,直径约为50 nm。作为一种内源性天然载体,外泌体具有优异生物相容性、渗透性和低毒性,可用于药物和基因的传递[57]。Zou等[58]制备了内皮祖细胞衍生的黄芪甲苷外泌体,用于改善糖尿病并促进血管生成,细胞染色结果表明,高糖诱导的人脐静脉内皮HUVEC细胞能有效摄取黄芪甲苷外泌体。此外,黄芪甲苷外泌体还能减轻细胞损伤作用,并促进血管生长相关蛋白的表达。
黄芪甲苷新型单一给药系统的制备、性质及结果见表1。
2 黄芪甲苷复合给药系统
2.1 纳米乳-凝胶
凝胶可增加制剂黏度和生物黏附性,从而延长药物在眼部的停滞时间,提高疗效。许凯[59]将纳米乳作为黄芪甲苷的核心载体,构建了黄芪甲苷纳米乳-眼用凝胶,观察其对大鼠干性年龄相关性黄斑变性(age-related macular degeneration,AMD)眼病的保护作用,结果发现黄芪甲苷纳米乳-眼用凝胶可有效保护干性AMD大鼠的视网膜,改善视网膜功能和病理组织损伤,并抑制视网膜细胞的凋亡,修复线粒体DNA损伤。
2.2 纳米粒-水凝胶
Chen等[60]首先采用疏水自组装法制备了黄芪甲苷纳米粒,再将其与金纳米棒负载于由聚乙二醇二丙烯酸酯、4-乙烯基苯硼酸和硫醇透明质酸组成的水凝胶中,体外研究表明,该凝胶系统表现出与天然心脏相似的导电性,并具有良好的药物释放特性。体内研究发现,黄芪甲苷纳米粒-水凝胶有效抑制了大鼠心肌梗死后的左心室重塑和心肌功能障碍,并促进了梗死边缘血管生成,减少细胞凋亡,增加间隙连接蛋白43的表达。
2.3 固体脂质纳米粒-水凝胶
基于固体脂质纳米粒的药物高渗透性和药物缓释性优势,Chen等[61]制备了新型固体脂质纳米粒-水凝胶来递送黄芪甲苷。在48 h时,固体脂质纳米粒和固体脂质纳米粒-水凝胶中黄芪甲苷累积释放率分别为80%和70%,表明水凝胶有效延缓了药物的释放。在体内研究中,与黄芪甲苷固体脂质纳米粒相比,固体脂质纳米粒-水凝胶复合系统显著促进了伤口愈合,并抑制了瘢痕形成。
表1 黄芪甲苷新型单一给药系统的制备、制剂性质及结果研究
Table 1 Preparation, pharmaceutical characters and results of astragaloside IV-loaded single drug delivery systems
载体形式药物制备方法平均粒径/nm电位/mV包封率/%结果文献 微乳丹参酮IIA-黄芪甲苷自发乳化法47.6±0.7−14.70±0.49——15 纳米乳黄芪甲苷自发乳化法20.7±0.2——黄芪甲苷的皮肤滞留量显著提高18 纳米混悬剂黄芪甲苷高速均质结合高压均质法195.2±14.9——延长药物在体内的停留时间,推测溶解能力和生物利用度有所提高20 脂质体奥希替尼-黄芪甲苷乙醇注入-硫酸铵梯度法96.9±12.0—89.74±6.5324 h累积释放约为60%,表现出缓释特性21 盐酸阿霉素-黄芪甲苷乙醇注入-硫酸铵梯度法102.6±0.2−11.20±1.3599.37±0.08明显改善药物的生物利用度等25 黄芪甲苷乙醇注入-硫酸铵梯度法109.0±6.1−15.9±1.798.49肿瘤靶向和抗肿瘤效果显著29 黄芪甲苷乙醇注入法138.6±0.1−23.10±1.5371.61±0.43黄芪甲苷作用时间延长,生物利用度提高30 纳米结构脂质载体黄芪甲苷高压均质法136.7±5.2−21.2±0.783.50±1.57显著提高药物的体外溶出度且具有明显的缓释效果32 脂质微球黄芪甲苷高压均质法166.3−2989血药浓度略高于黄芪甲苷溶液剂33-34 脂质纳米胶囊黄芪甲苷相反转方法19.88−1.51>9048 h内释放率约为80%,并达到平稳期36 二元醇质体黄芪甲苷注入法227.0±5.0−21.06±0.3286.28±0.03—38 聚合物胶束黄芪甲苷冷冻干燥-水化法36.4±2.3—98.4±1.5显著提高药物渗透性,有望提高生物利用度40 黄芪甲苷纳米沉淀法158.8—84.32具有缓释效果,72 h释放率约为80%;生物利用度显著改善41 黄芪甲苷自组装45.3±3.823.02±0.5196.16±0.18具有缓释效果;与游离药物相比,制剂的相对生物利用度为233.90%42 PLGA纳米粒黄芪甲苷溶剂挥发法112.8±4.6−29.77±1.4068.86±2.9012 h时累积溶出57.59%,具有一定的缓释效应45 蛋白纳米粒黄芪甲苷自组装85.8±1.720.5±3.251.8±4.6—48 无载体纳米粒黄芪甲苷超临界反溶剂法61.59——溶解能力是游离药物的2.4倍;24 h累积释放度增加至(41.4±2.8)%49 纳米纤维黄芪甲苷静电纺丝技术———12 h内药物释放快速,而12~48 h释放缓慢53 黄芪甲苷静电纺丝技术476±89——12 h药物释放含量约为82%,在12~24 h持续释放54 黄芪甲苷静电纺丝技术———12 h药物释放含量超过80%,36 h累积释放率超过95%55 金属有机框架丹参酮IIA-黄芪甲苷被动载药法258.3±25.2−42.30±1.27——15 外泌体黄芪甲苷—56~132———58
2.4 脂质体-静电纺丝纳米纤维
静电纺丝纳米纤维可促进细胞迁移和黏附[62],因此常用于伤口愈合。目前,静电纺丝纳米纤维与其他制剂相结合是研究的热点[63]。Yue等[64]构建了荷载黄芪甲苷脂质体的黄芪多糖/聚乙烯醇纳米纤维膜。伤口愈合实验发现,术后第15天,空白载体黄芪多糖/聚乙烯醇纳米纤维膜的伤口愈合面积为(83.8 ± 11.9)%,而荷载黄芪甲苷脂质体的黄芪多糖/聚乙烯醇纳米纤维膜的伤口愈合面积达到(94.5 ± 6.1)%,表明静电纺丝纳米纤维膜与脂质体结合能促进黄芪甲苷的局部和持续递送,提高治疗效果。
2.5 介孔二氧化硅-黑磷纳米片
介孔二氧化硅纳米粒因其有序的孔道、较大的比表面积、可调节的尺寸等优点,广泛用于药物载体的开发[65]。黑磷是一种类石墨烯的二维层状材料,在电学、光学、机械领域和生物学有广阔的发展前景。通过超声剥离等方法制成的黑磷纳米片是一种新型二维纳米材料,具有优良的生物降解性和光热特性[66]。Liu等[67]将负载黄芪甲苷的介孔硅纳米粒与黑磷纳米片有机结合,构建了新型黄芪甲苷二氧化硅-黑磷纳米片。该体系对大肠杆菌和金黄色葡萄球菌的抗菌率分别高达99.58%和99.13%。体内伤口愈合实验发现,第7天时,黄芪甲苷二氧化硅-黑磷纳米片处理的伤口面积为56.3%,而第10天减少到12.5%,在所有实验组中疗效最佳。
黄芪甲苷复合给药系统的制备、性质及结果见表2。部分黄芪甲苷单一及复合新型给药系统进行了体内外药效学研究,证实了新型制剂的优势,具体结果见表3。
表2 黄芪甲苷复合给药系统的制备、制剂性质及结果研究
Table 2 Preparation, pharmaceutical characters and results of astragaloside IV-loaded composite drug delivery systems
载体形式药物制备方法平均粒径/nm电位/mV包封率/%结果文献 纳米粒-水凝胶黄芪甲苷沉淀法-化学交联法———6 h累积释放率约10%,10 h累积释放率接近100%60 固体脂质纳米粒-水凝胶黄芪甲苷溶剂蒸发法-交联法332±11−23.6±1.593±58 h累积释放率达到70%,具有可控的释放性能61 脂质体-纳米纤维黄芪甲苷-黄芪多糖乙醇注入法-静电纺丝技术143.2±3.2−11.20±1.3589±6—64 二氧化硅-黑磷纳米片黄芪甲苷蚀刻模板法200~2609.25±0.4870.78 h释放率达到40%,96 h释放达91.3%,具有缓释效果67
3 结语与展望
通过对近年来黄芪甲苷新型给药系统(新型制剂的构建、药物释放、靶向给药和治疗作用)进行综述,发现黄芪甲苷给药系统具有理想的制剂学性质,提高了黄芪甲苷的成药性,并在肿瘤、创伤、急性心肌梗死、骨质疏松、年龄相关性黄斑变性等多种疾病显示出良好的治疗效果,但仍有许多关键问题需要解决,以进一步提高黄芪甲苷新型制剂的治疗效率,并加快落地转化。
3.1 开发“药辅合一”型给药系统
“药辅合一”是中药制剂的用药经验与哲学智慧,可指导现代制剂的设计。Jin等[69]以三七皂苷为稳定剂,制备了“药辅合一”型灯盏花素纳米混悬剂,研究发现其抗血小板聚集活性显著高于传统纳米混悬剂(稳定剂为聚氧乙烯氢化蓖麻油),提示三七皂苷和灯盏花素可能产生了协同效应。此外,甘草酸[70]、绞股蓝皂苷[71]和川芎油[72]等中药有效成分/有效部位也作为辅料用于新型制剂的构建。然而,基于该理念的黄芪甲苷给药系统鲜有报道。因此,可利用中药的“药辅”双重作用,开发“药辅合一”型给药系统,用于黄芪甲苷的传递。
3.2 构建多药联合的精准给药系统
研究表明,单一药物的治疗作用往往欠佳,而多药联合可实现较为满意的治疗效果[73]。联合给药已成为当前研究热点,也是临床疾病治疗的主要趋势。目前,已有黄芪甲苷与其他药物(如丹参酮IIA、阿霉素、奥希替尼)联用的新型制剂报道[15,21,25],但研究还较少。实际上,不同药物干预的靶点和作用机制不尽相同,这就要求药物应在相应的“位置”(如作用于不同的细胞或细胞器)“各司其职”。而只有精心的载体设计,药物才能精确地传递至靶标,达到最佳协同效果。因此,今后的研究还需合理设计给药系统以精准递送机制不同的多种药物。
3.3 提高给药系统的“渗透”效率
尽管黄芪甲苷给药系统在动物模型取得了满意的效果,但由于人体疾病形成机制复杂,导致动物的治疗作用并不能真实反映患者的结果。如纳米药物到达肿瘤部位需同时克服多种生物障碍[74],限制了纳米系统在肿瘤组织的富集。研究数据表明,只有0.7%的纳米药物能到达肿瘤部位,其中仅有0.001 4%能穿透肿瘤细胞[75],这主要是由于递送系统的低肿瘤靶向性和不足的穿透率导致。而目前的黄芪甲苷给药系统往往忽视了该问题,因此迫切需要进一步开发兼具“主动靶向”和“高渗透”特性的高递送效率传递系统。
表3 黄芪甲苷新型给药系统在不同疾病治疗中的应用
Table 3 In vitro and in vivo application of astragaloside IV-loaded delivery systems for different disease therapy
疾病类型给药系统细胞/动物模型给药剂量给药途径治疗效果文献 肿瘤丹参酮IIA-黄芪甲苷微乳bEnd.3、CTLL-2、H22细胞3.9~500.0 μg·mL−1—抑制内皮细胞和H22细胞增殖,促进T细胞的增殖15 奥希替尼-黄芪甲苷共载脂质体小鼠肺癌模型40 mg·kg−1ig对肿瘤的抑制作用显著增强21 阿霉素-黄芪甲苷共载脂质体MDA-MB-231/DOX细胞0.4 μmol·L−1—有效逆转细胞的耐药性,协同促进细胞凋亡26 叶酸和八精氨酸共修饰的黄芪甲苷脂质体小鼠耐药乳腺癌模型8 mg·kg−1iv显著抑制肿瘤生长,并克服阿霉素的耐药性29 黄芪甲苷纳米结构脂质体载体小鼠肺癌模型5 mg·kg−1iv显著提高对肺癌小鼠的抑制率,降低黄芪甲苷的静脉刺激性32 皮肤光老化黄芪甲苷纳米乳小鼠离体皮肤—透皮给药皮肤滞留量提高8.8倍18 胃黏膜损伤黄芪甲苷纳米混悬剂大鼠胃黏膜损伤模型75 mg·kg−1ig提高抗阿司匹林致大鼠胃黏膜损伤疗效20 糖尿病血管并发症黄芪甲苷外泌体内皮细胞损伤模型100 μg—促进miR-214的表达,显著改善高糖损伤的人内皮细胞的生存能力58 干性年龄相关性黄斑变性黄芪甲苷脂质纳米胶囊大鼠干性年龄相关性黄斑变性模型——能够减少活性氧产生,降低细胞凋亡率,对视网膜的形态和功能具有良好的保护作用36 黄芪甲苷纳米乳-眼用凝胶大鼠干性年龄相关性黄斑变性模型80 μL·d−1眼部给药改善视网膜细胞功能损伤,抑制视网膜细胞凋亡,修复线粒体DNA损伤59 急性心肌梗死黄芪甲苷纳米胶束小鼠急性心肌梗死模型5.84 mg·kg−1iv提高游离黄芪甲苷的心脏和线粒体保护活性41 骨质疏松阿仑膦酸修饰的黄芪甲苷纳米胶束大鼠骨质疏松症模型150 mg·kg−1ig良好的生物相容性和骨组织靶向能力,骨质疏松症治疗效果明显增强42 伤口/疤痕黄芪甲苷静电纺纳米纤维敷料大鼠烧伤、创伤模型0.25 mg·d−1局部给药烧烫伤治疗效果明显,加快创伤伤口愈合,且对疤痕起到了抑制作用53 黄芪甲苷静电纺纳米纤维大鼠烧伤创面模型0.25 mg·d−1局部给药促进快速愈合和血管生成,并抑制伤口的疤痕并发症54 黄芪甲苷静电纺纳米纤维大鼠急性创伤模型0.25 mg·d−1局部给药显著促进血管生成,增加伤口免疫功能,加速伤口愈合,抑制瘢痕形成55 黄芪甲苷水凝胶大鼠皮肤切除模型0.5 mg·d−1局部给药显著改善创面闭合,激活皮肤附肢再生,增加血清中转化生长因子-β水平68 黄芪甲苷纳米粒-水凝胶大鼠皮肤切除模型0.25 mg·d−1局部给药提高伤口闭合率,促进血管生成,加快伤口愈合,并抑制体内疤痕形成61 黄芪甲苷脂质体-纳米纤维糖尿病大鼠皮肤创伤模型—局部给药抑制伤口炎症发生,促进伤口愈合64 黄芪甲苷二氧化硅-黑磷纳米片大鼠皮肤缺损模型2 μg·mL−1局部给药促进血管生成,促进感染伤口愈合67
3.4 促进给药系统的临床转化
较传统制剂而言,黄芪甲苷新型给药系统的处方和制备通常较为复杂,为批量生产带来困难。因此,减少辅料的种类及用量,并简化制备工艺显得尤为重要。与此同时,新型给药系统的结构、粒径、多分散性、表面性质和稳定性等对其药动学性质和体内治疗效果有重要影响[12],这要求制备过程应精确且可重复,严格进行质量控制,以确保黄芪甲苷给药系统性能的一致性。更重要的是,制剂的安全性是临床转化的首要前提,故还需重点研究辅料的过敏反应、药物相互作用、作用机制和生物安全性等。
综上,新型给药系统的发展为克服黄芪甲苷的缺陷提供了有利途径。随着中药学、中药制剂学、药剂学、材料学、药理学、生物学等多学科交叉研究,黄芪甲苷新型给药系统将在未来大放异彩,为守护人类生命健康做出重要贡献。
利益冲突 所有作者均声明不存在利益冲突
[1] 孟丹丹, 李宗新, 贾瑞雪, 等. 黄芪甲苷抗肿瘤作用机制研究进展 [J]. 中草药, 2023, 54(3): 1002-1009.
[2] 徐世一, 刘秀波, 陆佳欣, 等. 黄芪活性成分抗肿瘤作用机制的研究进展 [J]. 中草药, 2022, 53(23): 7613-7623.
[3] Li L, Hou X J, Xu R F,. Research review on the pharmacological effects of astragaloside IV [J]., 2017, 31(1): 17-36.
[4] Chen T Q, Yang P Y, Jia Y J. Molecular mechanisms of astragaloside‑IV in cancer therapy (Review) [J]., 2021, 47(3): 13.
[5] Huang C R, Wang G J, Wu X L,. Absorption enhancement study of astragaloside IV based on its transport mechanism in Caco-2 cells [J]., 2006, 31(1): 5-10.
[6] Zhang Q, Zhu L L, Chen G G,. Pharmacokinetics of astragalosideIV in beagle dogs [J]., 2007, 32(2): 75-79.
[7] Zhang W D, Zhang C, Liu R H,. Preclinical pharmacokinetics and tissue distribution of a natural cardioprotective agent astragaloside IV in rats and dogs [J]., 2006, 79(8): 808-815.
[8] Domingues C, Santos A, Alvarez-Lorenzo C,. Where is nano today and where is it headed? A review of nanomedicine and the dilemma of nanotoxicology [J]., 2022, 16(7): 9994-10041.
[9] Pei Z R, Chen S T, Ding L Q,. Current perspectives and trend of nanomedicine in cancer: A review and bibliometric analysis [J]., 2022, 352: 211-241.
[10] Luo K P, Gao Y, Yin S P,. Co-delivery of paclitaxel and STAT3 siRNA by a multifunctional nano complex for targeted treatment of metastatic breast cancer [J]., 2021, 134: 649-663.
[11] Luo K P, Yin S P, Zhang R X,. Multifunctional composite nanoparticles based on hyaluronic acid- paclitaxel conjugates for enhanced cancer therapy [J]., 2020, 589: 119870.
[12] Yan C M, Li Q X, Sun Q,. Promising nanomedicines of shikonin for cancer therapy [J]., 2023, 18: 1195-1218.
[13] 汤小涵, 王哲, 闫巧, 等. 基于羧甲基壳聚糖-氧化透明质酸自组装行为构建的pH响应型纳米乳水凝胶给药系统 [J]. 中草药, 2022, 53(16): 4992-5000.
[14] Callender S P, Mathews J A, Kobernyk K,. Microemulsion utility in pharmaceuticals: Implications for multi-drug delivery [J]., 2017, 526(1/2): 425-442.
[15] 李霞, 郭弘, 毛登烜, 等. 2种丹参酮IIA-黄芪甲苷共载纳米给药系统的制备及体外抗肿瘤活性比较 [J]. 中国中药杂志, 2023, 48(3): 672-680.
[16] Li G T, Zhang Z Y, Liu H F,. Nanoemulsion-based delivery approaches for nutraceuticals: Fabrication, application, characterization, biological fate, potential toxicity and future trends [J]., 2021, 12(5): 1933-1953.
[17] 郁梅. 黄芪甲苷纳米乳的处方筛选研究 [J]. 内蒙古中医药, 2016, 35(7): 79-80.
[18] 陈筱瑜, 冯玉天娇, 吴少嫒, 等. 单纯形网格法优化黄芪甲苷纳米乳处方及其皮肤滞留量考察 [J]. 中国医院药学杂志, 2022, 42(20): 2121-2126.
[19] Singhal M, Baumgartner A, Turunen E,. Nanosuspensions of a poorly soluble investigational molecule ODM-106: Impact of milling bead diameter and stabilizer concentration [J]., 2020, 587: 119636.
[20] 姜佳琦, 彭海生, 李明慧, 等. 黄芪甲苷纳米混悬剂的制备及对胃黏膜损伤大鼠治疗效果评价 [J]. 哈尔滨医科大学学报, 2017, 51(4): 304-307.
[21] 贺艳. 奥希替尼-黄芪甲苷共载脂质体的制备及其体内外药效学研究 [D]. 遵义: 遵义医科大学, 2022.
[22] Cabeza L, Ortiz R, Arias J L,. Enhanced antitumor activity of doxorubicin in breast cancer through the use of poly(butylcyanoacrylate) nanoparticles [J]., 2015, 10: 1291-1306.
[23] 田彦璋, 苗青旺, 赵浩亮, 等. 黄芪甲苷逆转耐药肝癌细胞株HepG2/GCS多药耐药的研究 [J]. 中国药物与临床, 2011, 11(7): 778-779.
[24] 岳贵娟, 王成祥, 秦楠坤, 等. 基于转录组学探讨黄芪甲苷逆转乳腺癌阿霉素耐药的作用机制 [J]. 中华中医药杂志, 2021, 36(6): 3545-3548.
[25] 王成祥, 岳贵娟, 秦楠坤, 等. 盐酸阿霉素-黄芪甲苷脂质体制备工艺研究 [J]. 辽宁中医药大学学报, 2021, 23(6): 32-37.
[26] 岳贵娟, 王成祥, 于梦琦, 等. 黄芪甲苷逆转人乳腺癌细胞MDA-MB-231对阿霉素多药耐药的体外研究 [J]. 中草药, 2020, 51(20): 5237-5242.
[27] Gullotti E, Yeo Y. Extracellularly activated nanocarriers: A new paradigm of tumor targeted drug delivery [J]., 2009, 6(4): 1041-1051.
[28] Yin Y J, Wu X D, Yang Z Y,. The potential efficacy of R8-modified paclitaxel-loaded liposomes on pulmonary arterial hypertension [J]., 2013, 30(8): 2050-2062.
[29] Yue G J, Wang C X, Liu B,. Liposomes co-delivery system of doxorubicin and astragaloside IV co-modified by folate ligand and octa-arginine polypeptide for anti- breast cancer [J]., 2020, 10(20): 11573-11581.
[30] 杨婉露. 乳铁蛋白黄芪甲苷脂质体的制备及活性研究 [D]. 长春: 吉林大学, 2022.
[31] Khosa A, Reddi S, Saha R N. Nanostructured lipid carriers for site-specific drug delivery [J]., 2018, 103: 598-613.
[32] 陈敏燕, 原永芳, 吴飞华, 等. 黄芪甲苷纳米结构脂质载体的制备及其对肺癌作用的体内外研究 [J]. 中南药学, 2022, 20(12): 2793-2798.
[33] 刘爱娜, 陈昊, 唐星. 黄芪甲苷脂质微球注射液的制备及其物理稳定性研究 [J]. 中国药剂学杂志: 网络版, 2009, 7(4): 290-298.
[34] 刘爱娜. 黄芪甲苷脂质微球注射液的研究 [D]. 沈阳: 沈阳药科大学, 2009.
[35] Dabholkar N, Waghule T, Krishna Rapalli V,. Lipid shell lipid nanocapsules as smart generation lipid nanocarriers [J]., 2021, 339: 117145.
[36] Sun R, Zhang A N, Ge Y,. Ultra-small-size astragaloside-IV loaded lipid nanocapsules eye drops for the effective management of dry age-related macular degeneration [J]., 2020, 17(9): 1305-1320.
[37] Alshehri S, Hussain A, Altamimi M A,.,, andstudies of binary ethosomes for transdermal delivery of acyclovir: A comparative assessment [J]., 2021, 62: 102390.
[38] 吴少媛, 冯玉天娇, 陈筱瑜, 等. 星点设计-响应面法优化黄芪甲苷二元醇质体处方及其理化性质考察 [J]. 福建中医药, 2022, 53(9): 36-40.
[39] Tambe P, Kumar P, Paknikar K M,. Smart triblock dendritic unimolecular micelles as pioneering nanomaterials: Advancement pertaining to architecture and biomedical applications [J]., 2019, 299: 64-89.
[40] 黄昭峰, 徐丽. 黄芪甲苷纳米胶束的制备及Caco-2单层细胞转运研究 [J]. 西北药学杂志, 2022, 37(2): 94-98.
[41] 杨珂, 李澜, 樊官伟. 负载黄芪甲苷的心脏—线粒体双靶向递药纳米胶束改善急性心肌梗死后心脏损伤 [J]. 生物医学转化, 2022, 3(3): 45-56.
[42] Xi Y H, Wang W H, Ma L,. Alendronate modified mPEG-PLGA nano-micelle drug delivery system loaded with astragaloside has anti-osteoporotic effect in rats [J]., 2022, 29(1): 2386-2402.
[43] Mishra V, Thakur S, Patil A,. Quality by design (QbD) approaches in current pharmaceutical set-up [J]., 2018, 15(8): 737-758.
[44] Khaliq N U, Chobisa D, Richard C A,. Engineering microenvironment of biodegradable polyester systems for drug stability and release control [J]., 2021, 12(1): 37-54.
[45] 李姿锐, 王一婷, 兰帆, 等. 基于质量源于设计 (QbD) 理念的黄芪甲苷PLGA纳米粒制备工艺研究 [J]. 中草药, 2022, 53(15): 4678-4686.
[46] Wu J J, Yang Y, Yuan X Y,. Role of particle aggregates in herbal medicine decoction showing they are not useless: Consideringdecoction as an example [J]., 2020, 11(12): 10480-10492.
[47] Zhao Q, Luan X, Zheng M,. Synergistic mechanisms of constituents in herbal extracts during intestinal absorption: Focus on natural occurring nanoparticles [J]., 2020, 12(2): 128.
[48] Zhou J W, Zhang J A, Gao G Z,. Boiling licorice produces self-assembled protein nanoparticles: A novel source of bioactive nanomaterials [J]., 2019, 67(33): 9354-9361.
[49] Chen B Q, Liu H, Zhao Y,. Preparation of astragaloside IV (AS-IV) nanoparticlesSAS process for anticancer efficacy: Optimization based on Box-Behnken Design [J]., 2022, 188: 105650.
[50] Luraghi A, Peri F, Moroni L. Electrospinning for drug delivery applications: A review [J]., 2021, 334: 463-484.
[51] 张思祺, 周兆杰, 傅强, 等. 载阿霉素丝素蛋白纳米粒的制备及其理化性质 [J]. 华西药学杂志, 2022, 37(4): 361-364.
[52] Elzoghby A O, Samy W M, Elgindy N A. Protein-based nanocarriers as promising drug and gene delivery systems [J]., 2012, 161(1): 38-49.
[53] 单颖慧. 载药静电纺丝纳米纤维用于创伤愈合及疤痕抑制的研究 [D]. 杭州: 浙江大学, 2015.
[54] Shan Y H, Peng L H, Liu X,. Silk fibroin/gelatin electrospun nanofibrous dressing functionalized with astragaloside IV induces healing and anti-scar effects on burn wound [J]., 2015, 479(2): 291-301.
[55] Zhang D P, Li L J, Shan Y H,.study of silk fibroin/gelatin electrospun nanofiber dressing loaded with astragaloside IV on the effect of promoting wound healing and relieving scar [J]., 2019, 52: 272-281.
[56] Ma L, Jiang F B, Fan X,. Metal-organic-framework- engineered enzyme-mimetic catalysts [J]., 2020, 32(49): e2003065.
[57] Betzer O, Perets N, Angel A,.neuroimaging of exosomes using gold nanoparticles [J]., 2017, 11(11): 10883-10893.
[58] Zou X L, Xiao H, Bai X E,. Astragaloside IV drug-loaded exosomes (AS-IV EXOs) derived from endothelial progenitor cells improve the viability and tube formation in high-glucose impaired human endothelial cells by promoting miR-214 expression [J]., 2022, 73(2): 336-345.
[59] 许凯. 黄芪甲苷纳米乳眼用凝胶对实验性大鼠干性年龄相关性黄斑变性的作用研究 [D]. 北京: 中国中医科学院, 2018.
[60] Chen J R, Han X X, Deng J,. An injectable hydrogel based on phenylboronic acid hyperbranched macromer encapsulating gold nanorods and astragaloside IV nanodrug for myocardial infarction [J]., 2021, 413: 127423.
[61] Chen X, Peng L H, Shan Y H,. Astragaloside IV- loaded nanoparticle-enriched hydrogel induces wound healing and anti-scar activity through topical delivery [J]., 2013, 447(1/2): 171-181.
[62] Xue J J, Wu T, Dai Y Q,. Electrospinning and electrospun nanofibers: Methods, materials, and applications [J]., 2019, 119(8): 5298-5415.
[63] Yu D G, Wang M L, Ge R L. Strategies for sustained drug release from electrospun multi-layer nanostructures [J]., 2022, 14(3): e1772.
[64] Yue Y A, Liu X J, Pang L,.polysaccharides/PVA nanofiber membranes containing astragaloside IV-loaded liposomes and their potential use for wound healing [J]., 2022, 2022: 1-11.
[65] Porrang S, Davaran S, Rahemi N,. How advancing are mesoporous silica nanoparticles? A comprehensive review of the literature [J]., 2022, 17: 1803-1827.
[66] Chen W S, Ouyang J, Yi X Y,. Black phosphorus nanosheets as a neuroprotective nanomedicine for neurodegenerative disorder therapy [J]., 2018, 30(3): 1703458.
[67] Liu L C, Wang W F, Hong W H,. Photothermal 2D nanosheets combined with astragaloside IV for antibacterial properties and promoting angiogenesis to treat infected wounds [J]., 2022, 9: 826011.
[68] Peng L H, Chen X, Chen L,. Topical astragaloside IV-releasing hydrogel improves healing of skin wounds[J]., 2012, 35(6): 881-888.
[69] Jin X, Luo Y J, Chen Y C,. Novel breviscapine nanocrystals modified bysaponins for enhancing bioavailability and synergistic anti-platelet aggregation effect [J]., 2019, 175: 333-342.
[70] 唐海龙, 李小芳, 龙家英, 等. 以甘草酸为稳定剂制备水飞蓟素纳米混悬剂及稳定机制研究 [J]. 中草药, 2020, 51(4): 971-977.
[71] Chen H J, Deng M, Xie L,. Preparation and characterization of quercetin nanosuspensions using gypenosides as novel stabilizers [J]., 2022, 67: 102962.
[72] 张继芬, 叶鑫, 王艳华, 等. 通脉方药效组分纳米晶自稳定Pickering乳剂的制备、表征及Caco-2细胞模型评价 [J]. 药学学报, 2023, 58(1): 208-216.
[73] Gao Q, Feng J, Liu W C,. Opportunities and challenges for co-delivery nanomedicines based on combination of phytochemicals with chemotherapeutic drugs in cancer treatment [J]., 2022, 188: 114445.
[74] Sun Q H, Zhou Z X, Qiu N S,. Rational design of cancer nanomedicine: Nanoproperty integration and synchronization [J]., 2017, 29(14): 1606628.
[75] Dai Q, Wilhelm S, Ding D,. Quantifying the ligand-coated nanoparticle delivery to cancer cells in solid tumors [J]., 2018, 12(8): 8423-8435.
Research progress on astragaloside IV-loaded novel drug delivery systems
LUO Kai-pei1, JIANG Ying-jie2, XU Meng-han2, YANG Wen-bo2, YANG Lu3
1. State Key Laboratory of Southwestern Chinese Medicine Resources, School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 2. School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 3. Innovative Institute of Chinese Medicine and Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
Astragaloside-Ⅳ is one of the active ingredients extracted from Huangqi (), which has a wide range of pharmacological effects including anti-inflammatory, anti-fibrosis, anti-oxidative stress, anti-asthma, anti-diabetes, antitumor, immune regulation, and heart protection. However, the poor water solubility, low bioavailability, and insufficient tissue targeting of astragaloside IV greatly limit its development and application. Compared to traditional formulations, the novel drug delivery systems can improve bioavailability and targeting ability through prolonging circulation time, triggering drug release, increasing drug accumulation in deseased region, enhancing therapeutic efficacy. This paper summarized the research progress of astragaloside IV-loaded novel delivery systems (single and composite delivery systems), and elaborated on their therapeutic effects on various diseases. The current research problems and possible strategies of delivery systems were discussed, providing an idea for the development and clinical application of novel astragaloside IV formulations.
astragaloside IV; novel drug delivery system; bioavailability; dissolution rate; therapeutic effect; clinical conversion
R283
A
0253 - 2670(2023)18 - 6118 - 10
10.7501/j.issn.0253-2670.2023.18.029
2023-04-15
国家自然科学基金资助项目(82204633);国家自然科学基金资助项目(82304880);中国博士后科学基金资助项目(2021M700550);四川省科技计划项目(2022NSFSC0634);四川省科技计划项目(2023NSFSC1782);成都中医药大学“杏林学者”学科人才科研提升计划项目(BSH2021024)
罗开沛,博士,讲师,从事中药纳米给药系统研究。E-mail: luokaipei@cdutcm.edu.cn
杨 露,博士,实验师,从事中药纳米给药系统及中药药理研究。E-mail: yanglu@cdutcm.edu.cn
[责任编辑 赵慧亮]
