肿瘤切除手术诱发术后复发的机制及纠正策略研究进展
2023-09-13刘富垒
李 彬 冯 锋 刘富垒
1. 中国药科大学中药学院,江苏 南京 211198;2. 青岛大学附属泰安市中心医院肿瘤精确干预与转化医学实验室,山东 泰安 271000
恶性肿瘤一直以来都是威胁人类健康的主要原因之一,手术切除是多数实体瘤的基础治疗策略[1]。多项临床数据显示,乳腺癌、肝癌、结直肠癌等多种肿瘤的术后转移复发率较高且与手术密切相关[2-4],手术切除可通过一系列机制诱发肿瘤转移复发[5-6]。由于肿瘤转移与术后肿瘤导致的死亡密切相关,术后复发转移一直是临床上棘手的问题。即使是局部肿瘤复发也会严重影响术后患者生存期与生活质量[7],这也是当前肿瘤手术治疗策略所面临的最大挑战之一。因此,本文拟综述手术切除引发肿瘤复发转移机制的研究进展,并探讨目前用于预防或减轻手术应激反应从而改善患者预后的治疗方法。
1 手术切除肿瘤诱发其转移复发机制的复杂性
肿瘤细胞既可以循环肿瘤细胞(circulating tumor cells,CTCs)的形式在外周血中扩散,也可以作为弥散性肿瘤细胞(disseminated tumor cells,DTCs)迁移到骨髓或淋巴结,在化疗中存活并启动肿瘤复发和再生[8]。当肿瘤细胞扩散到新环境时,可能会保持几年甚至几十年的休眠状态,而肿瘤手术引起的一系列应激反应可能是唤醒休眠细胞的有利条件[9]。
接受手术治疗后的肿瘤复发包括局部/区域复发与远端转移[2],局部复发会严重影响患者生存期与生活质量[7],远端转移更是导致肿瘤患者死亡的主要原因[10]。肿瘤转移是一个动态过程,主要包括肿瘤细胞逃离原发灶、通过循环系统扩散到全身、定植到远端器官并形成转移灶[11]。局部复发则主要涉及干预后原发灶内休眠状态残余肿瘤细胞的激活与增殖[12]。手术则以一种复杂的方式诱发上述过程,包括交感神经系统(sympathetic nervous system,SNS)兴奋、应激激素释放、凝血系统激活、炎性反应、免疫抑制等[5]。
恶性肿瘤侵袭性极强,在接受手术完全切除术后,依然有处于休眠状态的残余肿瘤细胞存在并成为复发的“种子”[12-13]。此外,手术创伤诱发炎症环境,释放各种生长因子,为“种子”的植入及后续生长提供了肥沃的“土壤”[13]。虽然术后炎症及生长因子可以消除潜在病原体及促进伤口愈合,多为创伤后的生理反应,但其与肿瘤恶性进展的相关机制高度重合,因此会被残余肿瘤利用导致复发[1,5,13](图1)。
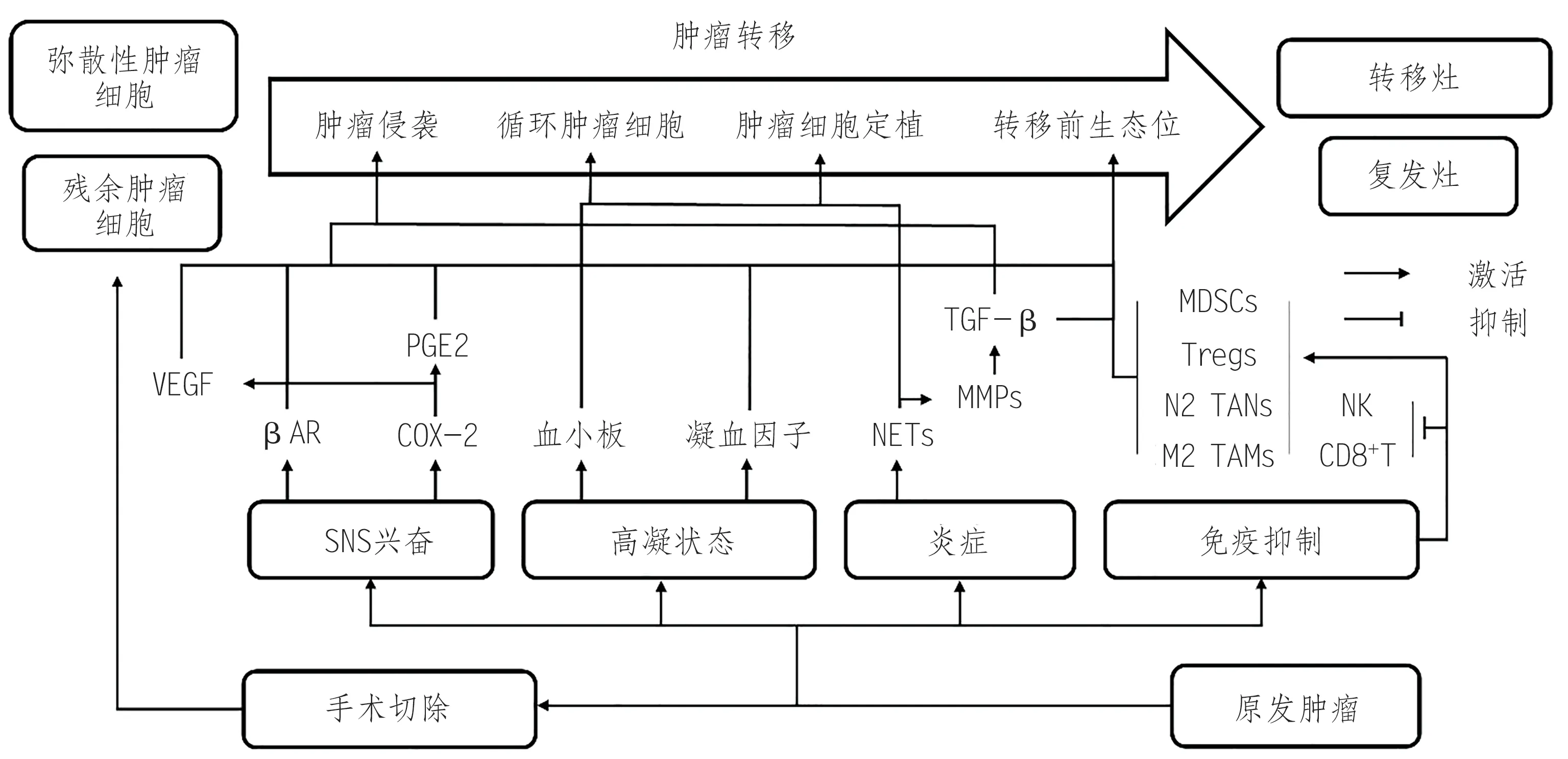
图1 手术切除肿瘤诱发转移的简要机制
1.1 手术激活SNS
手术切除肿瘤后,SNS 激活并促进儿茶酚胺的释放以及前列腺素E2(prostaglandin E2,PGE2)的合成,儿茶酚胺可通过激活β-肾上腺素受体(β-adrenoceptors,βAR),在肿瘤细胞和肿瘤微环境中诱导转移效应,从而导致癌症复发;PGE2也是诱发肿瘤转移的关键介质[14-15]。βAR激活刺激的信号通路包括环磷酸腺苷(cyclic adenosine monophosphate,cAMP)信号环路,该环路能上调促转移因子转录,同时βAR 激活还能通过炎症依赖机制导致肿瘤相关的淋巴管和血管的重塑,进而使得体内肿瘤细胞扩散[16-17]。此外,儿茶酚胺还可以通过βAR 创造一个接受弥散性肿瘤细胞转移性生长的环境来增加患癌的风险[13]。更有研究表明,儿茶酚胺对免疫系统的影响强于糖皮质激素,SNS 激活抑制了自然杀伤(natural killer,NK)细胞对肿瘤细胞的杀伤作用[18]。
手术引起的机体应激反应还能激活上调环氧合酶-2(cyclooxygenase-2,COX-2),直接强化肿瘤细胞增殖与转移侵袭能力[19]。同时,COX-2/PGE2 通路是一条经典的促炎通路,可参与肿瘤发生、发展、转移等多种功能[20]。除此之外,SNS 激活能间接导致一些促肿瘤因子的释放,包括基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、转化生长因子-β(transforming growth factor-β,TGF-β)、白细胞介素-8(interleukin-8,IL-8)、IL-6 等,触发一系列炎症反应刺激肿瘤复发、转移[21-22]。
1.2 手术激活凝血系统
手术后创伤部位会自发启动伤口修复程序,传统上分为3 个阶段:炎症期、纤维组织增生期、修复期。第1阶段炎症期在受伤后会通过凝血途径和血小板激活,形成凝血酶和纤维蛋白凝块,从而导致术后高凝状态[23]。在正常状态下,肿瘤细胞通过侵入血管或淋巴管进入循环并植入次要部位形成转移,而血流剪切力可以破坏该侵入过程[24]。然而在高凝状态下,肿瘤细胞侵入过程会受到保护[25]。此外,纤维蛋白凝块在肿瘤细胞周围可以起到保护涂层的作用,防止NK 细胞的检测和攻击[25-26],并介导肿瘤细胞与内皮细胞的粘附,释放促血管生成和有丝分裂因子[26]。
血小板在止血和伤口愈合中发挥重要作用。然而,血小板激活后可通过多种方式加速肿瘤转移,如结合肿瘤细胞形成血小板-CTC 聚集体,帮助肿瘤细胞在血管系统中滞留,增强内皮细胞收缩来帮助肿瘤细胞外渗以及提供各种生长因子为肿瘤细胞定植提供环境[25,27-28]。
1.3 手术激发急性炎症
细胞损伤相关分子模式(damage associated molecular pattern,DAMP)是触发手术损伤后炎症免疫反应的关键分子配体,中性粒细胞在术后几分钟内就会迅速被DAMP 招募到损伤部位并诱导中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)形成[29]。研究表明,中性粒细胞及其形成的NETs 在癌症的发生、发展和转移中起着重要作用[30]。NETs 不仅可以在炎症状态下唤醒小鼠休眠的肿瘤细胞[9],还能携带CTCs逃避循环系统内免疫细胞的杀伤作用,诱发CTCs 在远端器官定植[31]。此 外,NETs 还 能 局 部 释 放MMP-9、VEGF 等 因子[30,32]。其中,MMP-9 不仅可通过水解VEGF 的分子结合结构域来增强VEGF在肿瘤微环境中的生物利用度,进而激活休眠肿瘤细胞、诱发肿瘤转移侵袭[4,9,33];还会加速NETs局部细胞外基质的降解,导致储存于NETs局部细胞外基质内的其他促肿瘤因子被大量释放激活[30,34]。此外,MMP-9还能局部放大TGF-β的促肿瘤作用,而激活态TGF-β不仅能直接促进肿瘤侵袭与血管生成,还能对肿瘤微环境产生广泛免疫抑制,进一步诱发肿瘤转移[35-37]。
除中性粒细胞外,肿瘤切除术后部位的炎症变化还包括巨噬细胞及促炎因子的招募。其中,IL-1、TNF-α等促炎因子能够增强CTCs的粘附性,有利于在外缘位置捕获肿瘤细胞[38]。此外,炎症还可能通过剥去微循环内皮形成转移前生态位[13]。
1.4 手术诱导免疫抑制
免疫抑制在围手术期间较为常见[39],在动物实验中已被证实能够促进转移[40]。研究证实,手术创伤及后续伤口修复程序的启动能直接解除机体免疫系统对肿瘤的限制,触发肿瘤生长[41]。手术主要通过触发适应性免疫反应的术后下调来促使免疫逃逸,例如术后细胞毒性T 淋巴细胞与NK 细胞数目的降低[42-43],而免疫抑制性细胞的数目升高[44]。其中,调节性T 细胞(regulatory T cells,Treg)是一种高度免疫抑制性的CD4+T 细胞,术后可迁移至炎症部位并抑制效应淋巴细胞,与肿瘤复发密切相关[45-46]。Treg不仅可以分泌多种抑制性细胞因子参与肿瘤免疫,如IL-10、IL-35、TGF-β;还能通过高表达IL-2 阻断代谢[47]。骨髓来源抑制性细胞(myeloid-derived suppressor cells,MDSCs)聚集于肿瘤及外周淋巴器官,可抑制T 细胞、NK 细胞和树突状细胞的免疫作用,导致肿瘤生长、转移[48-50]。肿瘤切除能够诱发MDSCs 在肺部等特定远端器官内的蓄积,进而形成利于肿瘤细胞定植的转移前生态位[51]。MDSCs 可以通过诱导Tregs 和TGF-β 分泌来介导T细胞抑制,从而抑制肿瘤免疫[52]。此外,手术还能导致肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)向M2型分化[53-54],而M2型巨噬细胞增多可导致肿瘤的增殖、侵袭和转移[55]。同时,手术引发的一系列促生长因子在促进伤口愈合的同时,也诱发了Tregs 和MDSCs 的快速扩张[44]。因此,围手术期可能代表一个免疫间隙,在此期间细胞外环境更利于残余肿瘤生长。
综上所述,手术切除后的残余肿瘤细胞会成为复发的“种子”,其触发的一系列创伤生理反应又为复发提供“土壤”,导致手术在实现肿瘤治疗的同时又会成为肿瘤复发的诱因。因此,一方面针对“种子”,清除残余肿瘤细胞,另一方面针对“土壤”,阻止手术所触发的促肿瘤机制的产生可能会成为纠正肿瘤术后复发的有效策略。
2 肿瘤术后转移复发的纠正策略及治疗
围手术期(immediate perioperative period,IPP)包括术前等待手术的短暂紧张期、术中一系列医疗过程期、术后恢复期,一般持续几天到十几天[1]。由于手术诱发肿瘤复发转移机制的复杂性,对于术后纠正策略的设计要求极为苛刻,而围手术期提供了一个宝贵的治疗窗口,是决定肿瘤手术治疗预后的关键[15]。因此,围绕肿瘤术后转移复发机制探索针对性纠正策略具有重要临床意义。肿瘤切除术后复杂的复发转移机制具备3个特点:(1)复杂且形成交互网络;(2)集中在术后围手术期内迅速发生;(3)原本是创伤后机体的生理修复反应但被残余肿瘤利用。基于此,对于干预术后复发的策略有3 个关键点:(1)能够有效应对促肿瘤复发机制所形成的复杂交互网络;(2)能够在围手术期这一短暂时间及时发挥纠正作用;(3)不干扰创伤后机体正常的生理修复。
目前,已有研究探索IPP 内应用化疗辅助治疗术后一系列转移复发等问题。术后单次短期服用环磷酰胺或蒽环类药物可显著提高肿瘤患者的长期生存率[56-57]。然而化疗药物毒副反应较重,会严重损害机体免疫功能,具有一定的危害,更不宜在围手术期内应用。
近年来,免疫治疗快速发展并用于临床治疗,围手术期免疫治疗与标准护理手术相结合有可能提高外科癌症患者的生存率[42]。相关文献综述了减少术后细胞免疫损伤的治疗策略,包括抗DAMP、抗术后炎症或炎症/细胞焦亡、手术联合免疫疗法、抗血管生成和中性粒细胞、巨噬细胞、MDSCs 和Tregs 的靶向治疗等[43]。由于免疫抑制细胞的表型及其免疫作用复杂,相关靶向疗法发展较为缓慢。也有研究指出,创伤后炎症反应、炎症消除、组织修复是机体发挥生理防护功能的有序过程[58],在围手术期内采用免疫疗法干扰该过程,可能会导致过度炎症及其危害[1]。
除了围手术期化疗及免疫治疗外,各促瘤因子水平也得到了较多关注,如神经内分泌介质在手术应激后反应性升高,可直接刺激肿瘤细胞的促转移能力并抑制细胞介导的免疫反应,因此扭转手术创伤的神经内分泌反应是有希望的。对于术后应激引起的儿茶酚胺和前列腺素过度释放,导致肿瘤转移并缩短患者的无进展生存期,使用βAR 阻滞剂、COX 抑制剂可阻止术后肿瘤转移、复发[19]。然而,这些分泌介质多为机体在手术创伤时的生理修复反应,阻断也可能导致一些不良事件,例如βAR 阻滞剂会增加术后心动过缓、卒中与死亡发生率[59],COX抑制剂会增加手术出血风险[60]。
除上述疗法之外,还有一些生物靶向药物治疗策略,例如抗人表皮生长因子受体-2(human epidermal growth factor receptor 2,Her-2)药物[61]、抗血管生成药物[62]、脱氧核糖核酸酶药物或弹性蛋白酶抑制剂[30],但此类药物更严格依赖于肿瘤相应靶点表达水平。Her-2 药物、抗血管生成药物需要与常规化疗药物联合应用[61-62],难以在围手术期内应用。
近年来,有不少研究致力于局部给药系统的研发。相对于全身给药方式,局部制剂具有提高药物有效浓度、发挥长效作用、减少药物进入循环产生毒性等优势,大大改善了肿瘤治疗效果。但是目前绝大多数局部给药制剂只在动物模型上得到验证,未来的应用转化还需要进一步摸索。
3 小结与展望
手术切除仍是部分实体瘤的首选治疗策略,而围手术期也确实提供了一个能以较小代价有效阻止肿瘤复发转移的短暂而又宝贵的治疗机会窗口。先前的研究描述了交感神经系统、循环系统、神经内分泌系统及免疫细胞的变化对术后肿瘤进展的影响。对于术后形成的复杂交互网络,围手术期应用化疗、免疫治疗、单一靶点及生物靶向治疗虽能起到一定的治疗效果,但往往也有其局限性,并非完全安全有效。因此,需要进一步开发相关疗法,针对术后转移复发机制进行多靶点综合纠正,提高实体瘤患者生存率。
基于肿瘤术后复发机制的特点与目前纠正策略探索经验,可从以下几方面寻求突破:(1)肿瘤切除手术虽然是创伤手术,但在肿瘤这一特殊部位,术后生化级联反应中,一定存在与普通创伤具有细微差别的机制,纠正这些机制,可能对机体术后生理性修复影响比较小;(2)术后肿瘤复发机制的形成虽然迅速,但需要一个过程,这些复发机制形成之前的时间,是一个能以较小代价有效阻止肿瘤复发的宝贵机会窗口,充分研究有望事半功倍;(3)术后残余肿瘤虽然是复发的“种子”,但不一定必须在围手术期内清除,只需以温和的手段让其暂时丧失对“土壤”的响应能力即可,待围手术期过后,有较多方法可将其清除,这种策略有望把患者所承受的危害降至最低。
总之,手术切除肿瘤导致其复发转移的机制极为复杂,对术后治疗策略的要求极为严苛,临床上还需不断探索开发更为有效的治疗策略。
利益冲突所有作者均声明不存在利益冲突
