不同肝组织炎症分级和纤维化分期的自身免疫性肝炎患者外周血单个核细胞TLR2和CTLA-4水平变化研究*
2023-09-12商惠民
黄 静,商惠民,王 菁,周 娟
自身免疫性肝炎(autoimmune hepatitis,AIH)是自身免疫反应介导的累及肝脏实质的特发性疾病,其临床特征包括血清自身抗体阳性、高免疫球蛋白G血症、血清丙氨酸氨基转移酶(ALT)水平升高,其组织学特征表现为以淋巴细胞和浆细胞浸润为主的慢性炎症。若未能及时进行有效的诊治,可导致肝硬化和肝衰竭的发生[1,2]。AIH临床表现多样,发病隐匿,易复发,临床控制难度较大。目前,AIH的病因和发病机制尚不清楚,但研究表明,AIH发病多与遗传和自身免疫反应等因素有关[3]。Toll 样受体(Toll-like receptors,TLRs)是大量表达于外周血单个核细胞(peripheral blood monocytes,PBMCs)表面的免疫识别受体。有研究[4,5]表明,非特异性的肝损伤释放TLR2/4配体,可促进炎症因子持续表达,从而引起AIH的启动,而阻断TLR2/4配体则可有效抑制肝损伤和肝纤维化,表明TLR2可能参与了AIH的发生和发展过程。靶向TLR2/4信号传导或可为AIH治疗策略提供新方向。最新研究报道[6,7]指出,细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)基因多态性与AIH的发病有关。应用免疫检查点抑制剂阻断CTLA-4表达可用于治疗AIH患者。CTLA-4又称CD152,是存在于T细胞表面的免疫球蛋白超家族基因成员,可传递阻止信号和负性调节T细胞增殖,在CD4+T细胞激活过程中具有关键性作用[7]。本研究检测了AIH患者PBMCs TLR2和CTLA-4 mRNA水平变化,以分析其与肝组织病理学变化特征的关系,现报道如下。
1 资料与方法
1.1 病例来源 2018年6月~2022年6月我院收治的AIH患者47例,男性11例,女性36例;年龄为36~69岁,平均年龄为(52.8±10.3)岁。AIH符合《自身免疫性肝炎诊断和治疗共识(2015年)》[8]的诊断标准。排除标准:(1)存在病毒性肝炎或其他肝病;(2)存在其他自身免疫性疾病;(3)合并严重的心脑血管疾病:(4)血液系统疾病;(5)存在恶性肿瘤;(6)近期有应用免疫抑制剂治疗史;(7)既往有肝脏手术史。另选择同期健康人50例作为对照组,男15例,女35例;年龄为35~67岁,平均年龄为(51.7±8.9)岁。两组年龄和性别比较差异无统计学意义(P>0.05)。本研究获得我院医学伦理委员会批准,患者签署知情同意书。
1.2 肝活检 常规对AIH患者行肝穿刺检查,肝组织炎症活动度分为G1~G4级,肝纤维化程度分为F1~F4期[9]。根据界面破坏范围和细胞浸润程度,分为:轻度:局部或少数门管区被破坏;中度:<50%门管区被破坏或纤维间隔形成;重度:≥50%门管区被破坏或纤维间隔形成。
1.3 PBMCs TLR2和CTLA-4 mRNA检测 采集空腹静脉血,使用淋巴细胞分离液(中国科学院天津试剂厂)和采用Ficoll密度梯度离心法分离得到PBMCs,4℃冷藏、备用。采用Trizol法提取PBMCs总RNA,使用紫外分光光度计(美国Thermo公司)检测并记录总RNA浓度和纯度。使用逆转录试剂盒(FINNZYMES公司)将总RNA逆转录为cDNA。取cDNA,建立20μL反应体系,行PCR扩增。TLR2上游引物(上海生工生物公司)为5′-TTTGCTGGACTTACCTTCCTTG-3′,下游为5′-CAGTATCTCGCAGTTCCAAACA-3′;CTLA-4上游引物(上海生工生物公司)为5′-GACCAGGGACTCTACATCTGC-3′,下游为5′-TCACATTCTGGCTCTGTTGG-3′。PCR 反应如下:95℃ 5 min,94℃ 30 s,57℃ 60 s,72℃ 60 s,共35个循环。PCR扩增产物经2%琼脂糖凝胶(北京瑞达恒辉科技发展有限公司)电泳,计算TLR2和CTLA-4 mRNA相对水平,以2-△△Ct表示。
1.4 PBMCs表面TLR2和CTLA-4 表达水平检测 使用美国贝克曼CytoFLEX流式细胞仪检测PBMCs表面TLR2和CTLA-4表达水平,抗体均购自美国BD公司。
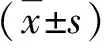
2 结果
2.1 两组PBMCs和细胞表面TLR2和CTLA-4比较 AIH患者PBMCs TLR2 mRNA水平和TLR2阳性的细胞百分比显著高于健康人,而PBMCs CTLA-4 mRNA水平和CTLA-4阳性的细胞百分比显著低于健康人(P<0.05,表1)。
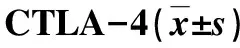
表1 两组PBMCs和细胞表面TLR2和比较
2.2 不同病情严重程度的AIH患者PBMCs TLR2和CTLA-4水平及表面分子阳性细胞百分比比较 重度AIH患者PBMCs TLR2 mRNA水平和TLR2阳性的PBMCs百分比显著高于中度或轻度患者(P<0.05),而PBMCs CTLA-4 mRNA水平和CTLA-4阳性的PBMCs百分比显著低于中度或轻度患者(P<0.05,表2)。
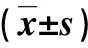
表2 不同病情患者细胞TLR2和CTLA-4 mRNA水平及表面分子阳性细胞百分比比较
2.3 不同肝组织炎症分级的AIH患者细胞TLR2和CTLA-4 mRNA水平及表面分子阳性细胞百分比比较 肝组织G3/G4级患者PBMCs TLR2 mRNA水平和TLR2阳性的PBMCs百分比显著高于G1/G2级,而PBMCs CTLA-4 mRNA水平和CTLA-4 阳性的PBMCs百分比显著低于G1/G2级(P<0.05,表3)。
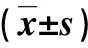
表3 不同炎症分级患者细胞TLR2和CTLA-4 mRNA水平及表面分子阳性细胞百分比比较
2.4 不同肝纤维化分期的AIH患者细胞TLR2和CTLA-4 mRNA水平及表面分子阳性细胞百分比比较 肝组织F3/F4期患者PBMCs TLR2 mRNA水平和TLR2阳性的PBMCs细胞百分比显著高于F1/F2期或F0期,而PBMCs CTLA-4 mRNA水平和CTLA-4阳性的PBMCs百分比显著低于F1/F2期或F0期(P<0.05,表4)。
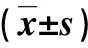
表4 不同肝纤维化分期患者细胞TLR2和CTLA-4 mRNA水平及表面分子阳性细胞百分比比较
3 讨论
AIH主要由患者自身免疫不耐受导致肝脏损伤而发病,具有淋巴细胞和浆细胞浸润为主的炎症性肝组织学特征,与慢性炎症反应密切相关[10,11]。基于AIH的临床和肝组织学特征,学者们多认为自身免疫异常和持续慢性炎症反应参与了AIH的发病和疾病发展[12]。TLRs是先天性和适应性免疫的单个跨膜非催化性蛋白质,在免疫反应的激活过程中起关键作用,其免疫耐受的打破可诱导肝脏持续的炎症反应。TLR2、TLR3和TLR4等多种TLRs均与AIH的发生、发展有关[13,14]。CTLA-4为白细胞分化抗原,也是T细胞跨膜受体,可负性调节T细胞水平,抑制机体免疫应答反应,其数量或功能异常参与了自身免疫性疾病的发病过程,被证明是癌症和自身免疫性疾病免疫检查点靶向治疗的重要位点,近年备受临床关注[15,16]。
本研究发现,相较于健康人,AIH患者PBMCs TLR2 mRNA水平和TLR2阳性的PBMCs百分比显著升高,而CTLA-4水平显著降低,提示PBMCs TLR2和CTLA-4表达异常可促进AIH的发生。TLR2是自身免疫相关炎症的重要调节因子,不仅可通过识别病原体驱动免疫反应,还可识别内源性危险信号,触发机体免疫应答,促进免疫细胞活化,导致组织炎症反应,有利于机体对抗病原体感染,但过度活跃的炎症反应或TLR2信号传导功能失调则可能引起无菌性炎症和自身免疫性疾病的发生和发展,被证实在肝脏疾病炎症、纤维化和肝硬化乃至肝细胞癌进程过程中均发挥了重要的作用[17,18]。国外研究[19]发现,CTLA-4基因多态性对T淋巴细胞具有不同的抑制程度,其49A>G位点基因多态性与AIH易感性有关,可能与CTLA4基因突变降低了CTLA-4 mRNA水平或导致CTLA4蛋白结构的修饰改变有关。本研究发现不同病情严重程度、不同肝组织炎症分级和不同肝纤维化程度的AIH患者PBMCs TLR2和CTLA-4均存在显著性差异,并与肝组织炎症分级和纤维化分期存在明显的关联,提示随着病情加重、炎症程度加深和纤维化加剧,AIH患者PBMCs TLR2 mRNA水平越高,而CTLA-4阳性的PBMCs百分比越低。国外研究[20]表明,相较于健康人,AIH患者血清TLR2明显升高,且与细胞因子水平有关。他们认为AIH发病与单核细胞TLR2/TLR4通路被激活有关,该通路被激活后可导致肝组织炎症小体增多,引起过度炎症反应,损伤肝组织,同时驱动相关炎症性细胞因子分泌,调节T细胞表型,造成T淋巴细胞功能障碍。TLR2相关信号通路被激活可刺激巨噬细胞功能,促进肝星状细胞增殖,加剧肝纤维化,提示TLR2与肝组织纤维化程度有关[21-23]。TLR2相关通路可调控多条炎症通路和相关的细胞因子水平,参与了AIH患者肝组织炎症和纤维化进程。