低聚木糖下调鼠伤寒沙门氏菌STM0306基因表达并抑制其黏附能力的作用
2023-09-11于晓蕾曹庆云冯定远左建军王伟唯
■ 凌 翀 于晓蕾 曹庆云 叶 慧 冯定远 左建军 王伟唯
(华南农业大学动物科学学院,广东省动物营养调控重点实验室,广东广州 510630)
鼠伤寒沙门氏菌(Salmonella Typhimurium,S.typhimurium)属于沙门氏菌种属(Salmonellaspp.),是一种常见的革兰氏阴性人畜共患病原菌[1]。鼠伤寒沙门氏菌对动物具有极其广泛的致病性并且能够在动物产品(肉、蛋、奶等)中长期存活,对畜禽养殖和公共卫生安全具有重大威胁。与宿主上皮细胞的黏附是沙门氏菌感染起始也是最关键的一步,这种黏附通过细胞膜上的受体与细菌表面存在的多种黏附因子(菌毛和黏附素等)的相互作用来实现[2]。STM0306(又称PagN)是鼠伤寒沙门氏菌的黏附素之一,STM0306基因的表达主要受PhoP/PhoQ 双组分调控系统调控,PhoP/PhoQ是沙门氏菌重要的二元信号转导系统[3]。
低聚木糖(xylooligosaccharides,XOS)是一类具有益生元活性的短链聚合物,是一种功能性寡糖,能够通过动物肠道细菌(如双歧杆菌)对其代谢所产生的代谢产物如短链脂肪酸(short-chain fatty acids,SCFAs)对肠道健康进行调控[4]。研究表明,XOS 具有提高动物生产性能、改善肠道形态、改善肠道微生物组成和促进激素分泌等多种功能[5-7]。虽然关于XOS 在动物生产上的研究已有大量报道,然而,其对畜禽致病菌毒力影响方面的研究仍较少。已有研究表明[8],XOS能够抑制李斯特菌对Caco-2 细胞的黏附并下调其黏附相关基因inlA和lap的表达。本研究利用猪小肠上皮细胞系IPEC-J2 为模型,探究XOS 对鼠伤寒沙门氏菌黏附宿主肠道上皮细胞的影响,通过qRT-PCR对鼠伤寒沙门氏菌黏附素进行筛选,并进一步探索XOS调控鼠伤寒沙门氏菌黏附素基因表达的机制,为XOS在畜禽养殖中沙门氏菌感染的缓解提供参考依据。
1 材料与方法
1.1 试验材料
试剂:低聚木糖(纯度≥95%)购自上海源叶生物科技有限公司。
细菌培养:鼠伤寒沙门氏菌野生型菌株(ATCC14028),购自广东省微生物食品安全工程技术研究开发中心;LB 肉汤培养基、技术琼脂粉和一次性细菌培养皿,购自广东环凯微生物科技有限公司;BIOG 细菌RNA 提取试剂盒,购自常州百代生物科技股份有限公司;HiScript®Ⅱ Reverse Transcriptase(R222)和ChamQ Universal SYBR qPCR Master Mix(Q711),购自南京诺唯赞生物科技股份有限公司;鼠伤寒沙门氏菌特异性引物,购自北京擎科新业生物技术有限公司;镁浓度检测试剂盒(微量法),购自北京索莱宝科技有限公司。
细胞培养:IPEC-J2 猪小肠上皮细胞系由华南农业大学动物科学学院印遇龙院士课题组馈赠;高糖DMEM 细胞培养基(美国Gbico)和无菌PBS(美国Hyclone),购自广州致邦生物有限公司;胰酶、双抗、胎牛血清(美国Gibco),购自广州昂科生物技术有限公司;细胞培养皿、细胞培养板(美国Corning),购自上海百赛生物技术有限公司。
1.2 细菌黏附能力的测定
1.2.1 XOS、细菌、细胞共孵育黏附试验
在12 孔细胞培养板中接种IPEC-J2 细胞,置于5% CO2,37 ℃恒温培养箱中培养,待细胞生长至约90%时,更换培养基,加入PBS 洗涤三次后的处于对数生长期的鼠伤寒沙门氏菌菌液(1×109CFU/mL,MOI=100),同时在培养基中加入XOS 至总浓度为20 mg/mL,对照组加入等体积PBS,37 ℃孵育1 h 后PBS 洗涤三次以去除未黏附的细菌,加入1 mL 1%Triton-100 常温30 min 裂解细胞,将细胞裂解液充分吹打混匀后进行倍比稀释,通过琼脂平板倒板法进行菌落计数,计算黏附细菌总数量。
1.2.2 XOS预处理细菌、细胞黏附试验
黏附试验方法同上,鼠伤寒沙门氏菌与IPEC-J2细胞均用20 mg/mL XOS进行预处理,处理方法如下。
细菌预处理:在细菌培养过程中加入总浓度为20 mg/mL 的XOS 溶液,对照组加入等体积PBS,置于37 ℃空气摇床培养至对数生长期,进行后续处理。
细胞预处理:待12 孔细胞培养板中的细胞生长至约80%时,弃培养基并用PBS 洗涤细胞一次,加入新鲜培养基,并加入总浓度为20 mg/mL 的XOS 溶液,对照组加入等体积PBS,轻摇混匀后置于5% CO2,37 ℃恒温培养箱中培养,待细胞生长至约90%时进行后续处理。
1.3 qRT-PCR
培养鼠伤寒沙门氏菌并用20 mg/mL XOS 对菌液进行处理,对照组加入等体积PBS。待细菌处于对数生长期,通过BIOG 细菌RNA 提取试剂盒提取鼠伤寒沙门氏菌总RNA 并进行逆转录后,采用表1所示体系进行qRT-PCR,以鼠伤寒沙门氏菌DNA 消旋酶亚基基因gyrA(DNA gyrase subunit A)作为内参,对获得的信号、数据进行处理,根据公式2-ΔΔCt计算目的基因相对于内参基因的比值以反映其表达丰度。引物信息见表2。

表1 qRT-PCR反应体系

表2 引物序列
1.4 pH测定
培养鼠伤寒沙门氏菌并添加20 mg/mL XOS 溶液,置于37 ℃空气摇床220 r/min 培养,每隔2 h 测定一次细菌培养液的pH,测定前将菌液进行离心以分离菌体与培养液。
1.5 Mg2+浓度测定
培养鼠伤寒沙门氏菌并添加20 mg/mL XOS 溶液,置于37 ℃空气摇床220 r/min 培养,每隔2 h 测定一次培养液中的Mg2+浓度,离心后通过镁浓度检测试剂盒(微量法)测定Mg2+浓度。
1.6 数据统计与分析
使用SPSS 21.0对试验数据进行单因素方差分析。所有数据以“平均值±标准差”表示,各组之间的差异使用Duncan’s多重比较法进行检验。*表示组间差异显著(P<0.05);**表示组间差异极显著(P<0.01)。
2 结果与分析
2.1 XOS 共孵育对鼠伤寒沙门氏菌黏附IPEC-J2 细胞的影响
如图1 所示,与未加XOS 组相比,XOS 共孵育能够极显著抑制鼠伤寒沙门氏菌对IPEC-J2 细胞的黏附(P<0.01)。在共孵育处理体系中,XOS、鼠伤寒沙门氏菌和IPEC-J2 细胞三者同时存在,表明XOS 能通过影响鼠伤寒沙门氏菌与IPEC-J2 细胞之间的互作来抑制其对细胞的黏附作用。
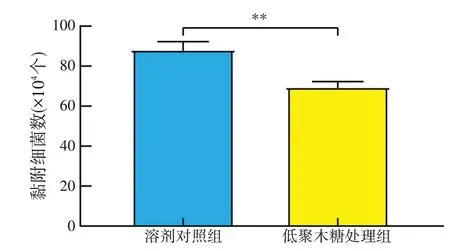
图1 XOS共孵育对鼠伤寒沙门氏菌黏附IPEC-J2细胞的影响(n=6)
2.2 XOS 预处理对鼠伤寒沙门氏菌黏附IPEC-J2 细胞的影响
为探究XOS 单独处理细菌与细胞对细菌黏附的影响作用,通过20 mg/mL XOS 分别对鼠伤寒沙门氏菌和IPEC-J2 细胞进行预处理,测定细菌黏附能力。结果如图2 所示,与未加XOS 组相比,XOS 预处理的鼠伤寒沙门氏菌对IPEC-J2 细胞的黏附能力显著降低(P<0.01);XOS 预处理IPEC-J2 细胞组虽然未达到显著性(P>0.05),但是黏附细菌数量在数值上有一定的降低;另外设置共孵育处理组,结果与2.1相同。表明除了参与细菌与细胞间的互作外,XOS 还能够通过影响鼠伤寒沙门氏菌本身从而抑制其对细胞的黏附能力。
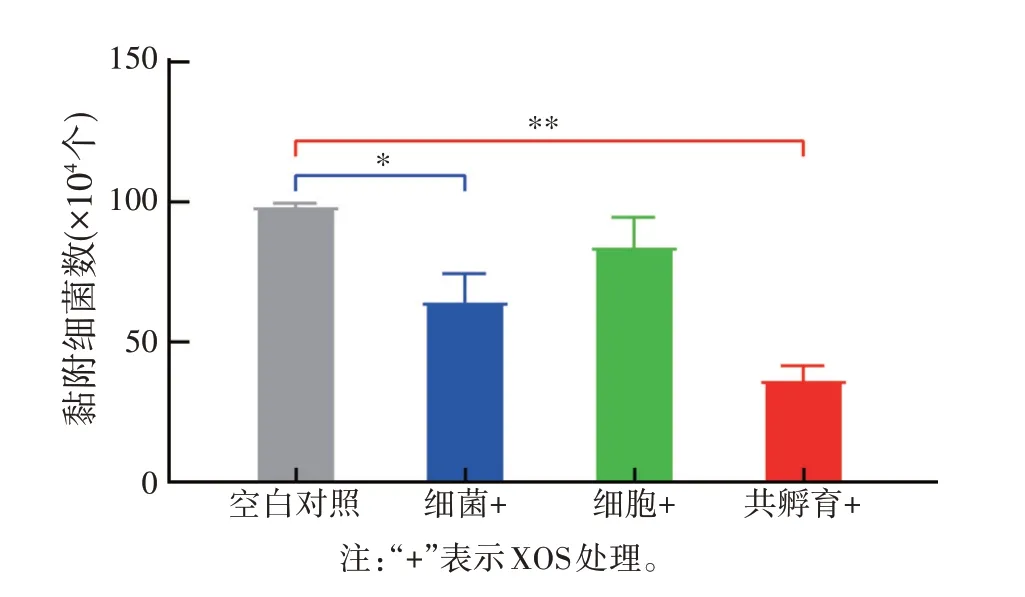
图2 XOS预处理对鼠伤寒沙门氏菌黏附IPEC-J2细胞的影响(n=3)
2.3 XOS对鼠伤寒沙门氏菌黏附素基因表达的影响
为了探究XOS 对鼠伤寒沙门氏菌黏附能力的影响是否与其黏附素基因的表达量变化有关,进行了qRT-PCR,结果如图3 所示。通过基因筛选,发现XOS 极显著下调了鼠伤寒沙门氏菌黏附素STM0306基因的mRNA 相对表达量(P<0.01)(无显著性变化的基因结果未展示)。表明XOS可能通过影响鼠伤寒沙门氏菌STM0306基因表达进而影响其的黏附能力。

图3 XOS对鼠伤寒沙门氏菌黏附素基因表达的影响(n=6)
2.4 XOS对鼠伤寒沙门氏菌培养液pH的影响
鼠伤寒沙门氏菌STM0306基因的表达受PhoP/PhoQ 调控系统调控,该调控系统的活性主要受菌体细胞膜外的pH、Mg2+浓度和抗菌肽浓度的影响。由于XOS 单独处理细菌的体系并不涉及宿主细胞,因此,在该体系中,PhoP/PhoQ 调控系统的活性主要取决于培养环境中的pH和Mg2+浓度。
为了探究XOS 调控STM0306基因表达的机制,我们测定了XOS 处理后菌液中的pH,结果如图4 所示,XOS 处理组的pH 在2 h 和4 h 均 显 著低于未加XOS组(P<0.05)。
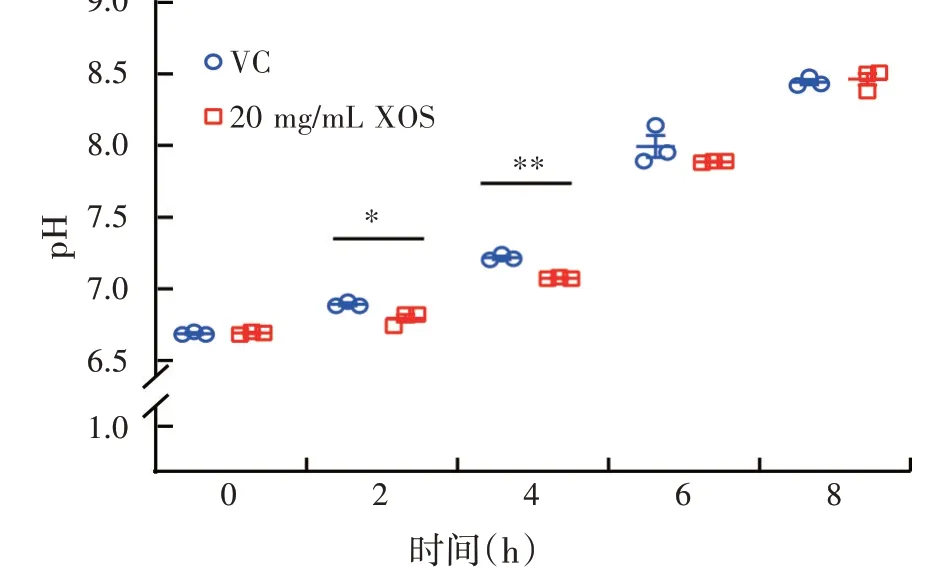
图4 XOS对鼠伤寒沙门氏菌培养液pH的影响(n=3)
2.5 XOS对鼠伤寒沙门氏菌培养液中Mg2+浓度的影响
通过微量法测定了XOS 处理后菌液中的Mg2+浓度,结果如图5所示,XOS处理组培养基中的Mg2+浓度在2~6 h 均低于对照组,且在4 h 达到了显著性(P<0.05)。表明XOS 可能通过影响细菌培养环境的pH和Mg2+浓度调控PhoP/PhoQ 双组分系统的活性,进而影响下游STM0306基因的表达。
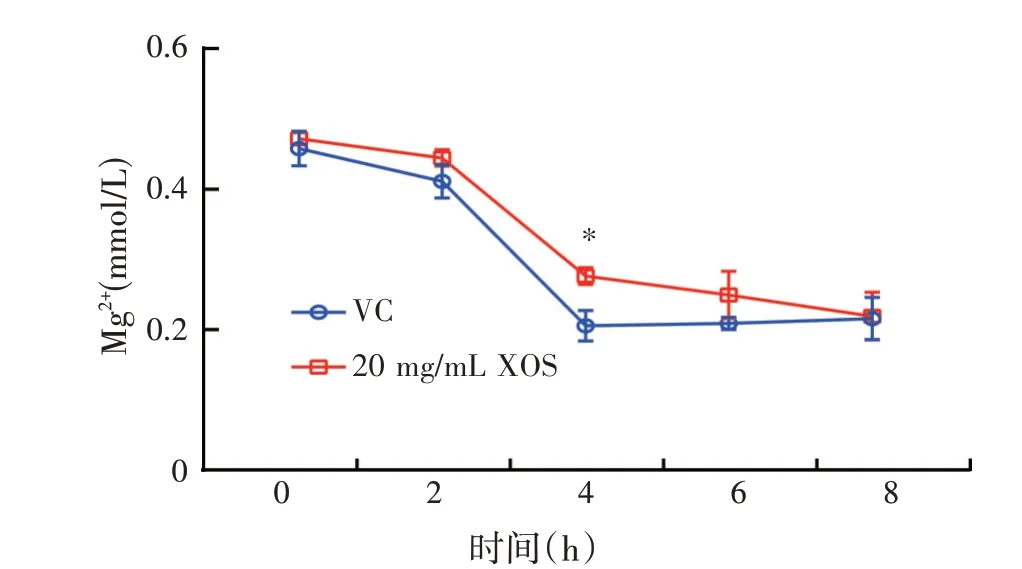
图5 XOS对鼠伤寒沙门氏菌培养液中Mg2+浓度的影响(n=3)
3 讨论
3.1 低聚糖对病原菌黏附的抑制作用
病原菌对宿主肠道上皮细胞的黏附主要取决于菌体表面分布的多种菌毛及黏附素,这种黏附过程是通过宿主细胞上的受体与黏附素之间的特异性结合来实现的。迄今为止,已有大量研究表明益生性低聚糖能够抑制病原菌黏附宿主肠道上皮细胞,包括乳果糖[9]、低聚半乳糖[10]、壳寡糖[11]和甘露寡糖[12]等。由于低聚糖在一些理化性质上与某些细菌黏附素或细胞膜受体具有相似性,因此低聚糖对黏附的抑制作用可能是由于低聚糖参与了病原菌和宿主肠上皮细胞的互作。
3.2 XOS 下调鼠伤寒沙门氏菌STM0306 基因表达并抑制其对IPEC-J2细胞的黏附
XOS 是通过木聚糖酶分解富含木聚糖的植物,再进行分离纯化得到的一类非消化性低聚糖,主要由木二糖~木六糖组成[13]。XOS 作为寡糖之一,同样有抑制病原菌黏附上皮细胞的作用。Ebersbach 等[8]研究发现,添加20 mg/mL XOS 能够显著抑制李斯特菌对Caco-2 细胞的黏附,并显著降低李斯特菌黏附素基因inlA和lap表达。为了探究XOS 是否同样有干预鼠伤寒沙门氏菌黏附素表达抑制其黏附宿主肠道上皮细胞的能力,本试验将20 mg/mL XOS、鼠伤寒沙门氏菌和IPEC-J2 细胞进行共孵育,结果显示黏附的鼠伤寒沙门氏菌数量显著降低。为了探究XOS 抑制鼠伤寒沙门氏菌黏附的作用方式(即XOS影响细菌、XOS 影响细胞或XOS 影响细菌与细胞互作),分别对细菌与细胞进行预处理,结果显示XOS预处理的鼠伤寒沙门氏菌对IPEC-J2 细胞的黏附数量显著降低,且预处理细胞同样能降低细菌黏附数量,但未达到显著性差异。说明XOS 不仅影响细菌与细胞互作,还能够通过直接影响细菌从而抑制细菌黏附细胞。qRT-PCR 发现,XOS 处理的鼠伤寒沙门氏菌中黏附素STM0306的基因表达量显著下调,说明XOS 可能通过干预鼠伤寒沙门氏菌黏附素表达从而抑制其黏附能力。
3.3 XOS 下调鼠伤寒沙门氏菌STM0306 基因表达的机制探究
本试验进一步研究了XOS 抑制鼠伤寒沙门氏菌STM0306基因表达可能的分子机制。鼠伤寒沙门氏菌STM0306基因的表达主要由PhoP/PhoQ 双组分系统调控。PhoP/PhoQ 是沙门氏菌重要的调控系统,由两部分组成,分别是跨膜的组氨酸蛋白激酶PhoQ 和细胞质内的反应调控蛋白PhoP,当细菌处于特定刺激时,PhoQ 细胞质结构域的组氨酸残基发生二聚体内反式自磷酸化,随后将磷酸基团转移至反应蛋白PhoP 的天冬氨酸残基上,获得磷酸基团的PhoP 蛋白构型发生改变从而具备转录调控活性[14],与DNA 结合以促进活化和抑制基因的表达[15]。PhoP/PhoQ 双组分系统的活性主要受Mg2+浓度、pH和抗菌肽影响,外界微环境这些因素的变化都能导致PhoP/PhoQ 的激活或抑制。Mg2+能够与PhoQ 的周质结构域结合,从而使其蛋白构象改变使其去磷酸化[16](见图6),因此,高浓度(1 mmol/L)的Mg2+能够抑制PhoQ 活性,而低浓度(8 μmol/L)能够诱导PhoQ发生自磷酸化启动下游信号传递过程[17]。抗菌肽与PhoQ 的作用机制类似于Mg2+,二者均能与PhoQ周质结构域结合导致其构象改变,不同的是,抗菌肽的结合只激活PhoP/PhoQ 双组分系统而不会抑制[18],且其与PhoQ 的亲和力要远大于Mg2+[3]。低pH也是PhoQ 的激活信号之一,该激活过程依赖于PhoQ 传感域酸性残基的构象变化,进而启动下游信号的转导[19]。
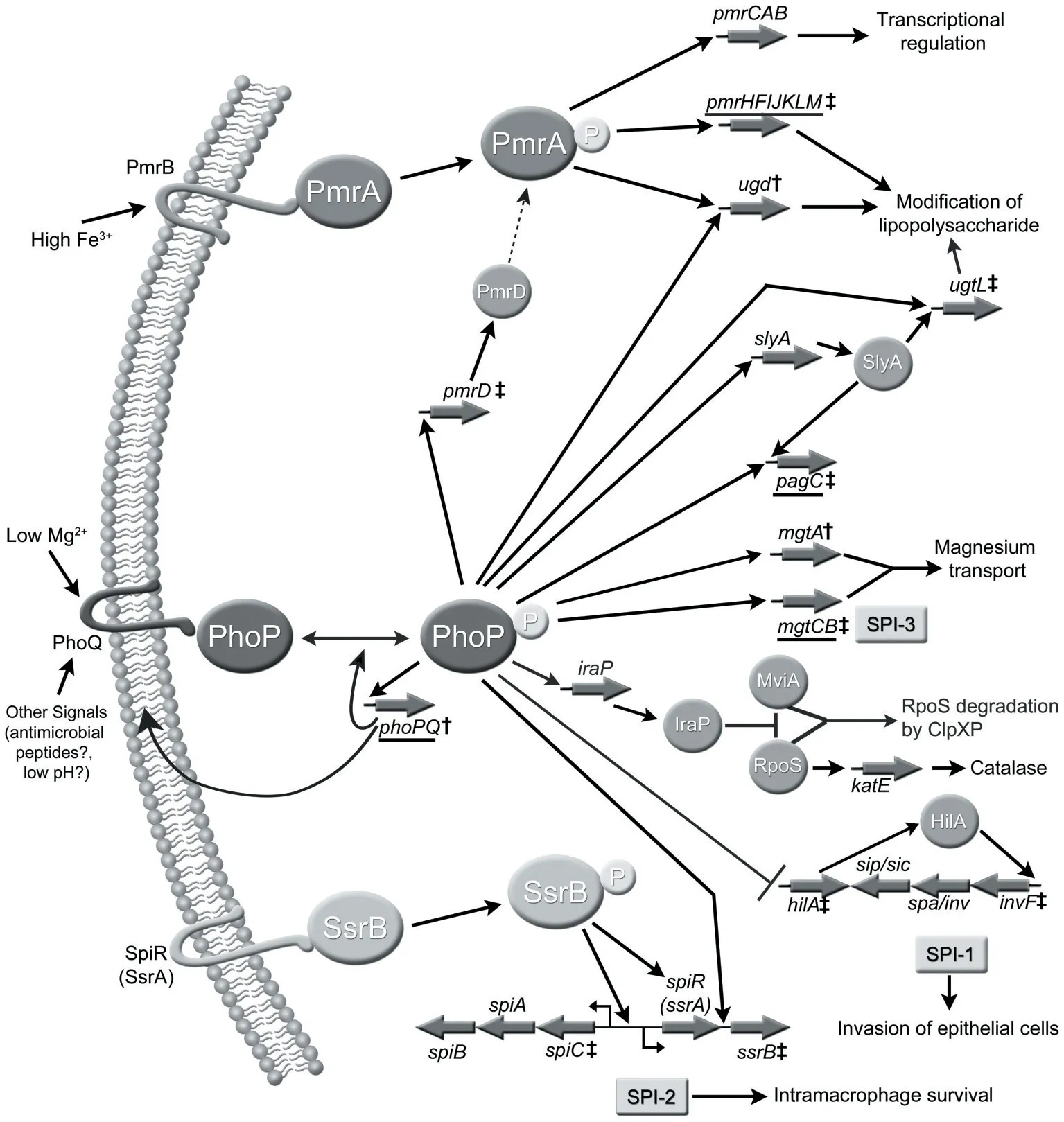
图6 鼠伤寒沙门氏菌PhoP/PhoQ调控网络
试验检测了细菌外环境中的pH 和Mg2+浓度,结果显示,XOS 处理组细菌培养基的pH 显著低于对照组,Mg2+浓度显著高于对照组。其中,XOS 降低pH 的结果与体内试验结果一致,XOS 能够降低动物肠道的pH,这可能跟细菌利用XOS 产生的SCFAs 有关[4],然而,大量研究表明,SCFAs 是通过双歧杆菌等细菌代谢XOS产生,对于鼠伤寒沙门氏菌是否同样能够代谢XOS 产生SCFAs 仍未有定论。虽然pH 的降低对PhoP/PhoQ 调控系统起激活作用,然而,Prost 等[3]研究发现,低pH 是1 mmol/L Mg2+存在下PhoQ 的激活信号,本试验中的Mg2+浓度相比于1 mmol/L 浓度是偏低的,因此,在本试验的Mg2+浓度条件下,pH 的降低并不会激活PhoQ,即pH 降低的激活信号有可能被Mg2+升高的抑制信号所覆盖,Núñez-Hernández 等[19]也提到,PhoP/PhoQ 调控系统三种刺激信号之间的刺激强度并不相同。Mg2+是一种重要的生物活性物质,可以激活多种酶的活性,同时也是三磷酸腺苷(ATP)和核糖体RNA(rRNA)的组成成分之一[20]。对于XOS 如何通过提高Mg2+浓度抑制PhoP/PhoQ 调控系统活性,需进一步研究。
值得一提的是,在本研究中,虽然XOS 能够抑制鼠伤寒沙门氏菌STM0306基因表达,但是由XOS处理导致的细菌的黏附能力下降是否是由STM0306表达的下调直接导致的,这个问题仍需进一步探究,因为XOS可能不只影响STM0306基因的表达,黏附细菌的减少可能是多种基因表达量的变化共同作用的结果。
4 结论
综上所述,XOS 能够影响细菌外环境中的pH 和Mg2+浓度,偏高的Mg2+浓度可能导致鼠伤寒沙门氏菌PhoP/PhoQ 调控系统活性受到一定程度抑制,进而抑制下游靶基因STM0306表达。XOS 可能通过靶向抑制鼠伤寒沙门氏菌STM0306表达,降低其对IPEC-J2细胞的黏附能力。
