海洋硅藻中金藻昆布多糖提取纯化工艺和定量检测方法优化
2023-09-09王珊杨润青魏东
王珊,杨润青,魏东
(华南理工大学食品科学与工程学院,广东广州 510640)
金藻昆布多糖(Chrysolaminarin)是一类水溶性的β-1,3-葡聚糖,主要由葡萄糖通过β-1,3-糖苷键主链和少量的β-1,6-糖苷键支链连接而成[1],广泛存在于硅藻、金藻和黄藻等海洋微藻中,作为微藻光合作用的主要产物储存于藻细胞液泡内[2]。金藻昆布多糖具有抗氧化、抗肿瘤、降血糖、降血脂、强化免疫等β-葡聚糖特有的生物活性[3-5]。研究表明,具有生物活性的β-葡聚糖分子量一般在4~5 ku;与大型海藻来源的褐藻β-葡聚糖(分子量一般在5 000 ku以上)和酵母来源的β-葡聚糖(50~2 400 ku)相比,金藻昆布多糖分子量低(1~40 ku),具有更高的免疫活性[6],可作为免疫刺激剂和益生元,在功能性食品和动物饲料领域具有广泛的应用潜力[7,8]。目前没有金藻昆布多糖标准品,尚缺乏准确的定量检测方法,严重影响了其结构与功能研究和应用。
目前,针对藻基β-1,3-葡聚糖含量的检测方法主要包括酶法[9,10]、高效凝胶色谱法[11,12]和物理化学方法[13]。酶法主要利用特异性水解酶将β-葡聚糖水解为寡糖,再用β-葡萄糖苷酶进一步水解为葡萄糖,测定葡萄糖含量后换算为β-葡聚糖含量。酶法优点是结果准确,缺点是酶试剂价格昂贵、步骤繁琐且受酶的种类和纯度影响较大[14]。高效凝胶色谱法不仅可以测定β-葡聚糖分子量,还可对其含量进行定量。通过示差折光检测器测定不同分子量的β-葡聚糖和待测样品,以保留时间与样品最接近的葡聚糖标准品比较后建立标准曲线,再用外标法测定样品中β-葡聚糖的含量[15]。该方法的优点是准确度高、重现性好,缺点是对样品纯度要求较高,样品一般需经纯化处理,操作时间长。苯酚-硫酸法是一种常用的物理化学法,主要原理是多糖在浓硫酸作用下脱水生成的糠醛或羟甲基糠醛能与苯酚络合成一种橙红色化合物,经比色法在485 nm波长下测定葡萄糖含量,再换算为β-葡聚糖含量。其优点是试剂易得、操作简便,但样品中的多糖和寡糖的存在导致该方法专一性较差[16]。目前,金藻昆布多糖的测定常用苯酚-硫酸法[17,18]和凝胶色谱法[1],但仍缺乏方法学上的系统比较和筛选。
金藻昆布多糖的提取纯化及定量检测是工业生产的关键技术之一。本研究对硅藻中金藻昆布多糖的水提、醇沉提取纯化工艺进行了优化,并利用β-1,3-葡聚糖能与荧光剂特异性结合并增强荧光强度的原理[19,20],建立了新型苯胺蓝荧光检测法测定金藻昆布多糖含量。通过苯酚-硫酸法、凝胶液相色谱法和苯胺蓝荧光检测法的方法学比较,评价其结果的准确度和经济实用性。
1 材料与方法
1.1 藻种、培养基与培养条件
三角褐指藻(Phaeodactylum tricornutum)CCMP 1327由中国科学院水生生物研究所胡晗华研究员惠赠。采用改良的兼养f/2培养基(表1)进行斜面保种,盐度20‰,pH值8.0,斜面保存温度4 ℃。藻种活化时,置于50 mL装有无菌改良f/2液体培养基的250 mL三角瓶中,置于20 ℃、光照强度10 μmol/(m2s)、转速150 r/min的恒温光照摇床中进行连续光照培养3~5 d后,以10%接种量转接至装有100 mL无菌改良f/2培养基的250 mL三角瓶中,相同条件下培养6~8 d至对数期用于后续研究。配制的培养基在121 ℃下高温灭菌15 min,尿素母液经过滤除菌后加入已灭菌、冷却到室温的培养基中。
1.2 试剂与仪器
标准品酵母β-1,3葡聚糖,北京百灵威科技有限公司;苯胺蓝染料,上海迈坤化工有限公司;三氯乙酸,上海麦克林生化科技有限公司;胰蛋白胨,广东环凯微生物科技有限公司;总氮试剂,美国HACH公司;甘油、尿素、硝酸钠等均为分析纯试剂。CYTATION-5酶标仪,广州市众创生物科技有限公司;高效凝胶渗透色谱仪(1525型高效液相色谱泵),美国Waters公司;凝胶色谱柱(Prevail Carbohydrate ES,5 μm),美国安捷伦科技有限公司;Tissuelyse-24珠磨仪,上海净信实业发展有限公司。
1.3 研究内容
1.3.1 96 微孔板的筛选
通过测定空白96孔板的背景荧光强度,筛选出对样品检测精密度无显著性影响的微孔板类型。采用酶标仪在激发波长为398 nm、发射波长为502 nm下,测定来自生工(Sangon Biotech)和康宁(Corning Incorporated Costar)两家品牌的透明板、白板和全黑板的荧光强度值,筛选出荧光强度最低的96板用于后续实验。
1.3.2 藻粉中金藻昆布多糖提取条件优化
1.3.2.1 藻粉提取次数
收集新鲜藻细胞在4 ℃下8 000 r/min离心5 min,真空冷冻干燥后准确称取15 mg,悬浮于12 mL pH值8.0的Tris-EDTA(TE)缓冲液(配制5 mmol/L EDTA溶液,用10 mmol/L Tris-HCl调节pH至8.0)中,50 ℃温水浴30 min。在细胞破碎仪中70 Hz破碎10 min,8 000 r/min离心5 min,收集所有上清液S。分别重复提取2、4、6次,最终合并上清液。随后加入三氯乙酸(Trichloroacetic Acid,TCA)溶液使其终体积分数为10%,50 ℃水浴60 min,10 000 r/min离心20 min,得到上清液F。将上清F与5倍无水乙醇混合,置于-20 ℃冰箱过夜,次日取出,再以10 000 r/min离心20 min,收集粗多糖样品沉淀物T。将湿沉淀T溶解在蒸馏水中,稀释、定容至10 mL作为待测液[21]。
1.3.2.2 TCA溶液体积分数
利用TE缓冲液提取冻干藻粉4次,向收集的上清液S中加入TCA溶液使其终体积分数分别5%、10%、15%,以考察其去除蛋白能力。其余条件同1.3.2.1。
1.3.2.3 醇沉
分别称取冻干藻粉10、15、20 mg,利用TE缓冲液提取冻干藻粉4次,向收集的上清液S中加入TCA溶液使其终体积分数为10%。对得到的上清液F进行醇沉与不醇沉的处理对比。其余条件同1.3.2.1。
1.3.3 金藻昆布多糖测定方法的比较
1.3.3.1 苯胺蓝荧光检测法
准确称取酵母β-1,3-葡聚糖20.00 mg,溶解于1 mol/L氢氧化钠溶液并定容至100 mL,配置成200 μg/mL葡聚糖母液,稀释为1、2、5、10、15、20、30、40、60 μg/mL系列工作液。在1.10 mL工作液中加入2.10 mL苯胺蓝工作液,50 ℃水浴30 min。将反应液pH值调至9.6后室温放置30 min,去除未反应的试剂。取200 μL反应液在398 nm激发波长和502 nm发射波长条件下测定其荧光强度。绘制标准曲线为Y=89.57X+4 264.50(R2=0.99),其中X为酵母β-1,3-葡聚糖质量浓度,Y为荧光强度。
取1.3.2中1.00 mL金藻昆布多糖待测液,加入0.10 mL 6 mol/L氢氧化钠溶液,80 ℃水浴30 min。随后迅速将离心管插入冰浴中10 min,随后加入苯胺蓝工作液,反应后取200 μL反应液测定反应液荧光强度,通过标准曲线计算金藻昆布多糖含量。
1.3.3.2 苯酚-硫酸法
准确称取无水葡萄糖20.00 mg,用蒸馏水溶解并定容至100 mL,制备200 μg/mL葡萄糖储备液,稀释为2、4、6、8、10、20、40、60、80、100、120 μg/mL系列工作液。取1 mL待测样液加入1 mL 5%(m/V)苯酚溶液及5 mL浓硫酸,室温静置10 min后摇匀,避光静置20 min,在490 nm处测定吸光度,绘制标准曲线为Y=0.007 9X+0.057(R2=1.00),式中X为葡萄糖质量浓度,Y为反应物的吸光度。
准确称取5 mg冻干藻粉,加入10 mL超纯水,50 ℃水浴30 min,取1 mL待测样液加入1 mL 5%(m/V)苯酚溶液及5 mL浓硫酸,室温静置10 min后摇匀,避光静置20 min,取上清在490 nm处测定吸光度,通过标准曲线计算葡萄糖含量,结果乘以转换系数0.90计算β-1,3-葡聚糖含量[22]。
1.3.3.3 凝胶液相色谱法
称取200.00 mg分子量为5 200 u的酵母β-1,3-葡聚糖标准品,50%(V/V)乙腈水溶液并定容至100 mL以配置200 μg/mLβ-葡聚糖母液,稀释为40、60、80、100、200、400、600、800、1 000、2 000 μg/mL系列工作液,用于后续凝胶色谱上机。采用1525型高效液相色谱泵、Prevail Carbohydrate ES(250 mm×4.6 mm)色谱柱;流动相为75%(V/V)乙腈溶液;流速为1.0 mL/min;柱温35 ℃;Waters 2414示差折光检测器,进样量20 μL;每个样品运行时间15 min。绘制标准曲线为Y=141.11X-2 394.60(R2=1.00),式中X为β-葡聚糖质量浓度,Y为峰面积。经测定,酵母β-1,3-葡聚糖的出峰保留时间为9.141 min。
取1.3.2中提取后的粗多糖沉淀物T复溶于5 mL流动相中,用于凝胶液相色谱分析,通过标准曲线计算金藻昆布多糖含量。经测定,金藻昆布多糖的出峰保留时间为9.753 min。
1.3.3.4 检测下限、精密度及重现性比较
样品的检测下限是相对于空白可检测到的最低样品浓度,也就是最低检测浓度。定义样品检测下限为3倍的空白标准偏差(即3ð空白),样品定量检测下限为10倍的空白标准偏差(即10ð空白)。
按照1.3.3.1~1.3.3.3方法重复测定同一样品5次,计算相对标准偏差(Relative Standard Deviation,RSD)值,考察三种方法的精密度;按照1.3.2确定的金藻昆布多糖的最佳提取条件制备5份冻干藻粉提取物的待测液,采用1.3.3.1~1.3.3.3方法测定样品浓度,考察样品的重现性。
1.3.3.5 样品加标回收率测定
精密称取待测冻干藻粉6份,采用1.3.2优化的金藻昆布多糖的最佳提取条件得到粗多糖,分别向6份粗多糖中加入2 mL 40 μg/mL酵母β-1,3-葡聚糖进行加样回收实验,用超纯水稀释至10 mL,得待测样液。按照样品测定步骤进行测试,若测定结果显示加样回收率均在方法要求范围100%±5%内,说明方法准确度较高。
1.4 数据分析
采用Origin 9.0和SPSS软件对数据进行处理和统计学分析,实验数据均采用平均值±标准误差(Mean±SD)标出。采用单因素分析法和t-检验进行显著性分析,不同字母之间表示显著性差异(P<0.05)。
2 结果与讨论
2.1 96微孔板的筛选
生工(Sangon Biotech)和康宁(Corning Incorporated Costar)两家品牌的96孔透明板和全黑板对不同品牌96孔板的背景荧光强度如图1所示。结果表明,生工品牌96孔全黑板的背景荧光强度最低(700左右),对待测样品的荧光强度影响最小;而使用透明板或白板的荧光强度高于4 000。预实验结果表明,本实验待测样品的荧光强度为4 000~8 000,因此透明板或者白板会直接影响检测结果的精密度。综上,选择生工品牌96孔全黑板用于后续样品荧光强度的检测。
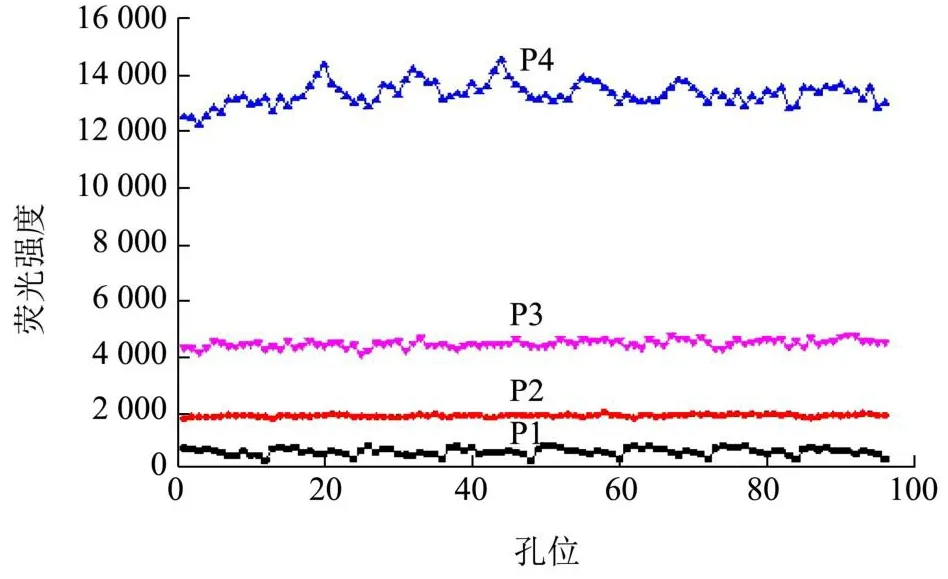
图1 不同品牌96微孔板的背景荧光强度Fig.1 Background fluorescence intensity of 96-well microplates from different brands
2.2 藻粉中金藻昆布多糖提取纯化工艺优化
TE缓冲液提取次数、TCA终体积分数和醇沉与否对金藻昆布多糖含量测定值的影响如图2。由图2a可知,藻粉中金藻昆布多糖含量测定值随着TE缓冲液提取次数的增加而增大,当提取次数为6时,多糖含量测定值最高(18.81%干质量)。说明提取次数越多,金藻昆布多糖的测定含量就越高,但提取次数为4次和6次时,多糖的测定含量无显著差异(P>0.05)。研究表明,水提法提取谷物中β-葡聚糖时,适当延长提取时间可以显著提升产物得率[23]。因此,为了降低提取时间成本并获取高得率,选择TE缓冲液提取次数为4次用于后续优化。
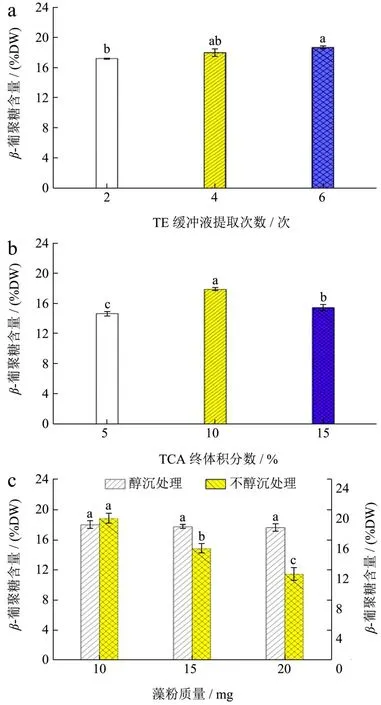
图2 TE缓冲液提取次数(a)、TCA终体积分数(b)和醇沉与否(c)对金藻昆布多糖含量测定值的影响Fig.2 Effects of extraction times by TE Buffer, TCA concentrations and extraction with or without ethanol precipitation on the detected value of chrysolaminarin content
如图2b所示,随着TCA终体积分数的提高,金藻昆布多糖的含量测定值呈现先升高后降低的趋势。当TCA终体积分数为10%时,多糖含量测定值最高(17.91%干质量),比5%和15%条件下高出22%和16%(P<0.05)。辛泉伯等[24]研究了Sevag法和TCA法除蛋白对湛江等鞭金藻中多糖组成和结构特征的影响,结果表明采用Sevag法处理2次或10%(V/V)TCA法可以获得最大的多糖回收率和最小的蛋白残留率,其结果与本研究结果相似。故选择10%(V/V)TCA体积分数条件进行后续实验。
如图2c所示,经醇沉处理后,不同质量藻粉中金藻昆布多糖含量的测定值无显著性差异;而未经醇沉处理组中,多糖含量测定值显著降低(P<0.05)。研究表明,在三角褐指藻胞内岩藻黄素、二十碳五烯酸和金藻昆布多糖的同步提取中,4 ℃过夜醇沉后金藻昆布多糖的得率高达43.54%[1]。本实验所用样品为同一批次培养实验中收获的藻粉,其胞内金藻昆布多糖含量无差异,说明醇沉处理对多糖析出至关重要,大大提高了金藻昆布多糖含量检测的准确度。故后续对粗多糖进行醇沉过夜处理后再测定金藻昆布多糖含量。
2.3 金藻昆布多糖检测下限、精密度及重现性
如表2所示,苯胺蓝荧光法、苯酚-硫酸法和凝胶色谱法线性方程回归范围分别为1~40、2~120和40~2 000 μg/mL,检测下限分别为4.12、4.56和14.93 μg/mL。其中,苯胺蓝荧光法的检测范围最小,凝胶色谱法检测范围最广。但是,苯胺蓝荧光法的检测下限最低,有利于测定低生物量、低含量样品中金藻昆布多糖的含量。
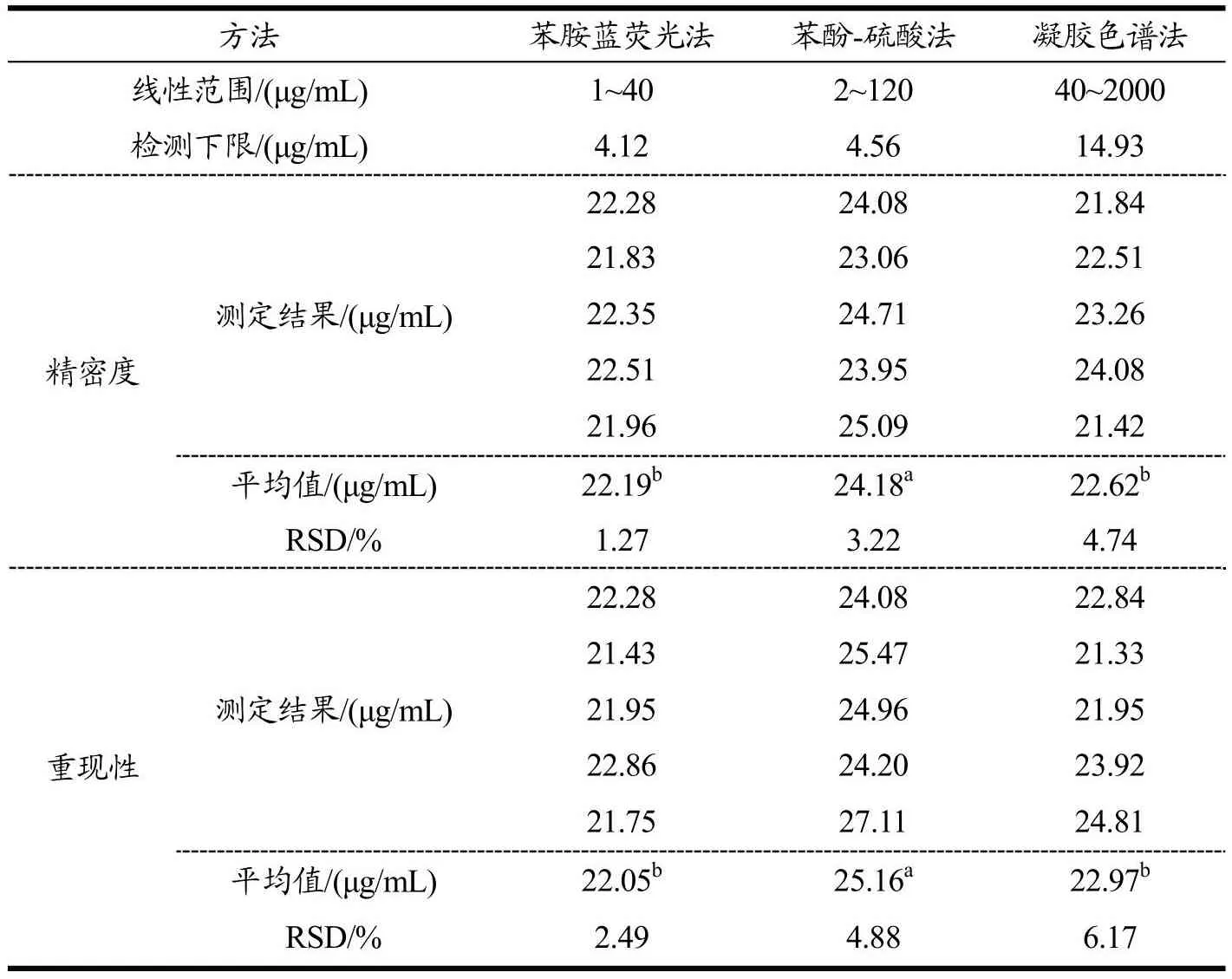
表2 金藻昆布多糖测定方法学的比较Table 2 Comparison of the methodology for chrysolaminarin determination
苯胺蓝荧光法、苯酚-硫酸法和凝胶色谱法的精密度和重现性比较结果见表2。结果表明,三种方法的精密度RSD均小于5%,尤其苯胺蓝荧光法的精密度最高(RSD为1.27%)。而凝胶液相色谱法的精密度最低(RSD为4.74%),可能是示差折光检测器灵敏度较低,对样品的检测下限要求较高。在重现性上,苯胺蓝荧光检测法测得样品含量的RSD最低(2.49%),说明该方法重现性最好。据报道,在燕麦β-葡聚糖的三种测定方法(酶法、凝胶色谱法和刚果红法)中,凝胶色谱法的重现性RSD最大为5.27%[14],与本研究结果基本一致。这是因为凝胶色谱法对样品的纯度要求较高,样品前处理的醇沉过程对该方法检测结果影响较大,意味着样品需要纯化,工作量大、成本高。上述结果表明,苯胺蓝荧光法测定三角褐指藻中金藻昆布多糖含量的精密度和重现性最好。
2.4 加样回收率
在三种方法的线性范围内,考察低浓度标准品(酵母β-1,3-葡聚糖)的加样回收率,测定结果如表3所示。结果表明,苯胺蓝荧光检测法的加标回收率范围在96%~105%之间,平均回收率为100.85%,RSD最小(3.12%),说明苯胺蓝荧光法对于三角褐指藻中金藻昆布多糖的测定更为准确,是优选检测法方法。苯酚硫酸法的加样回收率范围在106%~116%之间,尽管RSD较小(3.19%),但该方法测定结果比实际值偏高,因此不适宜联用校正因子来直接衡量β-1,3-葡聚糖的含量。凝胶液相色谱法的加样回收率范围在98%~109%之间,平均回收率(104.19%)与苯胺蓝荧光法差别不大,可应用于测定金藻昆布多糖的含量。郑立等[21]研究结果同样表明,利用苯胺蓝染色法可以较为准确地测定海带中昆布素(Laminarin)含量,其精密度和稳定性的RSD分别为2.52%和2.09%。韩素芳等[25]利用快速荧光光谱法检测桑黄中的多糖含量,其精密度和加样回收率分别为4.07%和92%~104%,表明此方法适用性好,检测出桑黄粗多糖中β-葡聚糖含量为19.86%。苯胺蓝荧光检测法为新型的检测金藻昆布多糖含量的方法,与常规检测方法相比,其经济成本低、检测的精确度和重现性高,被认为是三角褐指藻中金藻昆布多糖的最佳检测方法。
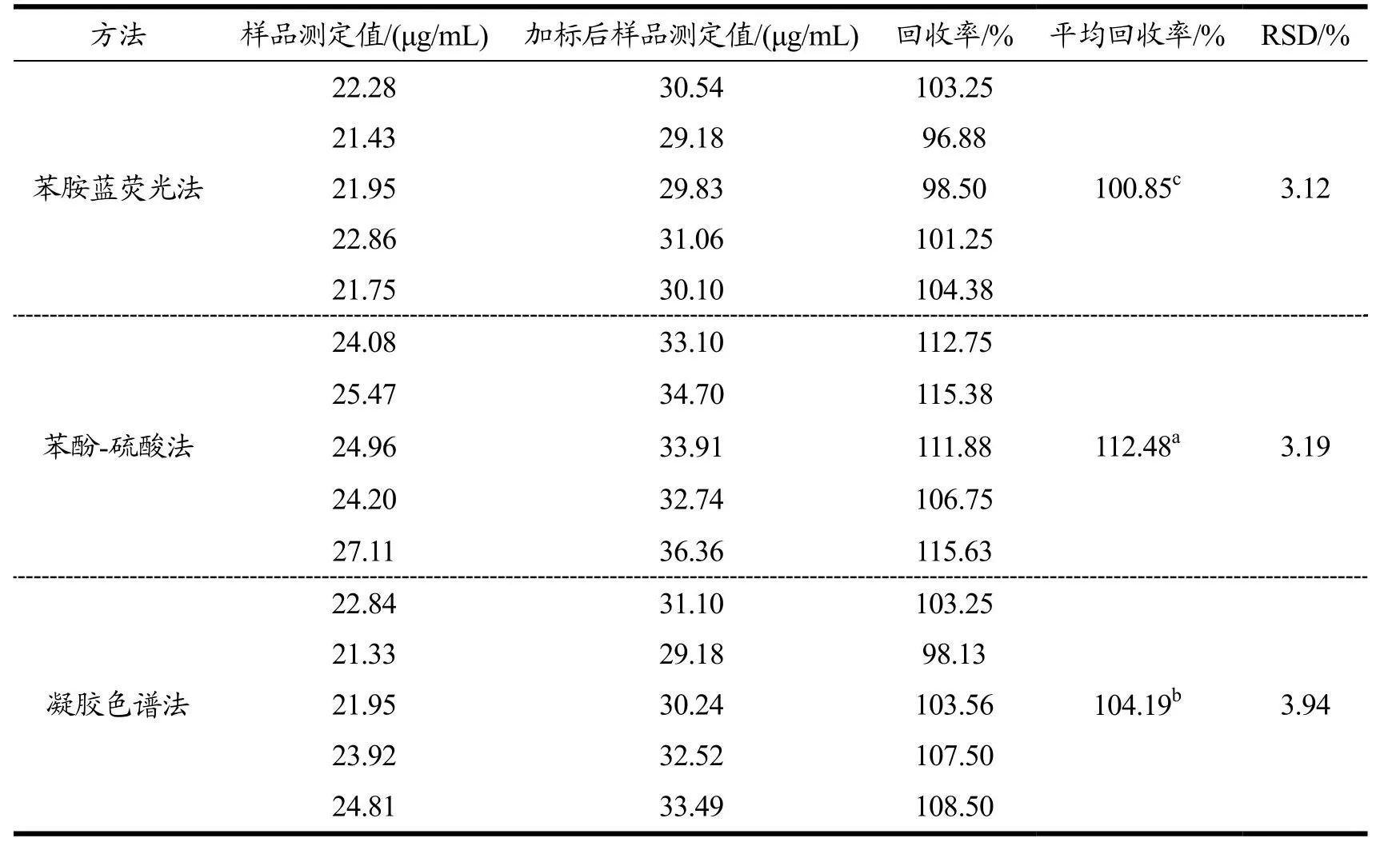
表3 回收率测定结果Table 3 Results of standard recovery
3 结论
本研究针对三角褐指藻中金藻昆布多糖的提取纯化工艺进行了优化,建立了藻粉中含量快速检测的苯胺蓝荧光法。对三角褐指藻胞内金藻昆布多糖的提取工艺进行优化,建立了最佳条件为:TE缓冲液提取4次、以终体积分数10%的TCA溶液除蛋白后对样品进行醇沉处理。经对比三种方法(苯胺蓝荧光法、苯酚-硫酸法和凝胶液相色谱法)的检测下限、精确度、重现性和加样回收率,确定藻粉中金藻昆布多糖含量的最佳检测方法为苯胺蓝荧光法。该方法精密度高、重现性好、加标回收率高,为后续研究和产品品质控制提供了关键分析技术。
