肉桂醛对耐药性肺炎克雷伯菌的抑菌活性及其机制
2023-09-08唐廷杜娟周小仙赵素梅王涛蒋奇滨尹立子
唐廷,杜娟,周小仙,赵素梅,王涛,蒋奇滨,尹立子*
肉桂醛对耐药性肺炎克雷伯菌的抑菌活性及其机制
唐廷1,杜娟1,周小仙2,赵素梅1,王涛1,蒋奇滨1,尹立子1*
(1.四川农业大学动物医学院,四川 成都 611130;2.遵义医科大学附属医院,贵州 遵义 563000)
采用微量肉汤稀释法、平板涂布法及通过生长曲线测定,研究肉桂醛对耐药性肺炎克雷伯菌的抑菌活性;通过电导率、膜电位、DNA渗出量探讨肉桂醛对该菌细胞壁、细胞膜的影响;运用扫描电子显微镜观察肉桂醛作用后该菌的形态变化;通过SDS–PAGE试验探究肉桂醛对该菌胞内蛋白量的影响;采用结晶紫染色法分析肉桂醛对该菌生物膜形成的抑制作用。结果表明:肉桂醛对耐药性肺炎克雷伯菌的最低抑菌浓度为512~1024 μg/mL,最低杀菌浓度为512~2048 μg/mL;与对照组相比,添加肉桂醛1 h时,耐药性肺炎克雷伯菌培养液中电导率极显著增加达到最大,菌体内DNA渗透量极显著升高达到最大;肉桂醛作用后,菌体细胞膜电位极显著升高,出现超极化现象;SDS–PAGE电泳图谱显示,肉桂醛药物作用浓度与细菌胞内蛋白减少量呈正相关;菌体超微结构显示,肉桂醛作用导致菌体细胞壁及细胞膜损伤,且随浓度升高损伤程度增加;生物膜试验结果显示,在所有亚抑菌浓度肉桂醛作用下,肺炎克雷伯菌生物被膜的形成均受到显著抑制,抑制程度与药物浓度呈正相关。综上所述,肉桂醛可通过损伤耐药性肺炎克雷伯菌的细胞膜和细胞壁、破坏菌体可溶性蛋白质代谢和菌体形态结构、抑制生物膜形成等来达到抑菌作用。
耐药性肺炎克雷伯菌;肉桂醛;抑菌活性;抑菌机制
肺炎克雷伯菌()为肠杆菌科克雷伯菌属,属革兰阴性菌,为兼性厌氧菌,是一种常见的人畜共患的条件致病细菌[1]。其致病性与荚膜多糖(CPS)和脂多糖(LPS)等毒力因素及宿主的免疫防御有关[2],可感染人和熊猫、家兔、狐狸、水貂等多种动物,使其出现肺炎、脑膜炎、败血症等临床病症,并成为亚洲地区人群细菌性肝脏脓肿的主要病原体[3]。据中国疾病预防控制中心数据统计,由肺炎克雷伯菌引起的呼吸道感染疾病在所有细菌引起呼吸道感染疾病中位列前五,阳性率达11.8%,由此引起了人们的强烈关注[4]。同时,在肺炎克雷伯菌病的治疗过程中,由于抗生素的不合理使用,导致肺炎克雷伯菌耐药性现象突出,已给治疗带来预想不到的难度,严重危害到人和动物的健康及公共安全。据全国细菌耐药网的检测数据统计,肺炎克雷伯菌对碳青霉烯类抗生素美罗培南和亚胺培南的耐药率分别由2005年的2.9%和3.0%升到2017年的26.3%和25%[5],对头孢菌素类和氟喹诺酮类抗生素也产生耐药性且呈现逐年升高的趋势[6]。可见,研究新型的抗肺炎克雷伯菌感染药物,解决耐药性肺炎克雷伯菌感染问题势在必行。
肉桂醛为中药肉桂挥发油中的主要有效成分。研究[7–8]发现肉桂醛对多种细菌具有较好的抑菌作用,且对人体无毒害,已被广泛应用于食品添加剂。此外,肉桂醛在抗炎、抗氧化、抗糖尿病、抗血小板凝集、抗肿瘤、抗病毒等方面的作用也受到人们广泛的关注[9]。已有多个研究[10–12]表明,肉桂醛通过影响菌体形态、蛋白质代谢及核酸等来达到抑菌效果。笔者以耐药性肺炎克雷伯菌为研究对象,研究肉桂醛对耐药性肺炎克雷伯菌细胞壁和细胞膜损伤、菌体蛋白质代谢、菌体形态结构、生物膜形成抑制等多方面的影响,探索肉桂醛对耐药性肺炎克雷伯菌的体外抑菌作用效果及其机理,以期为解决肺炎克雷伯菌耐药性问题及开发新的抗耐药菌的中药提供依据。
1 材料与方法
1.1 材料
人源耐药性肺炎克雷伯菌由遵义医科大学附属医院检验科分离鉴定;猪、牛、大熊猫、貂等动物来源耐药性肺炎克雷伯菌由四川农业大学动物医学院实验室分离保存。肉桂醛(纯度≥98.0%,成都瑞芬思生物科技有限公司出品)用DMSO(成都索莱宝科技有限公司出品)溶解,配成质量浓度为40.96 mg/mL的母液,备用;胰蛋白胨大豆肉汤培养基(TSB)、琼脂粉、考马斯亮蓝R–250、无水葡萄糖、无水蔗糖购于成都浩博优科技有限公司;磷酸盐缓冲液粉末(PBS)、2.5%戊二醛溶液购于成都好校友生物科技有限公司;SDS–PAGE凝胶配置试剂盒、罗丹明123染液购于创赢博元科技有限公司;结晶紫购于成都索莱宝科技有限公司。
1.2 不同来源肺炎克雷伯菌对肉桂醛的敏感性测定
采用微量肉汤稀释法测定5株肺炎克雷伯菌的耐药谱及肉桂醛对不同来源耐药性肺炎克雷伯菌的最低抑菌浓度(MIC)。取96孔板,采用倍比稀释法使孔中肉桂醛的最终质量浓度分别为2048、1024、512、256、128、64、32、16 μg/mL,后加入稀释好的菌液,同时设置加TSB培养基和菌液的阳性对照组、加TSB培养基和肉桂醛药液的阴性对照组及仅加TSB培养基的空白对照组。参照文献[13]的方法,孔板在37 ℃培养箱中静置培养24 h后,将澄清透明、无菌生长的孔内的肉桂醛的质量浓度定义为该药液的MIC。参照文献[14]的方法,在MIC的基础上,将肉眼可见澄清的所有孔中取100 μL试验菌液均匀涂布于TSA平板,37 ℃静置培养24 h观察结果,以生长的菌落个数不超过5个的肉桂醛质量浓度为该药的最低杀菌浓度(MBC)。
1.3 肉桂醛对耐药性肺炎克雷伯菌生长抑制作用的测定
接种人源耐药性肺炎克雷伯菌于TSB培养基中,37 ℃静置培养过夜,菌液用新鲜TSB液体培养基按体积比1∶100稀释后于37 ℃培养箱中静置培养。当菌液的吸光度(600 nm)为0.3时,分装于50 mL锥形瓶中,加入肉桂醛药液,使最后肉桂醛质量浓度为64、128、256、512 μg/mL,同时设加入DMSO的为对照组,于37 ℃培养箱中静置培养,并在培养0、1、2、4、6、8、16、24 h时分别取出菌液,测定其600 nm。
1.4 耐药性肺炎克雷伯菌培养液中电导率的测定
参照文献[15]的方法,接种人源耐药性肺炎克雷伯菌于TSB培养基中,37 ℃培养至对数生长期,按10%的比例重新转菌体于100 mL TSB培养基中,37 ℃振荡培养12 h,加入1024 μg/mL的肉桂醛药液,以加入DMSO的为对照,于37 ℃恒温箱中静置培养,在0、1、2、4、6、8 h分别取10 mL菌液离心(6000 r/min、5 min),收集上清液,将上清液稀释40倍与5%葡萄糖溶液充分混合后采用电导率仪测定其电导率情况。
1.5 耐药性肺炎克雷伯菌细胞膜电位的测定
采用罗丹明123荧光染色法[16]测定膜电位。接种人源耐药性肺炎克雷伯菌于TSB液体培养基中,37 ℃培养至对数生长期,分别加入128、256、512、1024 μg/mL的肉桂醛药液,对照组加DMSO溶液,振荡培养6 h后离心(6000 r/min、5 min)弃上清液,菌体用无菌磷酸盐缓冲液洗涤后重悬于无菌磷酸盐缓冲液中,备用;使用无菌磷酸盐缓冲液将罗丹明123充分溶解,使其配制成质量浓度为1 mg/mL的母液,备用;随后加入菌液储备液中,使其终质量浓度为2 μg /mL,于37 ℃恒温箱中避光孵育30 min,孵育完毕后离心,弃上清多余浮料,菌体用无菌磷酸盐缓冲液充分洗净、重悬;最后转移至96孔板中,采用酶标仪测定其平均荧光强度,其中,设置激发波长为480 nm,发射波长为530 nm。
1.6 耐药性肺炎克雷伯菌外渗DNA含量的测定
接种人源耐药性肺炎克雷伯菌于TSB培养基中培养至对数生长期,离心(6000 r/min、10 min),收集菌体后用无菌PBS缓冲液洗涤菌体3次后重悬,加入1024 μg/mL的肉桂醛药液,以加入DMSO溶液的为对照组,37 ℃振荡培养。分别于0、1、2、4、6、8 h时取菌液离心(6000 r/min、5 min),得上清液后采用分光光度计测量其260 nm值,以260 nm表示胞外DNA渗出相对量[17]。
1.7 耐药性肺炎克雷伯菌的形态观察
将人源耐药性肺炎克雷伯菌接种于TSB培养基中培养至对数期,分别添加128、256、512、1024 μg/mL肉桂醛药液,以不加肉桂醛的为空白对照组,37 ℃振荡培养12 h;取细菌悬液6000 r/min离心10 min,弃去上清液,用已灭菌的PBS缓冲液洗涤菌体沉淀,用2.5%戊二醛溶液固定菌体,4 ℃下放置4 h,然后用PBS缓冲液洗涤3遍,经过30%、50%、70%、90%的乙醇进行梯度脱水,最后用无水乙醇洗脱3次,每次约5 min;随后室温晾干,干燥后的样品喷金后用扫描电子显微镜观察细菌形态[18]。
1.8 耐药性肺炎克雷伯菌可溶性蛋白含量的测定
接种人源耐药性肺炎克雷伯菌于TSB培养基中,37 ℃振荡培养至对数生长期,分别加入128、256、512 μg/mL的肉桂醛药液,以不加药液但加DMSO溶液作为对照组,37 ℃振荡培养24 h后取菌体离心,弃去上清液,使用无菌磷酸缓冲液调节菌体值,以保持各组菌体值相近;收集菌体,用无菌PBS缓冲液清洗3次,菌液重新悬浮于PBS中超声破碎,离心(8000 r/min、10 min)取上清液,将上清液和4×上样缓冲液以3∶1的比例充分混匀,100 ℃加热10 min,取样进行聚丙烯酰胺凝胶电泳(SDS–PAGE)。电泳结束后用考马斯亮蓝R–250进行凝胶染色,再用脱色液脱色后进行照片处理[19]。
1.9 耐药性肺炎克雷伯菌生物膜形成的测定
将人源耐药性肺炎克雷伯菌接种于TSB培养基中培养至对数期,随后转移菌液至含有0、16、32、64、128、256 μg/mL肉桂醛的TSB培养基中,共同培养至对数期(600 nm=0.6);于不同浓度培养物中分别取10 μL菌液加入至96孔板中,同时每孔加入290 μL含有3%的含药培养基,保持混合液最终浓度为原有药物浓度,将混合液放置于厌氧环境下,37 ℃静置培养36 h后移除96孔板中所有液体,加入100 μL的10%甲醛溶液,随后室温过夜培养;移除甲醛溶液,向每孔中加入0.1%的结晶紫100 μL,再室温培养30 min,最后用双蒸水冲洗并加入33%的乙酸200 μL,充分混匀后用酶标仪测量其490 nm值[20]。
1.10 数据分析
每个试验重复3次,结果取平均值。采用Prism8.0进行数据差异显著性分析。
2 结果与分析
2.1 耐药性肺炎克雷伯菌对肉桂醛的敏感性
由表1可知,肉桂醛对耐药性肺炎克雷伯菌的MIC为512~1024 μg/mL,MBC为512~2048 μg/mL,说明肉桂醛对耐药性肺炎克雷伯菌具有一定的抑制作用,且对人源肺炎克雷伯菌的抑菌活性最好。

表1 不同来源肺炎克雷伯菌对肉桂醛的敏感性
2.2 肉桂醛对耐药性肺炎克雷伯菌生长的影响
从图1可知,在肉桂醛质量浓度为512 μg/mL时,完全抑制了菌体的生长;在亚抑菌浓度作用下,肉桂醛对细菌的生长有一定的影响,但不明显。

图1 添加不同质量浓度肉桂醛的耐药性肺炎克雷伯菌的生长情况
2.3 肉桂醛对耐药性肺炎克雷伯菌培养液中电导率的影响
从图2可知,在加入肉桂醛药液1 h时,培养液中的电导率极显著(0.01)增加,电导率值达到最大,但随着共同培养时间的延长,电导率值变化不大,基本趋于平衡;而不加药物的对照组在1~8 h内培养液电导率基本保持不变。可见,肉桂醛可以在短时间内改变耐药性肺炎克雷伯菌的细胞膜通透性。
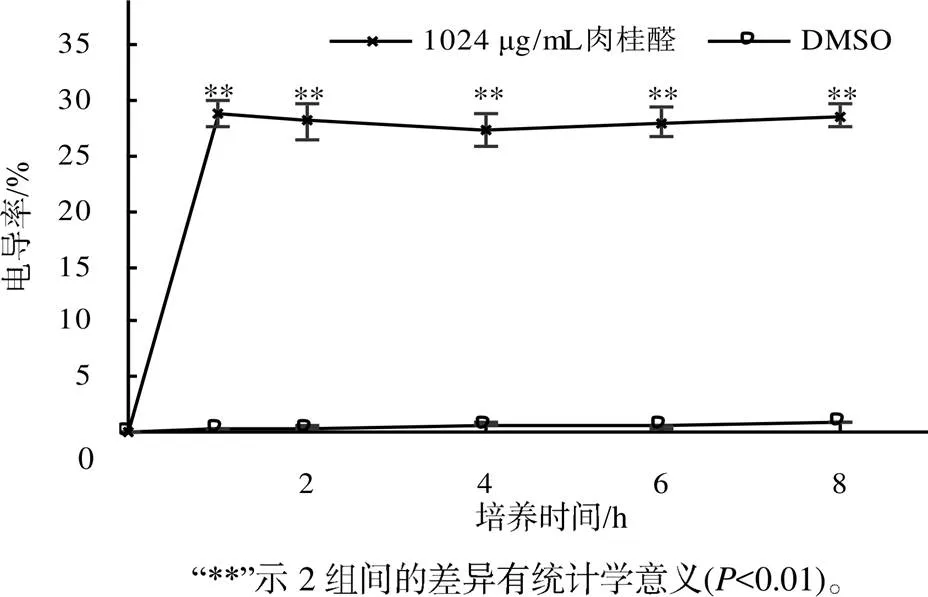
图2 肉桂醛作用耐药性肺炎克雷伯菌后不同时间点的培养液电导率
2.4 肉桂醛对耐药性肺炎克雷伯菌细胞膜电位的影响
从图3可知,与未处理的对照组相比,在128、256、512、1024 μg/mL肉桂醛作用6 h后,细胞膜的荧光强度均极显著(P<0.01)升高。可见,肉桂醛可显著影响耐药性肺炎克雷伯菌的细胞膜电位。
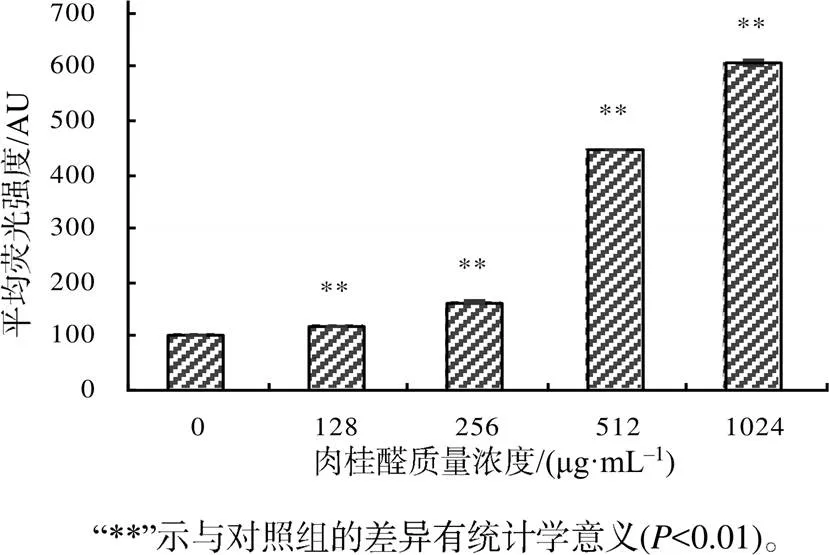
图3 添加不同浓度的肉桂醛后耐药性肺炎克雷伯菌的细胞膜电位
2.5 肉桂醛对耐药性肺炎克雷伯菌DNA外渗量的影响
从图4可知,与对照组相比,在肉桂醛作用1 h内耐药性肺炎克雷伯菌DNA大分子的外渗量极显著(<0.01)升高,但随着药物作用时间的继续延长,菌体的DNA渗出量再无明显变化,说明肉桂醛可在短时间内引起细胞膜的损伤。

图4 肉桂醛作用耐药性肺炎克雷伯菌后不同时间点的DNA渗出量
2.6 肉桂醛对耐药性肺炎克雷伯菌形态的影响
不同浓度肉桂醛作用耐药性肺炎克雷伯菌后,通过扫描电镜观察的结果如图5所示。与空白组相比,添加256 μg/mL肉桂醛时,耐药性肺炎克雷伯菌细胞膜发生坍塌,但细胞形态基本维持正常;添加512 μg/mL肉桂醛时,细胞膜出现皱缩,且部分菌体出现破碎;添加1024 μg/mL肉桂醛时,菌体损伤更严重,细胞膜皱缩更明显,菌体破碎更严重,且出现溶解。可见,随着药物浓度的增加,菌体的损伤程度越严重,推测该损伤可能是肉桂醛作用耐药性肺炎克雷伯菌引起菌体死亡的重要因素。

a 对照组;b、c、d 分别示添加256、512、1024 μg/mL肉桂醛组。
2.7 肉桂醛对耐药性肺炎克雷伯菌可溶性蛋白的影响
从图6可知,与未加药物的空白组相比,加入256 μg/mL肉桂醛时,蛋白条带明显变浅,且随着药物浓度的增加,蛋白条带变浅程度更明显。可见,肉桂醛可影响耐药性肺炎克雷伯菌的胞内蛋白代谢,其影响程度与药物浓度呈正相关。

M 预染蛋白Marker;1 对照组;2~4 分别示添加128、256、512 μg/mL肉桂醛组。
2.8 肉桂醛对耐药性肺炎克雷伯菌生物膜的形成的抑制作用
从图7可知,在亚抑菌浓度(16、32、64、128、256 μg/mL)的肉桂醛作用后,培养液中490 nm显著(0.05)或极显著(0.01)降低,可见,菌体形成的生物膜均明显减少,与对照组相比差异均有统计学意义,且药物浓度与生物膜形成的抑制程度成正相关。说明肉桂醛可显著抑制耐药性肺炎克雷伯菌生物膜的形成。

“*”“**”分别示与对照组的差异有统计学意义(P<0.05、P<0.01)。
3 结论与讨论
相关研究[21]报道的抑菌物质对细胞损伤的机理包括影响细胞膜蛋白凝聚、膜蛋白活性丧失、促使膜形成促进药物进出的离子通道、破坏细胞膜的完整性、引起膜通透性改变等,从而导致细菌无法正常生活后瓦解死亡。研究[22–23]发现,肉桂醛抑制细菌的机制主要为损伤细菌细胞膜和细胞壁及影响蛋白质代谢等。此外,细菌的细胞膜结构还可通过维持细胞相对稳定的内环境,以保持细胞内外渗透压的平衡来达到保证细胞的正常生命活动的功能[24],当细胞膜被破坏时,细胞内物质会释放出来,如钠、钾离子及DNA、RNA等[25]。本研究中,利用电导率仪对培养液中电解质的检测来探究细胞内容物的外溢情况,以反映细胞膜损伤情况,结果显示电导率在短时间出现极显著上升,说明肉桂醛可在短时间内达到损伤肺炎克雷伯菌细胞膜的作用。在肉桂醛作用后,菌体大分子物质DNA在短时间内极显著外渗,通过外渗量可直观反映出菌体细胞膜通透性增强的改变情况。推测可能是由药物引发细胞膜膜蛋白结构异常,物质交换难以正常进行所致,其结果与电导率试验结果一致。
罗丹明123是一种亲脂性阳离子染料,凭借跨膜电位进入到细胞基质中,通过荧光强度变化反映膜电位的变化[26]。在正常的细菌体内,通常膜内的电压比膜外的低,当细胞膜电位降低时,说明细胞膜出现去极化现象;反之,则说明细胞膜发生了超极化现象[27]。本研究中,当肉桂醛作用于耐药性肺炎克雷伯菌6 h后,耐药肺炎克雷伯菌呈现超极化现象,使细胞膜两侧各种离子浓度不再呈现原有相对稳定梯度,最终使细菌生长代谢受到影响,进而可能导致菌体死亡。这与LI等[28]研究得到绿原酸可导致金黄色葡萄球菌的细胞膜出现超极化现象的结果一致。
由扫描电镜观察得知,肉桂醛作用耐药性肺炎克雷伯菌后,导致菌体的基本形态受到破坏。细胞壁和细胞膜是维持细菌基本形态的基础,药物作用导致菌体细胞壁及细胞膜损伤,进而导致菌体无法维持正常形态以及正常的生理活动,甚至出现死亡,其与肉桂醛作用耐药肺炎克雷伯导致DNA渗出,电导率改变、膜超极化等试验结果相一致。
可溶性蛋白是细菌重要的渗透调节物质[29],它的增加和积累可提高细胞的保水能力。在肉桂醛的作用下,肺炎克雷伯菌胞内可溶性蛋白减少,说明肉桂醛可影响菌体可溶性蛋白的代谢,从而达到抑制肺炎克雷伯菌正常生命活动的作用。
细菌生物被膜是细菌在生长过程中为保护自身存在而特有的生命现象,可使细菌避开机体的免疫防御和抑菌药物的杀伤作用,且其作为细菌的天然保护屏障,加强细菌对环境的耐受性,成为疾病难治愈和反复发作的主要原因[30]。贾雯等[31]研究证明,肺炎克雷伯菌是易形成生物膜的细菌之一,其形成生物膜也是对抗生素耐药的重要原因。本研究中,在各亚抑菌药物浓度下,肉桂醛对其肺炎克雷伯菌生物膜的形成均具有显著抑制作用,由此说明肉桂醛有望成为扭转肺炎克雷伯菌耐药性的药物。
综上所述,肉桂醛可通过影响耐药性肺炎克雷伯菌的细胞壁和细胞膜、菌体内可溶性蛋白、菌体形态结构及生物膜形成等来达到抑菌作用。
[1] 唐小红,朱卫民.肺炎克雷伯菌耐碳青霉烯类抗菌药的研究进展[J].国外医药(抗生素分册),2014,35(3):115–118.
[2] BALAMAYOORAN G,BATRA S,FESSLER M B,et al.Mechanisms of neutrophil accumulation in the lungs against bacteria[J].American Journal of Respiratory Cell and Molecular Biology,2010,43(1):5–16.
[3] 吴柳,张洁,孙琳,等.肺炎克雷伯菌肝脓肿70例临床分析[J].中国感染与化疗杂志,2018,18(1):11–17.
[4] 朱利霞,王洪彬,赵希艳,等.肺炎克雷伯菌研究进展[J].黑龙江畜牧兽医,2019(13):42–45.
[5] HU F P,GUO Y,YANG Y,et al.Resistance reported from China antimicrobial surveillance network(CHINET) in 2018[J].European Journal of Clinical Microbiology & Infectious Diseases,2019,38(12):2275–2281.
[6] 邱星安.肺炎克雷伯菌的耐药趋势及耐药机制的研究进展[J].中国现代药物应用,2011,5(5):236–238.
[7] MALHEIRO J F,MAILLARD J Y,BORGES F,et al. Evaluation of cinnamaldehyde and cinnamic acid derivatives in microbial growth control[J].International Biodeterioration & Biodegradation,2019,141:71–78.
[8] UZUNLU S,NIRANJAN K.Laboratory antimicrobial activity of cinnamaldehyde and pomegranate-based polycaprolactone films[J].Journal of Applied Polymer Science,2017,134(39):45347.
[9] 刘玉兰.肉桂醛脂质体的制备及理化性质研究[D].长春:吉林大学,2019.
[10] SUN Q,SHANG B,WANG L,et al.Cinnamaldehyde inhibits fungal growth and aflatoxin B1biosynthesis by modulating the oxidative stress response of[J].Applied Microbiology and Biotechnology,2016,100(3):1355–1364.
[11] MOUSAVI F,BOJKO B,BESSONNEAU V,et al. Cinnamaldehyde characterization as an antibacterial agent towardmetabolic profile using 96-blade solid-phase microextraction coupled to liquid chromate- graphy-mass spectrometry[J].Journal of Proteome Research,2016,15(3):963–975.
[12] NARAYANAN A,MUYYARIKKANDY M S,MOOYOTTU S,et al.Oral supplementation of trans- cinnamaldehyde reduces uropathogeniccolonization in a mouse model[J].Letters in Applied Microbiology,2017,64(3):192–197.
[13] 鲁茹,陆桂玉,林浙哲,等.增强耐甲氧西林金黄色葡萄球菌抗生素敏感性的中药筛选[J].世界科学技术–中医药现代化,2018,20(12):2217–2223.
[14] 李汉浠,任赛赛,李勇,等.枫杨萘醌对常见菌的抗菌谱、最低抑菌浓度和最低杀菌浓度研究[J].时珍国医国药,2012,23(6):1422–1424.
[15] 王海涛.大豆异黄酮的抑菌活性及其机制的研究[D].大连:辽宁师范大学,2009.
[16] 刘雪,王静楠,陈文学,等.柠檬烯对铜绿假单胞菌的抑菌活性及其机理[J].食品工业科技,2018,39(7):1–5.
[17] 蒋斌,苏琰,蔡玉华.连翘对金黄色葡萄球菌的抑菌作用及机制的试验研究[J].基因组学与应用生物学,2018,37(8):3401–3406.
[18] 陈颖慧.紫甘蓝提取物对食源性致病菌的抑菌作用[J].食品研究与开发,2017,38(17):31–34.
[19] 石超峰,殷中琼,魏琴,等.α–松油醇对大肠杆菌的抑菌作用及其机理研究[J].畜牧兽医学报,2013,44(5):796–801.
[20] 戴雨芸,李超,袁中伟,等.香芹酚抑制金黄色葡萄球菌生物被膜的形成[J].微生物学通报,2020,47(3):813–820.
[21] 董世雷,刘伟,谢秀芝,等.抗菌肽及其应用前景概述[J].浙江农业报,2011,23(6):1274–1281.
[22] 何学文,戴雨芸,李欣越,等.肉桂醛体外对鼠伤寒沙门氏菌的抑菌机制[J].江西农业大学学报,2020,42(1):150–156.
[23] 王帆,杨静东,王春梅,等.肉桂醛对大肠杆菌和绿脓杆菌的作用机制[J].江苏农业学报,2011,27(4):888–892.
[24] 谢强,林玉桓,苗淑萍,等.香芹酚对大肠杆菌和金黄色葡萄球菌细胞膜的影响[J].食品工业科技,2014,35(23):54–58.
[25] CHEN C Z,COOPER S L.Interactions between dendrimer biocides and bacterial membranes[J]. Biomate- rials,2002,23(16):3359–3368.
[26] 张赟彬,刘笑宇,姜萍萍,等.肉桂醛对大肠杆菌和金黄色葡萄球菌的抑菌作用及抑菌机理研究[J].现代食品科技,2015,31(5):31–35.
[27] 乔支红,程永强,鲁战会,等.乳酸对三种食源性致病菌的抑菌及杀菌作用[J].食品科技,2008,33(10):187–191.
[28] LI G H,WANG X,XU Y F,et al.Antimicrobial effect and mode of action of chlorogenic acid on[J].European Food Research and Technology,2014,238(4):589–596.
[29] 袁中伟,陈志英,甘盈盈,等.百里香酚对耐甲氧西林金黄色葡萄球菌的抑菌作用机制[J].华南农业大学学报,2018,39(6):18–23.
[30] 张蒙蒙,刘静,张靖菊,等.中药及有效成分对动物源病原菌生物被膜抑制作用的研究进展[J].现代畜牧兽医,2020(11):60–64.
[31] 贾雯,郭瑞林.肺炎克雷伯菌生物膜形成及调控机制的研究进展[J].中国医学科学院学报,2021,43(6):936–944.
Antibacterial activity and mechanism of cinnamaldehyde against drug-resistant
TANG Ting1,DU Juan1,ZHOU Xiaoxian2,ZHAO Sumei1,WANG Tao1,JIANG Qibin1,YIN Lizi1*
(1.College of Veterinary Medicine, Sichuan Agricultural University, Chengdu, Sichuan 611130, China; 2.Affiliated Hospital of Zunyi Medical University, Zunyi, Guizhou 563000, China)
This study investigated the antimicrobial activity of cinnamaldehyde against drug-resistantusing microbroth dilution and plate coating methods, and growth curve determination. The impacts of cinnamaldehyde on cell wall and membrane were evaluated through conductivity, membrane potential and DNA leakage assays. Scanning electron microscopy was employed to observe bacterial morphology changes. The effect of cinnamaldehyde on intracellular protein levels was assessed using SDS-PAGE, and its inhibitory effect on biofilm formation was determined by crystal violet staining. Results indicated that cinnamaldehyde’s minimum inhibitory concentration against drug-resistantranged from 512 to 1024 μg/mL, with a minimum bactericidal concentration between 512 and 2048 μg/mL. Upon cinnamaldehyde exposure, the culture medium’s conductivity and intracellular DNA leakage significantly increased to the maximum within the first hour. Additionally, there was a notable increase in cell membrane potential leading to hyperpolarization. SDS-PAGE electrophoresis revealed a positive correlation between cinnamaldehyde concentration and intracellular protein reduction. Ultrastructural observations demonstrated that cinnamaldehyde damages both the cell wall and membrane, with the degree of damage corresponding to its concentration. Furthermore, biofilm formation bywas notably inhibited by all sub-inhibitory concentrations of cinnamaldehyde, with the degree of inhibition positively correlating with drug concentration. In summary, cinnamaldehyde exhibited antibacterial effects by impairing the cell membrane and wall, disrupting soluble protein metabolism and cell morphology, and inhibiting biofilm formation.
; cinnamaldehyde; antibacterial activity; antibacterial mechanism
S853.74
A
1007–1032(2023)04–0472–07
2022–03–11
2023–08–02
国家自然科学基金项目(31702284);四川省教育厅项目(2021YFH0156)
唐廷(1997—),女,四川广安人,硕士研究生,主要从事兽医药理学研究,tangting_sicau@163.com;*通信作者,尹立子,博士,副教授,主要从事兽医药理学研究,yinlizi@sicau.edu.cn
10.13331/j.cnki.jhau.2023.04.015
唐廷,杜娟,周小仙,赵素梅,王涛,蒋奇滨,尹立子.肉桂醛对耐药性肺炎克雷伯菌的抑菌活性及其机制[J].湖南农业大学学报(自然科学版),2023,49(4):472–478.
TANG T,DU J,ZHOU X X,ZHAO S M,WANG T,JIANG Q B,YIN L Z.Antibacterial activity and mechanism of cinnamaldehyde against drug-resistant[J].Journal of Hunan Agricultural University (Natural Sciences),2023,49(4):472–478.
http://xb.hunau.edu.cn

责任编辑:邹慧玲
英文编辑:柳正
