鸭坦布苏病毒E蛋白生物信息学分析
2023-09-08杜志强朱玲玲殷世彬汪招雄
胡 怡,徐 欢,杜志强,朱玲玲,汪 婷,殷世彬,汪 威,汪招雄
(长江大学动物科学学院,荆州 434025)
鸭坦布苏病毒(Duck Tembusu virus,DTMUV)是一种能引起蛋鸭产蛋量下降,卵泡膜出血的单股正链RNA病毒[1]。自2010年开始,国内部分鸭场陆续暴发了鸭坦布苏病毒病,给我国养鸭业造成了巨大的经济损失。DTMUV是黄病毒科黄病毒属成员,能感染鸭、鸡、鹅、鸽子等[2]。Tang等[3]在鸭场员工血清中检测到了DTMUV抗体,表明其对人具有潜在威胁性。该病毒的开放性阅读框(open reading frame,ORF),编码产生了一个长为3425个氨基酸的多肽,在宿主和病毒蛋白酶的作用下,水解为C、prM、E、NS1、NS2A、NS3、NS4A和NS5蛋白。其中C、prM、E蛋白为该病毒的结构蛋白,其他为非结构蛋白[4]。
DTMUV的E蛋白是重要的免疫原性蛋白,能诱导机体产生中和抗体[5],是研究亚单位疫苗的重要蛋白。研究结果表明,E蛋白在病毒的组织嗜性、神经毒性、介导病毒与细胞膜融合以及致病力等方面有着重要的作用[6-7]。通过对E蛋白进行生物信息学分析,其研究结果将为亚单位疫苗的研发,基因功能的研究提供更多的理论依据。
1 材料与方法
1.1 材料 毒株DTMUV E基因序列由本实验室分离病毒测序,由NovoPro软件将其翻译成氨基酸序列。
1.2 DTMUV E蛋白的理化性质分析 利用Protparam(https://web.expasy.org/protparam)分析DTMUV E蛋白的相对分子质量、理论等电点、不稳定指数等理化性质。
1.3 DTMUV E蛋白的亲疏水性分析 利用ProtScale(https://web.expasy.org/protscale/)在线软件对DTMUV E蛋白进行亲疏水性分析。
1.4 DTMUV E蛋白的跨膜区分析 利用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/-TMHMM/)分析DTMUV E蛋白的跨膜区。
1.5 DTMUV E蛋白的信号肽分析 利用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP)分析DTMUV E蛋白的信号肽。
1.6 DTMU E蛋白的亚细胞定位预测 利用Virus-mPLoc(http://www.csbio.sjtu.etu.cn/bioinf/vir-us-multi/)预测DTMUV E蛋白的亚细胞定位。
1.7 DTMUV E蛋白的二级结构预测 利用SOPMA(https://prabi.ibcp.fr/htm/site/web/login/SO-PMA)预测DTMUV E蛋白的二级结构,分析其无规律卷曲、α-螺旋、β-转角和延伸链的比例。
1.8 DTMUV E蛋白的三级结构预测 利用Phyre 2(http://www.sbg.bio.ic.ac.uk/~phyre)在线软件预测DTMUV E蛋白的三级结构,运用c5wsnC模型来进行预测。
1.9 DTMUV E蛋白的翻译后修饰位点预测分析 分别利用NetNGlyc 1.0 Server(http://www.c-bs.dtu.dk/services/NetNGlyc/)、NetAcet 1.0 Server(http://www.cbs.dtu.dk/services/NetAcet/)和NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)预测分析DTMUV E蛋白的糖基化、乙酰化和磷酸化修饰位点(阈值都为0.5)。
1.10 DTMUV E蛋白的潜在抗原表位分析 利用Predicting Anti-genic Peptides(http://imed.me--d.ucm.es/Tools/antigenic.pl)在线软件对DTMUV E蛋白的抗原决定簇进行预测分析(阈值为0.5)。利用IEDB(http://tools.immuneepitope.org/bcell/)对DTMUV E蛋白的B细胞抗原表位进行预测分析(阈值为0.35)。利用NetMHCⅡpan 3.1Server(http://www.cbs.dtu.dk/services/Net-MHCⅡpan)对DTMUV E蛋白的T细胞抗原表位进行预测分析。选取HLA_DRB1_0101、HLA_DRB1_0301、HLA_DRB1_0401、HLA_DRB1_0701、HLA_DRB1_0801、HLA_DRB--1_0901、HLA_DRB1_1001、HLA_DRB1_1201、HLA_DRB1_1301、HLA_DRB1_1401、HLA_DRB1_1501、HLA_DRB1_1601亚型为限定条件。
2 结果
2.1 DTMUV E蛋白的理化性质分析结果 DTMUV E蛋白的分子式为C2405H3757N649O723S32,相对分子质量为54357.12。DTMUV E蛋白由501个氨基酸组成,其中包含了20种氨基酸,氨基酸的组成及比例见图1。E蛋白的正负电荷氨基酸残基数分别为47和46个,其理论等电点为7.63。E蛋白的不稳定指数为26.84,低于阈值40,表明该蛋白为稳定性蛋白。
2.2 DTMUV E蛋白的亲疏水性分析结果 DTMUV E蛋白的平均亲水性指数为-0.092,位于第489和490位氨基酸的疏水性指数最大,为2.700,位于第398位氨基酸的疏水性指数最小,为-2.211,且该蛋白的亲水性氨基酸区域多于疏水性氨基酸区域,预测该蛋白为亲水性蛋白(图2)。
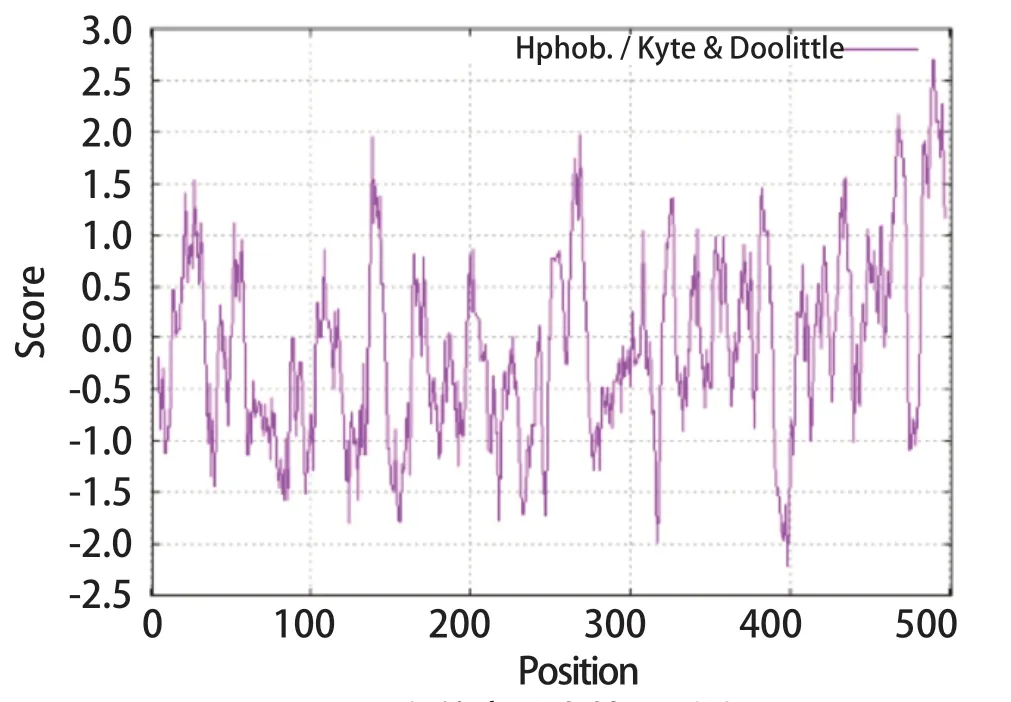
图2 E蛋白的亲疏水性预测结果Fig.2 Hydrophilic and hydrophobic prediction of E protein
2.3 DTMUV E蛋白的跨膜区分析结果 如图3所示,E蛋白有两个跨膜螺旋区,分别位于452~474位和481~499位。

图3 E蛋白跨膜螺旋区预测结果Fig.3 Predicted results of E protein transmembrane helical region
2.4 DTMUV E蛋白的信号肽分析结果 如图4所示C值(剪切位点)和Y值(综合S值和C值)均在第18位氨基酸达到最大,分别为0.169和0.134,S值(信号肽)第1~17位氨基酸的平均值为0.119,Y值与S值均小于阈值0.5,预测该蛋白没有信号肽结构。
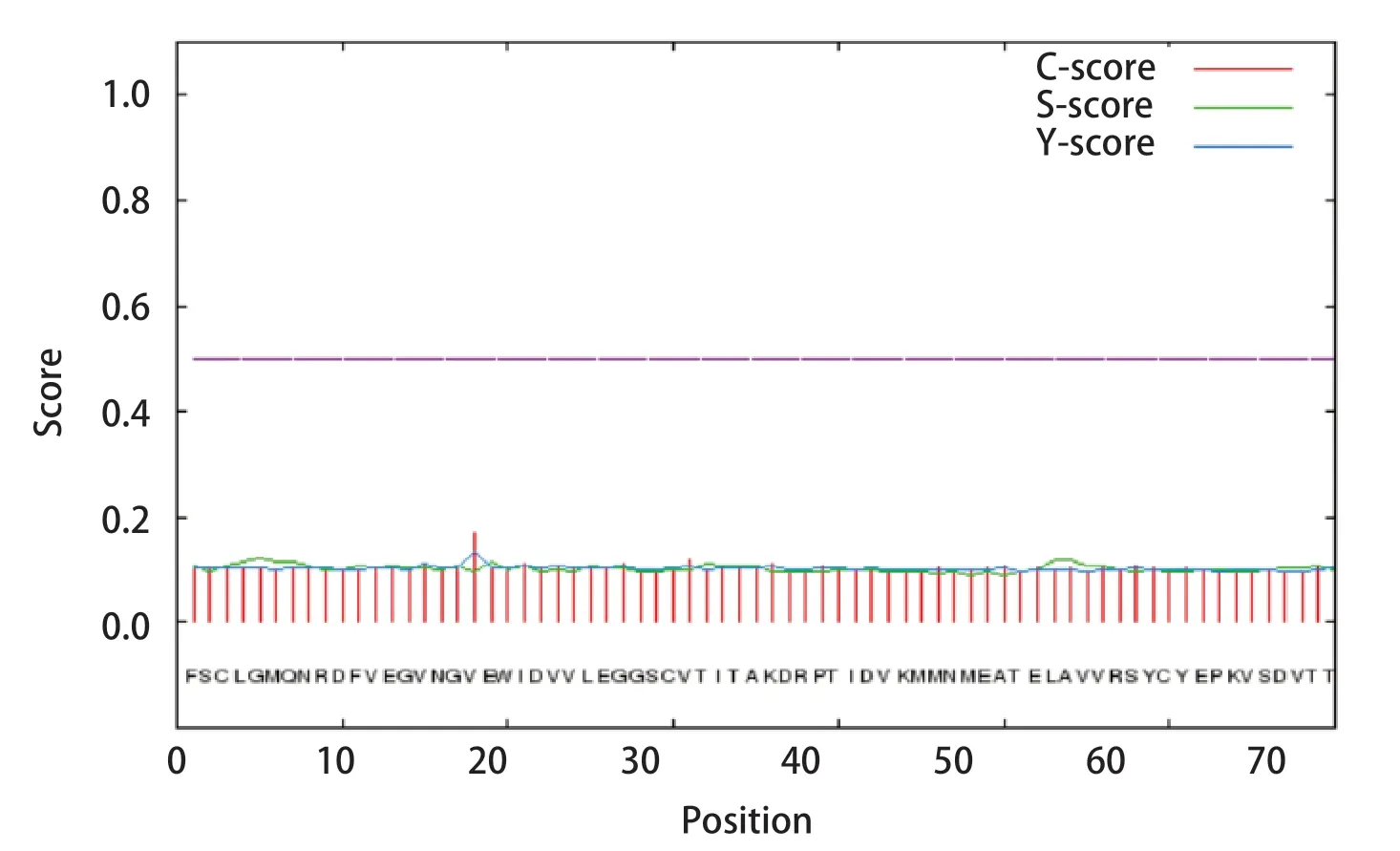
图4 E蛋白信号肽预测结果Fig.4 Prediction results of E protein signal peptide
2.5 DTMUV E蛋白的亚细胞定位分析结果 预测结果表明,E蛋白定位于病毒衣壳中,表明E蛋白为囊膜蛋白。
2.6 DTMUV E蛋白的二级结构分析结果 如图5所示,E蛋白中有208个氨基酸参与无规律卷曲的形成,占比最大,为41.52%;有100个氨基酸参与α-螺旋的形成,占比为19.96%;有162个氨基酸参与延伸链的形成,占比为32.34%;有31个氨基酸参与β-转角的形成,占比为6.19%。

图5 E蛋白二级结构预测结果Fig.5 Secondary structure prediction results of E protein
2.7 DTMUV E蛋白的三级结构分析结果 E蛋白的三级结构预测模型(c5wsnC)如图6所示,该预测模型的蛋白覆盖率为100%,可信度为100%。
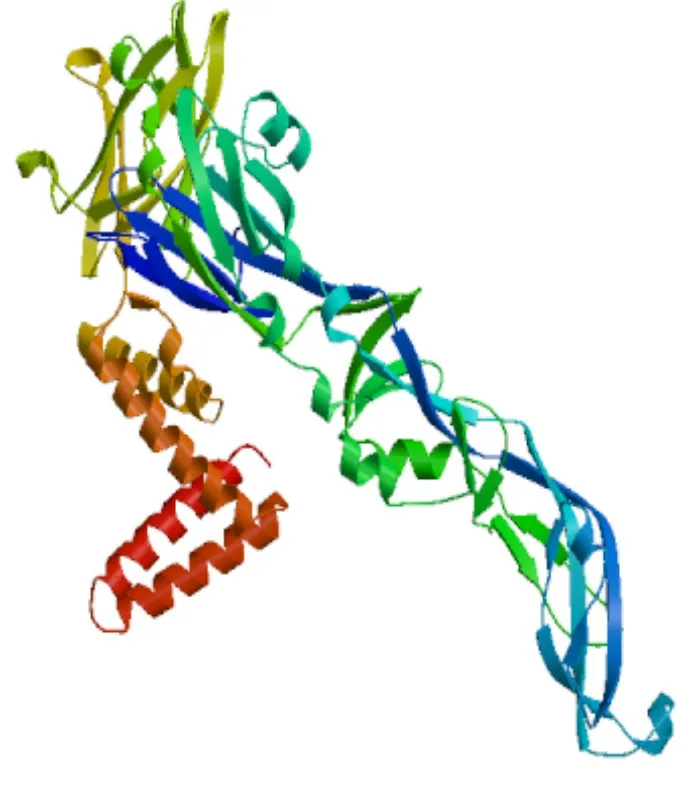
图6 E蛋白的三级结构模型Fig.6 Tertiary structure model of E protein
2.8 DTMUV E蛋白的翻译后修饰位点分析结果如图7所示,E蛋白有18个潜在的糖基化修饰位点,分别位于第8位、16位、47位、82位、103位、134位、154位、207位、214位、222位、235位、277位、307位、314位、347位、359位、475位和498位氨基酸。利用NetAcet软件预测结果表明,E蛋白没有乙酰化修饰位点。如图8所示,E蛋白含有24个丝氨酸磷酸化修饰位点,5个络氨酸磷酸化修饰位点,23个苏氨酸磷酸化修饰位点,包含有PKA、PKC、PKG、unsp、cdk5、p38MAPK、GSK3、SRC、CKⅠ、CKⅡ、EGFR、DNAPK、INSR、cdc2、RSK总共15类蛋白质激酶结合位点。

图7 E蛋白糖基化预测结果Fig.7 Predicted results of E protein glycosylation
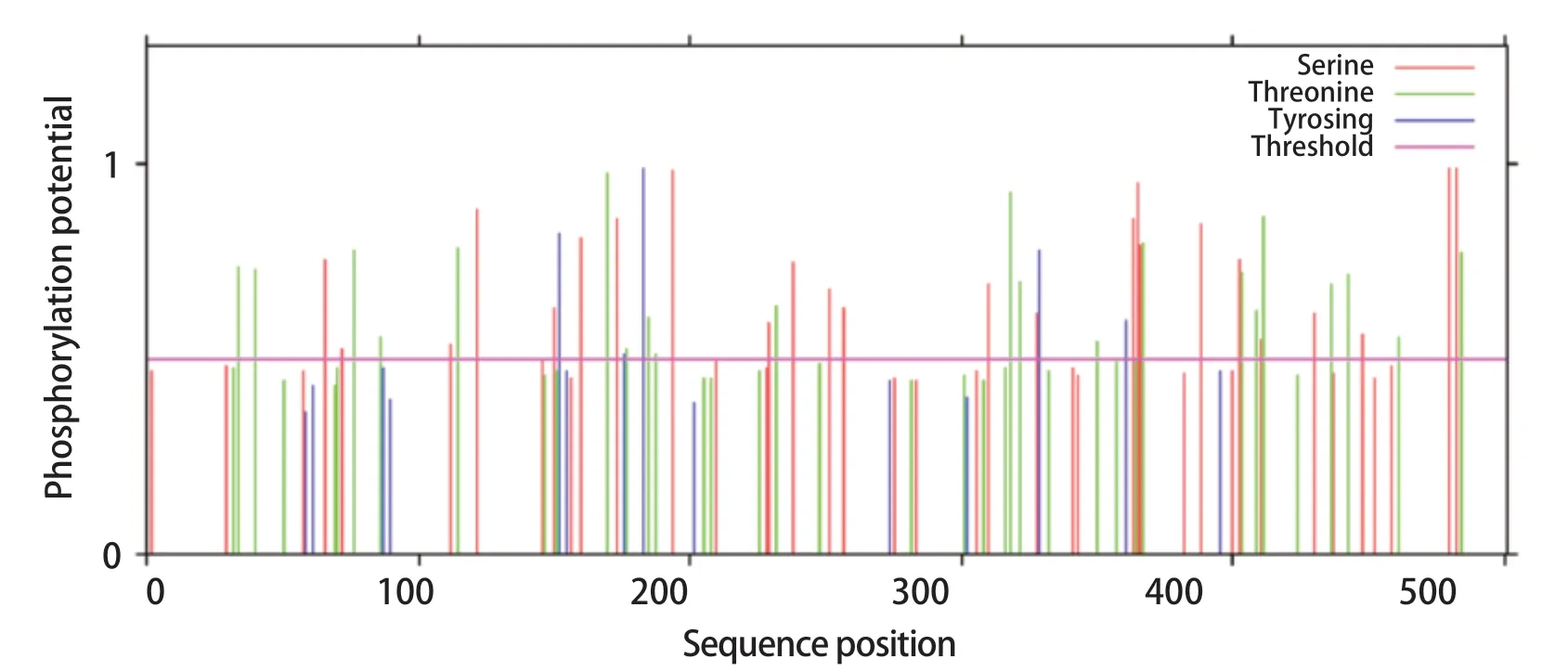
图8 E蛋白磷酸化位点预测结果Fig.8 Phosphorylation site prediction results of E protein
2.9 DTMUV E蛋白的潜在抗原表位分析结果 利用Predicting Anti-genic Peptides软件分析可知,E蛋白含有20个潜在的抗原决定簇。利用IEDB 软件分析E蛋白的B细胞抗原表位,结果如图9所示,连续氨基酸数量超过10个的B细胞抗原表位为62~86位、147~160位、172~183位、224~235位氨基酸。如表1所示,E蛋白的CD4+抗原表位结果中,HLA_DRB1_0801亚型的强结合肽最多,为15个,HLA_DRB1_0701亚型的弱结合肽最多,为52个。

表1 E蛋白CD4+抗原表位预测结果Table 1 Prediction results of E protein CD4+ antigen epitope
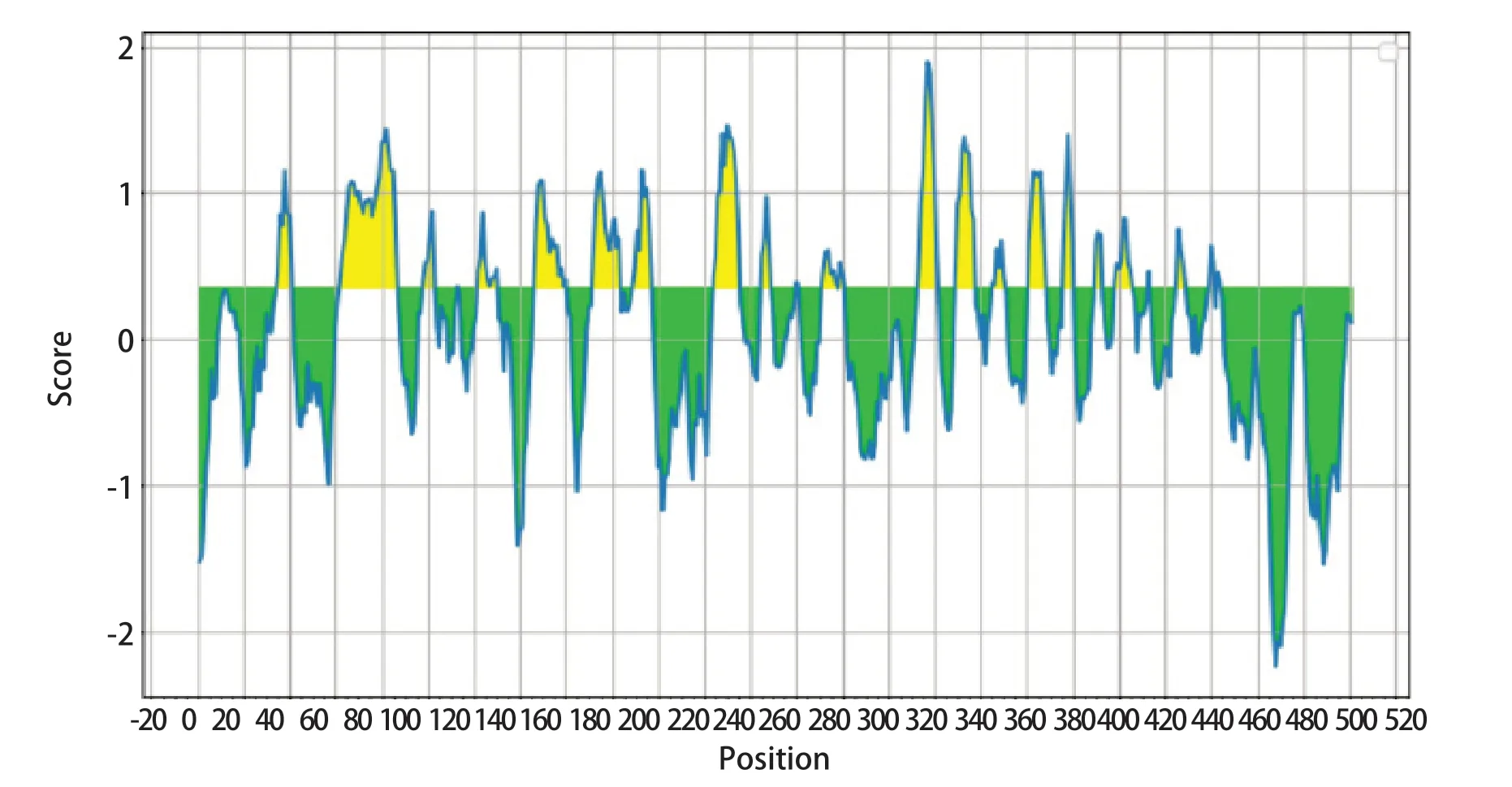
图9 E蛋白潜在B细胞抗原表位预测结果Fig.9 Prediction results of potential B cell epitopes of E protein
3 讨论
自2010年我国首次发现鸭坦苏病毒病以来,该病对我国养鸭业造成了比较大的经济损失。鸭群发病率可高达100%,虽然病死率低,但主要引起蛋鸭的产蛋量大幅度下降,甚至绝产。病鸭后期会出现神经症状,导致淘汰率升高,是造成我国鸭出栏量下降的主要因素之一。DTMUV不仅可以感染禽类,在将病毒接种于小鼠脑内实验中,还会使小鼠出现神经症状甚至死亡[8]。Tang等[31]甚至在鸭场员工血清中检测到了DTMUV的中和抗体。鸭坦布苏病毒病传入我国以后,就迅速传遍全国,因此开展鸭坦布苏病毒的研究是具有重要现实意义的。
E蛋白是DTMUV的重要抗原蛋白。庄育彬等[9]通过软件预测DTMUV E蛋白含有17个糖基化修饰位点、13个丝氨酸、4个酪氨酸和8个苏氨酸磷酸化修饰位点。与本研究所预测的18个糖基化修饰位点、24个丝氨酸、5个酪氨酸和23个苏氨酸磷酸化修饰位点有一定的出入,可能是毒株和软件不同所导致。与同为黄病毒属的乙型脑炎病毒的预测结果比较显示其也无信号肽,有两个跨膜螺旋区,但跨膜区域有所不同,在乙型脑炎病毒E蛋白的结构域上具有与其毒力相关的氨基酸位点[10]。E蛋白结构域上也存在与毒力相关的氨基酸位点(E367、E304、E156)[11-13],其中E156的突变是通过破坏E蛋白位于第154位氨基酸的N联糖基化结构,而使DTMUV的毒力在鸭中传播衰减。而位于E蛋白结构域上的第408位氨基酸的突变会增强中和抗体反应[14]。E蛋白结构域上的关键氨基酸位点的突变可能会导致蛋白质生物学功能的改变。DTMUV E蛋白的结构域Ⅰ、Ⅱ、Ⅲ均被研究人员证实可以使小鼠产生抗体,并能为小鼠提供良好的免疫保护力[15-16]。余磊等[17]鉴定出了5个B细胞线性表位E25(25LEGGSCVTITAKDKPTIDVK44)、E97(97VDRGWGNG104)、E229(229SAGTW QNK236)、E349(349MTPVGRLI356)和E385(LVGSGKGQIRYQWHRSGSTI404)。张琳等[18]鉴定出了DTMUV E蛋白的一个B细胞线性表位385LVGSGKGQI393(EP385),并证明了该表位具有良好的免疫原性。李晨曦等[19]鉴定出了DTMUV E蛋白的线性抗原表位EVEPPFG,并证实了其为黄病毒共享型抗原表位。Gong等[20]用一个新的中和单克隆抗体3B8鉴定出了一个新的线性表位FSCLGMQNR。Chen等[21]鉴定出了一种新的中和性交叉反应表位。外源性抗原E蛋白在诱导机体产生针对DTMUV的中和抗体中起着关键作用,Chen等[22]在以鸭为宿主进行密码子优化的缩短的E451基因在重组鸭瘟病毒载体中表达量最高[22]。由于E蛋白具有良好的免疫原性,将E蛋白与脂质体混合制成的亚单位疫苗的免疫效果更好[23],E蛋白还可以与Semliki Forest virus(SFV)复制子制备成自杀性DNA疫苗,该疫苗可诱导机体产生强烈的体液免疫和细胞免疫反应,可以完全抵抗小鸭的DTMUV攻击[24]。本研究所预测的DTMUV E蛋白中连续氨基酸数量超过10个的B细胞线性表位有4个,为B细胞抗原表位的鉴定提供了更多的可能性选择,也为针对E蛋白进行的相关疫苗研究提供了理论基础。
本研究利用生物信息学方法对DTMUV E蛋白进行了分析,结果显示E蛋白由501个氨基酸组成,为亲水性蛋白,稳定性较好;有2个跨膜螺旋区,无信号肽,且定位于病毒衣壳中的囊膜蛋白;有18个潜在的糖基化修饰位点、24个丝氨酸、5个酪氨酸和23个苏氨酸磷酸化修饰位点;有20个潜在的抗原决定簇,有4个连续氨基酸数量超过10个的B细胞线性表位;选择不同的亚型时,CD4+抗原表位都有多个结合肽。为进一步研究DTMUV的亚单位疫苗、E基因的功能提供了更多的理论支持。
