猪源盖塔病毒TaqMan实时荧光定量PCR检测方法的建立
2023-09-08王帅勇虞凌雪张毅峰严杰聪王曼茱周艳君单同领童光志
王 娟,王帅勇,虞凌雪,张毅峰,严杰聪,王曼茱,周艳君,单同领,童 武,郑 浩,童光志,于 海,2
(1.中国农业科学院上海兽医研究所,上海 200241;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
盖塔病毒(Getah virus,GETV)是一种虫媒病毒,属于披膜病毒科甲病毒属。GETV是一种单股正链RNA病毒,基因组长约11.5 kb,含有两个开放阅读框(open reading frame,ORF)[1],病毒基因组5'端前2/3部分编码病毒非结构蛋白(包括nsp1、nsp2、nsp3和nsp4),负责病毒RNA转录和复制,多聚蛋白质的切割和RNA带帽过程(Capping)[2]。病毒基因组后1/3部分为病毒结构基因,编码病毒多个结构蛋白,包括C(Capsid,衣壳蛋白)、E3、E2、6K和E1[2]。进入宿主的病毒颗粒被分解后,释放病毒正链RNA并将非结构蛋白翻译为多蛋白。在切割nsp4后,复制复合体合成来自基因组RNA的负链。非结构蛋白多蛋白进一步被切割成单个蛋白质进而合成基因组和亚基因组正链RNA。亚基因组RNA翻译结构蛋白形成核衣壳包装病毒基因组RNA,继而形成新的病毒[3]。当病毒进入宿主细胞时,E2糖蛋白在受体相互作用中起着重要作用。有证据表明,E2糖蛋白的氨基酸序列发生微小的甚至是单一的变化都会改变病毒所利用的细胞受体;因此,在甲病毒属中,E2蛋白通常是病毒特异性的,而且基因序列相对保守[3]。
GETV广泛分布于亚洲和大洋洲,宿主范围广泛,包括蚊子、马、猪、牛和蓝狐[4-8]。马匹感染GETV后出现发热性疾病,厌食症,后肢水肿,步态僵硬,荨麻疹和下颌下淋巴结肿大,马被认为是GETV扩增和传播的重要宿主[9]。GETV感染母猪会使其流产,感染仔猪则出现震颤和抑郁、腹泻、后肢瘫痪和高死亡率[10-11]。血清学调查显示,在云南省,包括猪、牛和家禽在内的多种脊椎动物都发生了感染。有文献报道GETV可以感染人并致使人发烧。在马来西亚、澳大利亚北部和中国海南省的一些人的血清中检测到了GETV的中和抗体,这说明研究GETV是具有潜在的公共卫生学意义的,虽然还没有关于GETV引起人类疾病的报告[1]。
GETV于1955年首次在马来西亚捕获的库蚊标本被分离到,后来在多种蚊子和动物中发现。多年来,GETV逐渐从马来西亚扩散到中国、俄罗斯、大洋洲等,已经成为欧亚大陆地区的“新发蚊传虫媒病毒”[1,5]。日本于1978年、1979年、1983年、2014年和2015年暴发了马匹GETV感染疫情[5,12]。1990年,印度马群中也出现了流行性GETV感染。1964年在海南省分离出中国第1株蚊虫GETV毒株,命名为M1。此后,在海南省、云南省、四川省、贵州省、甘肃省、吉林省、河北省、山西省等多个省份的蚊虫中都检测到了GETV[5]。猪源性GETV感染病例于2002年在台湾首次被发现,随后在河南省(2005年)、湖南省(2017年)、安徽省(2017年)和四川省(2018年)发现[10-11]。2017年,山东蓝狐发生GETV感染,可能与食用感染GETV的猪肉产品有关[8]。2018年吉林省患有发热性疾病的牛体内发现GETV,牛血清组阳性率为83.3%(40/48)。2018年8月,在广东省的发热的马匹中发生了中国首例马源GETV感染[13]。以上流行病学资料表明,GETV在我国广泛流行,对我国经济动物特别是猪有严重的影响。而且猪是自然界中GETV的主要扩增宿主,可以产生足够高的病毒血症滴度来感染叮咬的蚊子并维持GETV的传播周期[5,14-15],所以定期对猪群进行GETV监测对于预防潜在的GETV暴发具有重要意义。因此,有一个正确的工具来快速、具体地检测猪群中GETV感染是非常有必要的,而目前国内还没有建立针对猪源GETV相关的荧光定量PCR检测方法。本研究旨在建立一种快速检测和定量猪源GETV的荧光定量PCR方法,为GETV监测提供简便、快速、可靠的技术工具。
1 材料与方法
1.1 毒株、核酸样品与试剂 猪源盖塔病毒(GETV)由本实验室分离保存;猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪2型圆环病毒(Porcine circovirus type 2,PCV2)、猪伪狂犬病病毒(Pseudorabies virus,PRV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪流感(Swine influenza virus,SIV)均由本实验室提供。病毒核酸抽提试剂盒购自QIAGEN公司;反转录酶、RNA酶抑制剂、荧光定量PCR混合酶、rTaqDNA聚合酶、DNA Marker等均购自宝生物工程(大连)有限公司;T4 DNA连接酶购自NEB公司;质粒提取试剂盒和胶回收试剂盒购自上海华舜生物技术有限公司;大肠杆菌DH5α由本实验室保存。
1.2 引物和探针的设计与合成 参考WHO推荐检测方法,用MegAlign软件对实验室分离株及GenBank数据库中公布的GETV编码E2蛋白的核苷酸序列进行同源性分析,选择高度保守区域,用Oligo7软件设计一对特异性引物和TaqMan荧光探针。上游引物序列为:5'-AGCGACAAGACTATCAATTCGT-3',下游引物序列为:5'-TGCACTTTACCTTTGCGAGAC-3',TaqMan探针序列为:5'FAM-TTGTCCCTAGAGCCG ACCAGT-BHQ3';扩增片段长度为128 bp。此外,利用E2基因高度保守区域设计了一对常规PCR引物用于制备阳性标准品。上游引物序列为5'-CGCAGCAGTCAGGTAATGTAA-3',下游引物序列为:5'-TAGACTCCGGTACGTCA-3';扩增目的片段的大小为353 bp。引物由生工生物工程(上海)有限公司合成,TaqMan探针由上海吉玛制药技术有限公司合成。
1.3 病毒RNA的提取和cDNA合成 按照RNeasy Plus Mini RNA试剂盒说明书提取病毒总RNA。以16 μL总RNA为模板进行反转录,体系为20 μL,包含16 μL总RNA、4 μL混合反转录酶,混匀后于37℃水浴作用15 min,然后85℃灭活5 s,得到cDNA,用于实时荧光定量PCR。
1.4 实时荧光定量PCR检测方法的建立
1.4.1 阳性标准品质粒的制备 用标准品引物扩增GETV的E2基因,PCR扩增体系(50 μL):Pfu DNA聚合酶1 μL、10× Buffer 5 μL、dNTP mix(10 mmol/L)1 μL、上、下游引物(E2-F/R,10 μm/mL)均1 μL、cDNA模板2 μL,ddH2O补至终体积50 μL。反应程序为:95℃预变性1 min;95℃变性20 s,55℃退火20 s,72℃延伸30 s,共35个循环;72℃延伸10 min。反应结束后,PCR产物进行琼脂糖凝胶电泳。使用普通琼脂糖凝胶DNA回收试剂盒回收纯化目的片段,克隆到PLB载体上,转化至DH5α大肠埃希氏菌中,提取质粒测定序列。选取符合实验预期的质粒即阳性标准品并用超微量紫外可见分光光度测定其浓度,根据公式计算出质粒标准品的拷贝数并进行10倍连续稀释,置于-20℃备用。
1.4.2 引物的特异性检测 采用普通PCR方法,用设计好的引物,以阳性标准品质粒为模板进行引物特异性鉴定。反应体系:rTaq酶12.5 μL,上、下游引物各1 μL,质粒1 μL,用ddH2O补足25 μL。反应条件:94℃预变性3 min;94℃变性30 s,55℃复性30 s,72℃延伸30 s;72℃再延伸10 min,4℃保存10 min。电泳后紫外灯下观察并拍照。
1.4.3 标准曲线的绘制 取已稀释好的标准品不同稀释度分别作为标准模板,每个梯度设置3个重复,优化引物和探针的反应浓度、Tm值及反应时间,进行荧光定量PCR反应,荧光定量PCR仪自动生成扩增动力学曲线及标准曲线,即本方法的标准线性回归方程。
1.4.4 特异性试验 用建立的方法对PRRSV、PCV2、PRV、PEDV、SIV进行荧光定量PCR实验,验证本方法的特异性。
1.4.5 敏感性试验 对毒价为3.16×107TCID50/mL的GETV进行10倍系列稀释后对各个稀释度的病毒进行敏感性试验,每个梯度设置3个重复,评估本方法的敏感性。同时用普通PCR方法检测系列稀释的病毒,检测普通PCR方法的敏感性,与本方法进行比较。
1.4.6 重复性试验 对4份不同滴度的GETV感染样品提取RNA进行批内和批间重复试验。同一次每个样品设置3个重复,分别在不同的3个时间段进行荧光定量PCR试验。根据检测所得Ct值计算组内及组间标准差和变异系数(CV),评估该方法的重复性。
1.4.7 临床样品的检测结果 对实验室保存的猪血清样品按照试剂盒说明提取RNA,分别用本研究建立的荧光定量PCR方法和普通PCR方法进行检测。
2 结果
2.1 阳性标准品质粒的制备 通过普通PCR扩增获得部分保守E2基因片段,克隆到PLB载体中,对其进行PCR鉴定,得到约353 bp的单一条带,符合预期(图1),后续测序结果与参考序列一致。重组阳性标准质粒的浓度为260 ng/μL,大小为3327 bp,代入公式:拷贝数(copies)=(质量/分子量)×6.02×1023进行计算,得出阳性标准质粒的DNA拷贝数为7.13×1010copies/μL。先用DEPC水将阳性质粒稀释至1×1010copies/μL,再10倍梯度稀释,置于-20℃备用。
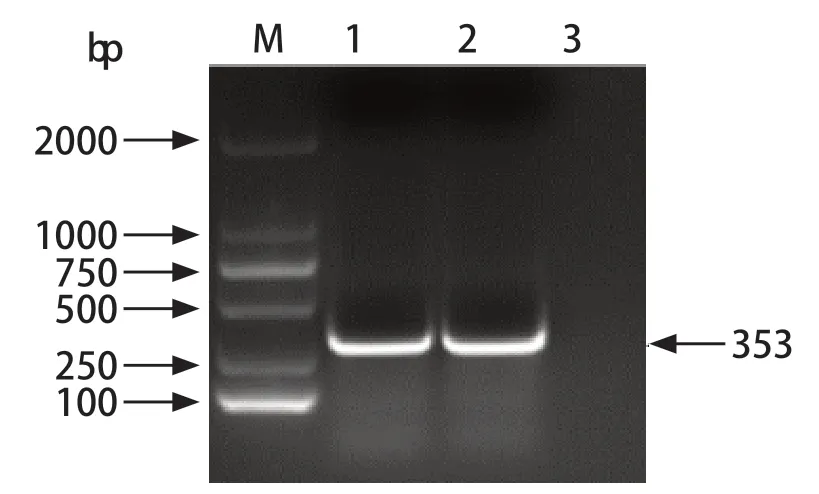
图1 GETV PCR扩增结果Fig.1 PCR amplification of GETV fragments
2.2 引物的特异性检测 通过普通PCR方法,用荧光定量引物,以阳性标准品质粒为模板进行PCR实验,鉴定引物特异性。PCR扩增出的条带单一,大小符合预期(图2),表明引物的特异性良好。

图2 PCR扩增产物Fig.2 PCR amplification of positive plasmid
2.3 扩增曲线和标准曲线 选取1×102~1×109copies/μL共8个浓度的阳性标准品质粒为模板进行荧光定量PCR反应。反应体系为包括Probe qPCR Mix(2×)10 μL,探针(10 μmol/L)0.4 μL,上、下游引物(10 μmoL/L)各0.6 μL,cDNA 1 μL,ddH2O补齐20 μL。反应条件为:95℃预变性1 min,以95℃变性5 s,55℃退火30 s,设置40个循环,在55℃进行单点荧光检测。结果显示线性关系良好,阴性对照成立,标准曲线方程为y=-4.8457×lgx+57.36,相关系数R2=0.99;扩增效率E=1.61,见图3。
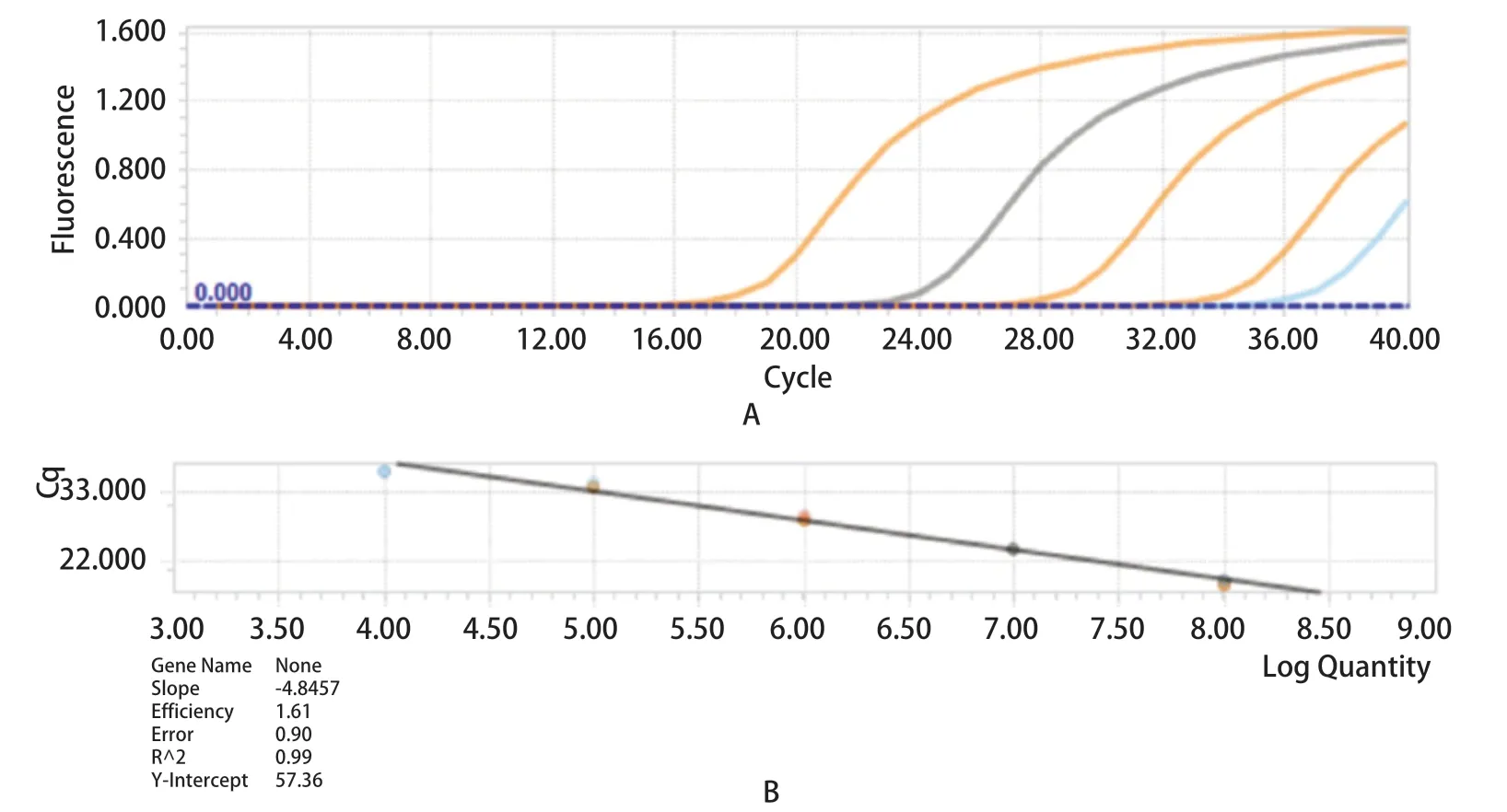
图3 实时荧光定量PCR检测GETV的扩增曲线(A)和标准曲线(B)Fig.3 Amplification curve (A) and standard curve (B) of qPCR for GETV detection
2.4 特异性试验结果 除GETV以外,PRRSV、PCV2、PRV、PEDV、SIV的实验结果均为阴性(荧光信号未到达阈值)(图4),这表明本方法具有良好的特异性。
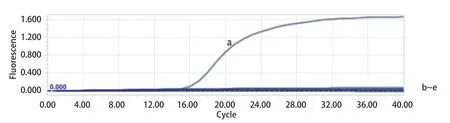
图4 实时荧光定量PCR检测方法的特异性Fig.4 The specificity of real-time quantitative PCR
2.5 敏感性试验结果 用普通PCR方法和本方法分别对10倍系列稀释的毒价为3.16×107TCID50/mL的GETV病毒液进行检测。样品在实时荧光定量PCR 40个循环内的Ct值>0,则将结果判定为阳性。实验显示,荧光定量PCR方法最低可检测出3.16 TCID50/mL的病毒(图5A),普通PCR方法最低可检测出3.16×103TCID50/mL的病毒(图5B)。以上结果表明荧光定量PCR方法比普通PCR方法更敏感。
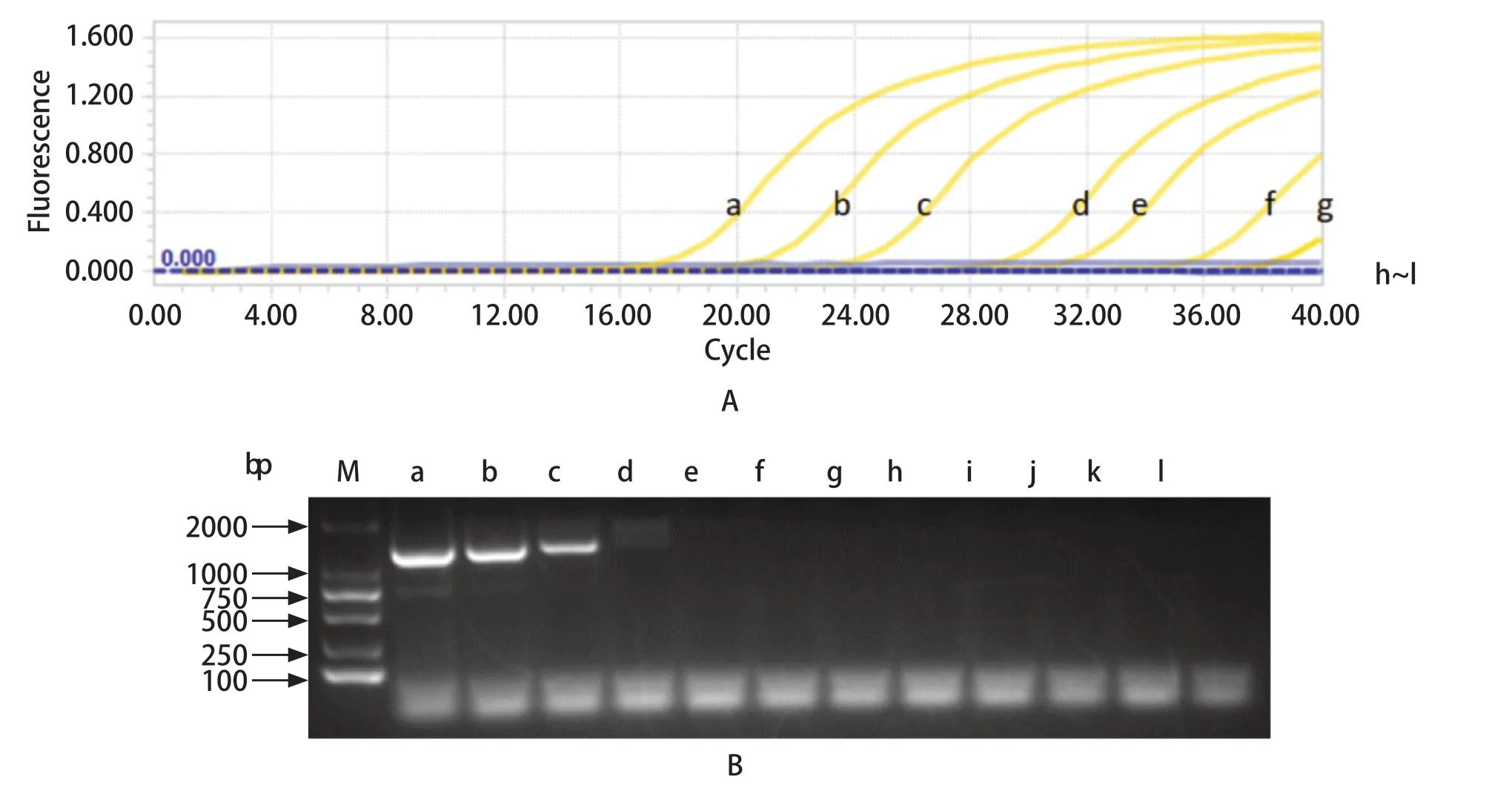
图5 实时荧光定量PCR(A)与普通PCR(B)的敏感性试验比较Fig.5 Comparison of sensitivity between qPCR (A) and ordinary PCR (B)
2.6 重复性试验结果 对4份不同滴度的GETV样品分别做3个批内重复和3个批间重复实验,结果见表1,批内变异系数为0.38%~0.64%;批间变异系数为0.97%~1.44%。以上结果表明该方法重复性良好。
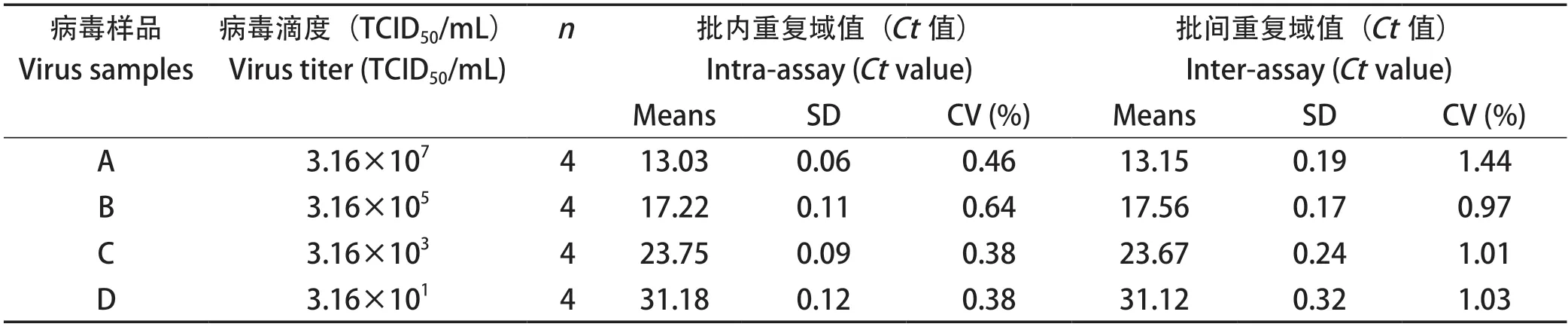
表1 实时荧光定量PCR检测方法的批内及批间重复性试验结果Table 1 Results of intra-batch and inter-batch reproducibility of the qPCR detection method
2.7 临床样品的检测结果 对实验室保存的猪血清样品按照RNA提取试剂盒说明书提取样品RNA,用本研究建立的实时荧光定量PCR方法和普通PCR方法分别进行检测。由表2可知,在50份猪血清样品中,荧光定量PCR方法检测出阳性样品9份,阴性样品41份;普通PCR方法检测出阳性样品7份,阴性样品43份。

表2 50份临床样品GETV实时荧光定量PCR及普通PCR检测结果Table2 The results of 50 clinical samples texted by GETV qPCR and ordinary PCR
3 讨论
目前,我国对GETV检测方法的研究仅限于人类血清学调查以及检测蚊虫体内的带毒情况。在过去的二十多年里,GETV在猪群多次暴发,已经成为与公共卫生和农业损失息息相关的重要病原体。建立快速有效的检测猪源GETV的方法来监测猪源GETV对弄清猪在GETV传播过程中起着何种作用具有十分重要的意义,这对于GETV的防控也具有十分重要的研究价值。传统的病毒分离检测方法耗时较长,只能检测活病毒;普通PCR方法易出现交叉污染,操作复杂,反应条件和反应副产物等会对检测结果产生影响;而荧光定量PCR方法减少了交叉污染,高效快捷,结果直观,对检测样品的要求相对较低[16]。相对于普通PCR方法,荧光定量PCR方法具有更强的特异性和更高的敏感性[16]。而且与传统TaqMan探针相比,本研究TaqMan BHQ探针的淬灭基团采用非荧光淬灭基团,本身不产生荧光,而且淬灭效率更高,可以大大降低本底信号强度,增强信噪比,提高了检测的灵敏度和特异性[14]。
本研究对GenBank数据库中公布的GETV编码E2蛋白的核苷酸序列进行同源性分析。选择高度保守区域,建立了一种靶向E2基因的实时荧光定量PCR检测方法,该方法灵敏度高,最低可检测到3.16 TCID50/mL的病毒远远低于普通PCR的检测限3.16×103TCID50/mL。此外,该方法特异性强,对PRRSV、PCV2、PRV、PEDV、SIV等猪常见传染病检测结果均为阴性。该方法具有良好的重复性和稳定性,组内、组间重复性试验的变异系数均小于2%。通过对临床样品的检测可见,本研究建立的TaqMan实时荧光定量方法可有效地检测出阳性核酸样品且灵敏度高于普通PCR方法。综上所述,本研究建立了一种能够快速有效检测和定量猪源GETV的荧光定量PCR检测方法,在猪群中GETV的监测方面具有很大的实用价值。
