靶向B细胞的口蹄疫GHloop多肽抗原的制备及免疫效力鉴定
2023-09-08侯立婷张媛媛于晓明杜露平张元鹏程海卫乔绪稳郑其升
侯立婷,张媛媛,4,于晓明,杜露平,张元鹏,程海卫,乔绪稳,李 丁,郑其升,陈 瑾
(1.江苏省农业科学院动物免疫工程研究所,南京 210014;2.江苏省农业科学院国家兽用生物制品工程技术研究中心,南京 210014;3.兽用生物制品(泰州)国泰技术创新中心,泰州 225300;4.省部共建国家重点实验室培育基地—江苏省食品质量安全重点实验室,南京 210014)
口蹄疫(foot-and-mouth disease,FMD)是危害世界各国养殖业最严重的疾病之一,其病原是口蹄疫病毒(Foot-and-mouth disease virus,FMDV)。免疫接种是预防和控制口蹄疫疾病的有效方法[1-2]。在我国,FMD属于国家强制免疫类疾病,目前商品化的疫苗有FMD灭活疫苗和合成肽疫苗两种。FMDV由VP1、VP2、VP3、VP4 4种衣壳结构蛋白构成,VP1结构蛋白位于病毒粒子表面,其中第140-160位氨基酸处的GHloop是最主要的保护性抗原位点,可诱导感染动物产生中和抗体[3-5]。众多学者将该表位作为研究重点,证实了其具有良好的免疫原性。
葡萄球菌A蛋白人工合成类似物的二聚体(DD,a dimer of an Ig-binding fragment D ofStaphylococcus aureusprotein A)是一种免疫球蛋白(Ig)结合片段,能够靶向B细胞受体,促进B细胞的活化和增殖[6]。B细胞作为体液免疫的重要组成部分,通过其表面分布的B细胞受体(B cell receptor,BCR)识别外界抗原,是机体产生保护性抗体及免疫记忆的关键步骤[7]。B细胞是介导抗体应答的效应性细胞,可分化为分泌高亲和力抗体的浆细胞及记忆性B细胞。浆细胞产生的抗体可帮助清除病原体,记忆性B细胞可在机体再次遭遇相同病原体时快速活化、高速增殖,介导高滴度、高亲合力的抗体应答,快速、高效、高度特异性地清除病原体[8-9]。
本研究利用基因工程技术构建了一种融合蛋白GHloop-DD,这种融合蛋白是在GHloop的C末端连接两个Ig结合域(DD),将融合蛋白可溶表达后利用镍柱进行纯化,制备疫苗免疫小鼠,评价其免疫效力,这为FMDV亚单位疫苗的研究提供了参考依据。
1 材料方法
1.1 材料 原核表达载体pET32a由动物免疫工程研究所免疫技术研究室保存。质粒提取、胶回收试剂盒购自AxyGEN公司;限制性内切酶、T4 DNA连接酶、PCR试剂、pMD-19-T vector、DNA Marker等试剂购自宝生物工程(大连)有限公司;DH5α、BL21感受态细胞购自北京全式金生物技术有限公司;蛋白质相对分子量标准、BCA试剂盒购自Thermo公司;PVDF膜购自Millipore公司;FMDV多肽阳性血清由本实验室制备,系用商品化的中牧实业股份有限公司生产的FMDV合成肽疫苗多次免疫小鼠获得;HIS单克隆抗体、DAB显色液、HRP标记的羊抗鼠IgG、MTT购自南京生兴生物科技有限公司;anti-B220 APC、anti-CD138 PE购自Milrenyi Biotec;5周龄的ICR小鼠购自扬州大学比较医学中心;猪口蹄疫O型合成肽疫苗(批号1911001)由动物免疫工程研究所提供;猪口蹄疫病毒O型VP1合成肽ELISA抗体检测试剂盒(批号200501)购自中国农业科学院兰州兽医研究所;206佐剂购自Seppic公司;IFN-γ和IL-4细胞因子检测试剂盒购自南京奥青生物公司。
1.2 目的基因设计与合成 根据口蹄疫GHloop(GenBank登录号:AEH05465.1;序列为VYNGN CKYAGGSLPNVRGDLQVLAQKAARPLPTSFNYG AIK)和葡萄球菌A蛋白人工合成类似物的二聚体(GenBank登录号:CAC7571947.1;序列为KTNST KISKVPSMKFTCRTMKNSAMALSNLKTIRRKAPT SWVKRKNMNHRPRKQTLNRMNLTKISNRRFTKSI CRIMKNSVMASSKAKTIRLRVRTFWAKRKNTNLR LRKVEEVLEEVVAEVANSAAATPATRRPRAWVN FWMNTRARLNVKSSAAIRATSIPTTVLRTS)的基因序列设计融合蛋白GHloop-DD,并通过全基因合成的方式合成。为提高该蛋白在大肠杆菌中的表达量并促进其可溶性表达,按照大肠杆菌偏好密码子对目的基因的核苷酸序列优化后合成,在序列两端添加NdeⅠ和XhoⅠ两个酶切位点,并克隆入pUC57载体。
1.3 重组质粒的构建 将基因片段GHloop-DD从pUC57载体上通过NdeⅠ和XhoⅠ两个酶切位点切下,克隆到原核表达载体pET32a,构建重组表达质粒,将其命名为pET32a-GHloop-DD。
1.4 重组菌的构建与表达 将重组质粒pET32a-GHloop-DD转化大肠杆菌BL21感受态细胞,涂布含氨苄青霉素的LB平板,挑取单菌落,得到重组菌pET32a-GHloop-DD/BL21。将空质粒pET32a按照相同的方法转化大肠杆菌BL21感受态细胞,得到对照菌株pET32a/BL21。
挑取重组菌pET32a-GHloop-DD/BL21与pET32a/BL21单菌落,接种5 mL含氨苄青霉素的LB液体培养基中,37℃振荡培养过夜,再按1∶100比例转接含新的氨苄青霉素和氯霉素的LB液体培养基,37℃、220 rpm振荡培养1.5~2 h(OD600至0.5~1.0),加入终浓度为1 mmol/L的异丙基硫代半乳糖苷,18℃诱导24 h,收获细菌。
1.5 目的蛋白可溶性鉴定 取2 mL诱导后菌液,离心收集菌体,用1 mL PBS缓冲液重悬,在冰水浴中超声波破碎细胞。破碎后离心收集全部上清液,保留备用,沉淀用1 mL PBS缓冲液重悬。将完整的诱导菌体以及超声波破碎后的上清液、沉淀进行SDSPAGE电泳,检测融合蛋白的表达及可溶性。
1.6 Western blot鉴定 重组蛋白SDS-PAGE电泳后再转印到PVDF膜上,37℃、5% BSA封闭孵育1 h,TBST洗涤2次,加1∶2000稀释的HIS单克隆抗体/FMDV多肽阳性血清孵育过夜,TBST洗涤5次,5 min/次,加1∶5000稀释的HRP标记羊抗鼠IgG,37℃孵育1 h,TBST洗涤5次,5 min/次,DAB显色后观察特异性条带。
1.7 疫苗制备及免疫原性鉴定
1.7.1 蛋白定量及小鼠免疫 镍柱纯化后的蛋白用BCA试剂盒测定蛋白浓度。按照2.5 μg/只的剂量与206乳化制备疫苗,免疫5周龄的ICR小鼠,每组8只,颈部皮下多点注射100 μL/只,同时设置空白和合成肽疫苗(生产厂家:中牧实业股份有限公司,批号1911001)对照组。合成肽疫苗按照说明书剂量,每只免疫2.5 μg/100 μL。免疫后28 d采集血液进行间接ELISA抗体检测。
1.7.2 血清IgG抗体检测 按照免疫程序采集小鼠血清,按照猪口蹄疫病毒O型VP1合成肽ELISA抗体检测试剂盒说明书测定其血清抗体。
1.7.3 淋巴结B细胞及相关转录因子检测 免疫后28 d,分离下颌淋巴结,制备单细胞悬液。调整细胞密度为1×106个/管,加入抗体anti-B220 APC,置于4℃,染色30 min,荧光洗液洗涤两次,加入固定液,进行流式细胞仪检测。
取相同质量的淋巴结,用TRIzol裂解法提取RNA,利用一步反转试剂盒获得cDNA。根据GenBank中公布的相关序列设计引物,参考文献[10]的方法利用荧光定量PCR检测Blimp1、IRF4、XBP1、Pax5的基因水平。
1.7.4 小鼠骨髓浆细胞检测 免疫后28 d,分离股骨,收集骨髓,制备单细胞悬液。调整细胞密度为1×106个/管,加入抗体anti-B220 APC、anti-CD138 PE,置于4℃,染色30 min,荧光洗液洗涤两次,加入固定液,进行流式细胞仪检测。
1.7.5 IFN-γ和IL-4细胞因子检测 无菌采取小鼠脾脏,分离淋巴细胞,细胞用含双抗的RPMI1640完全培养基调整细胞浓度至5×106个/mL,96孔板中,每孔100 μL,每个样品4个重复孔,加入终浓度为2 μg/mL纯化的O型FMD抗原刺激,培养48 h后,收集上清液,用IFN-γ和IL-4试剂盒检测(操作见说明书)相应的细胞因子含量。
2 结果
2.1 含目的基因的质粒的构建 将基因片段GHloop-DD用NdeⅠ和XhoⅠ酶切回收后,克隆到原核表达载体pET32a,构建重组表达质粒pET32a-GHloop-DD,并进行酶切鉴定。酶切产物经1%的琼脂糖凝胶电泳检测可得到690 bp左右的目的片段(图略),与预期设计的目的基因片段大小一致。
2.2 重组蛋白的表达及可溶性鉴定 将鉴定正确的重组表达质粒转化BL21感受态细胞,涂布含有氨苄氯霉素的LB平板,然后挑取单个菌落培养。取菌液接种到含有氨苄氯霉素的LB液体培养基中,37℃培养到细菌浓度达到OD600为0.6~1.0加入终浓度为1 mmol/L的IPTG,诱导20 h后,收集菌液,离心去除培养基,用PBS重悬菌体后经高压破碎仪破碎菌体,用SDS-PAGE检测表达产物(图1),重组蛋白分子量约为26 kDa,并以可溶性形式存在于破碎菌体的上清液中。

图1 重组蛋白表达及可溶性分析Fig.1 Expression and solubility identification of the recombinant protein with SDS-PAGE
2.3 重组蛋白表达产物Western blot鉴定 经SDSPAGE电泳后,转印至PVDF膜,用HIS单克隆抗体对表达产物进行Western blot鉴定,结果可知,PVDF膜上的条带与SDS-PAGE表达的蛋白条带大小一致,表明表达的重组蛋白可被特异性的HIS单克隆抗体和FMDV多肽阳性血清所识别(图2)。
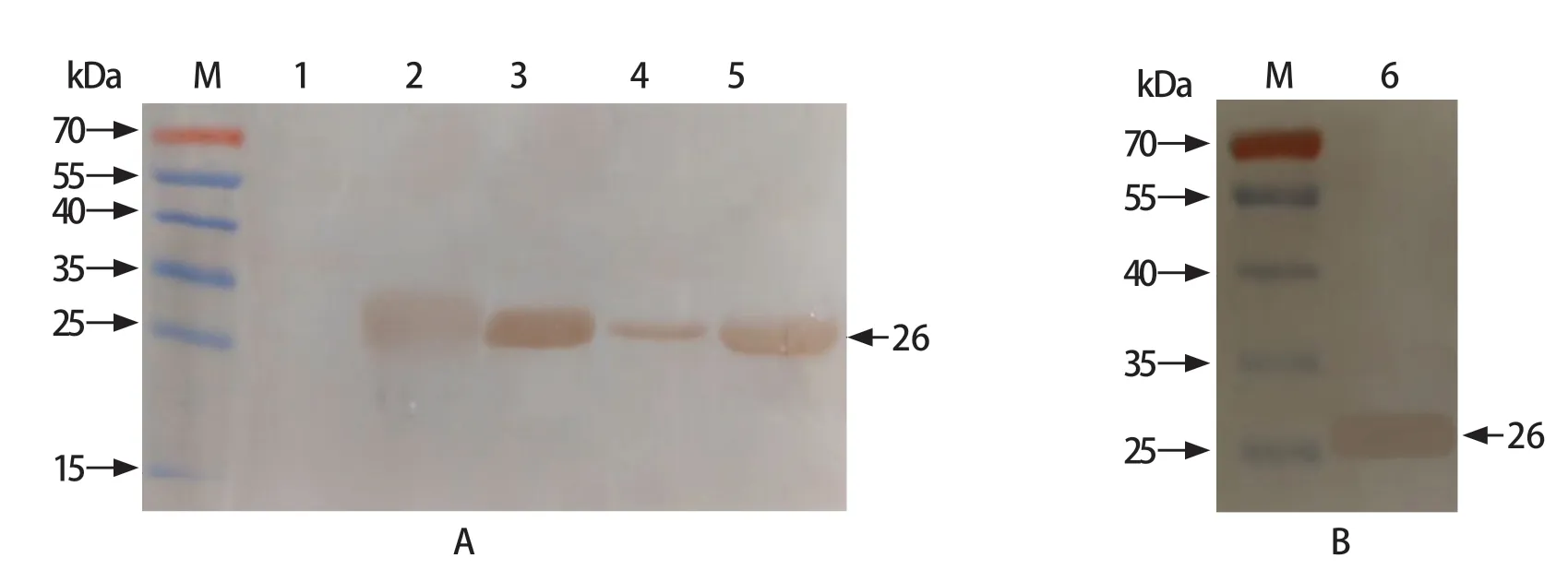
图2 重组蛋白Western blot鉴定结果Fig.2 Western blot analysis of recombinant protein
2.4 小鼠血清抗体检测 利用口蹄疫病毒O型VP1合成肽ELISA抗体检测试剂盒检测其抗体水平。结果可知,小鼠免疫后28 d,合成肽疫苗免疫组的平均抗体水平为2.27±0.1065,GHloop-DD疫苗免疫组的平均抗体水平为2.131±0.1018,统计学显示,两个疫苗免疫组的抗体水平无显著性差异(P>0.05)(图3)。实验结果表明GHloop-DD能够诱导小鼠机体产生与商品化合成肽疫苗类似的体液免疫反应。
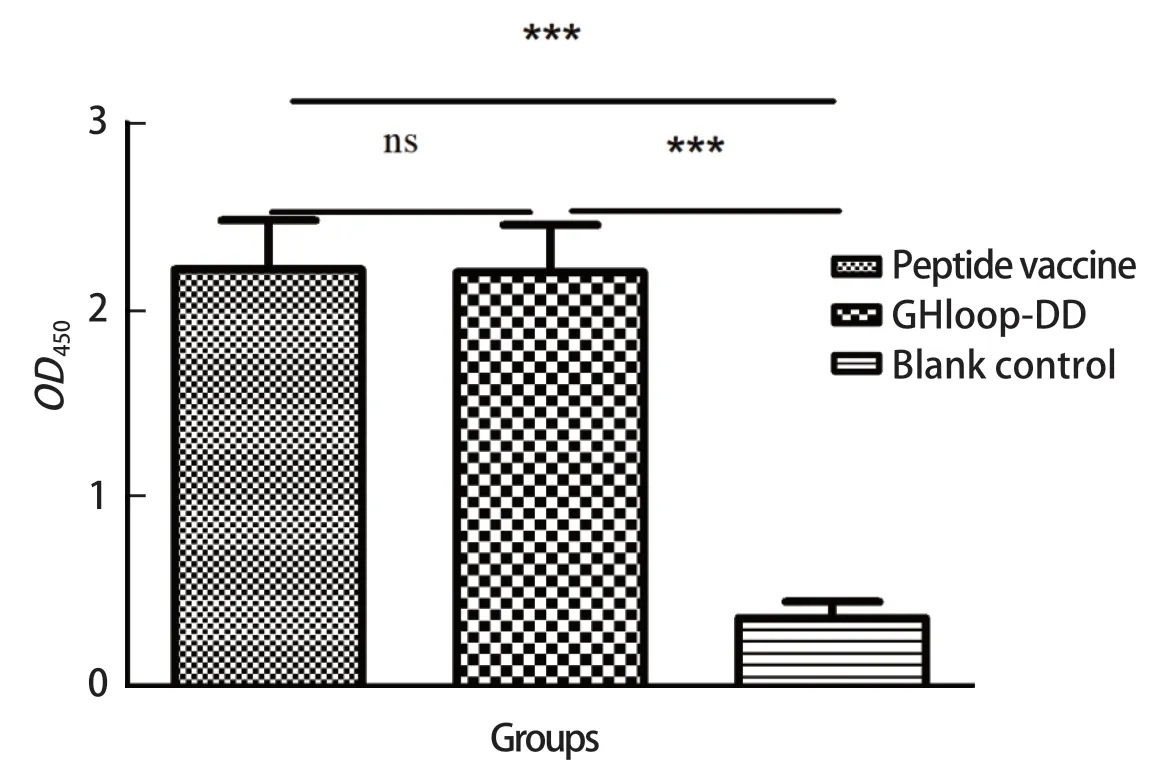
图3 疫苗免后FMDV VP1结构蛋白抗体检测Fig.3 Detection of antibodies against FMDV VP1 structural protein in mice by ELISA
2.5 小鼠淋巴结相关检测结果 采用流式和荧光定量的方法检测B细胞的数量和相关转录因子水平。结果可知,GHloop-DD疫苗免疫组小鼠在免疫后28 d淋巴结中B细胞的数量显著高于合成肽疫苗免疫组,统计分析显示与合成肽疫苗引发的B淋巴细胞反应差异极显著(P<0.001)(图4A)。免疫后28 d,利用荧光定量的方法检测下颌淋巴结相关转录因子的表达水平。结果可知,GHloop-DD免疫组小鼠能够上调转录因子Blimp1、XBP1、IRF4,下调转录因子Pax5。统计学分析显示,GHloop-DD免疫组与合成肽疫苗免疫组相关转录因子表达水平差异显著(P<0.05)(图4B)。
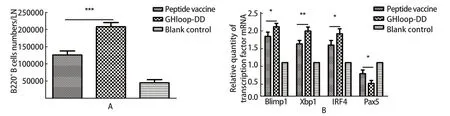
图4 小鼠免疫后28 d淋巴结B细胞及相关趋化因子水平检测Fig.4 The levels of B cells and chemokines in lymph nodes of mice 28 days after immunization
2.6 小鼠免后相关B细胞检测结果 免疫后28 d,利用流式检测骨髓中长寿浆细胞(B220-CD138+)的占比。结果可知,GHloop-DD疫苗免疫组小鼠骨髓中长寿浆细胞的比例显著高于合成肽疫苗免疫组(P<0.001)(图5)。实验结果表明,GHloop-DD组可以诱导更高水平的长寿浆细胞数目。
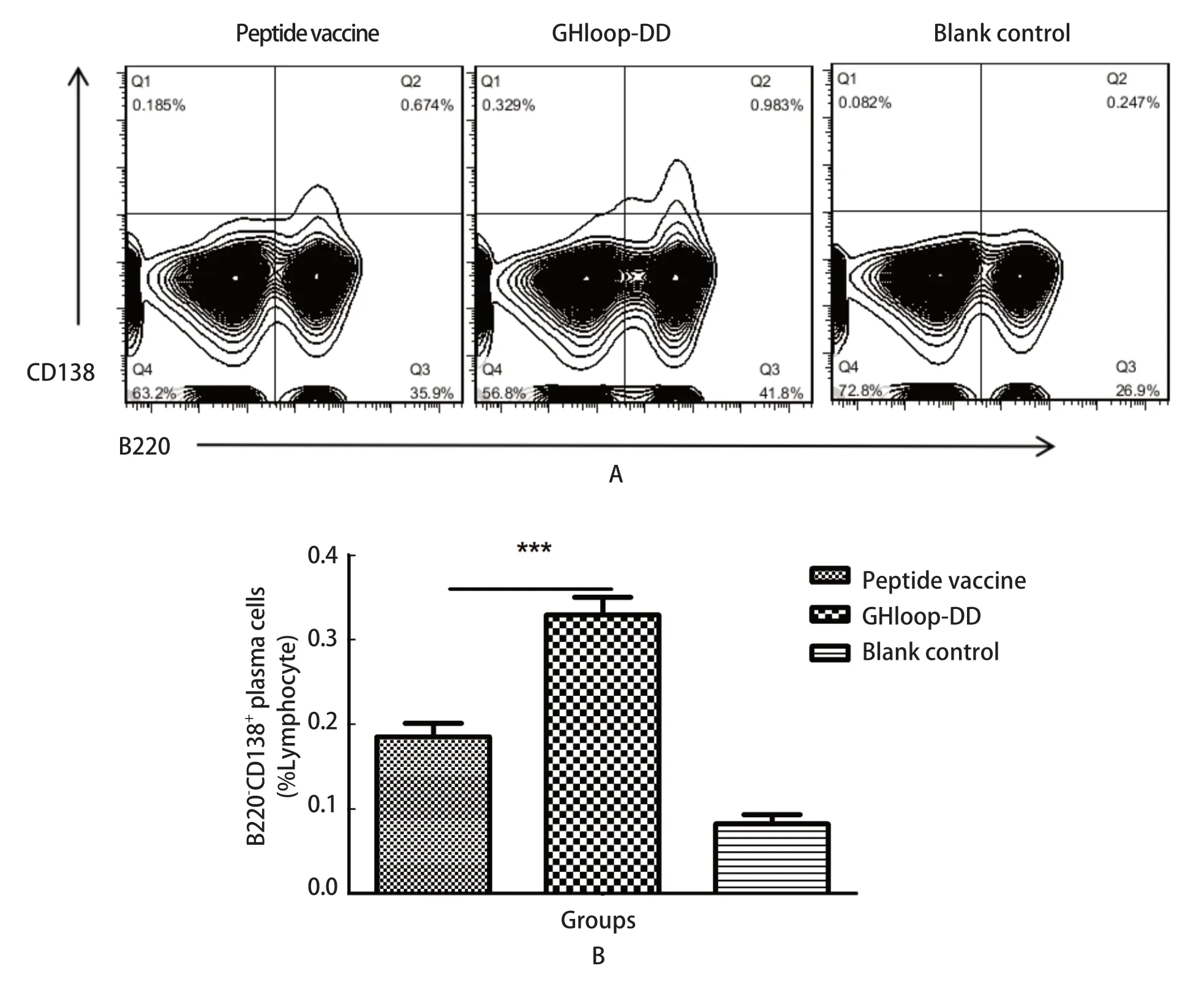
图5 小鼠免疫后28 dpi骨髓长寿浆细胞数目流式检测结果Fig.5 Long-life plasma cell responses were measured at 28 dpi by flow cytometry
2.7 小鼠免后相关细胞因子检测 收集脾脏淋巴细胞刺激后的上清液,利用试剂盒进行检测。结果可知,GHloop-DD疫苗免疫组的两种细胞因子水平显著高于合成肽疫苗免疫组。在GHloop-DD疫苗免疫组中,IFN-γ含量为287.65±18.76 pg/mL,显著高于合成肽疫苗免疫组的201.87±16.59 pg/mL(P<0.01);IL-4含量为41.87±3.56 pg/mL,显著高于合成肽疫苗免疫组的35.02±1.98 pg/mL(P<0.05)(图6)。

图6 免疫后28 dpi体外淋巴细胞增殖反应诱导的FMDV特异性细胞因子水平Fig.6 Cytokine concentrations after FMDV-specific lymphocyte responses in vitro at 28 dpi
3 讨论
口蹄疫在我国被列为A类传染病,因此该病防控十分关键[11]。目前商品化的合成肽疫苗和灭活疫苗具有良好的免疫效果,从疾病的净化角度出发,多肽苗具有明显的优势。FMDV VP1结构蛋白中的141~160 aa和200~213 aa是FMDV的主要中和表位,具有较好的免疫效果[12-13]。商品化的合成肽疫苗也包含这两个表位,然而商品化的合成肽疫苗主要通过化学合成的方法来制备,成本较高。本实验利用廉价的大肠杆菌表达系统,进行靶向B细胞的多肽疫苗的研制,并使其在大肠杆菌实现可溶性表达。该方法制备的重组蛋白可溶性高、成本低、操作简单,易于规模化生产的。同等剂量蛋白免疫小鼠后的抗体水平能够达到商品化合成肽疫苗的免疫水平。
口蹄疫疫苗免疫后,以体液免疫反应为主,抗体水平与攻毒保护具有直接的相关性[14],因此提高疫苗免疫后的抗体水平,对口蹄疫的防控具有重要的现实意义。B细胞是机体特异性体液免疫反应中的主要免疫活性细胞,B淋巴细胞到浆细胞的终末分化,是机体能否产生获得性免疫的关键步骤[15]。DD可与人类和多种哺乳动物IgG的Fc段结合,其本身也是一种B细胞丝裂原,可使多克隆B细胞活化和增殖[16]。本研究结果证明,与对照的合成肽疫苗免疫组相比,GHloop-DD疫苗免疫组小鼠的淋巴结中B细胞数量明显增多,说明GHloop-DD能够引发小鼠机体更强的体液免疫反应。B细胞转化为浆细胞需要多种转录因子的相互作用。转录因子Blimp、XBP1、IRF4可诱导成熟B细胞发育为浆细胞,Pax5是B细胞特有的核反式作用因子。其中Blimp-1的表达,抑制了Pax-5的表达;Pax-5的表达使XBP-1表达升高;Blimp-1和XBP-1的表达促使成熟B淋巴细胞向浆细胞发育[17-19]。GHloop-DD疫苗免疫组小鼠能够上调转录因子Blimp、XBP1、IRF4的表达水平,下调转录因子Pax5的表达水平,并且该疫苗免疫组骨髓中长寿浆细胞的数量显著高于合成肽疫苗免疫组,说明GHloop-DD可促进高水平和长效体液免疫反应的发生。
提高机体的细胞免疫水平对于机体预防FMDV感染具有重要的意义[20]。体外淋巴细胞增殖试验结果显示,FMDV刺激后,GHloop-DD疫苗免疫组的Th1型(IFN-γ)和Th2型(IL-4)细胞因子均有明显上调,说明GHloop-DD对机体的细胞免疫调节有一定的作用。
本研究利用大肠杆菌表达系统制备的可溶性重组蛋白GHloop-DD,制备疫苗免疫小鼠后,产生了高水平的体液免疫反应,这为FMD多肽疫苗的改进奠定了基础,也为新型高效的亚单位疫苗研究提供了新的思路。
