Ⅰ群禽腺病毒(4型)Fiber-2蛋白亚单位疫苗与全病毒灭活疫苗的免疫效果比较
2023-09-08杜东颖霍环艳王璐璐王孟月洪素梅高晓静田克恭
杜东颖,霍环艳,田 辉,王璐璐,王孟月,洪素梅,高晓静,田克恭
(国家兽用药品工程技术研究中心,洛阳 471000)
鸡肝炎-心包积液综合征(hepatitishydropericardium syndrome,HHS)是由血清4型禽腺病毒(Fowl adenovirus serotype 4,FAdV-4)引起的高致病性传染病[1],近几年来,该病在我国广泛流行,给我国养禽业造成了巨大的经济损失,目前已成为危害养禽业的主要疫病之一[2-4]。HHS可水平和垂直传播,不同品种的鸡均可感染发病[5]。
FAdV-4是无囊膜的双链DNA病毒,病毒粒子呈二十面体对称,包含3种主要结构蛋白[6-7],分别为六邻体(Hexon)蛋白、五邻体(Penton)基座、纤突蛋白(Fiber)。FAdV-4 Fiber具有两个独立的Fiber编码基因Fiber-1和Fiber-2[8],Fiber-2蛋白具有诱导中和抗体产生的能力,是具有保护性的免疫原[9]。现有研究结果显示,使用不同表达系统获得的重组Fiber-2蛋白均具有良好的免疫原性,可作为亚单位疫苗候选蛋白进行疫苗研制开发[9-11]。
目前对于禽腺病毒的防控主要以全病毒灭活疫苗为主,研究证实,全病毒灭活疫苗具有较好的免疫效果[12-14]。但全病毒灭活苗需借助鸡胚或细胞增殖病毒,制备工艺繁琐、生产成本较高,且活毒操作存在生物安全风险。因此,安全、有效、价格低廉的亚单位疫苗,在临床疫病防控方面具有良好的开发和应用前景。
本研究利用原核表达系统对Fiber-2蛋白进行表达、纯化,将纯化后的Fiber-2蛋白制备不同抗原含量的亚单位疫苗,同时制备不同抗原含量的全病毒灭活疫苗,采用超低免疫剂量对全病毒灭活疫苗和亚单位疫苗的免疫效果进行比较研究,为亚单位疫苗研制提供实验依据。
1 材料和方法
1.1 主要实验动物与试剂 SPF鸡购自北京勃林格殷格翰维通生物技术有限公司;大肠杆菌BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司;异丙基硫代半乳糖苷(Isopropyl β-D-Thiogalactoside,IPTG)诱导剂、预染蛋白Marker均购自北京索莱宝科技有限公司;辣根过氧化物酶标记的兔抗鸡IgY二抗购自北京百奥莱博科技有限公司;Ni Sepharose 6 Fast Flow购自美国General Electric Company;DMEM培养基、胎牛血清均购自Gibco;β-丙内酯购自美国Sigma公司;商品化禽腺病毒I群(FADV-I)抗体ELISA试剂盒购自荷兰BioChek。
1.2 质粒、毒株和细胞 pET-30a-Fiber-2重组质粒由国家兽用药品工程技术研究中心构建、鉴定与保存;Ⅰ群FAdV-4 FAV-HN株C3代毒种由国家兽用药品工程技术研究中心分离、鉴定与保存;LMH细胞由国家兽用药品工程技术研究中心保存;Ⅰ群FAdV-4阳性血清由国家兽用药品工程技术研究中心鉴定、制备与保存。
1.3 Fiber-2蛋白的表达与纯化 将重组质粒pET-30a-Fiber-2,转化入大肠杆菌BL21(DE3)中,挑取单菌落至LB液体培养基中(硫酸卡那霉素的质量浓度为50 μg/mL),37℃振荡培养过夜;将菌液按照1∶100的体积比加至LB液体培养基(硫酸卡那霉素的质量浓度为50 μg/mL)中;37℃继续培养至菌液OD600值为0.6,加入终浓度为0.2 mmol/L的IPTG进行诱导8 h。对诱导后的菌体进行超声裂解,取离心后上清液加入终浓度为0.01 mol/L的咪唑,利用Ni SepharoseTM6 Fast Flow镍柱进行层析纯化,收集流穿、洗脱液和洗脱样品进行SDS-PAGE电泳检测,PBS透析除去咪唑并过滤除菌。使用Ⅰ群4型禽腺病毒阳性血清进行琼脂扩散试验,测定Fiber-2蛋白液的AGP效价。
1.4 Ⅰ群禽腺病毒(4型)FAV-HN株病毒液制备及灭活
1.4.1 病毒液制备及病毒含量测定 取Ⅰ群禽腺病毒(4型)FAV-HN株C3代毒种,按照0.1%的体积比接种至长成单层的LMH细胞,37℃、5% CO2培养箱中培养。每6~8 h观察1次细胞病变,待80%以上细胞出现病变时收获。冻融2次,取样测定病毒含量,其余置-20℃以下冻结保存。
1.4.2 病毒液灭活及检验 取出冻结保存的Ⅰ群禽腺病毒(4型)FAV-HN株病毒液,融化后,加入2%的β-丙内酯溶液,使β-丙内酯的终浓度为0.1%,摇匀后,置2℃~8℃条件下灭活16 h,待病毒液温度降至恒温时开始计时,16 h后取出置37℃水解2 h。水解后取样进行无菌检验和灭活检验。
1.5 不同抗原含量的Fiber-2蛋白亚单位疫苗和全病毒灭活疫苗免疫效果比较
1.5.1 疫苗制备 为评价不同抗原含量的Fiber-2蛋白亚单位疫苗和全病毒灭活疫苗对SPF鸡的免疫效力,本研究将纯化的Fiber-2蛋白液分别稀释至AGP效价为1∶16、1∶8、1∶4,将灭活检验合格的病毒液按照灭活前病毒含量稀释至病毒含量分别为107.0TCID50/0.1mL、106.5TCID50/0.1mL和106.0TCID50/0.1mL,分别按照水相∶油相(1∶2)乳化制备6种不同抗原含量的亚单位疫苗和全病毒灭活疫苗进行免疫效果比较。
1.5.2 攻毒保护试验 选取60只健康的21日龄SPF鸡,随机分为6个组,每组10只,分别经腿部肌肉接种上述6种疫苗,20 μL/只,另设5只SPF鸡接种灭菌生理盐水作为攻毒对照、5只不免疫作为空白对照,分组情况详见表1。免疫21 d后,将所有疫苗免疫组和攻毒对照组的鸡只,经腿部肌肉注射Ⅰ群FAdV-4 FAV-HN株病毒液,每只0.5 mL(含106.0TCID50),观察7 d,记录免疫组和攻毒对照组鸡的发病和死亡情况,死亡鸡立即剖检,观察大体剖检病变并取肝脏进行组织病理学观察和免疫组化,至攻毒后7 d,所有存活鸡剖检,观察大体剖检病变并取肝脏进行组织病理学观察和免疫组化。

表1 试验分组Table 1 Test groups
1.5.3 泄殖腔拭子排毒 攻毒保护试验SPF鸡于攻毒后3、5、7 d采集每只鸡的泄殖腔拭子进行PCR检测排毒,提取泄殖腔拭子核酸,参考文献[15]报道引物PCR检测扩增HexonL1基因片段。所使用的上、下游引物分别为HexonL1-F和HexonL1-R,目的片段约为900 bp,引物序列HexonL1-F为:5'-CAARTTCAGRCAGACGGT-3',引物HexonL1-R为:5'-TAGTGATGMCGSGACATCAT-3'。
2 结果
2.1 Fiber-2蛋白的表达与纯化 诱导重组大肠杆菌表达Ⅰ群4型禽腺病毒Fiber-2蛋白,并利用Ni Sepharose 6 Fast Flow填料进行亲和层析,未纯化的蛋白和不同时间点纯化收集的蛋白、纯化后的蛋白样品进行SDS-PAGE电泳鉴定,结果可知,纯化后的蛋白在55~70 kDa处可见到明显的目的条带,纯度可达80%以上(图1)。测定纯化后Fiber-2蛋白液的AGP效价为1∶64。

图1 Fiber-2蛋白纯化过程SDS-PAGE分析Fig.1 SDS-PAGE analysis of purification process of Fiber-2 protein
2.2 Ⅰ群禽腺病毒(4型)FAV-HN株病毒液制备及检验 制备C4代病毒液,并取样测定其病毒含量为107.4TCID50/0.1mL。
2.3 灭活后病毒液的灭活检验及无菌检验 对灭活后的病毒液进行无菌检验和灭活检验,无菌检验结果显示,接种后7 d,TG小管、GA斜面、TSB小管均无菌生长,无菌检验合格。灭活后病毒液接种LMH细胞进行灭活检验,盲传2代,LMH细胞均未产生细胞病变,灭活检验合格。
2.4 攻毒保护 攻毒保护试验结果显示,G组SPF鸡于攻毒后第2~3 d发病,出现精神沉郁、羽毛蓬乱、不愿走动、嗜睡等临床症状,出现临床症状后1~2 d死亡,死亡鸡剖检可见心包积液、肝脏肿大、出血等病理变化,至攻毒后第7 d,4/5死亡、5/5发病。A、B、D组免疫鸡攻毒后全部健活,未出现任何临床症状,攻毒后7 d剖检,均无异常。C、E组免疫鸡均1/10出现羽毛蓬乱、不愿走动等临床症状,攻毒后7 d剖检,1/10~2/10免疫鸡出现少量心包积液或肝脏肿大等病变,而F组免疫鸡攻毒后7 d内5/10死亡、9/10发病,攻毒后7 d剖检,9/10免疫鸡出现心包积液或肝脏肿大、出血等病变。结果详见表2和图2。
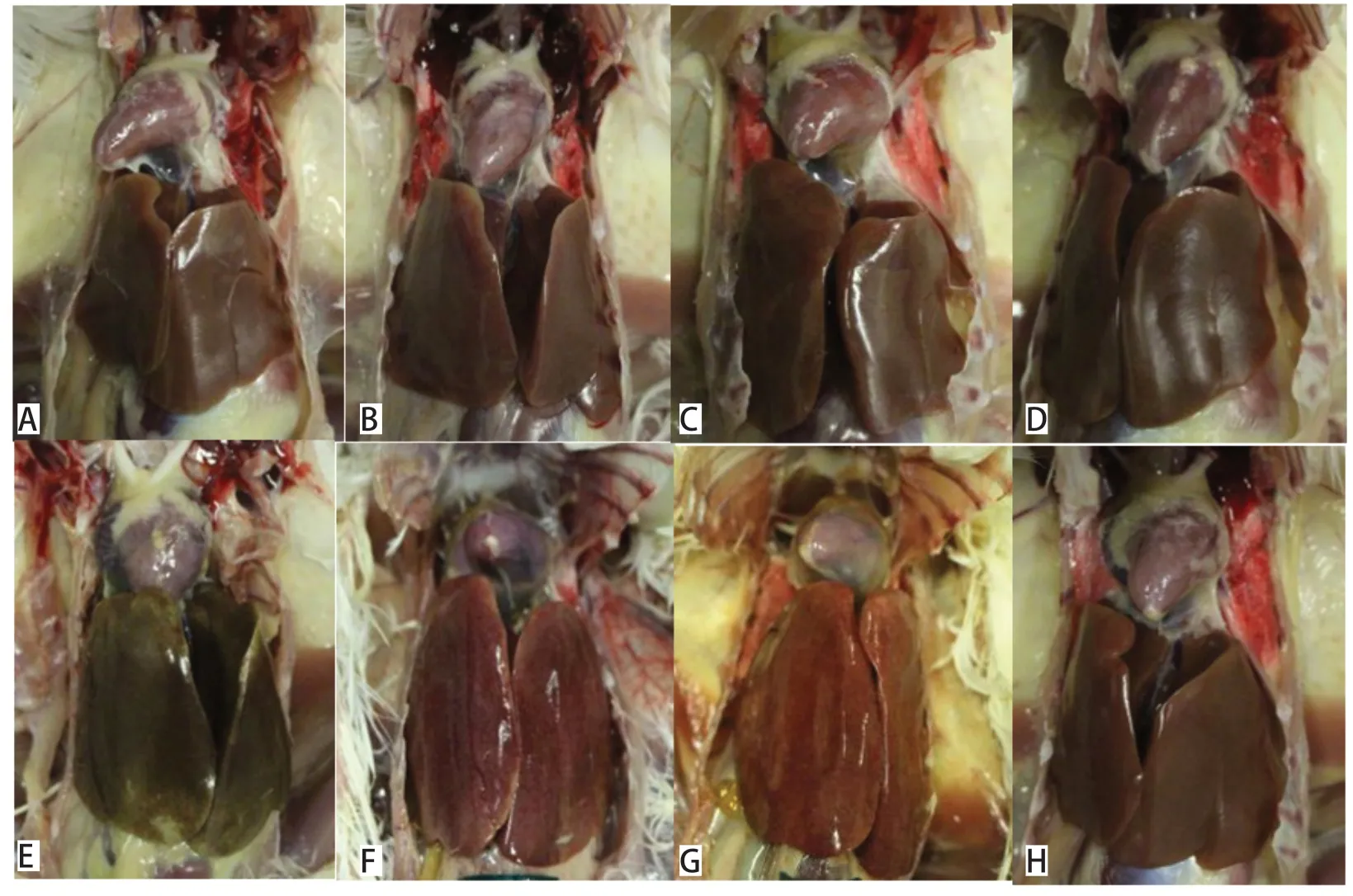
图2 不同抗原含量疫苗组的剖检病变结果Fig.2 Anatomy results of different vaccine groups
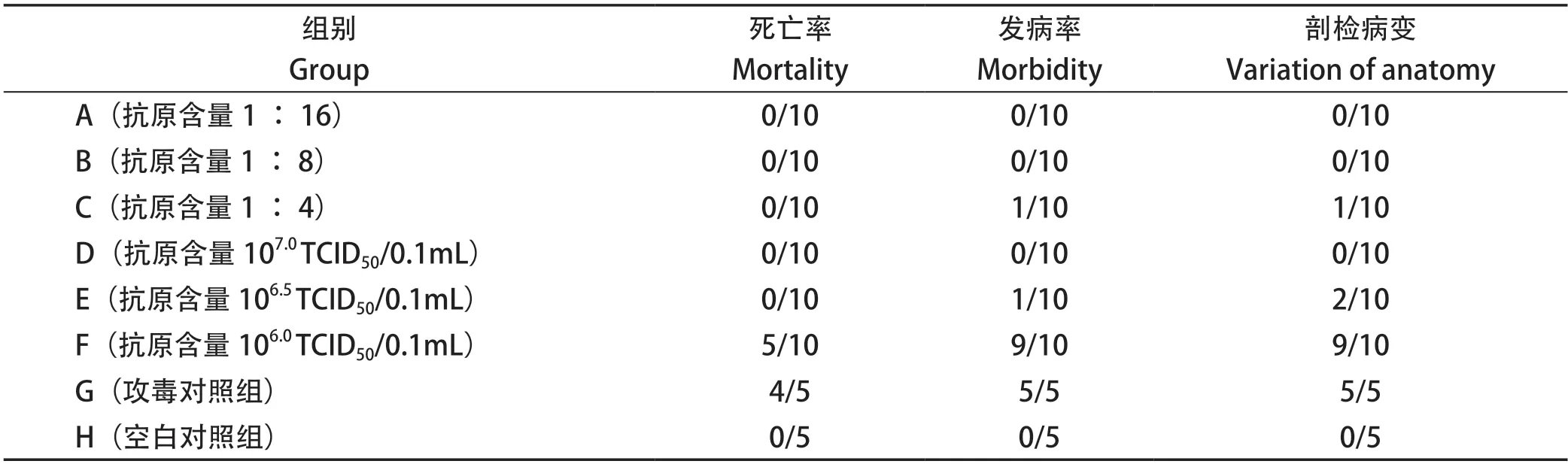
表2 不同抗原含量疫苗组的攻毒保护结果Table 2 Challenge protection results of different vaccine groups
2.5 肝脏组织病理学观察和免疫组化 攻毒后7 d内,立即剖检死亡鸡,取肝组织进行HE染色和免疫组化,至攻毒后7 d,所有存活鸡剖检取肝脏组织进行HE染色和免疫组化检测,结果可知,A、B、D组免疫鸡肝组织HE染色未见明显病变,免疫组化均为阴性;C、E组免疫鸡1/10~2/10可见不同程度的肝细胞脂肪变性、坏死,核内包涵体及局灶性淤血出血,1/10免疫组化阳性;F组免疫鸡9/10免疫鸡可见不同程度的肝细胞脂肪变性、坏死,大量核内包涵体及大面积淤血出血,8/10免疫组化阳性。G组免疫鸡均可见大量肝细胞脂肪变性、坏死,大量核内包涵体及大面积淤血出血,且免疫组化均为阳性(图3~4,表3)。
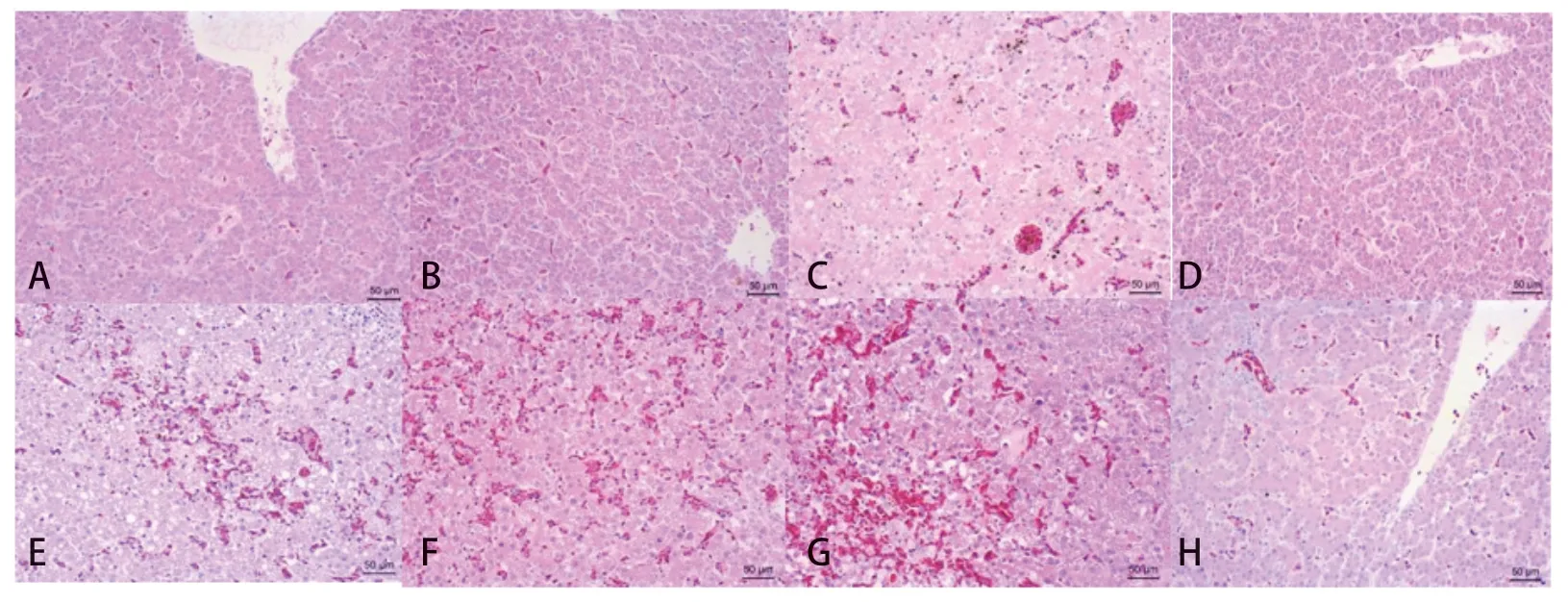
图3 不同抗原含量疫苗组的HE染色结果Fig.3 HE staining results of different vaccine groups
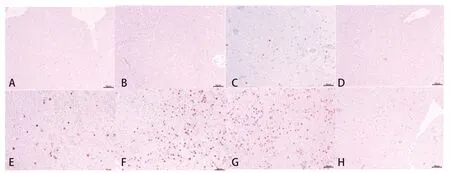
图4 不同抗原含量疫苗组的免疫组化染色结果Fig.4 Immunohistochemical results of different vaccine groups
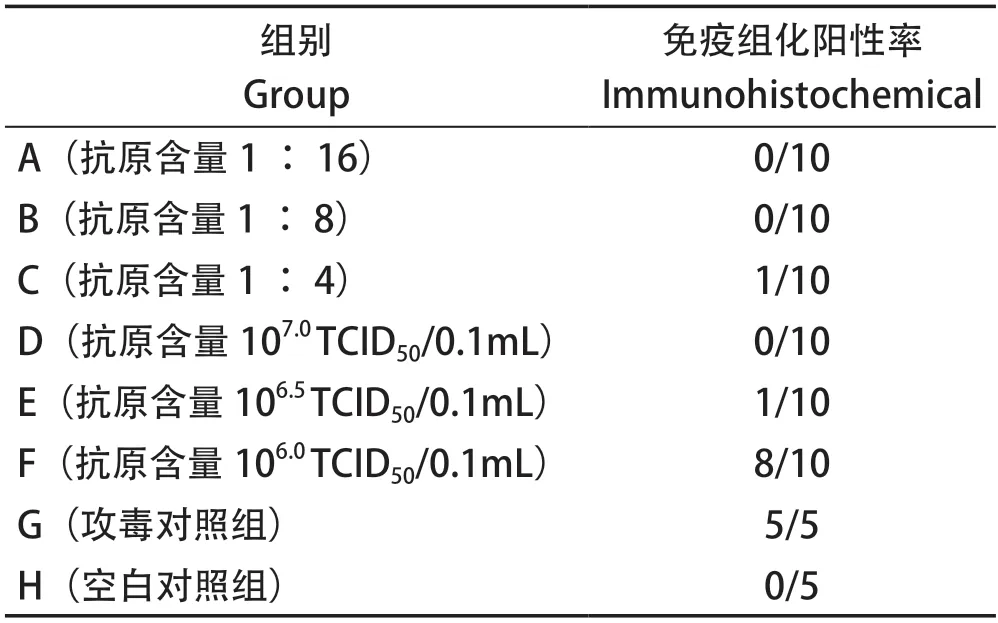
表3 不同抗原含量疫苗组的免疫组化染色结果Table 3 Immunohistochemical results of different vaccine groups
2.6 泄殖腔拭子排毒 于攻毒后3、5、7 d分别采集每组鸡泄殖腔拭子,采用PCR测定鸡泄殖腔拭子排毒情况,结果可知,A、B和D组攻毒后不同时间均未检测到排毒,而C、E、F组均检测到不同程度的排毒,综合分析,A、B和D组免疫效果相当,C略优于E组,F组免疫效果最差(表4)。
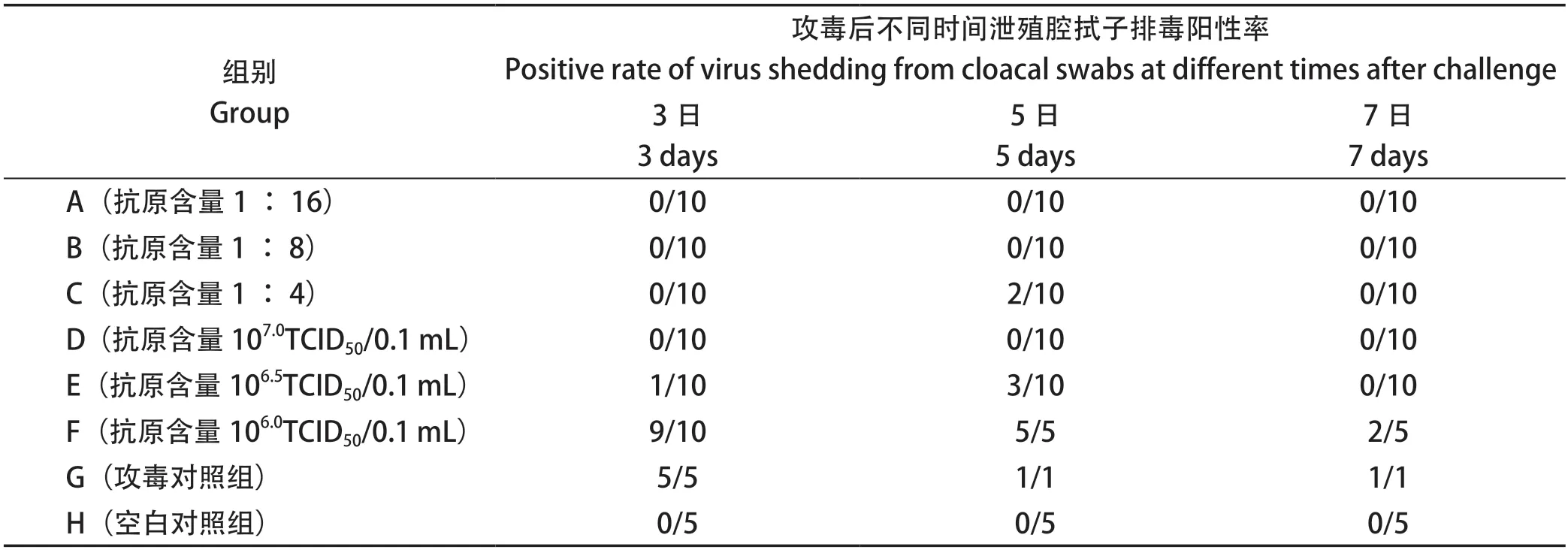
表4 不同抗原含量疫苗组的泄殖腔拭子排毒结果Table4 Cloacal swab detoxification results of different vaccine groups
3 讨论
禽腺病毒是一种在全世界范围内广泛流行的家禽和野禽常见的传染病病原。其分为3个亚群,Ⅰ亚群禽腺病毒分为A、B、C、D、E 5个种,12个血清型,其中鸡肝炎-心包积液综合征是由血清4型引起。该病首次在巴基斯坦的安卡拉地区发生,随后陆续在韩国、印度、美国等地区流行[16]。该病于2014年在我国零星发生,但2015年起,在我国多地呈暴发式传播,致死率高达50%,给我国养禽业造成巨大经济损失,疫苗接种是预防和控制该病传播的主要手段之一。
在HHS暴发初期,有研究报道将感染鸡肝脏组织研磨、灭活,制备组织灭活疫苗用于预防该病传播具有一定的效果,但组织苗存在制备工艺复杂、灭活不彻底等问题;为了更好的防控该病的传播,采用细胞培养和SPF鸡胚制备灭活苗成为更好的选择,但是仍存在部分毒株在细胞和鸡胚上增殖效果差,生产成本高等诸多问题。有研究报道,针对HHS的预防与治疗,与灭活苗相比,通过重组蛋白制备的亚单位疫苗可以为该病提供更好的防控[17-18],而且亚单位疫苗生产工艺抗原生产成本低、不存在灭活不彻底、抗原含量不易达标、活毒操作存在生物安全风险等不足,因此重组蛋白亚单位疫苗有望成为继灭活苗后更理想的新型疫苗。
王晨等[19-20]利用杆状病毒表达系统表达Fiber-2蛋白制备FAdV-4亚单位疫苗,该疫苗可为免疫鸡提供理想的免疫攻毒保护。但真核表达系统工艺复杂,成本较高。本研究选用大肠杆菌表达系统,获得可溶性的AGP效价不低于1∶64的Fiber-2蛋白,工艺简单,生产成本低,制备的亚单位疫苗免疫攻毒保护效果确实,适合进行规模化生产。同时,本研究发现,使用荷兰BioChek商品化的禽腺病毒Ⅰ群(FADV-I)抗体ELISA试剂盒对Fiber-2蛋白亚单位疫苗和全病毒疫苗免疫血清进行抗体检测时,前者血清抗体值显著低于后者。对造成这种现象的原因进行分析,ELISA试剂盒使用全病毒为包被抗原,FAdV-4病毒粒子中结构蛋白Hexon占比较高,而Fiber-2蛋白极低,因此使用ELISA试剂盒测得的Fiber-2抗体结果较低甚至阴性。因此不能使用全病毒为包被抗原的ELISA试剂盒评价Fiber-2亚单位疫苗免疫血清的抗体效价[21]。
本研究制备不同抗原含量的Fiber-2蛋白亚单位疫苗和全病毒灭活疫苗,在超低免疫剂量情况下,对全病毒灭活疫苗和亚单位疫苗的免疫效果进行全面比较研究,免疫攻毒保护试验结果显示,Fiber-2蛋白具有良好的免疫原性,抗原含量AGP效价不低于1∶4,与全病毒灭活疫苗抗原含量为106.5TCID50/0.1mL免疫效力相当,可用于疫苗研制开发。
