HSIL/CIN2自然转归及管理的研究进展*
2023-09-07张圆梦刘丽萍赵宇贺
张圆梦,刘丽萍,赵宇贺,陈 丽
(河北医科大学附属保定市第一中心医院,保定 071000)
子宫颈癌是最常见的恶性肿瘤之一,按发病率和死亡率计算,子宫颈癌是继乳腺癌、大肠癌和肺癌之后的第四大恶性肿瘤[1]。近几十年来,随着癌前病变筛查项目的开展,宫颈癌的发病率和死亡率显著下降。子宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)是与宫颈浸润癌相关的癌前期病变的统称,反映子宫颈癌发生、发展的连续过程。
CIN1归为低级别上皮内病变(low-grade squamous intraepithelial lesion,LSIL),CIN2和CIN3归为高级别上皮内病变(high-grade squamous intraepithelial lesion,HSIL)[2]。目前在CIN的治疗中,CIN1被认为是良性病毒复制的组织学诊断,即使是持续的CIN1,病变进展的几率也很低,大多数患者能达到自行消退,应保守处理。CIN3被认为是癌前病变,发展为宫颈浸润癌的风险很高,切除治疗是最佳选择[3]。作为临界值也是干预的阈值“CIN2”,则采用p16免疫组化染色对其进行分层管理的处理模式。Miralpeix等[4]研究显示,18岁以上CIN2/p16阳性患者中,57%的患者出现消退。目前,对于CIN2/P16阳性患者,切除治疗是不是过度治疗,哪些患者病变易消退或很快进展为CIN3乃至更高级的病变,目前并无明确结论。本文针对不同人群HSIL/CIN2的诊断和临床管理出现的问题进行综述与分析,为临床实践提供诊疗思路。
1 CIN2诊断和临床管理的重要发展史
20世纪60年代开始引入子宫颈上皮内病变这一概念。2003年WHO依据细胞的分化程度、细胞核的异型性及核分裂活性将其分为CIN1、CIN2、CIN3。2014年在《女性生殖器官WHO肿瘤学分类》中提出,根据子宫颈细胞学TBS分级建议对CIN采用二分类法,将CIN1归为LSIL,将CIN2、CIN3归为HSIL,并以此作为临床指导[2]。2017年《中国子宫颈癌筛查及异常管理相关问题专家共识》指出,若组织病理学为CIN2,需进一步行p16检测,p16阴性患者参照LSIL管理进行保守治疗,p16阳性患者参照HSIL管理[3]。2019年美国ASCCP[5]指出区分HSIL中的CIN2、CIN3具有重要意义,之后WHO根据CIN2、CIN3在侵袭力、预后、生物学行为等方面的不同,将HSIL重新划分为HSIL/CIN2、HSIL/CIN3,对CIN2、CIN3患者的管理有所区分。并指出对于<25岁CIN2患者首选观察随访,对于≥25岁非孕CIN2女性,如有生育要求,可进行为期2年的随访观察,对于鳞柱交界区完全可见患者,首选诊断性锥切,也可行消融治疗。鳞柱交界区上缘不可见,复发或ECC为CIN2+患者,首选诊断性锥切,这是指南中第一次提出年轻有生育要求的CIN2患者可行保守治疗。2022年3月《子宫颈高级别上皮内病变管理的中国专家共识》[6]提出,对于≥25岁有生育要求的年轻女性,在阴道镜检查充分、病灶完全可见的情况下,可行为期2年的随访,每6个月复查一次HPV分型、液基细胞学检测,若2年后CIN2病灶继续存在,则行切除治疗,对于不满足以上条件的患者,积极予以干预。综上可见,国内外对于一部分CIN2女性的管理趋于保守。
2 p16检测的作用
2.1 p16检测的诊断作用 CIN2在病理特点上存在与CIN1和CIN3的重叠,所以CIN2的诊断一致性低[6]。国外研究表明,对同样一份宫颈病理切片标本,病理学家对CIN2的诊断一致性最低[7]。2012年3月LAST(下肛门生殖器鳞状上皮术语)项目中[8],经大量文献分析,免疫组化检测p16蛋白可提高CIN2的诊断一致性。随后LAST项目建议行苏木精和伊红染色诊断,采用这种方式明显降低了对形态学的依赖性。两种染色联合使用有助于辨认CIN2的分化。结果判定:p16弥漫强阳性染色视为阳性,灶状、局部、块状、无染色等视为p16阴性。p16免疫染色的具体原理是当视网膜母细胞瘤蛋白被高危HPV的E7蛋白灭活后,鳞状细胞中p16的过表达导致细胞转化,只有鳞状细胞p16弥漫性阳性免疫染色与HSIL相关。但即使借助免疫组化,CIN2诊断一致性还是很低[8],因此这种诊断现状可能引起临床上对HSIL/CIN2诊治不足或过度治疗等情况。
2.2 p16检测在预后中的作用 p16检测的诊断价值已被国内外认可,其在CIN2女性患者的预后方面也具有重要意义。有研究[9]对62例35岁以下CIN2女性LEEP术后进行随访,p16阴性患者中仅3.2%患有SIL,无HSIL,p16阳性患者中19.4%患有SIL,6.5%复发为HSIL。因此,p16检测不仅在CIN2诊断方面有重要意义,在预后方面也有预测作用,但因样本量过少,需反复多次临床研究证实。
2.3 p16与Ki67双染色检测的作用 目前临床上对CIN2诊断最常见的分流方式是p16与Ki67的双重染色。p16与Ki67双染色具有协同作用,如p16染色状态是CIN2的定性标准,Ki67染色则起到巩固、加强的作用。Tornesello等[10]研究发现,p16是提高CIN2诊断准确性的有效工具,p16检测CIN2的灵敏度为83.2%,特异度为71%,p16与Ki67双重染色将诊断灵敏度提高到94.2%。p16与Ki67联合检测是提高CIN2诊断一致性的重要方法。
3 CIN2患者实施年龄分层管理
3.1 <25岁患者 各国将HSIL/CIN2女性患者通过年龄进行分层管理,积极监测的标准因国家而异,大多数国家将标准限制在25、30岁以下妇女。2012年美国[5]建议对25岁以下CIN2女性进行积极监测,这是最早提出此建议的国家之一,其次是欧洲其他各国[11]。美国、英国及我国[6]等国家指南中提出,<25岁CIN2女性患者应接受保守治疗,法国则建议30岁以下CIN2女性应积极监测。但是,25~30岁人群的CIN2消退率与25岁以下人群是否有差异,目前还没有得到进一步的证实。总而言之,<25岁CIN2女性消退率高且进展为癌的概率低[5],对于此类女性进行保守治疗具有可行性。
3.2 ≥25岁患者 我国指南目前规定:≥25岁符合一定条件有生育要求的女性可进行为期2年的随访观察。随着三胎政策开放,有生育要求的女性越来越多,25岁能否继续作为分层管理的截断值,目前还没有临床数据证实。随机选择1638例女性,79%的女性选择主动监测,最常见原因是对手术及其相关风险的担忧,对于选择手术的女性来说,规避风险、避免进展为癌是更好的选择。国外另一项电子调查问卷[11]对CIN2保守观察的禁忌证进行调查,除HPV16感染、p16检测阳性、病变超过50%、宫颈管内膜受损外,年龄>40岁被更多人认为是保守治疗的禁忌证。综上所述,25~40岁女性主观意识上更多倾向于保守治疗。目前国内仍需开展针对CIN2女性的大规模、多中心研究,将患者的需求与实际临床指南相结合,使CIN2患者得到更好的个体化治疗。
4 HSIL/CIN2的治疗方式
4.1 子宫颈切除性治疗(LEEP和CKC) LEEP术也称宫颈转化区大环切除术,CIN2是行LEEP手术适应证之一。其优点是:在妇科门诊即可完成,节省住院时间及费用、简单、便利、局部麻醉、术后并发症少、安全系数高。缺点是:热损伤影响切缘的判断,不利于术后对病变的进一步评估。相较于LEEP,冷刀锥切术更彻底,在诊断的同时达到治疗作用,不仅能切除病灶还能更好地清除HPV病毒,也能更好地评估切缘状态。缺点是:对于年轻患者,增加不良妊娠结局的风险,如宫颈机能不全、早产、流产、胎膜早破等[12]。
4.2 保守治疗 保守治疗包括随访观察及消融等。HSIL/CIN2患者实施消融治疗有严格的适应证:宫颈管内无组织学证实的更高级别病变、转化区和病灶完全可见、全部病变在可治疗范围内等。常见消融方式有:冷冻、激光、电凝治疗。消融治疗具有对宫颈破坏少、便利、术后恢复快等优点,但是无法对标本进行病理学分析及评估切缘状态,应慎重选择[13]。研究证实,对于CIN2患者,消融治疗是一个宫颈损伤较小且安全系数高的治疗策略,尤其对于有生育要求的女性。随着技术的发展,消融治疗可能成为CIN2的有效治疗方式。
5 HSIL/CIN2的消退、持续与进展
HSIL/CIN2的生物学意义至今尚未清楚,了解HSIL/CIN2消退、持续、进展的影响因素对临床管理也至关重要。
巴塞罗那医院进行的一项前瞻性观察性研究[14],291例CIN2女性接受24个月的保守治疗后,其中214例(73.5%)病变消退,43例(14.8%)病变持续为CIN2,34例(11.7%)病变进展到CIN3;HPV16型感染(95%CI为1.13~3.43)和细胞学HSIL(95%CI为1.99~6.02)显著增加CIN2病变持续或进展的风险。HPV16型以外的其他分型是HSIL/CIN2自发消退的因素,其中HPV检测阴性的患者退行率极高,可进行随访观察。Brun等[15]研究发现,60例CIN2患者中36例(60%)病变自发消退或消失,病变消退的影响因素是阴道镜检查结果、细胞学结果和HPV基因分型,年龄、吸烟、病变表面积、p16和Ki67表达对CIN2病变的消退无显著影响。王欢华等[16]研究中纳入99例CIN2患者,其中病变逆转者62例(63%,62/99),包括完全逆转45例(45%,45/99)、部分逆转17例(17%,17/99),病变持续者22例(22%,22/99),无一患者进展为子宫颈癌;CIN2累及两点及以上者的病变逆转率明显低于单点累及者。CIN2自然转归情况及影响因素为国内外的研究热点,表1与表2总结了近3年CIN2自然转归与影响因素的研究情况。HSIL/CIN2的消退率极高,但影响CIN2转归的因素各不相同,需进行多中心、大样本、前瞻性分析,进一步探索影响CIN2消退及进展的高危因素,从而更好地对HSIL/CIN2女性进行个体化管理。

表1 近3年文献报道的影响CIN2转归因素的统计
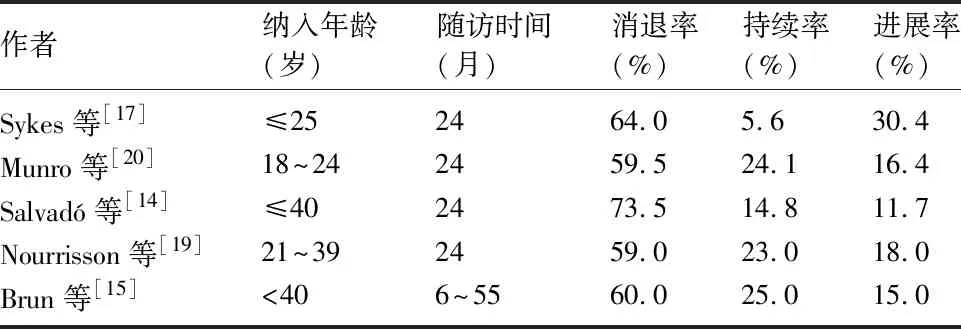
表2 近3年文献报道的CIN2消退率、持续率、进展率
6 小结与展望
综上所述,国内外指南提出CIN2/p16阳性患者是临床干预的时机,但是对于有生育要求的年轻女性,在符合阴道镜检查充分、病灶完全可见、具备随访条件的情况下可进行为期2年的严密随访。CIN2的消退率极高,需根据其年龄、生育要求、阴道镜病变情况、HPV分型、液基细胞学结果等综合考虑,进行个体化管理。冷冻、光动力学疗法、激光等对于CIN2的保守治疗具有一定的应用前景。建议建立一套评分系统来对HSIL/CIN2女性进行分层管理,在最大限度保留生育功能以及宫颈完整的情况下,避免过度治疗与诊治不足。
