血氧指数、血脂在主动脉夹层伴阻塞性睡眠呼吸暂停低通气综合征患者中的表达水平
2023-09-07杜长春黄丙森王寒秋王鑫王磊李苗苗张永波杜梅花刘新杨慎先王枫岭
杜长春,黄丙森,王寒秋,王鑫,王磊,李苗苗,张永波,杜梅花,刘新,杨慎先,王枫岭
(河南省胸科医院/郑州大学附属胸科医院 心内科,河南 郑州 450000)
主动脉夹层(aortic dissection,AD)是主动脉腔内的血液通过内膜破口进入动脉壁中层进而剥离动脉内膜与中层引发一系列症状的心血管急症,具有病死率高的特点[1]。研究发现,AD患者多伴有阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea and hypopnea syndrome,OSAHS),其特点是睡眠期间上呼吸道阻塞反复发作,可能导致严重的低氧血症和高血压[2]。OSAHS常诱发血压骤然升高,通过对血管壁产生病理性剪切力来破坏血管壁正常结构,这些都可能导致AD的发生、发展。有研究显示OSAHS与心血管疾病(cardiovascular disease,CVD)之间存在独立关联[3]。OSAHS好发于肥胖、高血压人群,其血脂、血氧水平对OSAHS的发生发展具有一定影响,因此,通过观察OSAHS患者和非OSAHS患者的血脂、血氧指标来推断影响OSAHS的影响因素,对OSAHS的改善和预防具有一定的指导意义,而OSAHS的改善也在一定程度上影响AD的发展。因此本研究通过比较AD伴OSAHS患者与AD不伴OSAHS患者的血脂、血氧指数特点,探讨AD患者合并OSAHS的影响因素,为预防OSAHS提供一定的指导。
1 对象与方法
1.1 研究对象
选择2019年6月至2022年10月于河南省胸科医院经胸腹主动脉CT血管成像(CT angiography,CTA)检查确诊的40例AD患者。患者均签署知情同意书,研究方案由医院医学伦理委员会批准。40例患者中男29例,女11例,年龄38~79(55.98±10.16)岁,体重指数18.6~29.7(24.77±3.27)kg·m-2。患者分型标准采用Stanford分型,分为Stanford A型(14例)和B型(26例),A型接受急诊手术治疗,B型接受相应的修复手术治疗。所有患者接受常规降压治疗。另随机选取40例同期住院的非AD患者为对照组,其中男28例,女12例,年龄42~80(55.85±12.75)岁,体重指数19.4~29.7(24.70±3.39)kg·m-2。两组性别、年龄、体重指数均衡可比(P>0.05)。
1.2 调查方法
采用STOP-BANG问卷表对AD组和对照组患者进行评分,评分≥3分者具有合并OSAHS风险,但是其阳性预测值较低,STOP-BANG问卷≥5分患者为中重度OSAHS,因此将AD组分为OSAHS组和非OSAHS组,OSAHS组患者STOP-BANG问卷≥5分,非OSAHS组患者STOP-BANG问卷<5分。
所有患者接受夜间多导睡眠监测(polysomnography,PSG)。PSG采用便携式睡眠监测器,记录时间至少7 h。观察指标包括:睡眠呼吸暂停低通气指数(apnea-hypopnea index,AHI)、≥4%氧减指数、血氧饱和度、最低血氧饱和度等。采集所有患者静脉血,采用酶联免疫吸附法检测患者甘油三酯、低密度脂蛋白、高密度脂蛋白、超敏C反应蛋白、血清同型半胱氨酸(homocysteine,Hcy)、血清胱抑素C(Cystatin C,Cys C)等指标。
1.3 统计学处理
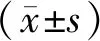
2 结果
2.1 STOP-BANG问卷调查结果
AD组中STOP-BANG问卷调查评分≥5分的患者有17例(42.5%),对照组中评分≥5分的患者有8例(20%),AD组患OSAHS比率高于对照组(χ2=4.713,P=0.030)。
2.2 OSAHS组和非OSAHS组患者临床资料
OSAHS组和非OSAHS组患者性别、年龄、血氧饱和度、最低血氧饱和度、高密度脂蛋白、超敏C反应蛋白水平比较差异无统计学意义(P>0.05);OSAHS组患者体重指数、STOP-BANG评分、AHI、≥4%氧减指数、甘油三酯、低密度脂蛋白、Hcy高于非OSAHS组,OSAHS组患者CysC低于非OSAHS组,差异有统计学意义(P<0.05)。见表1。

表1 OSAHS组和非OSAHS组患者临床资料比较
3 讨论
患有CVD(冠状动脉疾病、心律失常和主动脉扩张)和高血压的人群中OSAHS的患病率高。Saruhara等[4]发现主动脉疾病患者常合并中度至重度OSAHS,认为筛查OSAHS可能有助于早期发现主动脉疾病。然而,OSAHS和AD之间的关联尚未得到充分研究。有研究发现,AD患者在睡眠期间表现出更高的AHI和≥4%氧减指数以及更低的SaO2[5]。因此,通过观察AD患者的AHI、≥4%氧减指数与OSAHS症状表现的相关性,可以为AD患者是否伴有OSAHS提供指导意义。
本研究结果显示,OSAHS患者的体重指数高于非OSAHS患者,表明肥胖患者更容易合并OSAHS,这与范康钧等[1]研究结果一致,Yanagi等[6]也发现AD合并阻塞性睡眠呼吸暂停综合征者多为肥胖及合并高血压患者。因此,降低体重指数可能有助于降低OSAHS发生风险。而AHI、≥4%氧减指数也是区别OSAHS与非OSAHS的指标。OSAHS患者由于肥胖、扁桃体肥大、舌根后坠等因素引起呼吸道狭窄,睡眠过程中上气道对二氧化碳的刺激敏感性降低,导致呼吸频率降低[7]。AHI、≥4%氧减指数升高可能会增加主动脉向外扩张的压力,促进AD的发生。有研究认为OSAHS可能是AD发病的独立危险因素[3],合并OSAHS患者的AD更容易破裂,甚至导致患者死亡。由此,降低AHI、≥4%氧减指数不仅能够有效改善OSAHS,更能降低AD的发生风险。此外,OSAHS组甘油三酯、低密度脂蛋白、Hcy高于非OSAHS组,这可能与OSAHS患者脂质代谢紊乱有关,与肥胖具有较大的关联性,肥胖患者常伴有较高的甘油三酯、低密度脂蛋白、Hcy,这些都影响患者的血脂、血压,甚至影响血液氧的运输。AHI、≥4%氧减指数较高可导致OSAHS患者长期血氧较低,加剧了血脂的升高,两者增加AD的发生风险,这些与别自东等[8]研究一致。CysC是反映机体认知功能的一个指标,认知障碍患者的CysC表达较高,可以通过抑制酶的活性阻止Hcy的降解,使血液中Hcy含量提高,而Hcy可以促进炎症反应和氧化应激,通过产生细胞毒性造成神经损伤[9]。因此,OSAHS可能会通过下调CysC来促进Hcy的累积,以致损伤神经,降低认知功能[10],甚至升高AD的发生率。总之,影响OSAHS的一系列因素都可能加剧AD的发生。
然而,OSAHS导致AD发生的病理生理机制仍不明确。研究发现,OSAHS会诱导一系列的血管变化,如持续性高血压和血管炎症可能诱发动脉硬化[11],从而促进AD的发生。神经调节可能是最重要的机制之一。与阻塞性呼吸暂停事件相关的缺氧、高碳酸血症和氧化应激可能会刺激下丘脑垂体肾上腺轴,导致外周血管的交感神经兴奋增加,这可能会导致血压升高,心率加快[12]。另一方面,与呼吸暂停事件相关的反复间歇性缺氧可能通过氧化应激、内皮功能障碍和血管炎症诱发血管功能障碍和动脉粥样硬化。OSAHS中全身炎症的标志物C反应蛋白、肿瘤坏死因子-α和白细胞介素都可能直接或间接导致AD的发生。另外,儿茶酚胺生成过多、压力感受器静息、颈动脉体敏化导致的持续性高血压可促进平滑肌细胞凋亡、细胞外基质降解、弹性组织解离和坏死,导致血管壁僵硬和脉动压脆弱性增加。
对于无高血压的年轻AD患者,有研究提示OSAHS和AD之间的关系不仅与动脉粥样硬化加重或血压有关,而且与透壁压的变化有关[13]。这种机制包含两个方面:睡眠期间的上气道阻塞是阻塞性睡眠呼吸暂停综合征的一个主要特征,可通过胸内结构、心脏负荷和胸膜腔压力的实质性改变来影响胸内血流动力学[13];胸内负压可通过主动脉透壁压力的摆动引起主动脉壁快速扩张和主动脉压力感受器激活,从而导致左心室顺应性和左心室舒张充盈的间歇性下降。如果伴随的高血压所施加的过度剪切应力持续存在,内壁的转变和对主动脉的损伤将加速。
4 小结
AD伴OSAHS患者血氧指数、血脂异常于AD不伴OSAHS患者,这可能是由于OSAHS导致的一系列生理病理效应所致,可能对OSAHS及AD发展具有一定作用。因此,检测血氧指数及血脂对区别是否患有OSAHS有一定的指导意义,这些指标对OSAHS治疗效果的判断也具有一定的借鉴意义。然而,本研究仍存在一定的局限性,研究样本量较小,需要进一步的大样本随机试验来提高其循证医学证据。
