2 hPG及HbA1c指标在糖尿病患者利格列汀联合二甲双胍治疗前后的临床变化分析
2023-09-07赖瑞芳林春发张林婕
赖瑞芳,林春发,张林婕
1.南平市顺昌县中医院药剂科,福建南平 353200;2.南平市顺昌县中医院检验科,福建南平 353200
糖尿病(diabetes mellitus, DM)属临床常见代谢性疾病,是由胰岛素分泌缺陷或其他生物学作用障碍导致的疾病,与肾脏、视网膜病变、心血管疾病、恶性肿瘤发生存在密切相关性[1]。若血糖控制不佳,将可能增加患者并发症风险,甚至形成不良预后结局。药物治疗为首选治疗方案,其中二甲双胍属临床应用较广的经典降糖药物,具有抗炎、抑制细胞聚集多重功效[2]。利格列汀属于二肽基肽酶4(dipeptidylpeptidase 4, DPP-4)抑制剂,对于DM 同样有着理想降糖功效[3-4]。随着用药时间的延长,降糖药物效果不断减弱,单一用药策略难以满足临床需求,联合用药策略逐渐成为流行趋势。基于此,本研究选取2020 年4 月—2022 年4 月于南平市顺昌县中医院就诊的120 例DM 患者作为研究对象,分析联合疗法(利格列汀+二甲双胍)治疗DM的疗效及影响。现报道如下。
1 资料与方法
1.1 一般资料
选取本院120 例DM 患者,采用随机数表分为两组,各60 例。观察组男38 例,女22 例;年龄40~78 岁,平均(57.41±10.23)岁;体质指数21~28 kg/m2,平均(25.43±2.68)kg/m2;病程2~14 年,平均(5.31±1.26)年。对照组男39 例,女21 例;年龄38~75 岁,平均(57.26±10.45)岁;体质指数21~27 kg/m2,平均(25.13±2.74)kg/m2;病程1~16 年,平均(5.45±1.23)年。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经过医院医学伦理委员会批准。
1.2 纳入与排除标准
纳入标准:符合DM 诊断标准[5];年龄18~80 岁;患者及家属签署知情同意书。
排除标准:合并免疫缺陷疾病、脏器功能不全、恶性肿瘤;对本研究用药策略存在过敏反应或近2月服用降糖、维生素D 类、激素类药物;存在严重糖尿病并发症。
1.3 方法
两组均给予基础治疗,包括饮食、运动训练指导及生活方式干预等。对照组给予单纯二甲双胍(国药准字H20031225)治疗,0.5 g/次,3 次/d。观察组给予联合疗法,利格列汀(国药准字H20203294)+二甲双胍治疗,二甲双胍用法同对照组,利格列汀5 mg/(次·d),于早餐前30 min 服用,两组均连续治疗6 月。
1.4 观察指标
对比两组血糖控制疗效。参照诊断标准,分为显效:连续5 次监测显示糖化血红蛋白(glycosylated hemoglobin A1c, HbA1c)水平<7.0%,且餐后2 h血糖(2-hour postprandial blood glucose, 2 hPG)<8.3 mmol/L。有效:连续5 次监测显示HbAlc 为7%~9%,且2 hPG<8.3 mmol/L。无效(HbA1c、2 hPG 水平均未达到上述标准)。总有效率=(显效例数+有效例数)/总例数×100%。
对比两组治疗前后血清25-羟维生素D3[25-hydroxy cholecalciferol, 25-(OH)D3]水平。于治疗前、治疗6 个月后检测,采用电化学发光免疫法检测。
对比两组治疗前后血糖及胰岛功能相关指标水平。于治疗前、治疗6 个月后检测,采用贝克曼全自动生化分析仪(型号:AU5800)检测2 hPG 等相关指标,并计算胰岛β 细胞功能指数(homeostasis model assessment-β, HOMA-β),HOMA-β=空腹胰岛素(fasting insulin, FINS)×20/[ 空腹血糖(fasting plasma glucose, FPG)-3.5]。采集患者空腹静脉血液,采用伯乐糖化血红蛋白仪D-10(高效液相色谱法)检测HbA1c 水平。
对比两组药物相关不良反应发生情况。记录用药过程中发生的恶心呕吐、低血糖、乏力等不良反应事件。
1.5 统计方法
采用SPSS 23.0 统计学软件进行数据分析,计量资料符合正态分布,以(±s)表示,行t检验;计数资料以例(n)和率表示,行χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者血糖控制疗效对比
观察组血糖控制有效率明显高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组患者血糖控制疗效对比
2.2 两组患者治疗前后血清25-(OH)D3 水平对比
治疗前,两组25-(OH)D3 水平对比,差异无统计学意义(P>0.05);治疗后,两组25-(OH)D3 水平均明显升高,且观察组明显高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者治疗前后血清25-(OH)D3 水平对比[(±s),ng/mL]

表2 两组患者治疗前后血清25-(OH)D3 水平对比[(±s),ng/mL]
注:*表示与同组治疗前对比,P<0.05。
?
2.3 两组患者治疗前后血糖及胰岛功能指标对比
治疗前,两组2 hPG、HbAlc、HOMA-β 对比,差异无统计学意义(P>0.05);治疗后,两组2 hPG、HbA1c 指标均明显降低,HOMA-β 明显升高,且观察组2 hPG、HbA1c 水平明显低于对照组,HOMA-β明显高于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组患者治疗前后血糖及胰岛功能指标对比(±s)
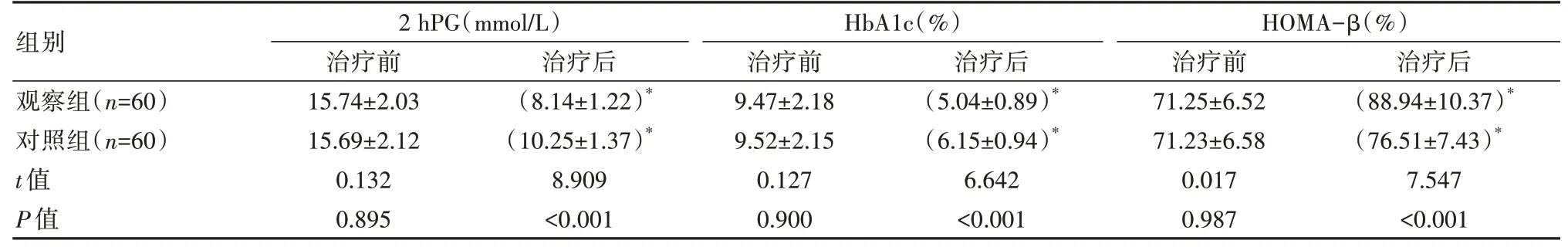
表3 两组患者治疗前后血糖及胰岛功能指标对比(±s)
注:*表示与同组治疗前对比,P<0.05。
?
2.4 两组患者药物不良反应发生情况对比
两组药物相关不良反应发生率对比,差异无统计学意义(P>0.05)。见表4。
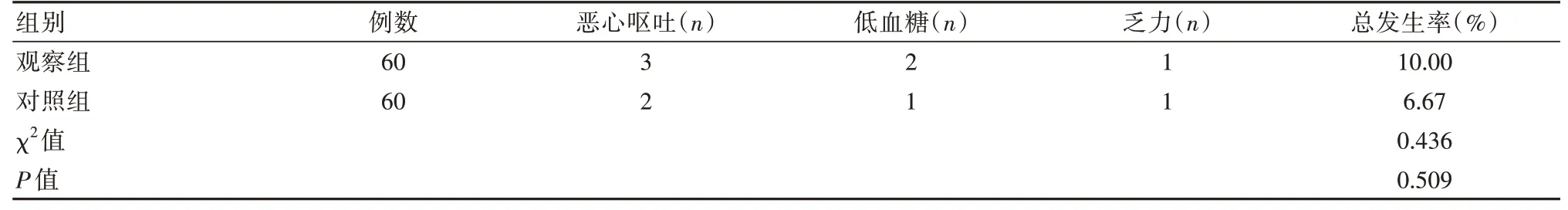
表4 两组患者药物不良反应发生率对比
3 讨论
DM 疾病发生因素较为复杂,与遗传、肥胖、糖类摄入过多等存在密切关系[6]。随着不良生活习惯的流行,DM 患病率呈现逐年增长趋势,且疾病负担日益加重。二甲双胍可通过增强外周靶组织葡萄糖摄取利用发挥降糖功效,此外还可以降低游离脂肪酸,抑制体质量增加[7]。但袁凤易等[8]研究报道,二甲双胍治疗后患者2 hPG 及HbA1c 指标明显改善,但停药3 月后,上述指标明显升高。表明采用单一二甲双胍治疗维持效果不够理想,仍需寻找更加理想的联合治疗策略。利格列汀作用机制是通过可逆性结合DPP-4,继而抑制DPP-4 对胰高血糖素样肽1 的降解功能,促使胰岛素分泌增加,继而发挥理想降糖功效[9]。此外弓慧杰等[10]研究报道显示,利格列汀还可以通过促进骨膜蛋白降解,抑制及减缓DM 大鼠肾组织纤维化进程。
本研究结果显示,观察组血糖控制有效率(98.33%)明显高于对照组(86.67%)(P<0.05)。说明联合疗法可以提高血糖控制水平。其原因在于二甲双胍可通过提高糖摄取及降低脂肪酸等发挥降糖功效,而利格列汀可以通过竞争性抑制DPP-4 水平,促进促胰岛素释放,继而增加胰岛β 细胞数量;发挥多靶点协同降糖功效[11]。治疗后观察组25-(OH)D3 水平明显高于对照组(P<0.05)。说明联合疗法可以进一步提高25-(OH)D3 水平。治疗后观察组2 hPG、HbA1c 水平明显低于对照组,HOMA-β 明显高于对照组(P<0.05)。说明联合疗法改善2 hPG、HbA1c、HOMA-β 水平更理想。邓韵等[12]研究结果与本研究一致,其结果显示联合疗法患者2 hPG(12.03±1.95)mmol/L、HbA1c(7.89±1.88)%明显低于二甲双胍治疗组(8.25±1.01)mmol/L、(5.02±1.68)%(P<0.05)。其原因在于25-(OH)D3可参与结合胰岛β 细胞维生素D 受体,促使胰岛β细胞活化,并增强胰岛素对葡萄糖敏感性及转运能力[13];而二甲双胍可以通过降糖效果改善糖尿病患者病理状态,继而影响25-(OH)D3 水平;联合利格列汀可以刺激胰腺β 细胞合成及胰岛素分泌,有效控制血糖,纠正胰岛素紊乱状态,降低HbA1c 水平,促进维生素D 受体表达,改善25-(OH)D3 水平。本研究两组药物相关不良反应(10.00% vs 6.67%)对比,差异无统计学意义(P>0.05)。说明长期联合服用利格列汀不易增加不良反应,安全性较高。此外该药物还具有抗氧化及保护心肌功效,可预防心血管事件发生。本研究仍存在一定不足之处,DM 属慢性疾病,远期疗效观察具有重要意义,而本研究仅完成近期疗效评估,未进行远期疗效随访;此外对于利格列汀联合二甲双胍协同作用机制未做进一步研究分析,未来仍需探索。
综上所述,DM 患者联合应用利格列汀+二甲双胍疗法临床效果显著,可有效改善患者血糖及胰岛β 细胞功能,提高25-(OH)D3 水平,且安全性较高。
