褪黑素调控水杨酸和乙烯代谢维持沙果贮藏品质
2023-09-07袁瑞敏王佳傲李湘鹏李建挥
袁瑞敏 彭 静 王佳傲 李湘鹏 李建挥 闵 婷 林 琼,*
(1中国农业科学院农产品加工研究所,北京 100193;2湖南省植物园,湖南 长沙 410116;3武汉轻工大学食品科学与工程学院, 湖北 武汉 430023)
褪黑素(melatonin, MT)是存在于动植物体内、具有较强生物活性的多功能胺类分子[1-2],于1958 年首次在牛松果腺中被发现[3],参与植物成熟衰老等一系列生命活动的调控[4-5],可提高植物对生物胁迫的抵抗性及对冷害、高盐等非生物胁迫的耐受性[6-7]。研究表明,MT 可通过自身的清除性,诱导果实中超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽还原酶(glutathione reductase, GR)及抗坏血酸过氧化物酶(ascorbate peroxidase, APX)等抗氧化酶和酚类物质、还原型谷胱甘肽等非酶抗氧化剂来消除柑橘[8]、番茄[9]、石榴[10]果实及大白菜[11]中过多的活性氧,保护其免受氧化损伤,维持活性氧代谢,延缓果蔬衰老以保持较好的品质。Wei等[12]研究表明,MT处理能诱导香蕉果实中MT、水杨酸(salicylic acid, SA)和乙烯含量的积累,提高香蕉对枯萎病的抗性。采前MT 喷施处理番茄果实能显著提高其对灰葡萄孢菌侵染的抵抗能力,有效提高番茄果实的贮藏品质[13-14]。此外,MT 在延缓苹果[15]、猕猴桃[16]、梨[17]果实及黄瓜[18]的后熟衰老进程中效果显著,能抑制果实组织中呼吸速率及乙烯合成,降低果蔬失水和软化的发生,更好地保持果实品质,但也能显著提高杏[19]果实中的乙烯积累,加快果实成熟进程,可能是由于不同浓度MT 在不同果蔬中的表达效果有所差异。
沙果(MalusasiaticaNakai)为蔷薇科仁果亚科苹果属植物的果实,正名花红果[20]。其果皮鲜红,果肉为淡黄色,富含多酚、有机酸、维生素、膳食纤维等成分,具有生津、止咳和抗氧化等功效[21]。乙烯信号对沙果果实这一典型的跃变型果实的成熟具有调控作用。乙烯是由S-腺苷甲硫氨酸通过1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylic acid,ACC)合成酶(ACC synthase, ACS)和ACC氧化酶(ACC oxidase,ACO)合成[22]。研究表明,MT 处理葡萄果实能诱导MYACS1表达,促进果实中乙烯的生物合成[23]。但Onik等[15]发现MT处理富士苹果能有效降低MdACO1和MdACS1的转录丰度,使其在贮藏期间的乙烯生成量减少。这与Yuan 等[24]的研究结果类似。水杨酸(salicylic acid, SA)是一种酚类物质,参与植物生长、发育和成熟衰老的调节[25-26]。前后关联分支酸是MT与SA在生物合成代谢途径中共同的起始物质,是合成苯丙氨酸、色氨酸的原料[27]。植物中的MT 由色氨酸通过邻氨基苯甲酸或吲哚途径合成[6],SA 则由苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL)或异分支酸合酶(isochorismate synthase, ICS)途径合成[28]。SA处理可以抑制苹果[24]、猕猴桃[29]、梨[30]和枸杞[22]果实的采后成熟,与MT 在维持果蔬成熟过程中的作用类似,两种植物激素具有较高的相似性。张静等[27]对荠菜进行SA处理,发现芽苗组织能通过上调BjTDC1/2和BjT5H1/2的表达来富集MT;同时MT 处理冷藏桃[31]果实显著提高了果肉中的SA含量。
鉴于此,本研究以沙果为试验材料,从SA 和乙烯生物合成代谢两方面研究MT 处理对沙果在常温贮藏期间生理生化指标变化的影响,探讨褪黑素处理后沙果品质及成熟的调控机制,旨在为揭示褪黑素调控沙果果实的机理奠定理论依据。
1 材料与方法
1.1 材料与试剂
新鲜沙果(MalusasiaticaNakai),于2021 年9 月采摘自内蒙古科右前旗,在24 h 内通过冷链运输至中国农业科学院农产品加工研究所实验室,放入4 ℃预冷箱预冷6 h 去除田间热,选取成熟度一致(八成熟)、大小均匀、果柄新鲜完整、无病虫害、无机械损伤、无腐烂变质的沙果果实作为试验材料。
褪黑素,Sigma-Aldrich 上海有限公司;三氯甲烷、异戊醇,上海麦克林生化科技有限公司;焦炭酸二乙酯(diethy pyrocarbonate, DEPC)、β-巯基乙醇,生工生物工程(上海)股份有限公司;三羟甲基氨基甲烷[tris(hydroxymethyl)aminomethane, Tris]、聚乙烯吡咯烷酮(polyvinylpyrrolidone, PvP)、十二烷基硫酸钠(sodium laurylsulfonate, SDS)、十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide, CTAB)、乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)、氯化锂、亚精胺、氯化钠,国药集团化学试剂北京有限公司。试剂均为分析纯。植物水杨酸酶联免疫分析试剂盒,北京威莱博生物技术有限公司;全式金试剂盒,北京全式金生物技术有限公司。
1.2 仪器与设备
GY-4果实硬度计,浙江托普云农科技股份有限公司;F-950 型便携式C2H4/CO2/O2分析仪,美国Felix 公司;YP502N 电子天平,上海精密科学仪器有限公司;BIORAD680型全自动酶标仪,美国Biorad公司;Nanodrop 2000 分光光度仪,北京龙跃生物科技发展有限公司;ABI7500实时定量PCR仪,美国Perkin Elmer公司。
1.3 试验方法
1.3.1 处理方法 试验前将预冷的沙果用清水冲洗浮尘,然后立即放入0.1% NaClO(v/v)水溶液浸泡5 min进行减菌处理,接着捞出控干水分,将沙果平均分成两组进行处理,每组150 个果实,分别为褪黑素(MT)处理组和对照组(CK)。MT 组沙果浸没到1.0 mmol·L-1MT 溶液中处理15 min;CK 组除溶液为蒸馏水,其他条件与MT 组相同。处理后将沙果果实捞出,轻轻甩掉表面的溶液,控干水分后置于(20±1) ℃的恒温箱中贮藏28 d。在贮藏3、7、14、21、28 d取样点随机取不同处理的沙果果实进行测定,每个指标测定时在不同处理组中进行3次重复取样。
1.3.2 品质指标的测定 参考苑智华[31]的方法并稍作修改,随机挑选9 个沙果并削去其赤道上间隔等距的3 个位置约1 mm 的果皮。将8 mm 圆柱形探针垂直于沙果的赤道表面,以2 mm·s-1的速度向下用力均匀地压入沙果的果肉中,穿透深度为10 mm,记录硬度计显示数据。在进行下一个位置的测定前需要将硬度计进行调零操作。结果用牛顿(N)表示。
沙果果实的失重率采用称重法[32]测定。在试验期间,MT 与CK 组中各9 个沙果果实被反复评估。计算见式(1):
式中,W为沙果果实重量损失;m0为初始沙果果实重量;mn为不同取样日称量的沙果果实重量。
1.3.3 呼吸速率和乙烯释放量的测定 参考Li等[33]的方法并稍作修改。将两处理组的沙果果实密封在两个密闭性较好的1.5 L 带盖塑料容器中(每个盒子3个沙果)。盖上盖子则开始计时,在20 ℃下密闭处理2 h。然后通过C2H4/CO2/O2分析仪分析塑料容器中的上层气体样本,得到CO2和乙烯(C2H4)浓度。每个处理重复取样3次,每个重复测定呼吸速率和乙烯释放量3次。结果分别以mL·kg-1·h-1和μg·kg-1·h-1表示。
1.3.4 SA 含量的测定 使用植物水杨酸酶联免疫分析试剂盒根据双抗体夹心法测定样品中SA含量。称取0.2 g粉末鲜样,加入磷酸缓冲盐溶液(phosphate buffer saline, PBS)缓冲液1.8 mL 涡旋混匀后,在4 ℃条件下5 000× g离心15 min得到SA 粗提液,每个样品重复测定3次。按照说明书进行后续试验。
1.3.5 基因表达水平的检测 使用Primer Premier 5.0 软件对沙果果实相关基因进行qPCR 特异引物的设计,引物的合成由北京擎科生物科技有限公司完成,引物序列见表1。使用传统的十六烷基三甲基溴化铵(CTAB)法从沙果果实中提取RNA。采用全式金试剂盒进行RNA 逆转录,合成cDNA。参考Yuan 等[24]的方法构建实时荧光定量聚合酶链反应(quantitative real time polymerase chain reaction, qRT-PCR)程序:Step 1:94 ℃ 孵育30 s;Step 2:94 ℃ 孵育5 s;Step 3:60 ℃ 孵育30 s;Step 4:跳回Step 2,40次循环;Step 5:95 ℃ 孵育15 s;Step 6:60 ℃ 采集34 s,通过7500 Fast Real-Time PCR System检测各代谢途径关键基因的表达水平。

表1 qRT-PCR分析的引物序列Table 1 Primer sequences used for qRT-PCR analysis
1.4 数据分析
使用SPSS 25.0软件进行数据分析,并表示为3 个重复的平均值±标准误差,各组间差异通过单因素方差分析(ANOVA)进行评估,P<0.05 表示差异显著。使用OriginPro 9.0软件绘制图表。
2 结果与分析
2.1 MT处理对沙果果实水杨酸含量的影响
由图1 可知,贮藏过程中,MT 处理组和CK 组沙果果实中SA含量表现为先升高后降低,均在贮藏14 d达到峰值,分别为0.84和0.71 mg·kg-1,MT较CK显著增长了19.18%(P<0.05)。何雪莹等[34]研究表明,不同品种苹果果实在成熟过程中的SA含量基本呈现先升后降的趋势。贮藏7 d后,MT处理组SA含量始终显著高于CK;贮藏28 d,MT处理组SA含量是CK的1.32倍。上述结果表明,外源MT 处理沙果果实能够使果肉中SA 含量累积,这与苑智华[31]在冷藏桃果实中的研究结果类似。
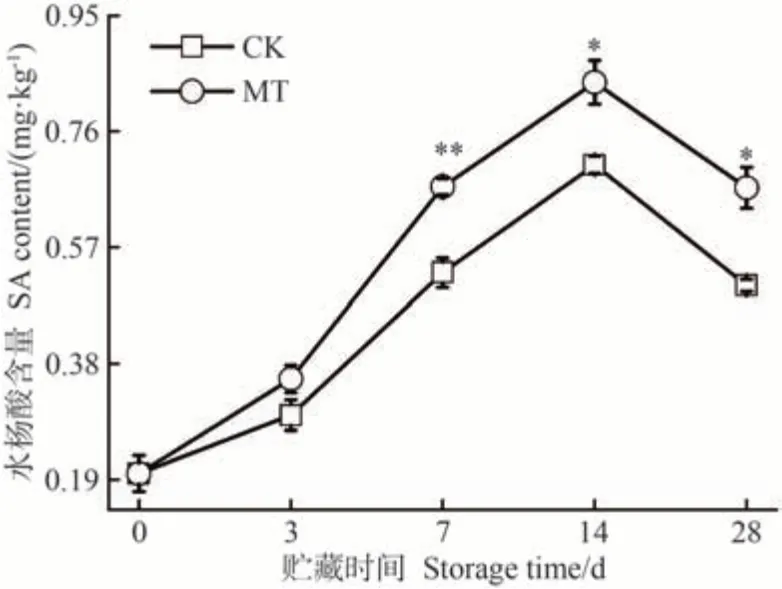
图1 MT处理对沙果果实水杨酸含量的影响Fig.1 Effects of MT treatment on SA content of shaguo
2.2 MT处理对沙果果实乙烯释放量的影响
呼吸跃变型果实成熟最典型的特征是果实采收后仍然需要等待后熟才能完全成熟,后熟的过程伴随着呼吸作用骤然升高以及大量乙烯的生成[35]。沙果作为典型的呼吸跃变型水果,其生长发育、成熟衰老和贮藏时间的长短主要依赖于乙烯的生成和催化[36]。由图2 可知,贮藏期间,沙果果实乙烯释放量呈现先急速上升至最高值,后随着果实成熟而缓慢下降的变化。CK 组沙果果实的乙烯高峰出现在贮藏14 d,达到70.34 μg·kg-1·h-1。MT 处理组果实的乙烯高峰也出现在贮藏14 d,但仅为65.17 μg·kg-1·h-1,较CK 显著降低了7.36%。同时,在整个贮藏期间其乙烯释放量始终处于较低水平。
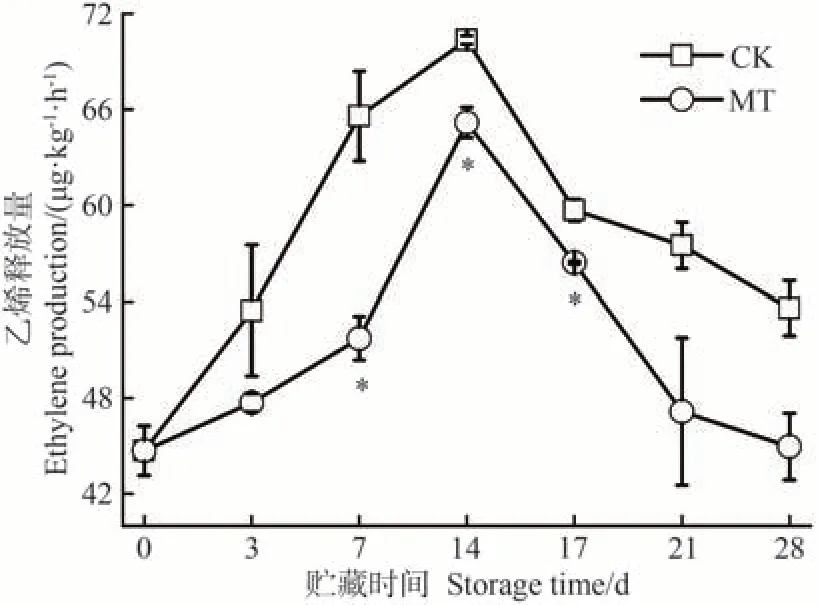
图2 MT处理对沙果果实乙烯释放量的影响Fig.2 Effects of MT treatment on ethylene production of shaguo
2.3 MT处理对沙果果实水杨酸合成关键基因的影响
在SA的两条生物合成途径中,ICS及PAL是其积累的关键酶。如图3所示,在贮藏期间,MdPAL和MdICS2在沙果果实中表达水平的变化趋势与SA含量一致。贮藏3、7和14 d时,MT处理组MdPAL相对表达量相较于CK组显著增加,其中贮藏14 d时,MT处理组MdPAL相对表达量显著增加38.29%。MT组MdICS2表达水平在贮藏3 d时较CK组显著增加了16.96%(P<0.05),其表达量在贮藏14 d达到峰值,可见MT处理诱导了水杨酸生物合成关键基因的上调,这与SA含量显著提高相一致(图1)。外源MT在贮藏过程中能够通过促进MdPAL和MdICS2的基因表达量,增加沙果果实中SA的生物合成。研究表明,SA及其代谢衍生物可以抑制乙烯前体的合成,最终降低乙烯产量[24,37]。因此推测MT可诱导沙果果实中SA合成,SA 与MT 均能抑制采后果实的乙烯生物合成途径[15,24],可能是由于MT和SA单独或共同作用抑制了乙烯生物合成和乙烯释放,最终达到延缓果实成熟的目的。
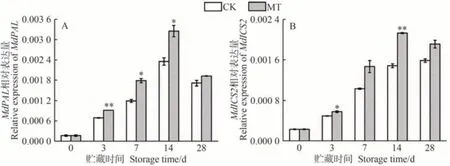
图3 MT处理对沙果果实水杨酸合成关键基因MdPAL(A)和 MdICS2(B)相对表达量的影响Fig.3 Effects of MT treatment on the relative expression of MdPAL (A) and MdICS2 (B) in shaguo
2.4 MT处理对沙果果实乙烯合成关键基因的影响
乙烯生物合成的关键酶主要为ACS 和ACO。在采摘后的苹果果实中,沉默MdACS1[38]和MdACO1[39]会导致果实无法发生呼吸跃变而出现无法成熟的表型,因此ACS1和ACO1被认为是调控苹果果实乙烯生物合成中重要的基因。如图4 所示,沙果果实中MdACS1和MdACO1的基因表达量在贮藏前期迅速上升,与乙烯释放量变化趋势一致(图2)。MdACS1和MdACO1在MT 处理组的沙果果实成熟过程中表现出相似的表达模式,在整个贮藏过程中均受到了显著抑制,贮藏28 d 时,两基因的相对表达水平相较于CK组分别显著降低了15.39%和15.31%。上述结果表明,外源MT 在贮藏过程中下调MdACS1和MdACO1的表达水平,从而抑制了沙果果实乙烯的释放,缓解了果实成熟。
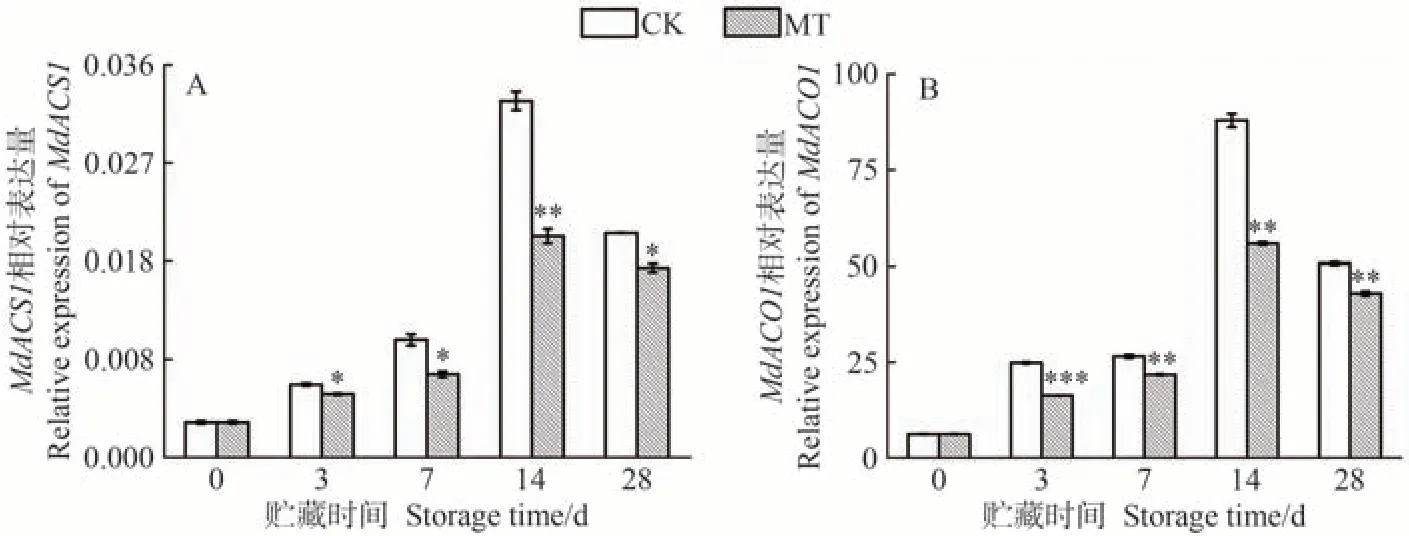
图4 MT处理对沙果果实乙烯合成关键基因MdACS1(A)和MdACO1(B)相对表达量的影响Fig.4 Effects of MT treatment on the relative expression of MdACS1 (A) and MdACO1 (B) in shaguo
2.5 MT处理对沙果果实失重率的影响
沙果果实采收后,在酶的催化下通过消耗营养物质来维持生命活动会使果实组织含水量下降,直接影响其新鲜程度,进而影响商品价值。失重率越小,果实水分保持越好,品质更佳。由图5可知,贮藏期间,CK和MT 处理组果实的失重率均持续上升,MT 处理组果实失重率始终低于CK。在贮藏早期,MT处理组与CK的失重率有显著差异,随着果实逐渐成熟,差异逐渐减小。贮藏17 d时,CK组果实失重率是MT处理组的1.34倍。贮藏28 d 时,CK 和MT 处理组失重率分别达到4.87%和3.68%。上述结果表明,MT处理能够减少沙果果实在贮藏期间的失水,这与MT 处理延缓猕猴桃[16]和蜂糖李[40]果实失重率上升的研究结果相似。
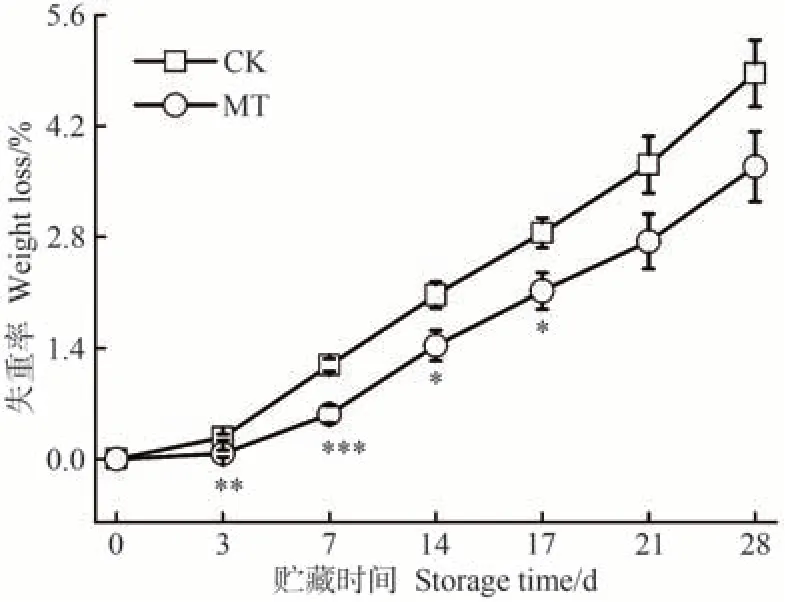
图5 MT处理对沙果果实失重率的影响Fig.5 Effects of MT treatment on weight loss of shaguo
2.6 MT处理对沙果果实硬度的影响
沙果果实在采后贮藏期间,伴随着果胶类物质分解及淀粉降解等成熟进程变化会出现发绵变软、果肉质地疏松等现象[33,41],造成沙果果实品质劣变。硬度被广泛用作成熟度和水果消费质量属性的判断指标。由图6 可知,贮藏0 d 时,沙果果实的硬度为48.36 N,随着沙果采后贮藏时间的延长,CK 和MT 处理组沙果果肉变软趋势加剧,到贮藏28 d,果实硬度分别为17.86和24.01 N,MT 组果实硬度是CK 组的1.35 倍。上述结果表明,MT处理采后沙果果实在维持其果实硬度上有显著效果,有效缓解了沙果果实软化现象的出现,在芒果[42]、富士苹果[15]中进行MT处理也有相同表现。
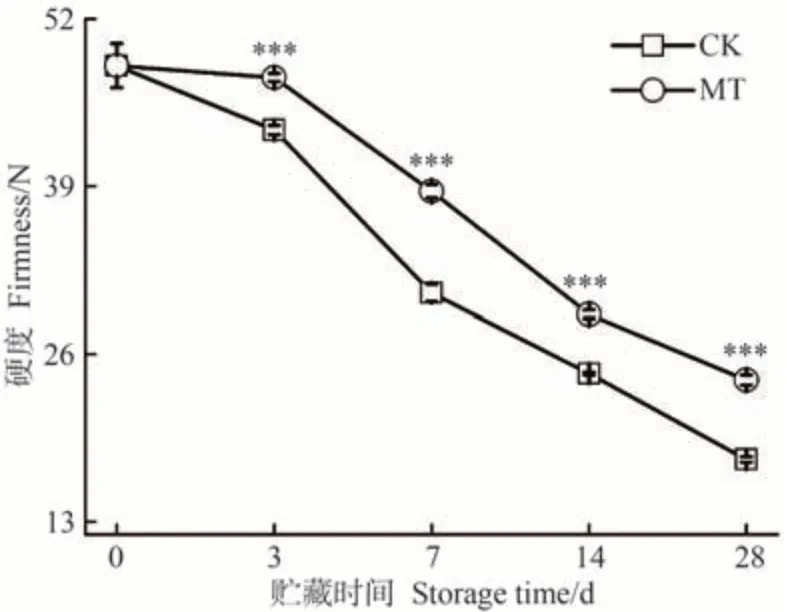
图6 MT处理对沙果果实硬度的影响Fig.6 Effects of MT treatment on the firmness of shaguo
2.7 MT处理对沙果果实呼吸速率的影响
呼吸代谢是果蔬采后贮藏过程中最基本的生命活动,也是评价果蔬贮藏时间长短的重要指标之一,与果实中多种有机大分子的生物合成、分解代谢密切相关,能通过氧化不同的碳底物,为果实在采后贮藏期间的生命代谢提供营养物质[43]。此外,消耗果实中糖分、有机酸等有机物质会降低果实的食用品质,缩短采后贮藏时间,加快果蔬成熟衰老。由图7可知,MT处理组能够有效降低沙果果实的呼吸速率,与CK组变化趋势相似,在贮藏前7 d迅速上升,中后期缓慢下降。两组呼吸速率高峰均在贮藏7 d出现,CK组达到52.07 mL·kg-1·h-1,而MT 处理组仅为42.45 mL·kg-1·h-1,其变化趋势与乙烯释放速率相似。因此,MT处理可有效抑制沙果果实呼吸强度,减少有机养分的消耗,维持其贮藏品质。
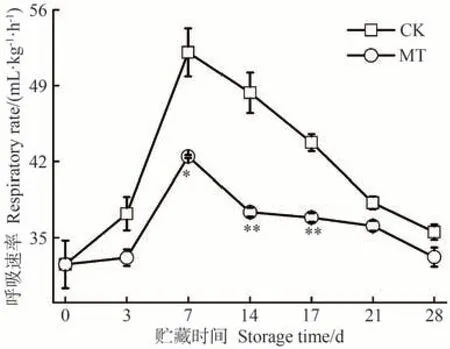
图7 MT处理对沙果果实呼吸速率的影响Fig.7 Effects of MT treatment on the respiration rate of shaguo
3 讨论
MT 作为参与多种植物活性成分合成的吲哚胺激素[1-3],在延缓果蔬衰老、维持果蔬品质方面发挥着重要作用[15-19]。Onik 等[15]使用0.1、1、10 mmol·L-1MT溶液处理不同种类苹果,发现1 mmol·L-1MT在常温下能更好地降低乙烯释放量。因此本研究选用同样浓度的MT 对沙果果实进行研究,结果发现,用1 mmol·L-1MT 处理沙果果实后,果实组织中SA 含量较对照组显著提高。在对SA 生物合成途径进行分析后发现,MT处理上调了SA 合成关键基因MdPAL和MdICS2的表达水平,促进了反式肉桂酸和异分支酸的合成,有利于果实组织中SA 的生物合成。研究表明,MT 与SA 在生物合成代谢途径中有共同的起始物质[27]。SA 作为一种高效、无毒、低成本且无残留的保鲜剂,在维持果蔬品质中被广泛使用[25-26]。SA 也是乙烯生物合成中的有效抑制剂,其衍生物能通过调节乙烯生物合成和信号传导影响果实成熟和衰老,抑制乙烯前体的合成,并减少乙烯的产生[24],在猕猴桃[29]、梨[30]和枸杞[22]中均有报道。Yuan 等[24]研究表明,SA 能通过降低王林苹果果实中的乙烯生物合成而减缓货架期间果实的品质劣变。因此猜测沙果果实中乙烯含量的下降可能是由于MT 处理激活了SA 生物合成,造成SA 积累,进一步抑制了乙烯的生物合成,从而减缓了采后沙果果实的衰老后熟进程,维持了硬度和贮藏品质。进一步对MT处理后沙果果实的乙烯生物合成关键基因MdACS1和MdACO1进行分析后发现,MT 处理组基因相对表达量较CK 显著降低,这与富士苹果[15]中MT 处理结果一致。说明沙果果实中乙烯释放的下降也可能是由MT直接造成的。SA 与MT 合成关键酶基因表达密切相关,但由于MT 在植物中的生物合成代谢途径尚不完全清楚,且SA在植物中的形成可能由多种因素共同调控,因此仍需进一步研究。
采摘后的果蔬仍可以通过旺盛的呼吸代谢消耗自身的营养物质,为果实的呼吸跃变准备能量[33]。呼吸跃变型果实中的呼吸速率会先呈现一个迅速上升的过程,造成果实衰老并伴随品质的下降,主要表现为果实蒸腾作用使组织含水量下降、果实褐变与软化、乙烯释放高峰的出现等,影响果实的商品价值[35,41,43]。本研究表明,在CK和MT处理组的乙烯释放高峰时期,沙果果实硬度迅速下降,说明乙烯的释放加速了果实的软化进程。沙果作为典型的呼吸跃变型果实,也证实了乙烯是控制沙果果实成熟衰老的关键所在。与CK 相比,MT处理组显著降低了乙烯释放的峰值,并抑制了其呼吸高峰的峰值,更有效地延缓了沙果果实中硬度的下降和失水现象的发生,与MT 处理降低猕猴桃[16]、梨[17]和黄瓜[18]失水和软化的结果类似。上述结果表明,MT处理有效抑制了采后沙果果实中的生命活动,减缓了相关代谢进程,引发了一系列生理生化活动的变化,延缓了沙果果实的衰老,在一定程度上保持了果实的硬度和含水量。
4 结论
本研究结果表明,MT处理的沙果果实激活了SA生物合成关键基因MdPAL和MdICS2的表达水平,诱导了果实中SA 的积累。同时,乙烯生物合成关键基因MdACS1和MdACO1均受到了不同程度的下调,与乙烯含量变化趋势一致,表明MT 通过调控MdACS1和MdACO1基因表达抑制乙烯积累,减缓乙烯信号对沙果果实的成熟作用,同时延缓硬度下降,失重率的上升以及抑制呼吸作用,有效减少营养物质消耗,维持了果实品质。综上,MT 能够通过上调沙果果实中MdPAL和MdICS2水平来积累SA,下调MdACS1和MdACO1表达以抑制乙烯生物合成,推迟贮藏期间果实的成熟衰老进程,维持果实品质。
