柴胡4种活性成分的体外抗氧化作用*
2023-09-05王淑惠刘泽干黄小凤雷攀王莉博江明珠蔡华杜士明
王淑惠,刘泽干,黄小凤,雷攀,王莉博,江明珠,蔡华,杜士明,
(1.湖北医药学院药学院,十堰 442000;2.湖北医药学院附属太和医院科研处,十堰 442000;3.湖北医药学院武当特色中药研究湖北省重点实验室,十堰 442000)
柴胡(Bupleurumchinese)是伞形科植物柴胡(Bupleurumchinese DC.)或狭叶柴胡(Bupleurumscorzonerifolium willd.)的干燥根,具有疏散退热、疏肝解郁、升举阳气等功效[1]。柴胡治疗肝病的历史悠久,张仲景《伤寒论》中记载小柴胡汤具有疏肝利胆、化浊解郁的功效[2];宋代《太平惠民和剂局方》中记载逍遥散,由柴胡、当归、炒白术等8味中药组成,用于肝郁气滞所致疾病[3]等,在以柴胡为君药的经典名方中,其主要发挥疏肝解郁的作用[4]。研究发现,柴胡的主要成分是柴胡多糖、柴胡黄酮、柴胡皂苷、柴胡挥发油等,具有抗氧化、抗炎、解热、抗病毒和抗肿瘤等药理作用,其主要成分可通过清除自由基、增强抗氧化酶活性等途径发挥抗氧化的作用[5-6]。谢志明等[7]研究柴胡多糖减轻氧化反应,发挥小鼠肝损伤的保护作用;张娜等[8]研究发现,柴胡皂苷d抑制人正常肝细胞焦亡和上皮间质转化减轻肝纤维化,但是柴胡4种活性成分抗氧化保肝作用及比较笔者尚未见报道。
慢性肝病持续进展可致肝炎、肝纤维化、肝硬化和肝癌[9]。氧化应激是影响慢性肝病发生发展的主要因素之一,体内氧化与抗氧化系统的动态失衡导致肝细胞功能和结构破坏,促进炎症反应,进一步加重氧化应激并诱导肝细胞持续性损伤[10]。因此,抗氧化应激为慢性肝病提供新的治疗策略。柴胡及其复方制剂在临床上被运用于预防和治疗肝脏疾病,谢维宁等[11]研究柴胡疏肝散改善非酒精性脂肪肝患者的肝功能;刘静等[12]研究小柴胡汤减轻非酒精性脂肪性肝炎模型小鼠的病理损伤,改善小鼠肝脏功能等,但柴胡的活性成分基于抗氧化发挥保护慢性肝病的作用需进一步明确,因此本研究通过提取柴胡4种活性成分,采用1,1-二苯基-2-三硝基苯肼[1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH]法和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2'-azinobis-(3-ethylbenzthiazoline-6-sulpho-nate),ABTS]法比较其化学抗氧化作用强弱,筛选出抗氧化活性较好的柴胡3种活性成分,对过氧化氢(H2O2)诱导人正常肝细胞(LO2)的损伤模型进行干预,测定细胞存活率、抗氧化酶活性及丙二醛等指标,评价并比较柴胡3种活性成分的抗氧化作用,为柴胡在临床上治疗慢性肝病提供理论依据。
1 仪器与材料
1.1仪器 TU-1901型紫外分光光度仪(北京普析通用仪器有限责任公司);TS100型生物倒置显微镜(日本Olympus公司);HERACE11型二氧化碳(CO2)恒温培养箱(美国Thermo Fisher公司);RE-3000A型旋转蒸发仪(上海亚荣生化仪器厂);SB-079型多功能酶标仪(美国Thermo Scientific公司);SF-TDL-5A型台式离心机(上海菲恰尔分析仪器有限公司)。
1.2药物及试剂 柴胡饮片购于湖北神农本草中药饮片有限公司(批号:20220301),由湖北医药学院杜士明教授鉴定为伞形科柴胡属植物北柴胡(BupleurumchineseDC.)的干燥根,按2020年版《中华人民共和国药典》中柴胡项下检查,符合各项要求;DPPH、ABTS和乙醇等试剂购自阿拉丁试剂上海有限公司;达尔伯克改良伊格尔培养基和胎牛血清购自Gibco公司;水为纯化水。
1.3细胞系 LO2由湖北医药学院附属太和医院生物医学研究所馈赠,培养条件:37 ℃、5%CO2;培养液:含10%胎牛血清的达尔伯克改良伊格尔培养基,实验选用对数生长期细胞。
2 方法与结果
2.1柴胡4种活性成分的提取及含量测定
2.1.1柴胡多糖的提取及含量测定 采用水提醇沉法[13]提取柴胡多糖,称取柴胡饮片100 g,加入纯化水750 mL,回流提取3 h,滤过,减压浓缩,离心(4 000 r·min-1,r=32 mm,15 min,下同),取上清液,加入95%乙醇使提取液中乙醇浓度达60%,冷藏静置过夜后,离心收集沉淀物,20 mL水复溶,加入等体积Sevage试剂[三氯甲烷-正丁醇(4:1)],剧烈振摇后离心,除去蛋白层,得柴胡多糖溶液,4 ℃保存备用。
以无水葡萄糖作为对照,采用苯酚硫酸法[14]测定柴胡多糖含量,精密吸取柴胡多糖溶液1.0 mL,置于冰水浴中,依次加入5%苯酚和95%浓硫酸各5.0 mL,摇匀后冷却,室温放置20 min,采用紫外-可见分光光度法于487 nm波长测定其吸光度(A值)。通过计算得标准曲线回归方程:Y=0.007 5X+0.049 9,R2=0.999 2,测算得柴胡多糖的含量5.78 mg·mL-1。
2.1.2柴胡黄酮的提取及含量测定 采用碱溶酸沉法[15]提取柴胡黄酮,取柴胡饮片50 g,加入85%乙醇500 mL,回流提取2 h,减压浓缩成浸膏状,加入5%碳酸钠(Na2CO3)溶液溶解粗提取物20 mL,再缓慢加入浓盐酸(HCl),pH值为2时抽滤,收集沉淀,反复2次碱溶酸沉过程,低温干燥法得柴胡黄酮,4 ℃保存备用。
以芦丁作为对照,称取柴胡黄酮提取物86.8 mg,加入60%乙醇50 mL溶解,精密吸取10.0 mL,依次加入5%亚硝酸钠(NaNO2)1.0 mL、硝酸铝[Al(NO3)3]1.0 mL和氢氧化钠(NaOH)溶液(1 mol·L-1) 10.0 mL,摇匀后放置15 min,采用紫外-可见分光光度法于波长506 nm处测定A值[16],通过计算得标准曲线回归方程Y=0.992 9X+0.036 7,R2=0.999 8,测算得柴胡黄酮的含量1.071 mg·mL-1。
2.1.3柴胡皂苷的提取及含量测定 采用热回流法[17]提取柴胡皂苷,取柴胡饮片100 g,加入70%乙醇2 000 mL,加热回流提取150 min,趁热滤过并浓缩,得乙醇浸膏,正丁醇萃取3次,合并萃取液减压浓缩,乙醇溶解得柴胡皂苷溶液。以柴胡皂苷A为对照,采用紫外-可见分光光度法[17]测定柴胡皂苷含量,依次加入5%香草醛-冰醋酸溶液0.2 mL和高氯酸0.8 mL,60 ℃恒温水浴15 min,冷却至室温,再加入冰醋酸,于波长610 nm处测A值。通过计算得标准回归方程Y=0.437 3X+0.091 2,R2=0.991 2,测算得柴胡皂苷的含量0.484 g·mL-1。
2.1.4柴胡挥发油的提取及含量测定 采用水蒸气蒸馏法提取柴胡挥发油[18],取柴胡饮片100 g,加入10%NaCl溶液1 200 mL,水蒸气蒸馏,收集初馏液进行重蒸馏得到柴胡挥发油精提液50 mL。以柴胡注射液为对照,通过紫外-可见分光光度法[18]测定柴胡挥发油浓度,甲醇溶解挥发油精提液,于波长276 nm处测定A值,分别测得柴胡挥发油精提液和柴胡注射液的吸光度为A1和A2,计算得柴胡挥发油含量1.893 g·mL-1(生药含量)。
2.2柴胡4种活性成分化学抗氧化活性的测定
2.2.1DPPH法测定自由基清除能力 DPPH测定液的配置:分别量取等倍稀释浓度的柴胡多糖、黄酮、皂苷和挥发油溶液各2 mL,分别加入DPPH乙醇溶液(0.1 mmol·L-1) 2 mL,摇匀后室温避光30 min,即得DPPH测定液[19]。
DPPH清除能力的测定:采用紫外-可见分光光度法于517 nm波长测定样品溶液吸光度(Ai)、空白组吸光度(A0)和无水乙醇对照组吸光度(Aj)。依据“公式1”计算得标准曲线回归方程,采用SPSS 25.0版软件计算得半数抑制浓度(half maximal inhibitory concentration,IC50),结果见表1和图1。

图1 4种活性成分的浓度与DPPH自由基清除能力的关系
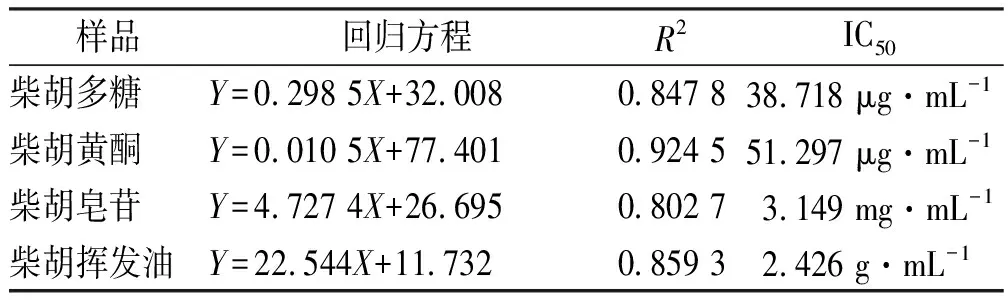
表1 柴胡4种活性成分的DPPH自由基清除能力
DPPH自由基清除率(%)=[A0-(Ai-Aj)]/A0×100%
(公式1)
柴胡4种活性成分对DPPH自由基清除能力随一定浓度升高而增强,IC50值分别为38.718 μg·mL-1(柴胡多糖)、51.297 μg·mL-1(柴胡黄酮)、3.149 mg·mL-1(柴胡皂苷)和2.426 g·mL-1(柴胡挥发油),而柴胡挥发油的最大提取浓度1.893 8 g·mL-1,无法达到其IC50值,表明柴胡挥发油对DPPH清除能力不足。由此得出,柴胡4种成分DPPH自由基清除能力与柴胡多糖、黄酮和皂苷密切相关。
2.2.2ABTS法测定自由基清除能力 ABTS测定液配置:取等体积ABTS溶液和过硫酸钾溶液,混匀得ABTS工作液。分别量取等倍稀释浓度的柴胡多糖、黄酮、皂苷和挥发油溶液各1.0 mL,依次加入ABTS工作液2.0 mL,混匀后室温避光30 min,即得 ABTS测定液[20]。
ABTS清除能力的测定:采用紫外可见光分光度法于波长734 nm处测定样品溶液吸光度(Ai),空白组吸光度(A0)。依据“公式2”计算得标准曲线回归方程,采用SPSS 25.0版统计软件计算得IC50,结果见表2和图2。
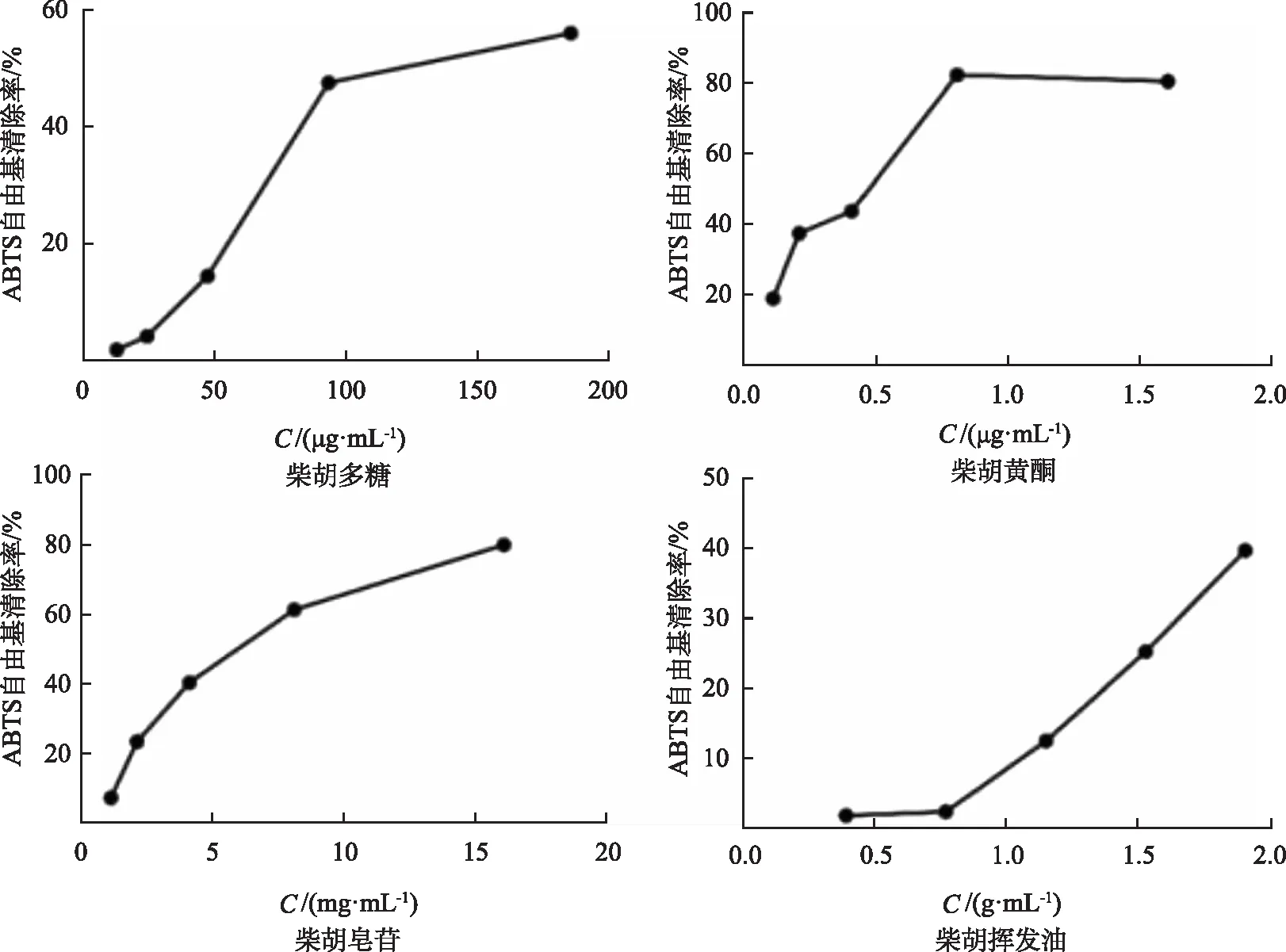
图2 4种活性成分的浓度与ABTS自由基清除能力的关系
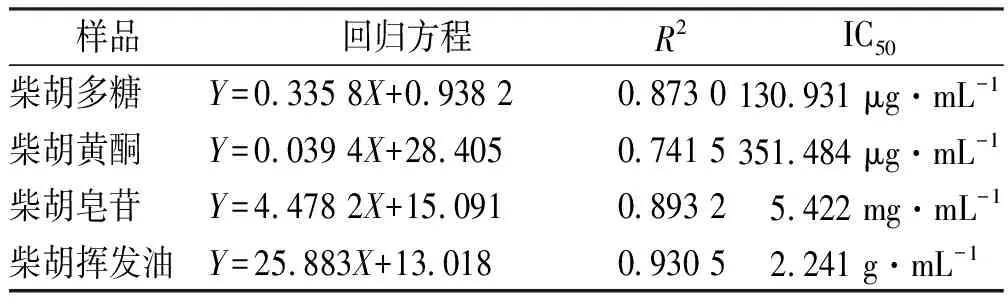
表2 柴胡4种活性成分的ABTS自由基清除能力
ABTS自由基清除率(%)=(A0-Ai)/A0×100%
(公式2)
柴胡4种活性成分对ABTS自由基清除能力随一定浓度范围升高而增强,IC50值分别为130.931 μg·mL-1(柴胡多糖)、351.484 μg·mL-1(柴胡黄酮)、5.422 mg·mL-1(柴胡皂苷)和2.241 g·mL-1(柴胡挥发油),而柴胡挥发油的最大提取浓度1.893 8 g·mL-1时,对ABTS自由基清除率仅为39.80%,无法达到其IC50值,表明柴胡挥发油对ABTS清除能力不足。由此得出,柴胡发挥ABTS自由基清除能力与柴胡多糖、黄酮和皂苷密切相关。
2.3柴胡3种活性成分体外抗氧化活性的测定
2.3.1H2O2诱导LO2氧化损伤模型的建立 采用噻唑蓝法检测不同浓度H2O2诱导LO2细胞的存活率。培养LO2细胞,制备成单细胞悬液,按每孔100 μL(含细胞5×103个) 接种于96孔板中,设模型组(0 μmol·L-1H2O2)、对照组(100、200、300、400、500、600、700、800、900 μmol·L-1H2O2)和空白组(只加入培养液),每组设置5个复孔,于37 ℃、5% CO2下培养24 h,弃去培养液,每孔加入含有10%噻唑蓝(0.5 mg·mL-1)的培养液100 μL,培养箱中孵育4 h后,加入二甲亚砜150 μL,摇床溶解15 min,于酶标仪λ=570 nm处测定A值,根据“公式3”计算细胞存活率,结果见图3。

①与0 μmol·L-1 H2O2组比较,t=3.063~20.19,P<0.05。
细胞存活率(%)=(模型组A值-空白组A值)/(对照组A值-空白组A值)×100%
(公式3)
细胞存活率随H2O2浓度增加而降低,当H2O2浓度为800 μmol·L-1时,细胞存活率降低至50%。因此实验选取800 μmol·L-1H2O2作用24 h作为后续诱导LO2细胞氧化损伤模型的条件[21]。
2.3.2柴胡多糖、黄酮、皂苷的细胞毒性实验 采用噻唑蓝法测定柴胡多糖、黄酮、皂苷对LO2的细胞毒性,培养LO2细胞,制备成单细胞悬液,按每孔100 μL(含细胞5×103个) 接种于96孔板中,设正常对照组(不做任何处理),给药组(给予不同浓度的柴胡多糖、黄酮、皂苷,二甲亚砜为溶媒)和空白对照组(只加入培养液),每组设置5个复孔,细胞存活率检测依据“2.3.1节”,结果见图4。
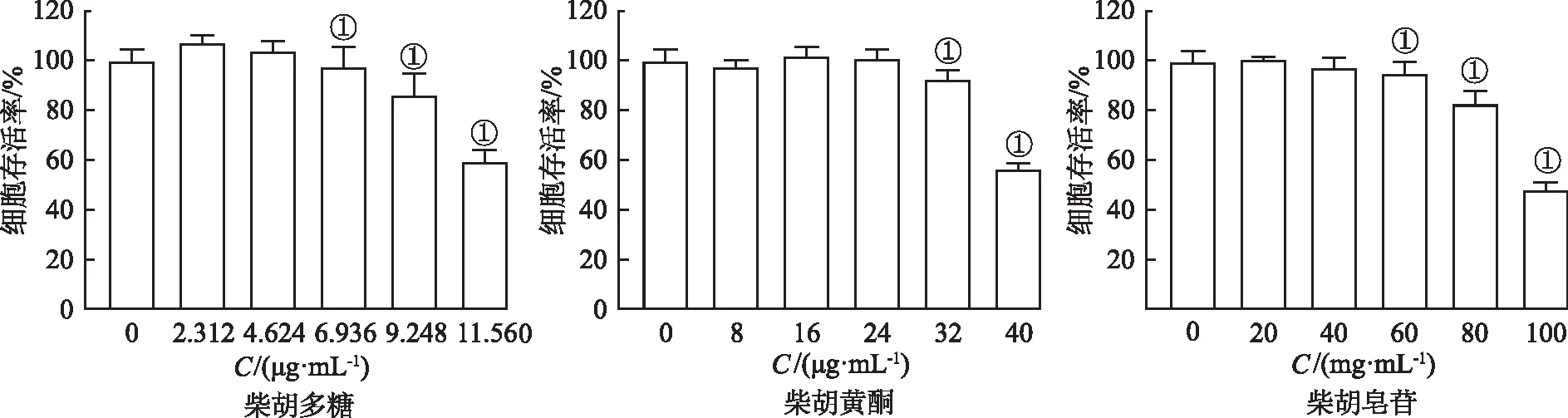
①与正常对照组比较,t=2.942~21.74,P<0.05。
LO2细胞存活率随药物浓度增加而降低,与正常对照组比较,当给予柴胡多糖(6.936 μg·mL-1)、柴胡黄酮(32 μg·mL-1)、柴胡皂苷(60 μg·mL-1)时,细胞存活率下降至90% (P<0.05)。因此实验分别选取柴胡多糖的低中高浓度(2.312、4.624、6.936 μg·mL-1)、柴胡黄酮的低中高浓度(16、24、32 μg·mL-1)和柴胡皂苷的低中高浓度(20、40、60 μg·mL-1)作为LO2 细胞氧化损伤的作用浓度。
2.3.3柴胡多糖、黄酮、皂苷对H2O2诱导LO2氧化损伤模型存活率 采用噻唑蓝法测定不同浓度柴胡多糖、黄酮和皂苷对细胞存活率的影响,设置正常对照组(不做任何处理),模型对照组(采用800 μmol·L-1H2O2诱导24 h),实验组(分别同时用低、中、高浓度的柴胡多糖、黄酮、皂苷预处理LO2细胞6 h后,800 μmol·L-1H2O2诱导24 h),检测方法与“2.3.1节”相同,结果见图5。

①与正常对照组比较,t=30.16,P<0.01;②与模型对照组比较,t=3.630~10.90,P<0.05。
与正常对照组比较,模型对照组LO2细胞存活率显著下降至51.65% (P<0.01);与模型对照组比较,柴胡多糖、黄酮和皂苷呈剂量依赖提高LO2细胞存活率,柴胡多糖(6.936 μg·mL-1)、柴胡黄酮(32 μg·mL-1)和柴胡皂苷(60 μg·mL-1)分别显著提高LO2细胞存活率至63.92%、60.85%和67.47% (P<0.05)。因此实验分别选取柴胡多糖(6.936 μg·mL-1)、柴胡黄酮(32 μg·mL-1)和柴胡皂苷(60 μg·mL-1)作为LO2 细胞氧化损伤的作用浓度。
2.3.4谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)活性及丙二醛(malondialdehyde,MDA)含量测定 试剂盒检测柴胡3种活性成分对模型细胞中GSH-Px、SOD活性及MDA含量的影响。将LO2细胞接种于6孔培养板中,设正常对照组(不做任何处理)、模型对照组(800 μmol·L-1H2O2诱导24 h)、实验组(柴胡多糖、黄酮、皂苷预处理细胞6 h后,800 μmol·L-1H2O2诱导24 h);弃去上清液,加入细胞裂解液,冰上裂解30 min后,4 ℃下离心(12 000 r·min-1,r=32 mm,15 min),弃去沉淀,试剂盒检测GSH-Px酶活性、SOD酶活性和MDA含量,结果见图6。
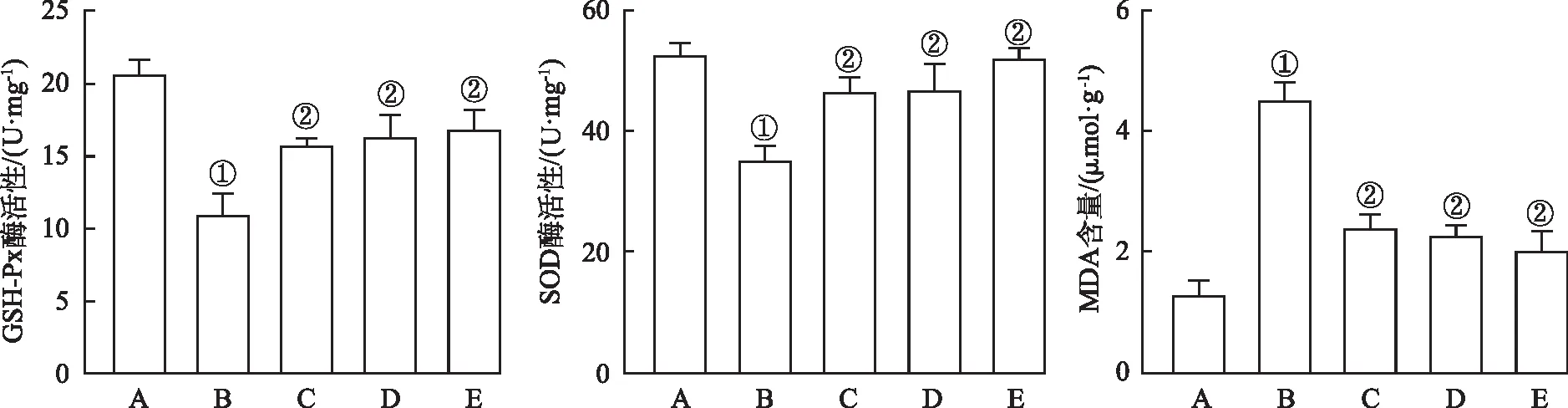
A.正常对照组;B.模型对照组;C.柴胡多糖组;D.柴胡黄酮组;E.柴胡皂苷组。 ①与正常对照组比较,t=9.886~16.71,P<0.05;②与模型对照组比较,t=4.81~13.65,P<0.05。
与正常对照组比较,模型对照组GSH-Px、SOD酶活性下降至11.17,35.18 U·mg-1(P<0.05),MDA含量提高至4.51 μmol·g-1(P<0.05);给予柴胡多糖(6.936 μg·mL-1)、柴胡黄酮(32 μg·mL-1)和柴胡皂苷(60 μg·mL-1)后,细胞内GSH-Px酶活性显著增加至15.81,17.10和17.06 U·mg-1(P<0.05),SOD酶活性显著增加至46.79,47.11和52.05 U·mg-1(P<0.05),MDA含量显著降低至2.34,2.28和2.11 μmol·g-1(P<0.05)。结果表明柴胡多糖、黄酮、皂苷能显著提高H2O2诱导LO2细胞氧化损伤的GSH-Px和SOD酶活性,降低MDA含量,其中柴胡皂苷作用最显著。
3 讨论
氧化应激是指机体或细胞暴露于氧化因子引起的损伤,同时机体自由基异常升高导致氧自由基累积,诱导细胞衰老、凋亡或坏死[22]。DPPH和ABTS法是体外评价自由基清除能力的常用方法[23],本实验通过该方法测定并比较柴胡4种活性成分清除自由基作用的强弱,结果表明柴胡多糖、黄酮和皂苷具有较好的自由基清除能力。GSH-Px酶、SOD酶和MDA是反映机体氧化和抗氧化水平的重要指标,当肝细胞受到H2O2诱导时,氧化与抗氧化水平失衡,引起GSH-Px酶和SOD酶表达水平下降,MDA表达水平升高[22]。本实验构建了H2O2诱导LO2模型,分别给予柴胡多糖、黄酮和皂苷干预,并测定GSH-Px酶、SOD酶和MDA的水平,结果显示柴胡皂苷的抗氧化作用最显著,为柴胡基于抗氧化治疗慢性肝病提供理论依据。
3.1实验结果与柴胡常用制剂的作用和用途相互印证 小柴胡汤、护肝片等均是以柴胡为君药制成的制剂,主要成分为柴胡多糖、黄酮和皂苷等,具有抗氧化、提高免疫力等药理作用,在临床上主要用于治疗慢性肝炎、肝硬化等肝脏疾病[24];柴胡注射液是柴胡经水蒸气蒸馏法制成的溶液,主要成分为挥发油,具有解热、镇痛等药理作用,在临床上用于治疗感冒及疟疾等疾病引起的发热[25]。本实验结果提示柴胡4种活性成分中,柴胡多糖、黄酮和皂苷强于柴胡挥发油,因此本实验印证了柴胡不同制剂发挥不同药理作用与其活性成分密切相关。
3.2对柴胡产品开发的启示 柴胡具有植物抗生素的[26]称谓,挥发油是发挥解热镇痛作用的物质基础,而柴胡注射液在临床应用中风险高,成分复杂易引起不良反应,12岁以下儿童禁用,但这类人群又是呼吸道感染的好发群体。王莉博等[27]将挥发油制成栓剂,为治疗12岁以下儿童治疗呼吸道感染提供了安全、可靠的治疗方案。临床上常将柴胡煎煮成汤剂,此过程中挥发油部分挥发较多,若将柴胡提取成解热和抗氧化两大物质群,分为挥发油和多糖、黄酮和皂苷等,以颗粒剂的方式供应市场,将有利于合理运用中药柴胡资源。
3.3对柴胡种植业的启发 不同产地、采收时间柴胡的活性成分不尽相同[28],鄂西北地区柴胡多糖、黄酮和皂苷的含量与柴胡不同采收期密切相关,分别在种子成熟11、10、7月份采收最佳[29];产地甘肃、山西的柴胡皂苷的含量较高[30]。因此,可以根据使用柴胡的不同活性成分选取不同产地及适宜采收时间,获取柴胡最大利用价值。
本实验仅对柴胡单一活性成分抗氧化保肝作用进行探讨,后期研究主要以柴胡皂苷为主,分析其关键活性成分和结构,在体内外探究其抗氧化改善慢性肝病的作用及分子机制,进一步探究柴胡3种成分在体内外协同抗氧化保肝作用及机制,为综合开发和应用柴胡中药资源奠定理论基础。
