乙酰紫草素体外抗2型单纯疱疹病毒机理的研究
2023-09-05廉梅芳时黎明郑文学李娟李桂霞于广福
廉梅芳,时黎明,郑文学,李娟,李桂霞,于广福
1.山东第一医科大学,山东省医学科学院,山东省高等学校新发传染病重点实验室,山东 泰安 271000 2.菏泽市立医院
疱疹病毒属DNA病毒,为有包膜病毒,包括1型单纯疱疹病毒(herpes simplex virus type 1,HSV-1)、2 型单纯疱疹病毒(herpes simplex virus type 2,HSV-2)和水痘-带状疱疹病毒(varicella-zoster virus, VZV)等[1]。单纯疱疹病毒(herpes simplex virus,HSV)基因组大小约为152 kbp,表面编码17 种包膜蛋白,包括12 种糖基化的包膜蛋白,其中型特异性糖蛋白gG可以区分HSV-1和HSV-2[2]。HSV-2属疱疹病毒科α 疱疹病毒亚科,是引起生殖器疱疹的主要病原体之一[3-4];该病毒还可感染白细胞和神经元细胞[5-7],导致脑炎和传播性疾病,影响其他器官系统[8-9]。全世界有超过5 亿人感染HSV-2,并且以每年2 300 万人的速度增加[10]。目前还没有可以有效预防HSV-2 感染的疫苗[11],阿昔洛韦(acyclovir, ACV)作为抗HSV-2 药物,安全有效、耐受性好[12],然而ACV 耐药性问题的出现严重影响其对HSV-2 的临床抑制效果[13],因此亟须开发其他有效的抗HSV-2药物对其进行预防和治疗。
紫草始载于《神农本草经》,从紫草中分离的乙酰紫草素(acetylshikonin, AS)纯度达到98.4%[14]。AS 可通过直接杀灭病毒、抑制病毒复制、免疫调节等机制发挥抗病毒作用[15]。同时,研究表明AS 对副流感病毒[16]、人类免疫缺陷病毒[17]、柯萨奇病毒[18]等均有抑制作用。多项研究结果证明,AS 在临床上具有独特的研究价值和广阔的应用前景,本研究拟明确AS 体外抗HSV-2 的作用,为抗HSV-2 感染提供新的治疗思路。
1 材料与方法
1.1 材料
1.1.1 细胞和病毒 成年非洲绿猴肾细胞(Vero)、HSV-2 由本实验室保存;实验中HSV-2 于维持液(97%DMEM+2%FBS+1%青霉素-链霉素溶液)中培养,滴度为10-5.5TCID50/100 μL。
1.1.2 药物 AS(货号:SA8980)购于北京索莱宝科技有限公司,ACV(国药准字:H10900095)购于湖北科益药业股份有限公司。
1.1.3 其他主要试剂和仪器 CCK-8 试剂购于北京索莱宝科技有限公司;Evo M-MLV 反转录试剂预混液、SYBR Green Pro Taq HS 预混型qPCR 试剂盒购于AG 艾科瑞生物。仪器设备主要为7500 Fast 荧光定量PCR 仪(美国Thermo Fisher Scientific公司),酶标仪(美国BioTek 公司),371 型CO2恒温培养箱(赛默飞世尔科技中国有限公司),1388 A2生物安全柜(赛默飞世尔科技中国有限公司),高压灭菌机(重庆雅马拓科技有限公司),高速冷冻离心机(赛默飞世尔科技中国有限公司),倒置显微镜(尼康株式会社)。
1.2 方法
1.2.1 AS 对Vero 细胞的毒性测定 用维持液将AS 和ACV 按2 倍梯度稀释为2-1、2-2……2-9,并以连续稀释的AS 或ACV 溶液接种在长满单层Vero 细胞的96 孔板中作为实验组,不加药物作为细胞对照组,空白对照组无细胞、无药物。细胞培养板在37 ℃5% CO2培养箱中培养2 d。每孔加入10 μL CCK-8 试剂,1 h 后用酶标仪在450 nm 波长测定吸光度(A),Graphpad Prism 5.0 软件计算最大无毒浓度(maximal atoxic concentration, TC0),检测AS 对Vero细胞的毒性作用。
1.2.2 AS 抗HSV-2 活性作用测定 以2 倍梯度稀释的AS 和ACV 分别与HSV-2 等体积混合,HSV-2病毒感染复数(multiplicity of infection, MOI)为0.1。在37 ℃5%CO2培养箱中培养2 h 后,接种于Vero细胞,细胞培养板继续培养2 d。每孔加入10 μL CCK-8 试剂,1 h 后于450 nm 波长测其吸光度(A),GraphPad Prism 5.0 软件计算半数有效浓度(50%effective concentration,EC50)。
1.2.3 AS 对HSV-2 病毒复制的影响 根据HSV-2复制周期的不同[10,18],分别在病毒感染前期、病毒生物合成期、病毒吸附期、病毒进入期以及病毒释放期加入AS 药物,HSV-2 病毒MOI 为0.1,AS 药物浓度为3.785 μmol/L,通过显微镜观察病毒感染24 h后Vero 细胞的形态变化。病毒感染前期,Vero 细胞中加入AS 培养5 h,随后接种HSV-2 培养1 h,弃培养上清并用PBS 清洗,用维持液培养12、24、36 h后收集细胞。病毒生物合成阶段,Vero细胞中接种HSV-2 培养1 h,随后加入AS 培养6 h,弃培养上清并用PBS 清洗,用维持液培养12、24、36 h 后收集细胞。病毒吸附阶段,Vero细胞中接种HSV-2,4 ℃培养1 h 后收集细胞。病毒进入阶段,Vero 细胞中接种HSV-2,4 ℃培养1 h、37 ℃培养2 h 后收集细胞。病毒释放阶段,Vero细胞中接种HSV-2培养1 h,弃培养上清并用PBS 清洗,用维持液培养6 h,加入AS 培养12、24、
36 h 后收集培养上清。同时设置维持液对照组和AS 直接灭活病毒组,AS 直接灭活病毒组是将AS 与HSV-2 混合后培养1 h,接种于Vero细胞12、24、36 h 后收集细胞,培养TRIzol 法提取细胞总RNA 测定病毒载量;培养上清进行半数组织培养感染剂量(50% tissue culture infective dose,TCID50)测定。
将提取的细胞总RNA反转录为cDNA,然后通过实时荧光定量PCR 扩增cDNA 来检测HSV-2gG2 基因(型特异性抗原,常用于HSV 诊断分型)和β-actin内参基因(常作为组织细胞基因表达内参)的Ct 值,其中HSV-2gG2 基因引物序列参照文献[19];β-actin内参基因引物序列参照文献[20]。采用2-△△Ct计算HSV-2 病毒mRNA 相对表达量,评估AS在HSV-2复制周期不同阶段的抗病毒效果。
1.2.4 AS 对HSV-2 噬斑形成抑制实验 以AS 和ACV 最大无毒浓度稀释液分别与HSV-2(MOI=0.100、0.010、0.001)等体积混合,在37 ℃5% CO2培养箱中作用2 h;取病毒混合液接种Vero 细胞并孵育1 h,弃去上清,PBS 清洗,滴加1.2%甲基纤维素覆盖细胞单层,继续培养至72 h;用1%结晶紫溶液染色,计算斑块,评估AS抗病毒作用。
1.2.5 AS 对HSV-2 病毒粒子超微结构的影响 用HSV-2(MOI=0.1)接种Vero 细胞,当病变程度达到90%,将细胞反复冻融,离心去除细胞沉淀,0.45µm滤膜过滤上清除菌;82 700×g,4 ℃离心2 h,弃上清,沉淀于PBS 溶解过夜;将病毒样液用2.5%戊二醛固定送样。TC0和EC50的AS分别与HSV-2(MOI=0.1)等体积混合,在37 ℃5%CO2培养箱中作用1 h,取病毒混合液制片,将切片放入TEM 透射电镜中观察并拍照。
1.3 统计分析 采用GraphPad Prism 5.0软件对数据进行分析,计量资料以均数± 标准差(-x±s)表示,采用重复设计的方差分析对数据进行分析,对不同时间点两组之间比较采用独立样本t检验,对多组之间比较采用单因素方差分析(组间多重比较采用LSD法),检验水准α=0.05。
2 结 果
2.1 AS 对Vero 细胞的毒性及抗HSV-2 活性测定AS的TC0为3.785µmol/L,阳性对照药物ACV的TC0为1 110.100µmol/L,此时细胞存活率>90%。AS 在1.678~3.785µmol/L抑制HSV-2的复制,AS的EC50为0.334µmol/L,ACV的EC50为0.678µmol/L(图1)。
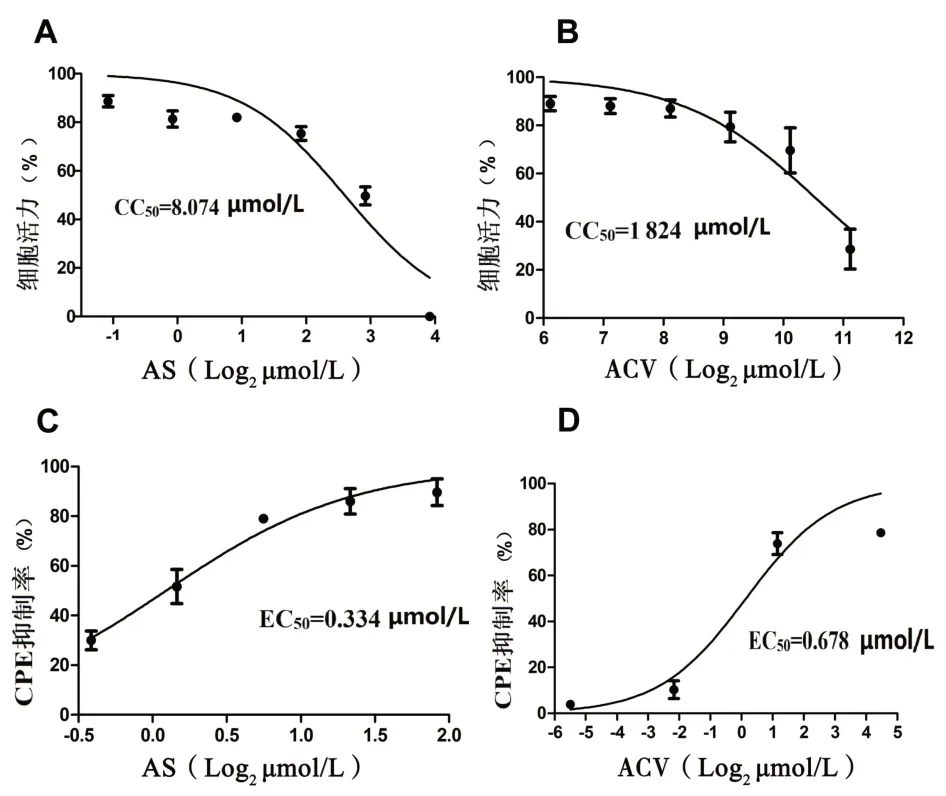
图1 AS和ACV在Vero细胞中的毒性及抗病毒活性测定Figure 1 Determination of toxicity and antiviral activity of AS and ACV in Vero cells
2.2 AS对HSV-2病毒复制的影响 实验组病毒感染前期(图2A)、生物合成期(图2C)添加病毒和药物后,细胞均变圆、收缩和分离,表明存在细胞毒性。在病毒感染前期12、24和36 h,实验组与病毒感染对照组病毒载量差异均无统计学意义(6.04±1.24vs.6.09±1.46,5.98±1.27vs.6.17±1.44,5.91±1.23vs.6.17±1.41;t=0.164、9.648、1.016,P均>0.05)(图3A)。在生物合成期12、24 和36 h,实验组与病毒感染对照组病毒载量差异均无统计学意义(6.78±1.05vs.6.78±1.10,6.68±1.03vs.6.78±1.07,6.69±1.09vs.6.78±1.12;t=1.942、1.516、5.752,P均>0.05)(图3B)。相比其病毒感染对照组(图2L),AS 直接灭活病毒组(图2K)镜检观察活细胞数相对较高,细胞单层在形态学上与细胞对照组更具可比性。在12、24、36 h,AS直接灭活病毒组的病毒载量低于病毒感染对照组(0.24±0.09vs.1.35±0.07;4.46±0.06vs.6.75±0.04;2.70±0.04vs.5.27±0.10),差异均有统计学意义(t=9.920、33.360、24.020,P均<0.05)(图3C)。在病毒吸附进入阶段,病毒载量与其相应的病毒感染对照组相比,差异无统计学意义(P>0.05)(图3D)。在病毒释放阶段,药物AS加入12 和36 h 后,实验组的病毒TCID50低于病毒感染对照组(13.43±10.04vs.127.00±0.32;3.47±0.55vs.5.80±0.12),差异均有统计学意义(t=8.359、4.161,P均<0.05)(图3E)。
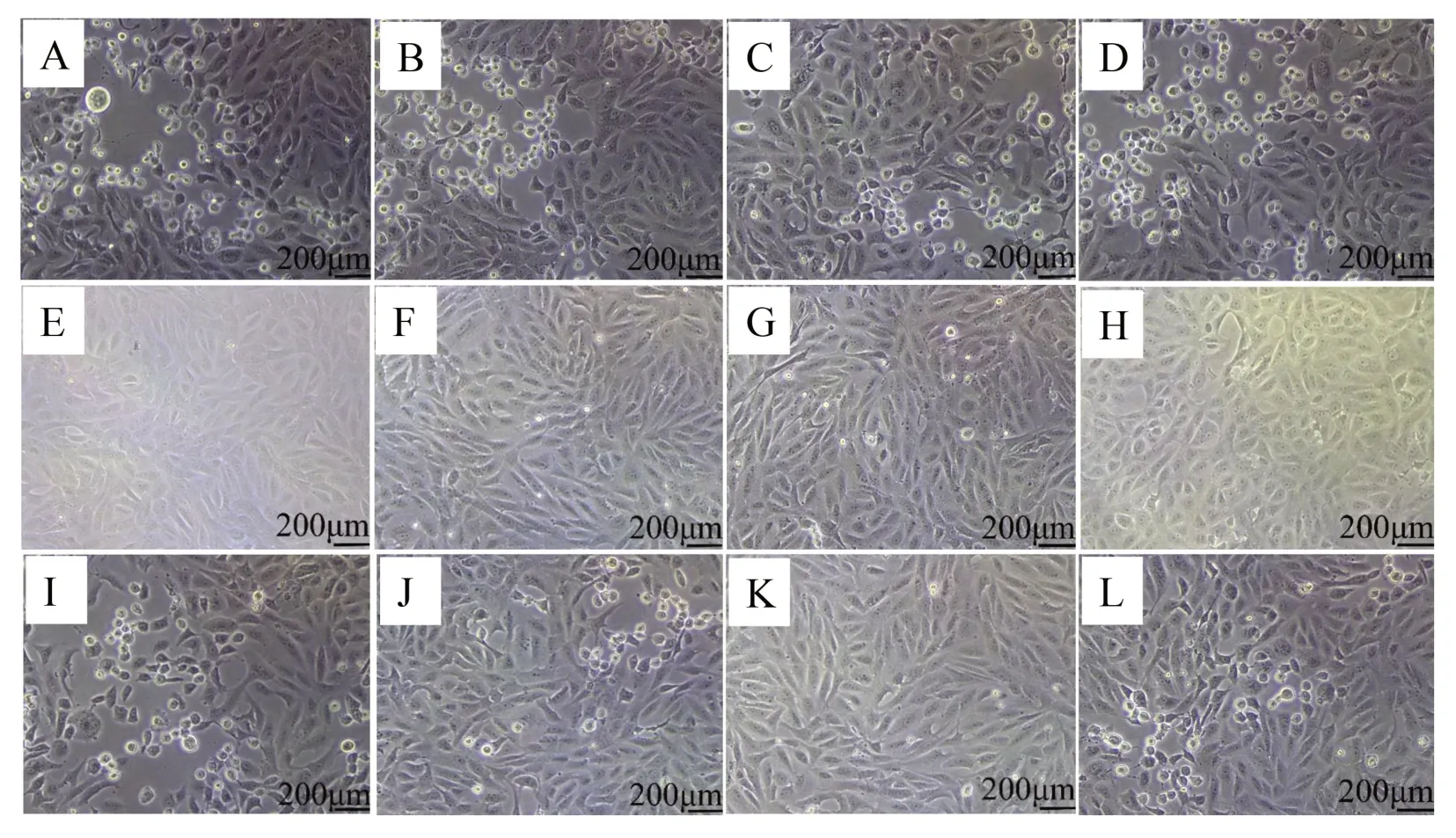
图2 AS抗病毒活性的测定(×100)Figure 2 Determination of the antiviral activity of AS against HSV-2(×100)
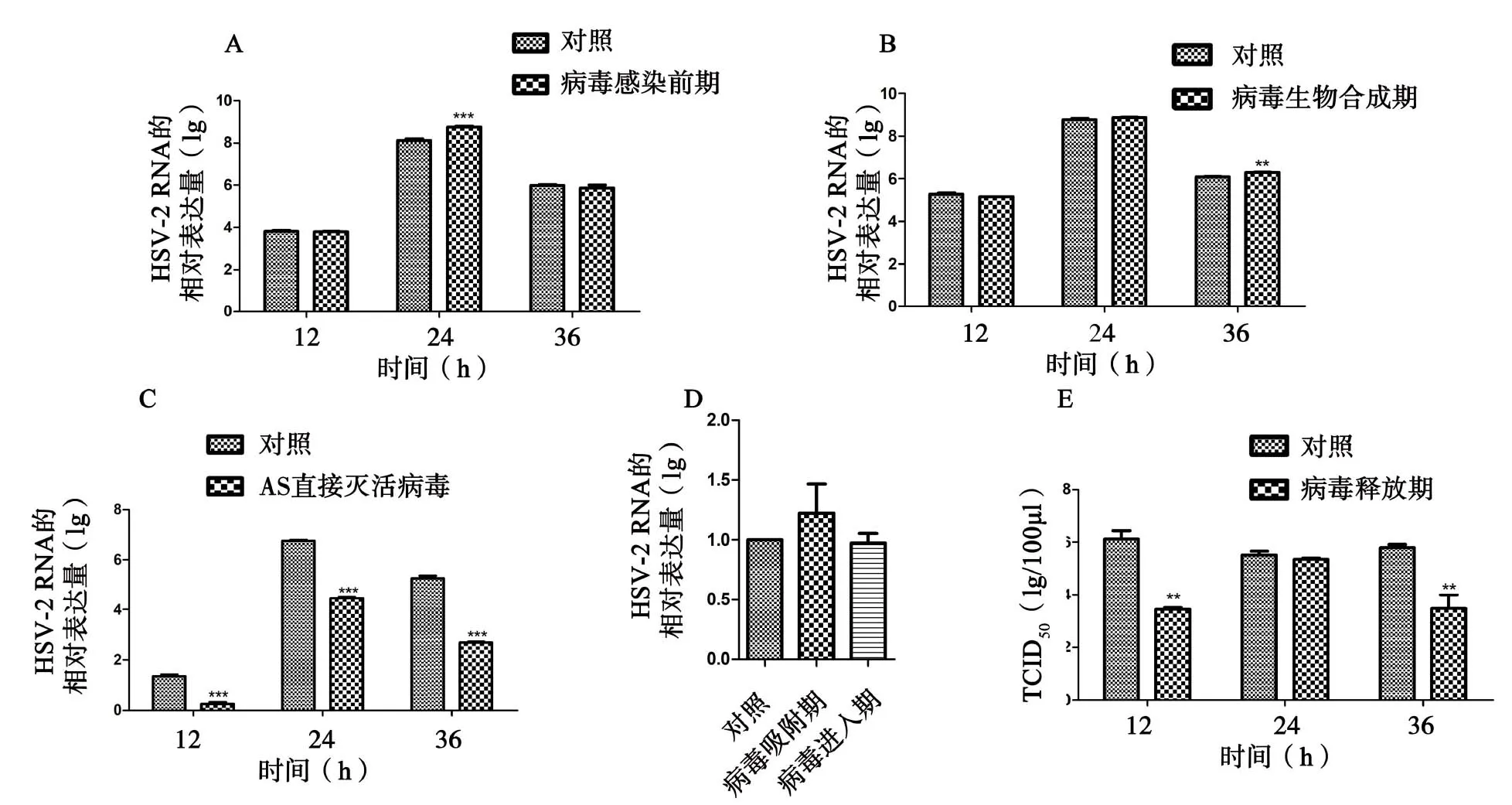
图3 通过实时荧光定量PCR和TCID50测定的AS抗病毒活性Figure 3 Measurement of the antiviral activity of AS against HSV-2 by RT-qPCR
2.3 AS 抑制HSV-2 噬斑形成 噬斑形成抑制实验中,HSV-2(MOI=0.100、0.010、0.001)感染Vero 细胞72 h后,1%结晶紫溶液染色后细胞中的空斑数量显著减少。不同剂量HSV-2与AS和ACV的混合液分别接种Vero细胞后空斑数量明显减少。见图4。
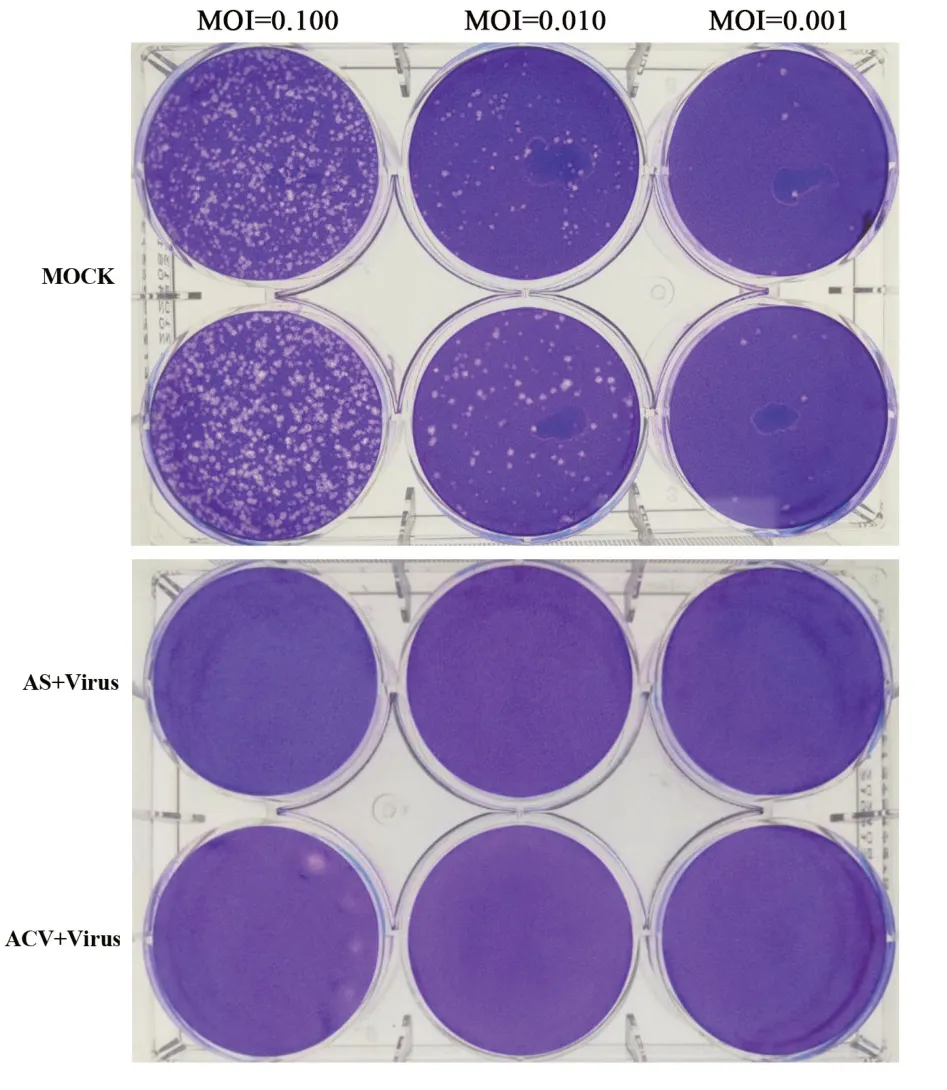
图4 AS对噬斑形成的抑制作用Figure 4 The inhibitory effect of AS against plaque formation
2.4 AS 影响HSV-2 病毒粒子超微结构 镜检结果显示,正常HSV-2 呈球形(图5A、图5F),最外层为典型的脂质双层囊膜,上有刺突。有包膜的病毒直径为150~200 nm。当用低浓度(1.678 µmol/L)AS 处理病毒时,原本呈球形的病毒粒子表面形状发生改变(图5B、图5C),缺损处明显可见(图5G、图5H);当AS浓度增加时,即用高浓度(3.785µmol/L)处理病毒,病毒粒径变小,约为70~80 nm,远小于正常HSV-2病毒粒径(图5D、图5E、图5I、图5J)。
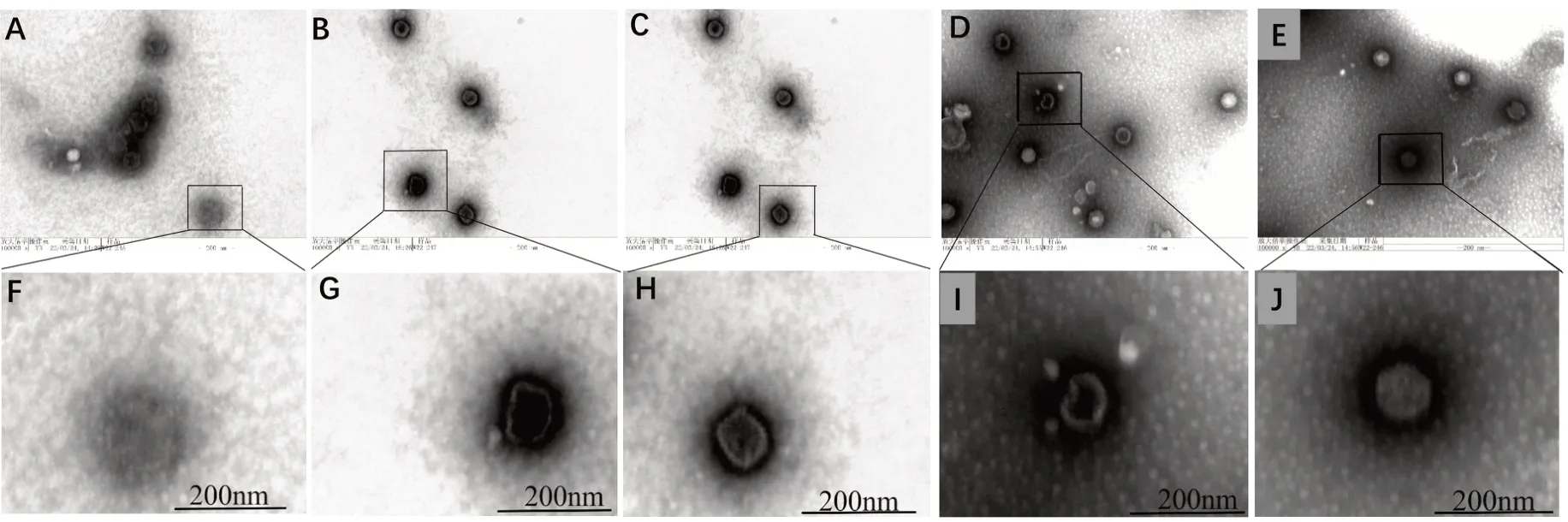
图5 透射电镜下AS对HSV-2病毒的影响(×100 000)Figure 5 Effect of acetylshikonin on HSV-2 virions under electron microscope(×100 000)
3 讨 论
近几年来,中草药在疾病预防及治疗中的作用越来越被重视,特别是在抗击新型冠状病毒感染疫情期间,人参及其复方制剂等中草药发挥了重要作用[21],中草药抗病毒效果及其机制研究的重要性日益凸显。既往研究表明,AS 可以阻断宿主细胞表面人体免疫缺陷病毒1 型进入辅助受体的表达,从而抑制病毒感染,主要作用于病毒吸附过程发挥抗病毒作用[17];AS 还可直接灭活柯萨奇病毒A16 型,并且可以阻断病毒在体外的吸附/穿入过程,进而有效地抗柯萨奇病毒A16 型感染[18]。紫草素酯衍生物能够抗H1N1流感的侵袭[22];此外,还能抑制横纹肌肉瘤细胞中促炎细胞因子(IL-1b、IL-6、IL-8 和TNF-a)的表达,表现出对肠道病毒的抗病毒活性[23]。多项研究证实,紫草素及其衍生物具有广谱的抗病毒活性,可以通过多种抗病毒途径或机制实现,本研究同样表明,AS 对HSV-2 具有一定的抗病毒效应。
HSV-2 是人类疱疹病毒家族中α 亚族的一种嗜神经性双链DNA 病毒,由包膜、被盖、衣壳和双链DNA 分子组成[24]。病毒通过吸附、穿入、脱壳、生物合成、组装与释放这五个主要阶段完成病毒在宿主体内的复制。本研究用HSV-2 感染Vero 细胞,用安全浓度范围内的AS 处理被感染的细胞,结果表明,AS 能有效抑制HSV-2 对Vero 细胞的感染。此外,病毒感染细胞主要表现为致细胞病变和噬斑形成,AS 可保护细胞免受病毒诱导的细胞损伤并且可以显著降低病毒感染引起的空斑数量,对MOI 为0.001~0.100 的HSV-2,AS 均具有抑制作用。AS 对HSV-2 不同复制阶段的抑制作用,主要表现在AS直接灭活病毒颗粒时可降低细胞里的病毒载量,在病毒释放阶段对子代病毒有一定抑制作用,体现出良好的体外抗HSV-2活性。透射电镜结果证实,AS 对病毒的形态结构具有破坏作用,并且随着药物浓度的增加,对病毒的损伤逐渐明显,说明AS对HSV-2的抗病毒作用可能是通过改变病毒颗粒的包膜结构,降低病毒的感染能力。由此推测,AS 破坏病毒包膜可能是抑制HSV-2 的作用机制之一。
综上,一定浓度范围内的AS 可以在体外直接抑制病毒,然而本次研究表明AS 仍有其局限性,其细胞毒性较强,且虽然表现出较强的体外直接抗病毒作用,但对病毒感染没有预防作用。AS 在体外对病毒的直接抑制作用可为开发治疗2 型单纯疱疹病毒感染新药物提供新思路,但更深入的抗病毒作用机制尚需进一步研究。
利益冲突声明全部作者声明无利益冲突
作者贡献声明廉梅芳负责实验实施、数据整理、论文撰写;郑文学参与实验实施与数据分析;李娟、时黎明、李桂霞参与实验指导;于广福负责实验设计、论文修改
