电针对阿尔茨海默病不同病理阶段自噬状态影响差异性研究
2023-08-31杨晓坤高誉珊栗晨璐陈浩天郭孟玮谭韵湘张洋薛卫国
杨晓坤,高誉珊,栗晨璐,陈浩天,郭孟玮,谭韵湘,张洋,薛卫国
(北京中医药大学,北京 100029)
阿尔茨海默病(Alzheimer's disease, AD)是一种以渐进性认知功能衰退为主要临床表现的神经系统退行性疾病。其特征性病理改变主要是β-淀粉样蛋白(β-amyloid, Aβ)聚集形成的老年斑和Tau 蛋白过度磷酸化形成的细胞内神经原纤维缠结[1]。
Aβ级联假说认为脑内Aβ聚集是AD 形成和发展的关键因素,AD 的主要病理过程是由于Aβ的生成和清除失衡[2-3]。AD 发病机制具有多样性,单一Aβ级联假说并不能完美解释AD 发病机制。近年自噬功能紊乱学说已成为AD 发病机制及治疗靶点研究的热点[4-6]。细胞内包括Aβ在内的错误聚集的蛋白质通过自噬-溶酶体系统降解。自噬的动态过程分为自噬启动、自噬体形成、自噬体溶酶体融合和蛋白降解[7]。自噬在Aβ代谢中具有二重性[8],自噬-溶酶体途径可以降解Aβ;当自噬功能低下时,会使细胞内Aβ不能被有效降解;尤其当自噬体与溶酶体融合及降解受阻时,Aβ不但不能被有效降解,反而会因自噬泡的堆积而剧增。
PP/PS1 双转基因小鼠具有脑内Aβ水平升高、聚集、沉积和自噬功能紊乱两种病理特征。老年斑是AD的主要病理特征,研究[9-10]表明AD 早期4~5 月龄该小鼠脑内可溶性Aβ水平开始升高,但未出现老年斑,行为学未出现异常;病理期6~8 月龄脑内可溶性Aβ大量聚集、沉积形成老年斑,行为学开始出现异常。故以脑内老年斑出现与否和行为学是否异常将AD 区分为不同病理阶段。
AD 不同病理阶段存在不同的自噬功能紊乱机制[11]。自噬启动时,LC3Ⅰ转化为LC3Ⅱ并定位于自噬体膜上,随自噬体降解而减少,LC3Ⅱ/Ⅰ比值提示自噬体的数量及堆积程度[12];自噬流是否通畅是自噬底物是否最终被降解的评价指标。当通畅时,自噬特异性底物p62 会随自噬的进行被不断降解,p62 表达提示自噬流是否顺畅[13-14]。从自噬流角度,以LC3Ⅱ/Ⅰ比值和p62 共同评价自噬状态的高低。研究[15-17]显示,针刺对自噬启动、自噬体与自噬溶酶体融合和自噬溶酶体降解都可能存在影响。有研究[18]表明,针刺可降低10 月龄SAMP8 小鼠LC3Ⅱ/Ⅰ比值;也有研究[19]发现,针刺可提高6 月龄双转基因鼠海马LC3Ⅱ/Ⅰ比值。针刺调节AD 小鼠自噬相关蛋白LC3Ⅱ/Ⅰ比值的不同是否与其自噬状态不同有关。因此,本研究提出针刺是否对AD不同病理阶段自噬状态的调控具有差异性的假说。
本实验以4 月龄和8 月龄APP/PS1 双转基因小鼠为动物模型,电针百会和涌泉穴,观察电针对AD 不同病理阶段自噬相关蛋白LC3和p62的影响,探讨电针对AD 不同病理阶段自噬状态的调控及其调控机制是否具有差异性。
1 材料与方法
1.1 实验动物与分组
4 月龄和8 月龄APP/PS1 双转基因雄性小鼠各20 只,购于北京华阜康生物科技股份有限公司(No.110324211101570363,No.110324211105773138),动物生产许可证为SCXK(京)2019-0008,体质量分别为(20±6)g 和(26±6)g;同月龄同性别C57BL/6 野生型小鼠各10 只,购于北京斯贝福生物科技有限公司,动物生产许可证为SCXK(京)2019-0010,体质量分别为(24±4)g 和(28±4)g。以随机数字表法将其分为模型组和电针组,即4 月龄模型组和电针组,8 月龄模型组和电针组,每组10 只;以同月龄同性别C57BL/6野生型小鼠为正常组,即4 月龄正常组和8 月龄正常组。上述小鼠饲养于北京中医药大学动物中心,室温20~22 ℃,湿度40%~60%,自然光照,自由进食和进水。本实验经北京中医药大学实验动物伦理委员会批准(动物伦理批准号BUCM-4-2021052406-2041)。
1.2 主要仪器与试剂
一次性针灸针(北京中研太和医药公司,规格0.25 mm×13 mm),LH202H 型韩氏电针仪(北京华卫产业开发公司),冰冻切片机(德国,Leica),酶标仪、电泳仪、 垂直电泳槽、 转膜仪、 曝光机( 美国,Bio-Rad),ImageJ 图像分析处理系统(美国NIH)。
兔源LC3 抗体(proteintech 14600-1-AP),兔源p62 抗体(proteintech, 18420-1-AP),鼠源GAPDH 抗体(proteintech, 60004-1),山羊抗鼠(proteintech,60004-1),山羊抗兔(proteintech, SA00001-2);鼠源Aβ一抗(Covance-SIG-39320),即用型免疫组化超敏S-P 试剂盒(鼠)(迈新,KIT-9701),DAB 显色试剂盒(迈新,DAB-0031),兔源LC3荧光一抗(abcam, ab192890),鼠源Aβ荧光一抗(Covance-SIG-39320),鼠源辣根过氧化物标记生物素(北京中杉金桥,ZB-2305),羊源辣根过氧化物标记生物素(proteintech, SA00001-2),羊抗鼠荧光二抗(美国,Abcam, ab150115),羊抗兔荧光二抗(美国,Abcam, ab150077),荧光封片剂(含DAPI)(中杉金桥,ZLI-9557);Aβ42 酶联免疫吸附法试剂盒(美国,invitrogen, KHB3544),BCA 蛋白定量试剂盒(北京普利莱有限公司)。
1.3 干预方法
将电针组小鼠以自制鼠袋固定于操作台上,按照小鼠针灸穴位图谱及比较解剖学方法,在顶骨正中取百会穴,在两足底前、中1/3 交界处取双侧涌泉穴。穴位常规消毒,百会用毫针向前平刺2~3 mm 后单向滞针并留针;双侧涌泉直刺后接电针仪,疏密波,频率1/50 Hz,电流强度1.0 mA,以针柄震颤且动物保持安静不挣扎嘶叫为度,干预持续20 min。正常组和模型组小鼠以相同方法和时间束缚20 min。隔日1 次,连续6 周。
1.4 Morris 水迷宫实验
干预结束后进行5 d Morris 水迷宫实验,检测各组小鼠空间学习记忆能力。水迷宫水池等距离划分4 个象限,定位航行平台置于第4 象限内。水池倒入温水并用脱脂奶粉混匀,水温22~23 ℃,隐藏平台,由图像采集系统记录小鼠游泳情况及运动轨迹。实验前1 d 进行适应性训练。实验前4 d 进行定位航行实验,将小鼠依次从第2、3、1 象限面朝池壁放入水池并开始计时,记录小鼠找到平台的时间,即逃避潜伏期。若小鼠60 s 内未找到平台,引导小鼠至平台上并停留15 s,记录小鼠找到平台时间为60 s。以第2 象限放入水池的逃避潜伏期作为检测指标。实验第5 天进行空间探索实验,撤掉平台,从第2 象限将小鼠面朝池壁放入,记录小鼠60 s 内平台象限停留时间。
1.5 取材方法
4 月龄和8 月龄APP/PS1 双转鼠随机每组选取4 只,以2%戊巴比妥钠[按50 mg/(kg·bw)剂量]腹腔注射深度麻醉,4%多聚甲醛心脏灌注固定后取出全脑,4%多聚甲醛溶液固定72 h,梯度蔗糖脱水、修块、包埋,﹣80 ℃保存,用于免疫组化和免疫荧光实验。4 月龄和8 月龄每组剩余6 只小鼠深度麻醉,冰盒上断头取脑,剥离海马及脑皮质放入EP 管中,﹣80 ℃保存,用于Western blot 及酶联免疫吸附法检测。
1.6 观察指标
1.6.1 免疫组化技术观察海马淀粉样斑块沉积情况
视交叉后冠状位连续冰冻切片,片厚10 µm。第1 天,冰冻切片复温30 min; PBS 洗,枸橼酸盐缓冲液热修复15 min; PBS 洗,山羊血清封闭10 min;甩掉封闭液,加入Aβ一抗,4 ℃孵育过夜。次日, PBS 洗,二抗(试剂2)孵育10 min; PBS 洗,试剂3 孵育10 min;PBS 洗, DAB 显色10 min 镜下观察情况;自来水冲洗;脱水,透明,封片。显微镜下观察表达情况并拍照。
1.6.2 免疫荧光技术观察海马及皮质内LC3 及Aβ的表达部位
第1 天,除一抗(Aβ和LC3 等体积混匀)外,其余步骤同上。次日,PBS 洗,荧光二抗(鼠源二抗和兔源二抗等体积混匀)避光孵育1 h; PBS 洗;DAPI 封片,荧光显微镜下观察阳性表达情况并拍照。
1.6.3 Western blot 检测小鼠海马LC3 与p62 蛋白的相对表达量
称取小鼠左侧海马组织于试管中,加RIPA 裂解液和 PMSF(RIPA:PMSF =100:1),超声仪研磨匀浆,4 ℃,12 000 r/min,离心20 min,取上清液,BCA 法测定蛋白浓度。每孔上样量20 µg,分离电泳、转膜、快速封闭20 min,TBST洗,裁膜,一抗(LC3为1:6 000,p62为1:4 000,GAPDH 为1:100 000)4 ℃孵育过夜;TBST洗,二抗(羊抗兔为1:5 000,羊抗鼠为1:5 000)孵育1 h, TBST 洗;滴加ECL 发光液显色,曝光显影。ImageJ 软件分析各条带灰度值,以GAPDH 的灰度值为基线计算各目标条带相对表达量。
1.6.4 酶联免疫吸附法检测小鼠海马Aβ浓度
取6 月龄和10 月龄每组右侧海马于EP 管中,按说明书加入PBS 裂解液,冰上匀浆;以16 000 r/min 速度和4 ℃环境,离心20 min 后取上清液。据预实验结果,以正常组不稀释、模型组稀释20 倍、电针组稀释10 倍为最佳稀释倍数,按所需加入上清液标准稀释液。按照说明书流程连续稀释标准品;检测板加入50 µL 标准品,显色空白孔留空;除空白孔外,每孔加50 µL 检测抗体溶液并覆盖平板,4 ℃过夜;洗板4 次,加100 µL 二抗(显色空白孔除外),膜封板,室温孵育30 min;洗板4 次,加100 µL 稳定色原,混匀后溶液变蓝,覆盖平板,避光孵育30 min;加100 µL 终止液。操作过程严格按照说明书中步骤。用酶标仪在450 nm波长下测定吸光度值,绘制蛋白标准品的曲线,根据方程式计算Aβ42 的浓度。
1.7 统计学分析
采用SPSS20.0 统计软件统计分析。当计量资料符合正态分布时,采用均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用LSD 检验;重复测量数据采用重复测量方差分析,组间比较采用单因素方差分析;若出现计量资料为非正态分布,数据比较则采用非参数检验。以P<0.05 表示差异具有统计学意义。
2 结果
2.1 各组不同月龄小鼠Morris 水迷宫结果比较
与同月龄正常组比较,6 月龄和10 月龄模型组小鼠Morris 水迷宫定位航行实验逃避潜伏期均增加(P<0.01);与同月龄模型组比较,6 月龄和10 月龄电针组小鼠逃避潜伏期均减少(P<0.01)。详见图1。

图1 各组不同月龄小鼠Morris 水迷宫定位航行实验逃避潜伏期比较(±s, n=10)
与6 月龄模型组小鼠比较,10 月龄模型组小鼠平均逃避潜伏期延长,差异具有统计学意义(P<0.05)。详见图2。
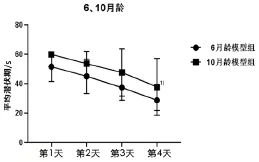
图2 6 月龄和10 月龄模型组小鼠Morris 水迷宫定位航行实验逃避潜伏期比较( ±s, n=10)
正常组比较,同月龄模型组Morris 水迷宫空间探索实验平台象限停留时间均减少(P<0.01);与模型组比较,同月龄电针组平台象限停留时间均延长(P<0.01)。详见图3。

图3 6 月龄和10 月龄模型组小鼠Morris 水迷宫空间探索实验平台象限停留时间比较(±s, n=10)
2.2 各月龄小鼠淀粉样斑块沉积情况比较
6 月龄和10 月龄模型组海马均可见褐色团块状淀粉样斑块沉积(如图4 箭头所指),10 月龄模型组褐色团块状淀粉样斑块沉积(老年斑)明显更多且密集;经电针治疗后,6 月龄和10 月龄电针组小鼠海马区褐色团状块淀粉样斑块沉积均有所减少。详见图4。

图4 6 月龄和10 月龄小鼠淀粉样斑块沉积情况比较(×40)
2.3 各组小鼠LC3 和Aβ免疫荧光表达情况比较
DAPI 细胞核标记为蓝色,LC3 标记为绿色荧光,主要表达在海马CA1 区核周(细胞质)与轴突中;Aβ标记为红色荧光,主要聚集在海马CA1 区的核周(细胞质),如图5 虚箭头所指;橘黄色区域为共表达区域,如图5实箭头所示,二者存在共表达情况。详见图5。
2.4 各组小鼠海马酶联免疫吸附法检测Aβ浓度比较
与正常组比较,同月龄模型组脑内Aβ浓度均升高(P<0.01);与模型组比较,同月龄电针组脑内Aβ浓度均降低(P<0.01);6 月龄模型组小鼠脑内Aβ浓度明显低于10 月龄模型组(P<0.01)。详见表1。
表1 各组小鼠海马ELISA 检测Aβ浓度比较(±s)单位:pg·g﹣1
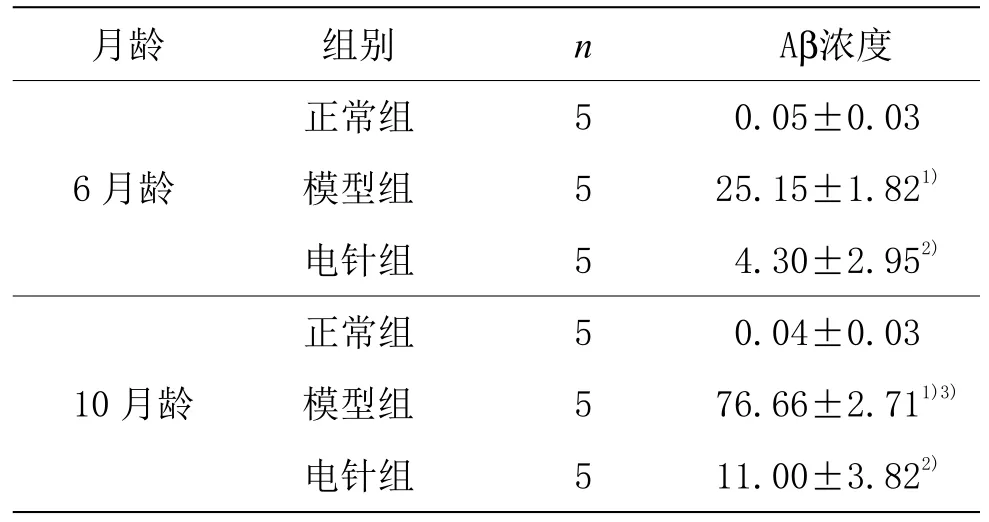
表1 各组小鼠海马ELISA 检测Aβ浓度比较(±s)单位:pg·g﹣1
注:与同月龄正常组比较1)P<0.01;与同月龄模型组比较2)P<0.01;与6 月龄模型组比较3)P<0.01。
月龄 组别 n Aβ浓度6 月龄正常组 5 0.05±0.03模型组 5 25.15±1.821)电针组 5 4.30±2.952)10 月龄正常组 5 0.04±0.03模型组 5 76.66±2.711)3)电针组 5 11.00±3.822)
2.5 各组小鼠海马自噬相关蛋白Western blot 检测结果比较
与同月龄正常组比较,6 月龄模型组LC3Ⅱ/Ⅰ比值和p62 表达降低(P<0.01),10 月龄模型组LC3Ⅱ/Ⅰ比值和p62 表达升高(P<0.01,P<0.05)。与同月龄模型组比较,6 月龄电针组 LC3 Ⅱ/Ⅰ比值增加(P<0.01),p62 表达降低但差异无统计学意义(P>0.05),10月龄电针组LC3Ⅱ/Ⅰ比值和p62表达均降低(P<0.01,P<0.05)。与6 月龄模型组比较,10 月龄模型组LC3Ⅱ/Ⅰ表达量增高(P<0.01),p62 表达量明显增加(P<0.01)。详见图6、图7 和表2。
表2 各组小鼠海马LC3Ⅱ/Ⅰ和p62/GA 比值表达情况(±s)

表2 各组小鼠海马LC3Ⅱ/Ⅰ和p62/GA 比值表达情况(±s)
注:与同月龄正常组比较1)P<0.01,2)P<0.05;与同月龄模型组比较3)P<0.01,4)P<0.05;与6 月龄模型组比较5)P<0.01。
月龄 组别 n LC3Ⅱ/Ⅰ比值 p62/GA 比值6 月龄正常组 6 0.35±0.07 0.79±0.05模型组 6 0.25±0.031) 0.69±0.051)电针组 6 0.41±0.073) 0.69±0.03 10 月龄正常组 6 0.33±0.05 0.72±0.07模型组 6 0.44±0.061)5) 0.85±0.092)5)电针组 6 0.37±0.043) 0.72±0.124)

图6 6 月龄各组小鼠海马LC3Ⅱ/Ⅰ比值和p62 表达情况比较

图7 10 月龄各组小鼠海马LC3Ⅱ/Ⅰ比值和p62 表达情况比较
3 讨论
β-淀粉样蛋白(Aβ)大量聚集、沉积形成的老年斑是阿尔兹海默病(AD)主要病理特征。Aβ级联假说是目前最为公认的AD 发病机制,细胞内可溶性Aβ寡聚体具有神经毒性,会造成突触功能障碍、神经元丢失等一系列级联反应,导致严重的记忆损坏[20]。自噬功能紊乱被认为是细胞内Aβ产生、聚集的主要原因;当自噬功能出现障碍时,会对Aβ的聚集创造条件[21]。通常认为,AD不同病理阶段的自噬状态不同。研究[22-23]发现AD 早期患者脑内自噬启动相关蛋白表达量下降,提示自噬水平处于低下状态;随病情发展,AD 患者及APP/PS1 转基因小鼠脑内存在自噬体转运及降解功能障碍,神经元及突起中大量自噬泡堆积,自噬-溶酶体途径功能紊乱是AD 疾病进程晚期的重要病理机制。
APP/PS1 双转基因小鼠是国际公认的影响Aβ水平及其机制研究的动物模型;随月龄增加,脑内大量Aβ不断地聚集、沉积形成老年斑,并伴随突触丢失和神经元变性等是研究AD 较好模型[24]。同时该模型小鼠脑内存在细胞内自噬功能紊乱,营养不良性神经突起内有大量自噬泡堆积,神经元核周存在大量自噬溶酶体,也是研究AD 自噬功能紊乱的理想模型。本研究发现此模型小鼠6月龄和10月龄的病理特征及自噬状态存在明显区别。本实验使用的6E10 Aβ抗体只能识别人来源的APP片段,故在免疫组化实验中APP/PS1双转基因小鼠脑内可见其阳性表达;而正常组C57BL/6 小鼠中无人来源的APP 片段,故正常组小鼠脑中无阳性表达。与正常组比较,6 月龄APP/PS1 双转基因模型小鼠空间学习记忆能力下降,脑内可溶性Aβ浓度升高,海马可见少量老年斑,自噬相关蛋白LC3Ⅱ/Ⅰ比值和p62 水平均偏低,说明其自噬功能低下,与此研究大致相同[12]。10 月龄模型小鼠空间学习记忆能力下降更为明显,脑内 Aβ 水平越来越高且已形成大量老年斑,LC3Ⅱ/Ⅰ比值和p62 水平均偏高,说明模型小鼠自噬功能紊乱,自噬泡出现堆积,自噬流处于不通畅状态。
众多研究[25-27]表明,针刺能够改善APP/PS1双转基因小鼠空间学习记忆能力,降低脑内Aβ水平。本课题组前期研究也显示[28-29],针刺百会和涌泉穴可以有效降低脑内Aβ水平,同时发现了针刺对自噬状态的影响。针刺治疗AD 可能具有双向调节作用,对AD 老年斑形成前后不同病理阶段的不同自噬状态都会产生一定的良性调节作用。以往的相关研究大多数是以单个月龄AD 模型小鼠为实验对象,观察针刺对该月龄模型鼠自噬水平的影响。由于AD 是一种起病隐匿的进行性发展的神经系统退行性疾病,故本研究基于Aβ级联假说和自噬功能紊乱假说,以AD 病理早期4 月龄和病理期8月龄APP/PS1双转基因鼠为动物模型,观察电针百会和涌泉穴干预4 月龄和8 月龄双转基因小鼠6 周对Morris 空间学习记忆能力、脑内可溶性Aβ水平及自噬状态的影响,探讨AD 不同病理阶段的自噬状态以及电针对其自噬状态的调控及其调控机制是否具有差异性,以阐释电针改善AD 不同病理阶段学习记忆能力机制的不同。
本次实验水迷宫结果显示,6 月龄和10 月龄电针组逃避潜伏期和平台象限停留时间均优于模型组,提示电针可以改善老年斑形成前后不同病理阶段AD 模型鼠的学习记忆能力。但由于其AD 病理状态不同,电针改善学习记忆能力的机制可能不同。酶联免疫吸附法检测结果显示,6 月龄和10 月龄电针组脑内可溶性Aβ浓度均低于模型组,提示两组电针干预都可以降低其脑内Aβ水平。Western blot 检测结果显示,与同月龄模型组 LC3 Ⅱ/Ⅰ比值降低不同,6 月龄电针组LC3Ⅱ/Ⅰ比值升高,p62 表达无明显变化,说明电针能够促进6 月龄双转鼠自噬体的形成,增强自噬状态,此结果与以往针刺增强AD 自噬状态的研究结果相仿[19,30-31];而与同月龄模型组LC3Ⅱ/Ⅰ比值升高及p62表达升高不同,10 月龄电针组LC3Ⅱ/Ⅰ比值和p62 表达均降低,说明电针能够减少10 月龄双转鼠自噬体的异常堆积,调节自噬功能紊乱,使自噬流通畅,此结果与以往针刺抑制AD 自噬状态的研究结果相仿[15,28]。本实验结果使以往AD 针刺研究中所出现的对自噬状态调节的不同结果得到较好的解释。由于AD 不同病理阶段脑内Aβ水平及自噬状态不同,针刺对AD 自噬状态有良性调节作用。6 月龄双转基因鼠脑内Aβ水平刚开始升高,自噬状态不足,电针可增强6 月龄双转基因鼠海马自噬功能,提升对Aβ的清除能力;10 月龄模型鼠脑内自噬体出现异常堆积,自噬流不通畅,脑内Aβ大量生成,电针可调节10 月龄双转基因鼠自噬功能紊乱状态,降低脑内Aβ水平。因此,通过实验,本研究可认为AD 不同病理阶段的自噬状态不同,电针降低其脑内Aβ水平,增强其学习记忆能力的机制存在差异性。
由于Aβ的种类多样性及其复杂性,再加上自噬流状态评估的整体性,本实验仅通过可溶性Aβ1-42 的酶联免疫吸附法检测Aβ水平。以LC3 和p62 的Western blot 检测自噬流,存在一定的局限性。对于6 月龄APP/PS1 双转鼠脑内自噬水平是否低下,还需要运用多种自噬检测方法进行研究。电针干预自噬的生物学机制尚待进一步探讨。
