经直肠超声造影与磁共振对不同Gleason评分前列腺癌诊断价值比较
2023-08-31张华方建华包凌云陈创华
张华 方建华 包凌云 陈创华
前列腺癌是男性泌尿系统最常见的恶性肿瘤[1],近年来其发病率明显增加。由于起病隐匿,早期缺乏典型的临床症状,多数患者确诊时已处于中晚期甚至发生转移,因此早期诊断能够改善患者预后,提高生存质量[2-3]。经直肠超声引导下前列腺穿刺活检术常被用于前列腺癌的术前诊断,但由于患病早期病灶体积较小,穿刺活检术仍存在一定的假阴性率,且该检查为有创操作,对操作者有较高的技术要求,因此难以得到全面开展[4]。影像学检查是一种无创且有效的检查方式,近年来磁共振成像(MR)、经直肠超声造影(CEUS)被广泛用于前列腺癌的早期诊断中,本文探讨MR、CEUS 对不同恶性程度前列腺癌的诊断效能。
1 资料与方法
1.1 临床资料 选取 2021 年1~10 月本院临床疑似前列腺癌患者309 例。纳入标准:①总血清PSA ≥4 ng/mL,直肠指检触及硬结节,经直肠超声(TRUS)发现前列腺低回声结节,MR 发现前列腺内异常信号区,上述至少具备一项;②具有完整的超声造影、磁共振及病理等检查资料。排除标准:①曾接受过前列腺手术和(或)前列腺药物治疗;②超声造影剂或磁共振造影剂过敏者,有严重出血、凝血功能障碍等不耐受前列腺穿刺手术者。
1.2 方法 (1)TRUS 检查:患者取左侧卧位,在标准横切面和纵切面分别测量前列腺横径、前后径、上下径,计算前列腺体积,前列腺体积(mL)=0.52×横径×上下径×前后径。对前列腺从尖端到基底部进行连续全面扫查,观察包膜是否完整,腺体内有无异常结节回声,测量结节大小,同时观察腺体内血流分布及结节内的供血情况。(2)CEUS 检查:应用百胜超声诊断仪,配备TRT 双平面探头,术前告知家属及患者签署知情同意书。如TRUS 发现异常回声结节,则取该切面为造影观察切面,如TRUS 无异常发现,则取前列腺最大横切面为造影观察切面。由护士选择左前臂肘静脉团注2.5 mL 声诺维混悬液,之后立即注射0.9%氯化钠溶液5 mL,动态收集不同时相的前列腺超声造影灌注图像。前列腺癌高增强、低增强、缘周区双侧不对称性增强、不均匀增强均为阳性征象[5]。由2 名主治以上超声医师采用盲法诊断超声造影结果,结果不一致时由第3 名同级别医师参与诊断。(3)MR 检查:采用飞利浦 Ingenia 3.0 T 磁共振扫描仪,患者取仰卧位,将腹部相控阵线圈中心置于耻骨联合处。成像序列包括:冠状位、横断位、矢状位快速自旋回波(FSE)高分辨率T2WI 成像,横断位弥散加权成像(DWI)、表观弥散系数(ADC)图。对比剂选用0.2 mL/kg 的钆喷酸葡甲胺(Gd-DTPA)。诊断标准参照2019 年9 月《EUROPEAN UROLOGY》在线发表的前列腺影像报告和数据系统(PI-RADS V2.1)[6]。由2 名影像科主治以上医师进行双盲阅片,结果不一致时,由第3 名同级别医师参与诊断。(4)前列腺穿刺活检:由1 名经验丰富的超声医师在常规超声引导下行12 针穿刺活检,先对前列腺基地部、体部和尖部取材,然后对超声造影和MR 提示可疑病灶增加穿刺点。病理标本由2 名工作10 年以上的病理主治医师诊断。依据Gleason 评分法8 分及以上患者纳入高危组,7 分纳入中危组,2~6 分纳入低危组。
1.3 统计学方法 采用 SPSS 22.0 统计学方法。计数资料(%)比较采用配对卡方检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 病理结果 309 例疑似前列腺癌患者中,病理证实的前列腺癌患者146 例,Gleason 评分6~9(7.17±1.02)分;其中前列腺良性病变163 例均为前列腺增生,其中7 例伴有前列腺炎症,3 例伴有脓肿形成,11 例伴上皮内瘤变,2 例伴肉芽肿性炎。
2.2 两种方法诊断结果 MR 总计检出阳性148 例,其中121 例为病理阳性,总计检出阴性161 例,其中115例为病理阴性。CEUS 总计检出阳性159 例,其中110例为病理阳性,总计检出阴性150 例,其中114 为病理阴性。CEUS+MR 总计检出阳性191 例,其中138 例为病理阳性,总计检出阴性118 例,其中110 为病理阴性。病理确诊146 例前列腺癌患者中,低危组41 例,CEUS 检出21 例,MR 检出28 例,CEUS 联合MR 检出36 例;中危组62 例,CEUS 检出49 例,MR 检出52 例,CEUS 联合MR 检出59 例;高危组 43 例,CEUS 检出40 例,MR 检出 41 例,CEUS 联合MR 检出43 例。见图1。
2.3 CEUS 和MR 对前列腺癌诊断效能比较 CEUS 和MR 对前列腺癌诊断敏感度分别为75.3%、82.9%,特异度分别为69.9%、70.5%,准确度分别为72.5%、76.4%,两组比较差异均无统计学意义(P>0.05)。CEUS+MR联合使用对前列腺癌诊断敏感度为94.5%,特异度为67.5%,准确度为80.3%;与MR 和CEUS 单独使用时,敏感度和准确度更高(P<0.05)。见表1。
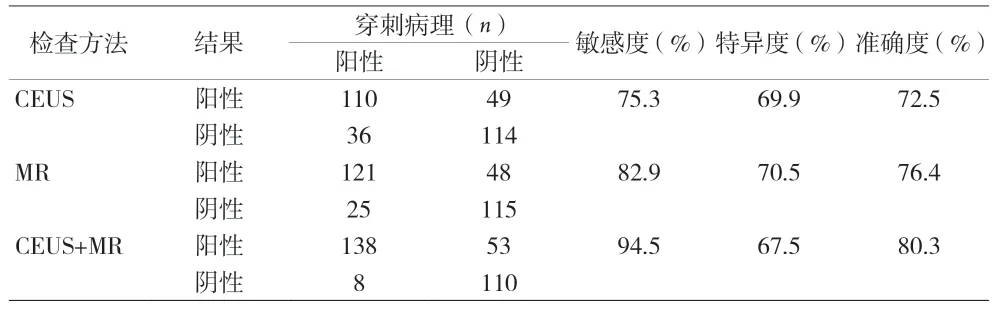
表1 CEUS、MR及CEUS联合MR对前列腺癌的诊断价值
2.4 三种检查方法对不同Gleason 评分前列腺癌阳性检出率比较 CEUS 和MR 检查对前列腺癌的阳性检出率随着Gleason 评分的增加而增加。低危组CEUS、MR、CEUS 联合MR 检查对前列腺癌的阳性检出率分别为 51.2%、68.3%、87.8%,中危组 CEUS、MR、CEUS联合MR 检查对前列腺癌的阳性检出率分别为79.0%、83.9%、95.2%,两组中 CEUS 联合MR 检查对前列腺癌患者的阳性检出率均高于单独使用CEUS、MR,差异有统计学意义(P<0.05),CEUS 和MR 单独使用时对前列腺癌阳性检出率差异无统计学意义(P>0.05)。高危组中CEUS、MR、CEUS 联合MR 检查对前列腺癌患者阳性检出率差异无统计学意义(P>0.05)。见表2。
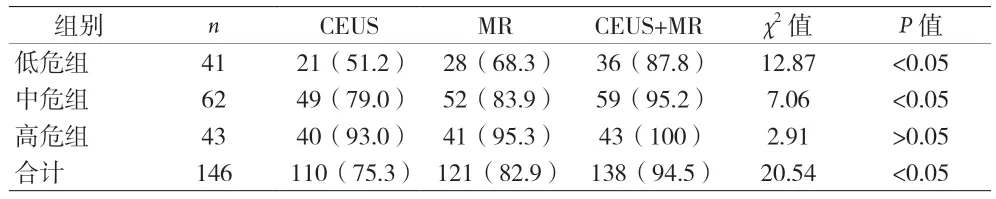
表2 三种检查方法对不同Gleason评分前列腺癌阳性检出率比较[n(%)]
3 讨论
前列腺癌是男性泌尿系统中发病率最高的恶性肿瘤,随着我国老龄化增长及检查技术水平的提升,其发病率也呈逐年上升的趋势。临床上对前列腺癌的诊断模式为“三阶梯法”,首先通过前列腺特异性抗原(PSA)和直肠指检对前列腺患者进行初筛,然后根据影像学检查方法对可疑病灶进行定位,最后经直肠超声引导下对前列腺进行系统穿刺,获得病理诊断[7]。研究发现,血清 PSA 水平易受多种因素影响,检测特异性较低,直肠指检只能检测到贴近前列腺后包膜的肿瘤,具有局限性[8]。
TRUS 相比经腹部前列腺超声检查能透过直肠的前壁清晰显示前列腺包膜、内外腺交界及前列腺内部结节回声,并能通过彩色多普勒技术清晰显示出腺体内部血流信号。但由于发病早期病灶体积较小,且很少有大范围的出血、坏死等情况,所以腺体内不规则低回声区与良性增生结节较难辨别。据文献报道,常规灰阶超声检查对前列腺癌诊断敏感度仅为40%左右,特异度不足55%[5,9]。研究发现,癌组织内的血管密度接近正常组织的2 倍,前列腺癌的生长、侵袭和转移主要依赖于肿瘤内新生的微血管,大量新生微血管缺乏树枝状结构的正常分布,结构杂乱,走行迂曲,粗细不均[10]。常规多普勒超声仅能显示直径>1 mm 的血管,对前列腺癌组织内的微血管显示不佳。CEUS 所使用的造影剂微泡直径约1~10 µm,与红细胞体积接近,能轻易穿过毛细血管床从而较好的反映前列腺癌病灶组织的微血管分布,提高对前列腺癌的早期诊断率[11]。典型前列腺癌超声造影灌注方式为“快进快出”,局灶性前列腺癌常表现为高增强或低增强,弥漫性前列腺癌表现为不均匀增强,内外腺分界不清;而前列腺良性病变常与周围组织同步灌注,多数表现为均匀性高增强,消退期也基本和周围组织一致[12]。本研究中,CEUS 对前列腺癌诊断敏感度为75.3%,特异度为69.9%,准确率为72.5%。其中有49 例为假阳性,分析原因49 例中有30例为前列腺增生伴前列腺炎,9 例上皮内瘤变,10 例为单纯前列腺增生。据研究报道,前列腺炎性区域在超声造影上增强方式和单纯前列腺增生不同,但和前列腺癌早期的造影增强方式类似,从而使急性或慢性前列腺炎易被CEUS 误诊为前列腺癌[13]。本研究中9 例上皮内瘤变在超声造影上均表现为快速增强,有学者认为高级别上皮内瘤变为前列腺癌的癌前病变,可能其微循环组成接近前列腺癌,使其在CEUS 上表现为高增强。
多参数MR 对软组织具有较高的分辨率,逐渐被公认为诊断前列腺癌的最佳影像学方法。在MR 各项参数中,DWI 对前列腺癌的检出率最高,DWI 主要测定组织水分子的自由扩散反映细胞形态和细胞膜完整度等信息,当前列腺癌破坏了正常前列腺组织,尤其是含水的腺泡细胞,由大量紧密堆积和分布不规则的癌细胞取代,阻碍水分子的扩散,DWI 信号强度增加[14]。KATELARIS[15]等学者研究发现,多参数MR 对前列腺癌诊断的敏感性达90%,特异性达85%。本研究多参数MR 对前列腺癌诊断的敏感性为82.9%,特异性为70.5%。本研究48 例假阳性患者中,31 例为前列腺增生伴前列腺炎,5 例上皮内瘤变,12 例为单纯前列腺增生。前列腺炎在T2WI 上也可能表现为类似于前列腺癌的低信号,前列腺良性增生性结节由于细胞密度增高水分子弥散受限,在DWI 和对应的ADC 图的表现与前列腺癌相似,这可能是导致假阳性的主要原因[16]。本研究25 例假阴性患者中有21 例均为微小癌,病灶体积小,缺乏血供,且无其他特征性表现,诊断相对困难。
肿瘤侵袭性可根据Gleason 评分评估,评分越高肿瘤分化程度越差,癌组织的侵袭性越强。既往研究发现前列腺癌Gleason 评分为7~10 患者比评分为6 分的患者疾病进展速度更快,病死率也明显更高[17]。也有研究发现大部分高分值的前列腺癌在造影时可以观察到不对称的血管结构,而在低分值前列腺癌很少见,同时在增强时间和消退时间上二者也有显著差异,高分值前列腺癌更多表现为快进快退和高增强,只有少部分低分值前列腺癌具有相同表现[18]。本研究将146 例前列癌患者根据Gleason 评分分为低危组、中危组和高危组,结果显示CEUS 和MR 对三组阳性检出率随Gleason 评分的增加而增加,和既往研究一致。前列腺癌组织比正常前列腺组织的血管生成水平高得多,且随着肿瘤分化程度降低,其组织内微血管生成增多,血供越丰富,既往研究表明Gleason 高分值组血管密度高于低分值组,这可能也是这两种影像学检查方法对Gleason 评分较高的分组检出率更高的原因。本研究结果在低危组和中危组中,CEUS 和MR 联合应用对前列腺癌的阳性检出率均高于单独使用,而在高危组中,CEUS 和MR 联合应用或单独使用均差异无统计学意义。一些前列腺炎症改变超声造影也可表现为快进快出,MR 也可表现为高增强,此时两种影像学方法联合使用能够查缺补漏,超声造影能动态判断癌组织内微血管分布及血流信号对称情况,MR 可对前列腺组织生理解剖结构做出全方位判断,有利于判断病可疑病灶区临近组织关系,从而提高了中、低危组前列腺癌的阳性检出率。
综上所述,CEUS、MR 对不同危险程度的前列腺癌患者诊断效能不同,二者联合应用可有效提高前列腺癌患者的阳性检出率,尤其对中、低危前列腺癌患者效果更明显。
