复方曲肽注射液对细胞色素P450酶活性的体内外影响Δ
2023-08-31刘凡琪王婧媛李自强黄宇虹王保和天津中医药大学研究生院天津067天津中医药大学第二附属医院临床药理中心天津0050天津中医药大学第一附属医院国医堂天津009
刘凡琪 ,王婧媛 ,李 楠 ,李自强 ,黄宇虹 ,王保和 (.天津中医药大学研究生院,天津 067;.天津中医药大学第二附属医院临床药理中心,天津 0050;.天津中医药大学第一附属医院国医堂,天津 009)
随着中西医结合研究的不断深入,中西药联用日益普遍,而二者相互作用引起的不良事件风险日益受到学者关注。细胞色素P450(cytochrome P450,CYP450)酶是体内参与药物及其他外源性物质代谢的主要肝药酶系,其多个重要亚型参与了约90%的药物代谢,如CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP3A4 分别承担8.9%、7.2%、4.7%、12.8%、6.8%、20.0%、30.2%的药物代谢[1]。CYP450 酶表达和功能的改变常会引起药物药动学参数的变化,故抑制或诱导该酶活性是影响药物代谢性相互作用的主要靶点。
复方曲肽注射液由曲克芦丁和猪脑提取物组成,可用于急慢性脑血管疾病及其所致相关功能障碍的临床治疗。研究指出,该药可抑制血小板聚集,增加脑血流量,调整和改善神经细胞代谢,对缺氧脑组织具有保护作用[2—3]。临床实践表明,复方曲肽注射液和常规西药(如依达拉奉)联用可明显改善急性脑梗死患者的临床疗效,提高其生活质量[4—5]。但目前复方曲肽注射液与脑血管疾病常用药物(如经CYP2C19代谢的氯吡格雷、CYP2C9底物华法林、CYP3A4底物阿托伐他汀等)联用的代谢性相互作用研究有限,可能存在用药安全隐患。
美国FDA 发布的《药物相互作用研究指导原则(2020)》[6]、我国国家药品监督管理局药品审评中心发布的《药物相互作用研究技术指导原则(试行)》[7]和国际人用药品技术要求国际协调理事会(International Council for Harmonisation of Technical Requirements for Pharmaceutical for Human Use,ICH)出台的《M12:药物相互作用研究(草案)》[8]均指出,研究者需评估由CYP450 酶介导的药物潜在相互作用。根据上述指导原则,本研究拟采用Cocktail探针药物法和实时荧光定量聚合酶链式反应(PCR)法评估复方曲肽注射液对人肝微粒体、人原代肝细胞中主要CYP450酶的体外抑制、诱导作用,以及对大鼠体内CYP450 酶活性的影响,旨在为复方曲肽注射液与其他药物的安全、有效联用提供依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Waters AQUITY UPLC型超高效液相色谱仪(美国Waters公司)、AB QTRAP 5500型质谱仪(美国AB 公司)、Rotor-Gene Q 型荧光定量PCR 仪(德国QIAGEN 公司)、Centrifuge 5430R 型高速离心机(德国Eppendorf公司)等。
1.2 主要药品与试剂
复方曲肽注射液[批号210409,规格2 mL∶80 mg 曲克芦丁、1.0 mg总氮、0.6 mg单唾液酸四己糖神经节苷脂(GM1)]购自吉林天成制药有限公司;还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH;批号SLCK5429,纯度≥97%)购自美国Sigma 公司;磷酸二氢钾(批号Q18D028,纯度98%)、磷酸氢二钾(批号W05E036,纯度99%)均购自阿法埃莎(中国)化学有限公司;总RNA 提取试剂盒(货号DP430)、cDNA 第一链合成试剂盒(货号KR116-02)、荧光定量PCR 试剂盒(货号FP206-02)均购自天根生化科技(北京)有限公司;甲醇、乙腈、甲酸均为色谱纯,水为蒸馏水。所用主要CYP450 酶底物、抑制剂、诱导剂、阴性对照、代谢产物及内标对照品的相关信息见表1。
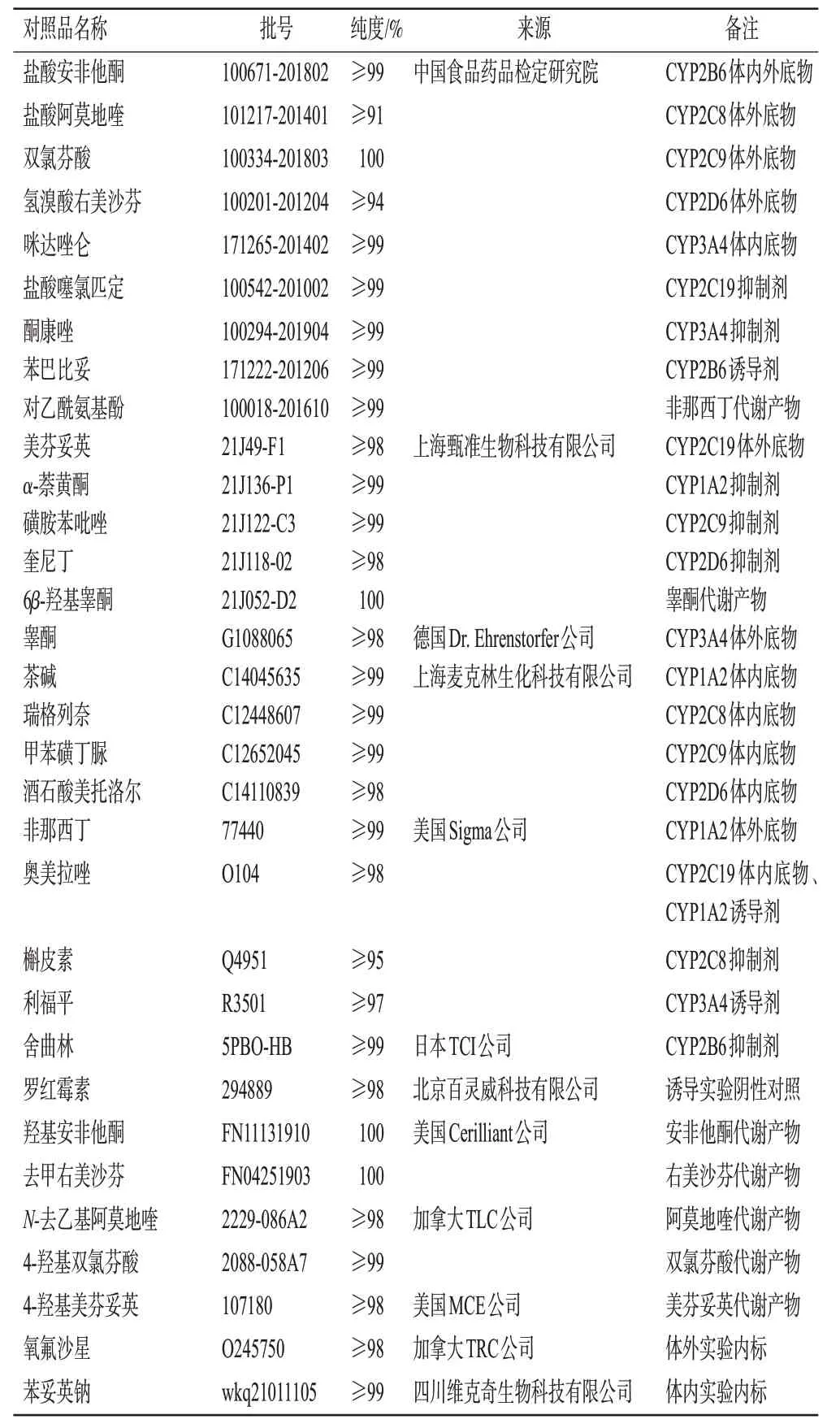
表1 主要CYP450酶底物、抑制剂、诱导剂、阴性对照、代谢产物及内标的相关信息
1.3 微粒体、细胞与动物
人肝微粒体(批号SDL,质量浓度24 mg/mL)、人原代肝细胞(批号HVN、QBU、MHK)及配套肝细胞培养液、贴壁培养液均购自美国BioIVT公司。健康SPF级雄性SD大鼠,体重200~250 g,由北京华阜康生物科技股份有限公司提供[动物生产许可证号SCXK(京)2019-0008]。实验方案经所在单位实验动物伦理委员会批准(编号为IRM-DWLL-2022209)。
2 方法
2.1 复方曲肽注射液定量分析方法的建立
采用超高效液相色谱-串联质谱技术进行定量分析。方法均以ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)为色谱柱,水(含0.1%甲酸,A)-乙腈(含0.1%甲酸,B)为流动相进行梯度洗脱(体外实验:0~3 min,90%A→10%A;3~4 min,10%A;4~4.2 min,10%A→90%A;4.2~8.0 min,90%A。体内实验:0~0.5 min,90%A;0.5~2.5 min,90%A→10%A;2.5~4.1 min,10%A→90%A;4.1~6.0 min,90%A);运行时间分别为8 min(体外实验)、6 min(体内实验);柱温均为30 ℃;进样盘温度均为10 ℃;进样量均为2.0 μL。质谱均采用电喷雾离子源,以多反应监测模式进行正离子扫描;气帘气压力均为40.0 psi;碰撞器压力均为7.0 psi;喷雾电压均为5 500.0 V;加热器温度均为450.0 ℃;离子源雾化压力均为50.0 psi;离子源加热辅助气压力均为50.0 psi。各待测成分的质谱监测参数见表2。
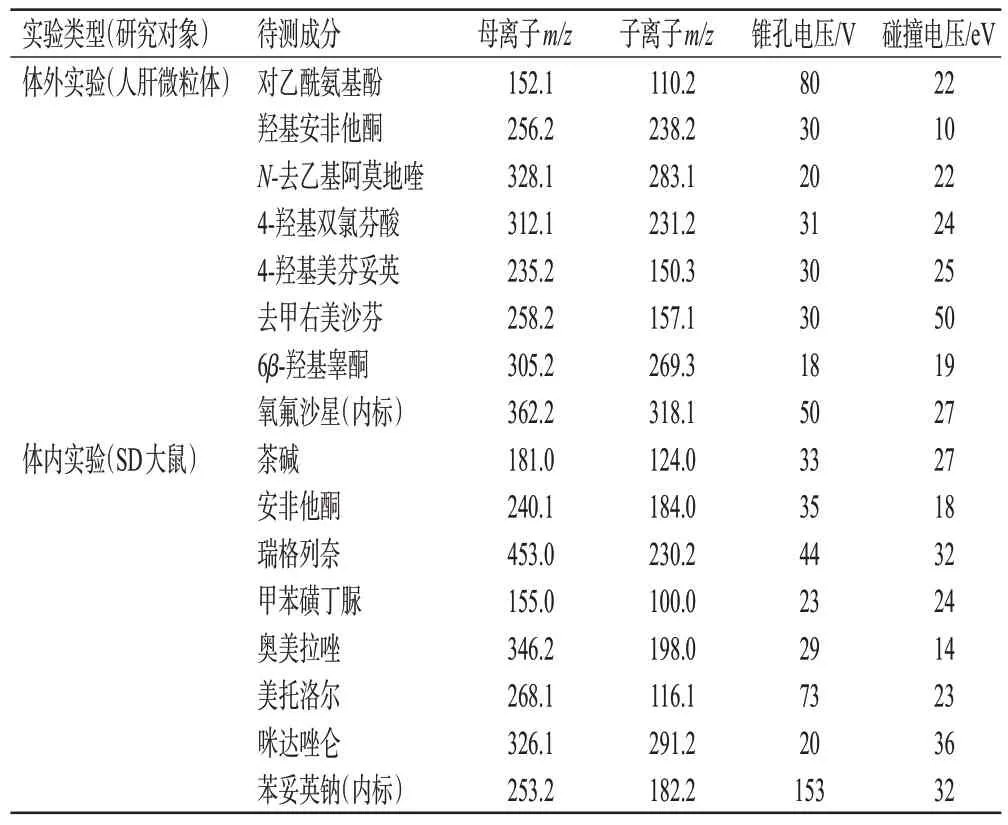
表2 各待测成分的质谱监测参数
方法学考察结果显示,对乙酰氨基酚、羟基安非他酮、N-去乙基阿莫地喹、4-羟基双氯芬酸、4-羟基美芬妥英、去甲右美沙芬、6β-羟基睾酮定量分析的线性范围分别为0.04~8、0.01~2、0.05~10、0.10~20、0.008~1.6、0.006~1.2、0.06~12 μmol/L(r均大于0.99),茶碱、安非他酮、瑞格列奈、甲苯磺丁脲、奥美拉唑、美托洛尔、咪达唑仑定量分析的线性范围分别为10~10 000、1~500、1~1 000、10~10 000、1~1 000、1~500、1~500 ng/mL(r均大于0.99);精密度、准确度、基质效应、稀释效应、稳定性均符合2020年《中国药典》(四部)的相关要求[9]。
2.2 复方曲肽注射液对人肝微粒体CYP450 酶的体外抑制实验
根据药品说明书,复方曲肽注射液的用法用量为静脉滴注,10 mL/次。以标准成人体重(60~70 kg)计算,其循环血量为4~5 L,故以临床常用剂量应用时,该药理论最大血药浓度为0.25%(体积分数,下同),考虑到肝脏内药物浓度可能会高于血药浓度[10],因此将体外实验浓度上限提高至10%(“2.3”项同)。
肝微粒体孵育体系(有机溶剂占比<1%)的最终体积为200 μL,包括人肝微粒体(最终质量浓度为0.5 mg/mL)、NADPH(最终浓度为1 mmol/L)、各亚酶的探针体外底物混合液(非那西丁30 μmol/L、安非他酮50 μmol/L、阿莫地喹5 μmol/L、双氯芬酸25 μmol/L、美芬妥英50 μmol/L、右美沙芬8 μmol/L、睾酮25 μmol/L)[10—11]、复方曲肽注射液(该药占肝微粒体孵育体系总体积的0.05%、0.1%、0.25%、0.5%、1%、2.5%、5%、10%)[10]或各亚酶的阳性抑制剂(α-萘黄酮2 μmol/L、舍曲林10 μmol/L、槲皮素20 μmol/L、磺胺苯吡唑10 μmol/L、噻氯匹定10 μmol/L、奎尼丁10 μmol/L、酮康唑10 μmol/L)[12]或空白对照(0.1 mmol/L 磷酸盐缓冲液);其余为0.1 mol/L 磷酸盐缓冲液(pH7.4,含氯化镁5 mmol/L)。待复方曲肽注射液或阳性抑制剂在人肝微粒体中预孵育15 min 后,加入各亚酶的探针底物和NADPH,于37 ℃下孵育30 min。每组配制3个平行样。各组加入含20 ng/mL 氧氟沙星(内标)的冰甲醇终止反应,涡旋3 min 后,以13 500 r/min 离心10 min,取上清液,按“2.1”项下条件以内标法测定各探针底物代谢产物(对乙酰氨基酚、羟基安非他酮、N-去乙基阿莫地喹、4-羟基双氯芬酸、4-羟基美芬妥英、去甲右美沙芬、6β-羟基睾酮)的生成量,并计算各CYP450酶亚型的剩余酶活性(剩余酶活性=复方曲肽注射液组或阳性对照组代谢产物生成量/空白对照组代谢产物生成量×100%);同时,采用GraphPad 8软件进行非线性拟合,并计算半数抑制浓度(IC50)。
2.3 复方曲肽注射液对人原代肝细胞CYP450 酶的体外诱导实验
待人原代肝细胞复苏后,用贴壁培养液稀释得0.7×106个/mL 的活细胞悬液,再以每孔100 μL 接种至预铺Ⅰ型胶原的96孔板中,于37 ℃、5%CO2条件下预孵育过夜,待贴壁单层细胞形成后,以肝细胞培养液继续培养。第2天,每孔加入含不同浓度复方曲肽注射液(该药占细胞孵育体系总体积的0.05%、0.25%、0.5%、1%、5%、10%)[10]或阳性诱导剂(奥美拉唑50 μmol/L、苯巴比妥1 000 μmol/L、利福平25 μmol/L)或阴性对照药(罗红霉素10 μmol/L)[13]的培养液,并设置不含受试药物、阳性诱导剂、阴性对照药的空白培养液作为空白对照。每组配制3 个平行样。连续培养2 d 后,弃去培养液,收集细胞并提取其总RNA,经消化后反转录合成cDNA,并以此为模板进行扩增。反应体系包括cDNA 模板(最终含量为200 ng)、正/反向引物(最终浓度均为300 nmol/L)、荧光探针(最终浓度为200 nmol/L)、2×Super-Real PreMix(Probe)、50×ROX 参比染料。反应条件为95 ℃预变性15 min;95 ℃变性3 s,60 ℃退火延伸30 s,循环40次。采集荧光信号,以β-actin为内参,以空白对照组为参照,采用2—ΔΔCt法计算CYP1A2、CYP2B6、CYP3A4 mRNA 的相对表达量(即诱导倍数)。PCR 引物/探针序列和产物长度见表3。

表3 PCR引物/探针序列和产物长度
2.4 复方曲肽注射液对大鼠CYP450 酶影响的体内实验
取SD大鼠12只,随机分为对照组和实验组,每组6只。对照组大鼠尾静脉注射生理盐水0.9 mL/kg,实验组大鼠尾静脉注射复方曲肽注射液0.9 mL/kg(以临床常用剂量换算得大鼠等效剂量),每天1 次,连续10 d;第10天尾静脉注射30 min后,两组大鼠均灌胃含7个探针底物的混合溶液(茶碱8 mg/kg、安非他酮2 mg/kg、瑞格列奈1 mg/kg、甲苯磺丁脲1 mg/kg、奥美拉唑10 mg/kg、美托洛尔10 mg/kg、咪达唑仑8 mg/kg,各探针底物的浓度由预实验确定)。
分别在灌胃探针药液前(0 min)以及给药后5、10、20、30、45 min 和1、2、4、6、9、12、24 h 于眼内眦取血0.5 mL,置于含肝素钠的抗凝离心管中,以3 000 r/min离心10 min,分离血浆;血浆样品经3倍体积的甲醇沉淀蛋白后取上清液(部分样品进样前需稀释),按“2.1”项下条件以内标法测定各时间点探针底物的含量,并应用Phoenix WinNonlin 8.1药动学软件计算各探针底物的药动学参数并绘制药-时曲线。
2.5 统计学方法
采用SPSS 20.0 软件对数据进行统计分析,采用GraphPad Prism 8.4.3软件作图。计量资料以±s表示,药动学参数比较采用独立样本t检验(方差齐)或t’检验(方差不齐)。检验水准α=0.05。
3 结果
3.1 复方曲肽注射液对CYP450酶的体外抑制作用
阳性抑制剂处理后的各CYP450酶亚型的剩余酶活性均低于50%,各探针底物代谢受到明显抑制,说明孵育体系合格(具体结果略)。复方曲肽注射液对人肝微粒体中CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP3A4 酶的抑制曲线见图1。由图1 可见,经不同浓度的复方曲肽注射液(0.05%~10%)处理后,CYP2B6、CYP2C8、CYP2C19 酶的活性无明显变化,未能拟合出 IC50;而 CYP1A2、CYP2C9、CYP2D6、CYP3A4 的活性均有所下降,且有一定的浓度依赖趋势,但剩余酶活性均在50% 以上,其IC50分别为419.90%、97.78%、176.00%、19.42%,提示0.05%~10%的复方曲肽注射液对人肝微粒体CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP3A4 均无明显的抑制作用。
3.2 复方曲肽注射液对CYP450酶的体外诱导作用
复方曲肽注射液对人原代肝细胞中CYP1A2、CYP2B6、CYP3A4 mRNA 的诱导倍数见表4。由表4 可见,阳性诱导剂对3 个批次人原代肝细胞中CYP1A2、CYP2B6、CYP3A4 mRNA 的诱导倍数均超过2,而阴性对照组的诱导倍数均普遍低于空白对照组,表明孵育体系合格。0.05%~10%的复方曲肽注射液最多可使MHK细胞中CYP3A4 mRNA的表达增至空白对照组的4.88倍(有2个浓度点的平均诱导倍数>2),且具有浓度依赖性升高趋势;最多可使CYP1A2、CYP2B6 mRNA的表达分别增至空白对照组的3.23、4.19倍(均仅有1个浓度点的平均诱导倍数>2);0.05%~10%的复方曲肽注射液对HVN 和QBU 细胞中上述酶mRNA 的诱导倍数均低于2,说明该药对CYP3A4 mRNA 的表达具有潜在的浓度依赖性诱导作用,对CYP1A2 和CYP2B6 无明显的诱导作用[6—7]。
表4 复方曲肽注射液对人原代肝细胞中CYP1A2、CYP2B6、CYP3A4 mRNA的诱导倍数(±s,n=3)
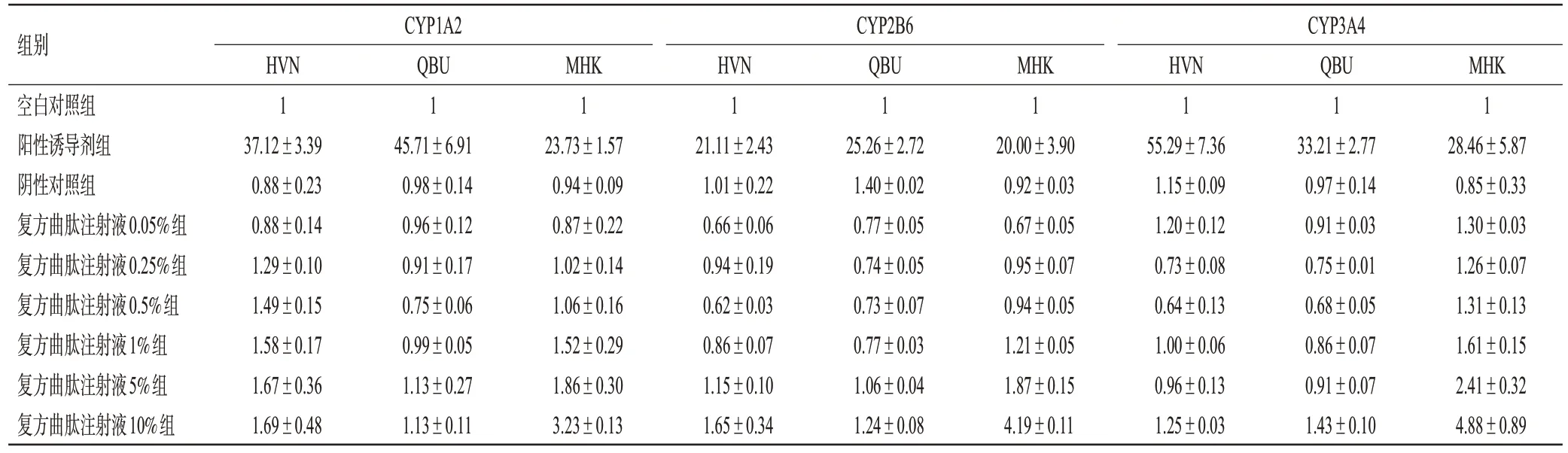
表4 复方曲肽注射液对人原代肝细胞中CYP1A2、CYP2B6、CYP3A4 mRNA的诱导倍数(±s,n=3)
CYP1A2 CYP2B6 CYP3A4组别HVN 1 37.12±3.39 0.88±0.23 0.88±0.14 1.29±0.10 1.49±0.15 1.58±0.17 1.67±0.36 1.69±0.48空白对照组阳性诱导剂组阴性对照组复方曲肽注射液0.05%组复方曲肽注射液0.25%组复方曲肽注射液0.5%组复方曲肽注射液1%组复方曲肽注射液5%组复方曲肽注射液10%组QBU 1 45.71±6.91 0.98±0.14 0.96±0.12 0.91±0.17 0.75±0.06 0.99±0.05 1.13±0.27 1.13±0.11 MHK 1 23.73±1.57 0.94±0.09 0.87±0.22 1.02±0.14 1.06±0.16 1.52±0.29 1.86±0.30 3.23±0.13 HVN 1 21.11±2.43 1.01±0.22 0.66±0.06 0.94±0.19 0.62±0.03 0.86±0.07 1.15±0.10 1.65±0.34 QBU 1 25.26±2.72 1.40±0.02 0.77±0.05 0.74±0.05 0.73±0.07 0.77±0.03 1.06±0.04 1.24±0.08 MHK 1 20.00±3.90 0.92±0.03 0.67±0.05 0.95±0.07 0.94±0.05 1.21±0.05 1.87±0.15 4.19±0.11 HVN 1 55.29±7.36 1.15±0.09 1.20±0.12 0.73±0.08 0.64±0.13 1.00±0.06 0.96±0.13 1.25±0.03 QBU 1 33.21±2.77 0.97±0.14 0.91±0.03 0.75±0.01 0.68±0.05 0.86±0.07 0.91±0.07 1.43±0.10 MHK 1 28.46±5.87 0.85±0.33 1.30±0.03 1.26±0.07 1.31±0.13 1.61±0.15 2.41±0.32 4.88±0.89
3.3 复方曲肽注射液对大鼠体内CYP450酶的影响
茶碱、安非他酮、瑞格列奈、甲苯磺丁脲、奥美拉唑、美托洛尔、咪达唑仑的主要药动学参数见表5,药-时曲线见图2。由表5、图2 可见,与对照组比较,大鼠连续10 d 尾静脉注射复方曲肽注射液后,瑞格列奈的AUC0—t、AUC0—∞分别增加了157.10%、152.43%,清除率(CL)减少了62.76%;甲苯磺丁脲的AUC0—t、AUC0—∞分别增加了43.35%、48.76%,t1/2延长了16.28%;奥美拉唑的AUC0—t、AUC0—∞分别增加了41.54%、42.54%,CL减少了29.75%,组间比较差异均有统计学差异(P<0.05);而茶碱、安非他酮、美托洛尔、咪达唑仑各药动学参数组间比较,差异均无统计学意义(P>0.05)。这说明瑞格列奈、甲苯磺丁脲和奥美拉唑在大鼠体内的代谢明显减慢;复方曲肽注射液可明显抑制CYP2C8、CYP2C9、CYP2C19 的活性,而对CYP1A2、CYP2B6、CYP2D6、CYP3A4的活性无明显影响。
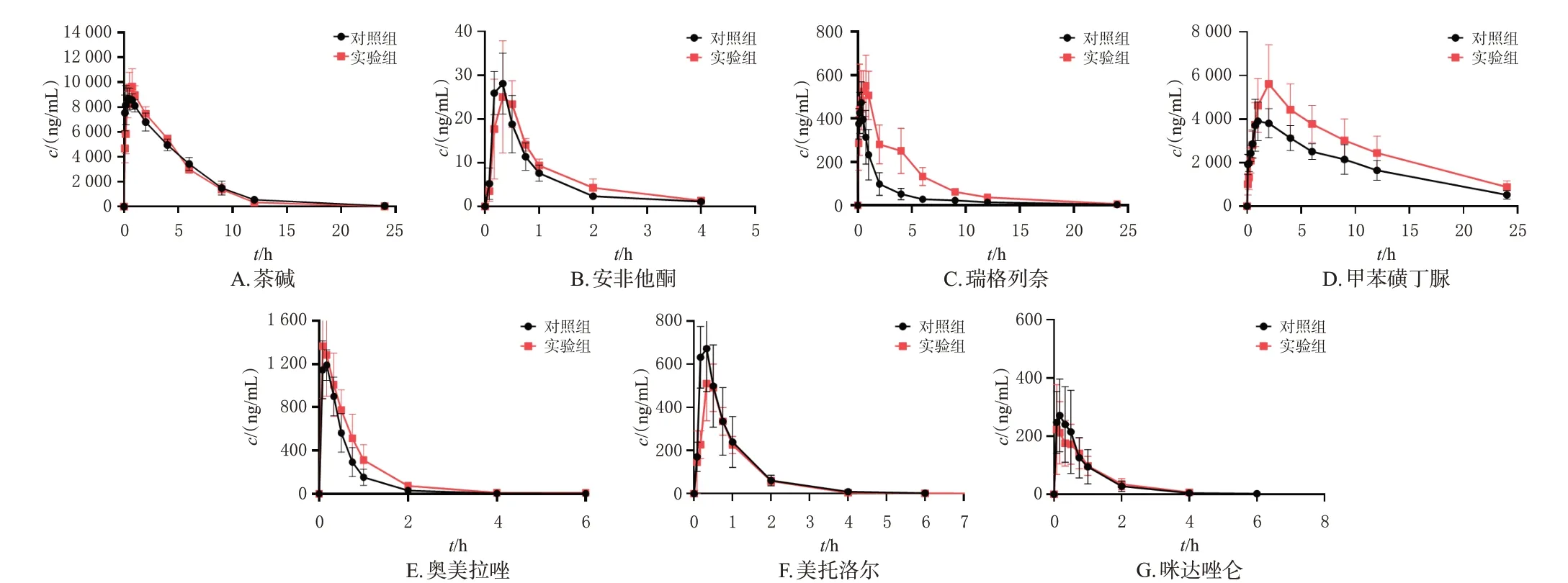
图2 茶碱等探针底物的药-时曲线(±s,n=6)
表5 茶碱等探针底物的主要药动学参数(±s,n=6)
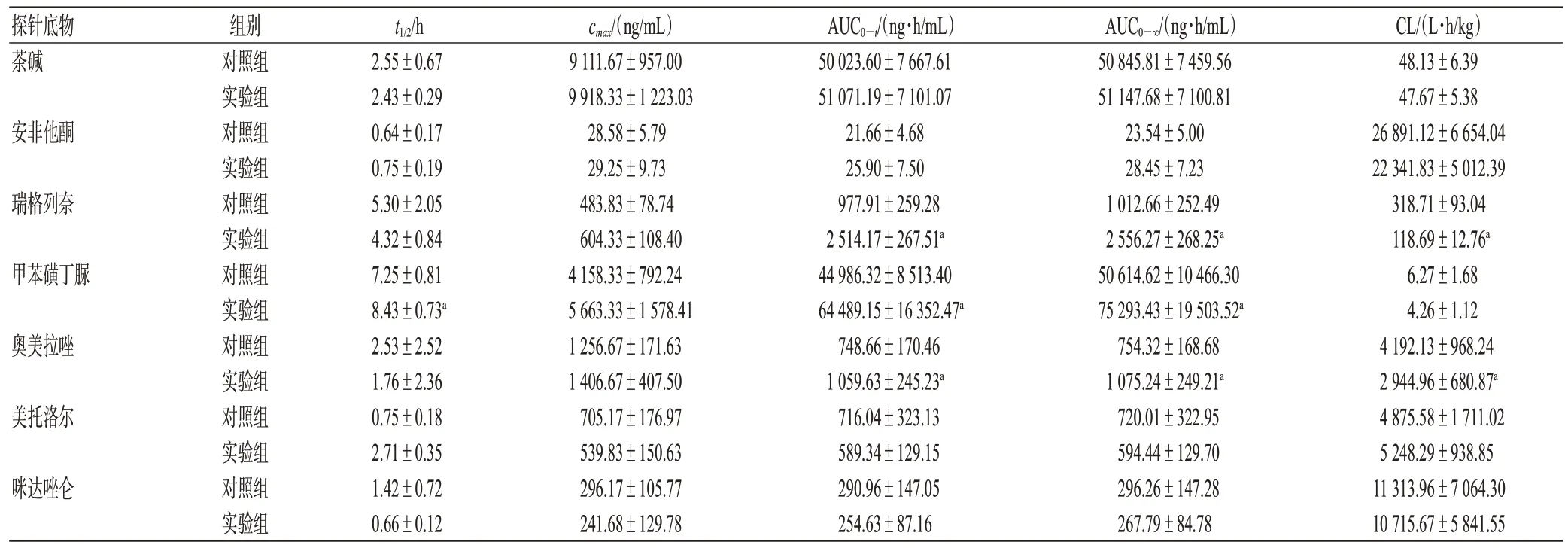
表5 茶碱等探针底物的主要药动学参数(±s,n=6)
a:与对照组比较,P<0.05。
探针底物茶碱安非他酮瑞格列奈甲苯磺丁脲奥美拉唑美托洛尔咪达唑仑组别对照组实验组对照组实验组对照组实验组对照组实验组对照组实验组对照组实验组对照组实验组t1/2/h 2.55±0.67 2.43±0.29 0.64±0.17 0.75±0.19 5.30±2.05 4.32±0.84 7.25±0.81 8.43±0.73a 2.53±2.52 1.76±2.36 0.75±0.18 2.71±0.35 1.42±0.72 0.66±0.12 cmax/(ng/mL)9 111.67±957.00 9 918.33±1 223.03 28.58±5.79 29.25±9.73 483.83±78.74 604.33±108.40 4 158.33±792.24 5 663.33±1 578.41 1 256.67±171.63 1 406.67±407.50 705.17±176.97 539.83±150.63 296.17±105.77 241.68±129.78 AUC0—t/(ng·h/mL)50 023.60±7 667.61 51 071.19±7 101.07 21.66±4.68 25.90±7.50 977.91±259.28 2 514.17±267.51a 44 986.32±8 513.40 64 489.15±16 352.47a 748.66±170.46 1 059.63±245.23a 716.04±323.13 589.34±129.15 290.96±147.05 254.63±87.16 AUC0—∞/(ng·h/mL)50 845.81±7 459.56 51 147.68±7 100.81 23.54±5.00 28.45±7.23 1 012.66±252.49 2 556.27±268.25a 50 614.62±10 466.30 75 293.43±19 503.52a 754.32±168.68 1 075.24±249.21a 720.01±322.95 594.44±129.70 296.26±147.28 267.79±84.78 CL/(L·h/kg)48.13±6.39 47.67±5.38 26 891.12±6 654.04 22 341.83±5 012.39 318.71±93.04 118.69±12.76a 6.27±1.68 4.26±1.12 4 192.13±968.24 2 944.96±680.87a 4 875.58±1 711.02 5 248.29±938.85 11 313.96±7 064.30 10 715.67±5 841.55
4 讨论
体外抑制实验是以阴性抑制剂为参照,通过在人肝微粒体中共孵育探针底物和不同体积分数的复方曲肽注射液,再通过抑制曲线的非线性拟合得到IC50值。结果显示,复方曲肽注射液对人肝微粒体中CYP1A2、CYP2C9、CYP2D6、CYP3A4 的IC50分别为419.90%、97.78%、176.00%、19.42%。复方曲肽注射液的临床用法用量为静脉滴注10 mL/d,而标准成人的循环血量为4~5 L,故在此剂量下的最大血药浓度为0.25%。该药对上述酶的IC50均显著超过0.25%,表明复方曲肽注射液在临床常用剂量范围内,与上述酶底物联用时发生相互作用的可能性较小。由于中药成分复杂,故不能像分子量明确的单体化合物以摩尔单位来表示IC50;考虑到中药注射剂直接注射入血,可准确计算出其在血液中的体积分数[10,14],故本研究以体积分数来表示IC50值。
原代肝细胞已被广泛用于预测药物对CYP450酶的潜在诱导作用,并被美国FDA批准为该领域研究的有效载体[6]。因此,本研究依据药物相互作用指导原则[6—7],采用实时荧光定量PCR 法测定复方曲肽注射液对人原代肝细胞中CYP1A2、CYP2B6、CYP3A4的诱导作用,结果显示,10% 的复方曲肽注射液对人原代肝细胞CYP3A4 mRNA表达的诱导作用为空白对照的4.88倍,且有浓度依赖趋势,表明该药对人原代肝细胞CYP3A4有潜在的诱导作用,当与CYP3A4 底物联用时,可能会影响后者的体内过程,临床应予以关注。本实验选择代谢酶mRNA的表达水平作为代谢酶诱导的评价终点,是考虑与评价酶活性相比,测定代谢酶mRNA的相对表达量更加敏感,可有助于降低CYP450 酶诱导实验假阴性的概率。
在体外实验基础上,本研究采用Cocktail 探针药物法在大鼠体内进一步验证药物对酶的影响。Cocktail探针药物法已成熟应用于药物对不同CYP450酶活性影响的研究,具有准确、经济、高通量的特点[15—16]。体内实验结果表明,复方曲肽注射液以临床等效剂量连续给药后,大鼠体内CYP2C8、CYP2C9、CYP2C19 活性被明显抑制,而CYP1A2、CYP2B6、CYP2D6、CYP3A4 活性未受明显影响。然而,体外实验并未发现复方曲肽注射液对CYP2C8、CYP2C9、CYP2C19 的抑制作用,这可能与CYP450酶的种属差异和体内外研究体系不同有关。有研究表明,在人和大鼠之间,除CYP1A具有较高的同源性外,CYP2C、CYP2D、CYP3A在分布、表达和催化活性方面均存在显著差异[17]。
综上所述,复方曲肽注射液在体外可诱导CYP3A4 mRNA 的表达,对其他酶活性及表达无明显影响;其在大鼠体内可明显抑制CYP2C8、CYP2C9 和CYP2C19 的活性,结果存在一定的种属差异。鉴于此,上述研究结果尚需临床试验进一步证实。
