紫檀芪对糖尿病性皮肤溃疡模型大鼠创面愈合的影响及机制Δ
2023-08-31刘亚坤徐会志吴彦江牛静亚李洪健张丙贵河北中医药大学研究生学院石家庄05000石家庄市中医院肛肠科石家庄050011河北北方学院附属第一医院药学部河北张家口075000河北省第八人民医院普外肛肠科石家庄0500
刘亚坤 ,李 刚 ,颜 娟 ,徐会志 ,吴彦江 ,尤 帅 ,牛静亚 ,李洪健 ,张丙贵 (1.河北中医药大学研究生学院,石家庄 05000;.石家庄市中医院肛肠科,石家庄 050011;.河北北方学院附属第一医院药学部,河北 张家口 075000;.河北省第八人民医院普外肛肠科,石家庄 0500)
糖尿病性皮肤溃疡多发于患者脚部,故又被称为糖尿病足溃疡。该症是一种严重的糖尿病并发症,其伤口难以愈合,是导致糖尿病患者截肢甚至死亡的主要原因之一。目前,糖尿病性皮肤溃疡的传统治疗方法包括药物治疗、物理治疗和手术治疗,但治疗效果均不太理想[1]。因此,开发有效的治疗方法具有重要的临床意义。
紫檀芪(pterostilbene,PTE)是白藜芦醇的甲氧基化衍生物,其所含的2个甲氧基提高了该成分的口服生物利用度;除抗氧化、抗炎和抗糖尿病活性外,PTE还具有较强的抗真菌活性(此活性为白藜芦醇的5倍)[2]。近期研究显示,PTE可通过抑制高血糖和炎症反应来加速糖尿病合并烧伤模型大鼠的创面愈合[3]。由此推测,该成分可能对糖尿病性皮肤溃疡具有一定的改善作用。
SRC是存在于细胞质中的专一性酪氨酸蛋白激酶,是Ras/Raf/胞外信号调节激酶(extracellular signalregulated kinase,ERK)、磷脂酰肌醇3-激酶/蛋白激酶B等信号通路的中枢,可影响细胞的增殖、侵袭、迁移和血管生成[4]。据报道,Ras/Raf/促分裂原活化的蛋白激酶激酶(mitogen-activated protein kinase kinase,又称MEK)/ERK 信号通路是促分裂原活化的蛋白激酶(mitogenactivated protein kinase,MAPK)通路中研究较为充分的级联反应通路,可调节细胞的生长、存活和分化等基本功能[5];SRC 和MEK/ERK 信号通路可改善皮肤的屏障功能和水合作用[6];激活的SRC/MEK/ERK 信号通路可促进全层皮肤缺损创面模型大鼠的血管生成和伤口愈合[7]。由此可见,上述信号通路对伤口愈合具有重要影响。基于此,本研究拟初步探讨PTE对糖尿病性皮肤溃疡模型大鼠创面愈合的影响及潜在作用机制,旨在为糖尿病性皮肤溃疡的治疗提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器包括HS-S7220-B型电动石蜡切片机(沈阳恒松科技有限公司)、CKX53型倒置显微镜(日本Olympus 公司)、SpectraMax iD5 型多功能酶标仪(上海美谷分子仪器有限公司)、iBright CL1500 型成像系统[赛默飞世尔科技(中国)有限公司]等。
1.2 主要药品与试剂
PTE 对照品(货号SC07256,纯度≥98%)购自北京凯诗源生物科技有限公司;PP2 对照品(SRC 抑制剂,货号HY-13805,纯度99.35%)购自美国MedChemExpress公司;链脲佐菌素(streptozotocin,STZ;货号S8050)购自北京索莱宝科技有限公司;苏木精-伊红(hematoxylin and eosin,HE)染色液(货号R20570)购自上海源叶生物科技有限公司;白细胞介素1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、血管内皮生长因子(vascular endothelial growth factor,VEGF)酶联免疫吸附测定(ELISA)试剂盒(货号分别为XY6155L、XY6156L、XY6157L、XY-SJH-3863)均购自上海烜雅生物科技有限公司;兔源SRC、磷酸化SRC(phosphorylated SRC,p-SRC)、MEK1/2、ERK1/2、p-ERK1/2 单克隆抗体和兔源甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、p-MEK1/2 多克隆抗体(货号分别为ab109381、ab185617、ab178876、ab184699、ab201015、ab9485、ab194754)均购自英国Abcam 公司;辣根过氧化物酶标记的山羊抗兔IgG二抗(货号33101ES60)购自翌圣生物科技(上海)股份有限公司;其余试剂均为分析纯。
1.3 动物
SPF级雄性SD大鼠50只,6周龄,体重(180±20)g,购自河北省实验动物中心,生产许可证号为SCXK(冀)2021-002。所有大鼠均饲养在温度24~26 ℃、相对湿度60%的动物房内。本研究方案经河北省第八人民医院医学伦理委员会审核批准,伦理审查编号为(2021)科伦审第(24)号。
2 方法
2.1 大鼠糖尿病性皮肤溃疡模型建立
所有大鼠适应性饲养1周后,随机选取10只大鼠作为对照组饲喂普通饲料;剩余40只大鼠饲喂高脂高糖饲料8 周后,禁食不禁水12 h,然后一次性腹腔注射2%STZ 30 mg/kg(以0.1 mmol/L 柠檬酸钠缓冲液为溶剂),在注射后第7天采集尾静脉血,测定其空腹血糖,若空腹血糖≥16.7 mmol/L则表明糖尿病模型建立成功[8]。对照组大鼠同法注射等体积0.1 mmol/L 柠檬酸钠缓冲液。糖尿病模型成功建立后,立即用1%戊巴比妥钠(40 mg/kg)麻醉对照组大鼠和糖尿病模型大鼠,剃除背毛并消毒,在腰椎正中偏上位置标记直径约2 cm 的圆形区域,于无菌条件下剪去该标记区域的皮肤及皮下组织(深至筋膜层),伤口用无菌纱布包裹。若糖尿病模型大鼠伤口出现感染且溃疡最大直径达1.8 cm,表明糖尿病性皮肤溃疡大鼠模型建立成功[9]。
2.2 大鼠分组与给药
将建模成功的糖尿病性皮肤溃疡模型大鼠随机分为模型组、PTE低剂量组、PTE高剂量组、PTE高剂量+PP2组,每组10只。建模结束后的第2天,PTE低、高剂量组大鼠分别腹腔注射40、80 mg/kg 的PTE[10];PTE 高剂量+PP2 组大鼠先腹腔注射80 mg/kg 的PTE 后,再腹腔注射2 mg/kg的PP2[11];对照组和模型组大鼠腹腔注射生理盐水,每天1次,连续14 d。
2.3 大鼠创面愈合率测算
分别在造模结束后第1 天和给药第7、14 天观察所有大鼠的创面愈合情况并拍照,使用Image J 软件计算创面面积并按下式计算给药第7、14天的创面愈合率:创面愈合率=(造模结束后第1天的创面面积—给药后的创面面积)/造模结束后第1天的创面面积×100%。
2.4 大鼠血清中IL-1β、IL-6、TNF-α、VEGF含量检测
给药第14天创面观察结束后,将所有大鼠用1%戊巴比妥钠麻醉,采集尾静脉血,于4 ℃下以2 000 r/min离心15 min,收集上清液,按照ELISA 试剂盒说明书方法操作,以酶标仪检测各组大鼠血清中IL-1β、IL-6、TNF-α、VEGF含量。
2.5 大鼠创面肉芽组织病理变化观察
采血结束后,将所有大鼠处死,收集每组5只大鼠的创面肉芽组织,于4%多聚甲醛中固定24 h后,制备石蜡切片。切片经二甲苯和梯度乙醇脱蜡水化后,用HE 染色,再经梯度乙醇脱水和二甲苯透明后,以中性树脂封片,使用显微镜观察各组大鼠创面肉芽组织中细胞和血管的变化。
2.6 大鼠创面肉芽组织中SRC/MEK/ERK信号通路相关蛋白表达检测
采用Western blot 法进行检测。收集每组另5 只大鼠的创面肉芽组织,于—80 ℃下保存。取上述冻存的创面肉芽组织,加入裂解液以提取总蛋白,用BCA法测定蛋白浓度后进行变性处理,然后电泳、转膜、封闭,加入SRC、p-SRC、MEK1/2、p-MEK1/2、ERK1/2、p-ERK1/2、GAPDH 一抗(稀释比例分别为1∶10 000、1∶5 000、1∶20 000、1∶500、1∶10 000、1∶1 000、1∶2 500),4 ℃孵育过夜;加入相应二抗(稀释比例为1∶500),室温孵育2 h;ECL 显色后,置于凝胶成像仪下成像。以GAPDH 为内参,使用Image J软件分析目的蛋白的表达水平,再以磷酸化蛋白与非磷酸化蛋白的表达水平比值表示目的蛋白的磷酸化水平。
2.7 统计学方法
采用GraphPad Prism 8.0 软件对数据进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。检验水准α=0.05。
3 结果
3.1 各组大鼠的创面愈合率比较
与对照组比较,模型组大鼠给药第7、14天的创面明显扩大,其愈合率均显著降低(P<0.05);与模型组比较,PTE 低、高剂量组大鼠给药第7、14 天的创面均有所缩小,其愈合率均显著升高(P<0.05);与PTE高剂量组比较,PTE 高剂量+PP2 组大鼠给药第7、14 天的创面均有所扩大,其愈合率均显著降低(P<0.05)。结果见图1(造模结束后第1天的愈合情况图略)、表1。
表1 各组大鼠的创面愈合率比较(±s,n=10,%)
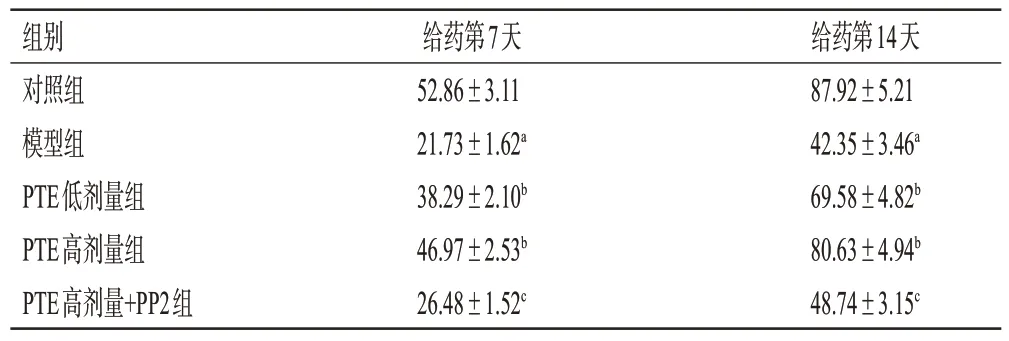
表1 各组大鼠的创面愈合率比较(±s,n=10,%)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与PTE高剂量组比较,P<0.05。
组别对照组模型组PTE低剂量组PTE高剂量组PTE高剂量+PP2组给药第7天52.86±3.11 21.73±1.62a 38.29±2.10b 46.97±2.53b 26.48±1.52c给药第14天87.92±5.21 42.35±3.46a 69.58±4.82b 80.63±4.94b 48.74±3.15c
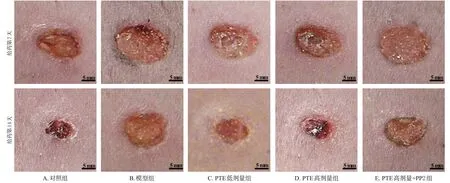
图1 各组大鼠皮肤创面的愈合情况
3.2 各组大鼠血清中IL-1β、IL-6、TNF-α、VEGF 含量比较
与对照组比较,模型组大鼠血清中IL-1β、IL-6、TNF-α 含量均显著升高,VEGF 含量显著降低(P<0.05);与模型组比较,PTE 低、高剂量组大鼠血清中IL-1β、IL-6、TNF-α 含量均显著降低,VEGF 含量均显著升高(P<0.05);与PTE高剂量组比较,PTE高剂量+PP2组大鼠血清中IL-1β、IL-6、TNF-α 含量均显著升高,VEGF含量显著降低(P<0.05)。结果见表2。
表2 各组大鼠血清中IL-1β、IL-6、TNF-α、VEGF含量比较(±s,n=10,pg/mL)
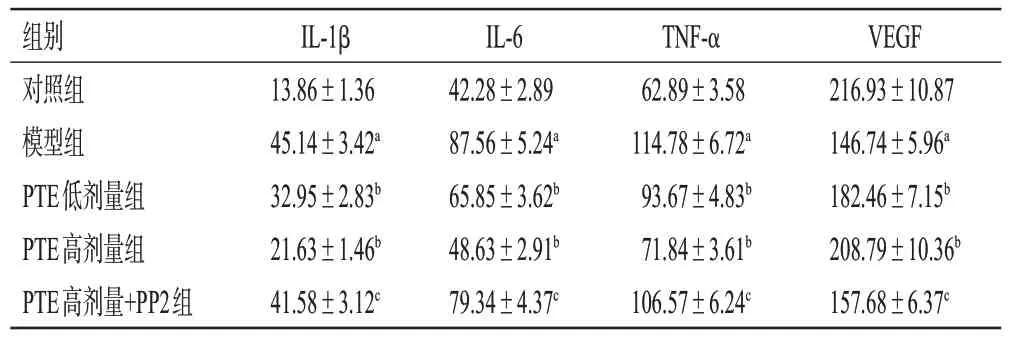
表2 各组大鼠血清中IL-1β、IL-6、TNF-α、VEGF含量比较(±s,n=10,pg/mL)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与PTE高剂量组比较,P<0.05。
VEGF 216.93±10.87 146.74±5.96a 182.46±7.15b 208.79±10.36b 157.68±6.37c组别对照组模型组PTE低剂量组PTE高剂量组PTE高剂量+PP2组IL-1β 13.86±1.36 45.14±3.42a 32.95±2.83b 21.63±1.46b 41.58±3.12c IL-6 42.28±2.89 87.56±5.24a 65.85±3.62b 48.63±2.91b 79.34±4.37c TNF-α 62.89±3.58 114.78±6.72a 93.67±4.83b 71.84±3.61b 106.57±6.24c
3.3 各组大鼠创面肉芽组织病理变化比较
对照组大鼠创面肉芽组织中有大量的新生血管,无明显的炎症细胞浸润;与对照组比较,模型组大鼠创面肉芽组织中有明显的炎症细胞浸润,新生血管数量减少;与模型组比较,PTE低、高剂量组大鼠创面肉芽组织中炎症细胞浸润减少,新生血管逐渐增多;与PTE 高剂量组比较,PTE高剂量+PP2组大鼠创面肉芽组织中炎症细胞增多,新生血管数量减少。结果见图2。
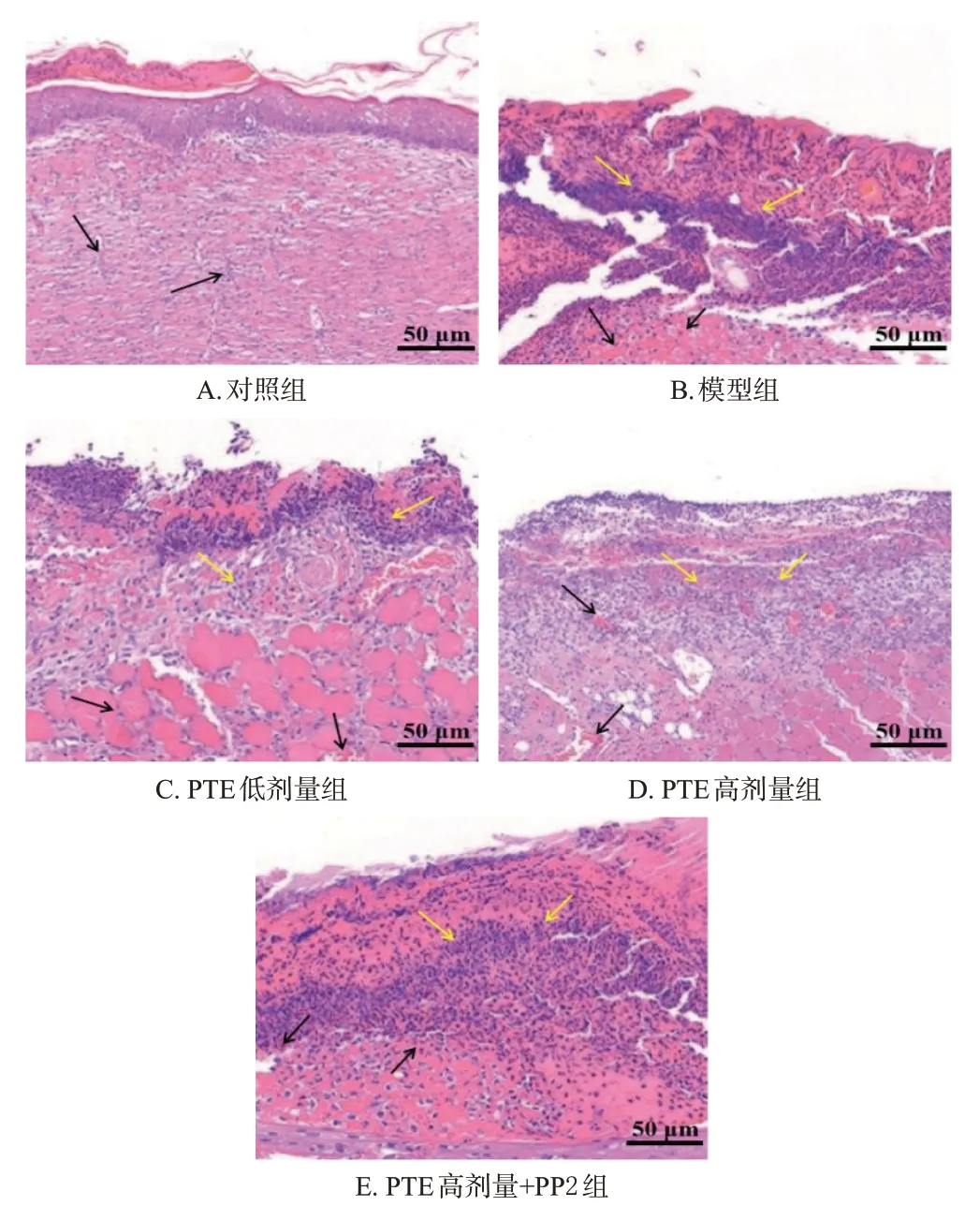
图2 各组大鼠创面肉芽组织病理变化的显微图(HE染色)
3.4 各组大鼠创面肉芽组织中SRC/MEK/ERK通路相关蛋白表达比较
与对照组比较,模型组大鼠创面肉芽组织中SRC、MEK1/2、ERK1/2 的磷酸化水平均显著降低(P<0.05);与模型组比较,PTE 低、高剂量组大鼠创面肉芽组织中SRC、MEK1/2、ERK1/2 的磷酸化水平均显著升高(P<0.05);与PTE高剂量组比较,PTE高剂量+PP2组大鼠创面肉芽组织中SRC、MEK1/2、ERK1/2 的磷酸化水平均显著降低(P<0.05)。结果见图3、表3。
表3 各组大鼠创面肉芽组织中SRC/MEK/ERK 信号通路相关蛋白磷酸化水平比较(±s,n=5)
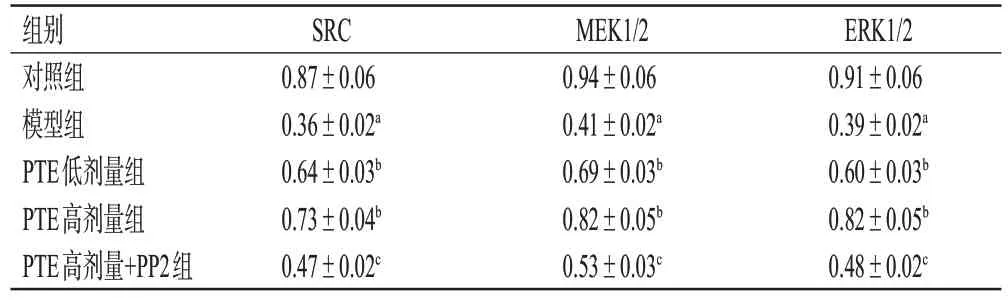
表3 各组大鼠创面肉芽组织中SRC/MEK/ERK 信号通路相关蛋白磷酸化水平比较(±s,n=5)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与PTE高剂量组比较,P<0.05。
ERK1/2 0.91±0.06 0.39±0.02a 0.60±0.03b 0.82±0.05b 0.48±0.02c组别对照组模型组PTE低剂量组PTE高剂量组PTE高剂量+PP2组SRC 0.87±0.06 0.36±0.02a 0.64±0.03b 0.73±0.04b 0.47±0.02c MEK1/2 0.94±0.06 0.41±0.02a 0.69±0.03b 0.82±0.05b 0.53±0.03c
4 讨论
糖尿病性皮肤溃疡的发病机制极其复杂,其发生可能与机体高血糖、氧化应激和炎症反应有关,其中IL-1β、IL-6、TNF-α 等炎症因子均参与了糖尿病性皮肤溃疡的发展,且与患者预后密切相关[12]。已知高血糖症与内皮功能障碍和血管生长减少有关,VEGF 是一种作用于血管内皮细胞的细胞因子,其可通过与VEGF 受体2结合来促进血管生成[8,13]。本研究先通过饲喂高糖高脂饲料并注射STZ建立糖尿病大鼠模型,随后再剪去大鼠腰椎区域的皮肤组织建立糖尿病性皮肤溃疡大鼠模型。创面观察和血清相关指标检测结果显示,模型组大鼠创面肉芽组织中有大量的炎症细胞浸润,新生血管明显减少,创面愈合率和血清中VEGF含量均较对照组显著降低,血清中IL-1β、IL-6、TNF-α 含量均较对照组显著升高;与模型组比较,PTE低、高剂量组大鼠创面肉芽组织中炎症细胞浸润减少,新生血管增多,其创面愈合率和血清中VEGF 含量均显著升高,血清中IL-1β、IL-6、TNF-α含量均显著降低,提示PTE能通过抑制炎症反应和促进新生血管生成来加速糖尿病性皮肤溃疡模型大鼠的创面愈合。
ERK1/2是MEK1/2的效应蛋白[14]。Raf是SRC的下游激酶,当Ras被SRC激活后,Raf可被募集到质膜上进行激活,同时磷酸化下游的MEK;活化的MEK 可双重磷酸化ERK,促使ERK转移到细胞核内,进一步激活多种转录因子[15]。本研究结果显示,与对照组比较,模型组大鼠创面肉芽组织中SRC、MEK1/2、ERK1/2 的磷酸化水平均显著降低;与模型组比较,PTE低、高剂量组大鼠创面肉芽组织中上述蛋白的磷酸化水平均显著升高,提示PTE 能够激活SRC/MEK/ERK 信号通路相关蛋白的表达。加入SRC 抑制剂PP2 的进一步研究发现,PP2可逆转PTE 对大鼠创面愈合和新生血管生成的促进作用,对炎症因子分泌的抑制作用,以及对SRC/MEK/ERK信号通路相关蛋白表达的激活作用,揭示了该成分对糖尿病性皮肤溃疡模型大鼠创面愈合的促进作用可能与SRC/MEK/ERK信号通路被激活有关。
综上所述,PTE能促进糖尿病性皮肤溃疡模型大鼠的创面愈合,其作用机制可能与激活SRC/MEK/ERK信号通路有关。但SRC 与MAPK 通路的级联反应机制比较复杂,因此SRC/MEK/ERK信号通路在糖尿病性皮肤溃疡治疗中的作用机制还有待更深入的研究与探索。
