水飞蓟素对神经胶质瘤的体内外抑制作用及机制Δ
2023-08-31刘熙鹏刘春江王海洋巩建青河北北方学院附属第一医院神经外科河北张家口075000
刘 明,刘熙鹏,李 淳,甄 诚,刘春江,王海洋,巩建青(河北北方学院附属第一医院神经外科,河北 张家口 075000)
胶质瘤是成人中枢神经系统常见的恶性原发性脑肿瘤[1]。神经胶质瘤是胶质瘤的常见类型之一,具有侵袭性,且患者预后不佳[2]。由于大脑中枢神经系统结构的特殊性(如存在血脑屏障),使得药物研发面临诸多挑战[2]。尽管研究者在肿瘤诊断方式和治疗策略方面取得了新的进展,但神经胶质瘤患者的病死率仍然很高[3]。因此,寻找更有效的神经胶质瘤治疗手段十分必要。
水飞蓟素(silymarin,SM)是一种多酚类黄酮,具有抗氧化、抗癌等多种生物活性[4]。据报道,SM 可抑制非小细胞肺癌细胞的增殖,促进其凋亡[5];同时,其可抑制胶质瘤皮下移植模型裸鼠体内肿瘤的生长[6]。以上研究均表明,SM具有一定的抗癌活性。相关研究显示,抑制蛋白激酶B(protein kinase B,又称Akt)/促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路可抑制胶质母细胞瘤细胞的增殖、迁移和侵袭[7];SM 可通过MAPK 信号通路来促进人肺腺癌A549 细胞的凋亡[8]。可见,Akt/MAPK信号通路可能是SM调控神经胶质瘤等肿瘤细胞增殖、凋亡的潜在途径之一。基于此,本研究拟探讨SM对人神经胶质瘤细胞增殖、凋亡及裸鼠体内移植瘤生长的影响,并通过Akt/MAPK信号通路探究其潜在作用机制,为神经胶质瘤的临床治疗提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括BPN-50CH型CO2培养箱(上海五久自动化设备有限公司)、ST-360 型酶标仪(上海科华实验系统有限公司)、FACS Calibur型流式细胞仪(美国Beckman Coulter 公司)、DYCZ-MINI 4 型四板垂直电泳仪(北京六一仪器有限公司)、CX33型显微镜(日本Olympus 公司)、EC3 型凝胶成像系统(美国UVP 公司)等。
1.2 主要试剂
SM 对照品(批号XKB0213,纯度≥98%)购自上海晅科生物科技有限公司;SC79对照品(Akt激活剂,批号HY-18749,纯度≥98%)购自美国MCE 公司;CCK-8 试剂盒(批号CK04)购自深圳市纽邦生物科技有限公司;Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒(批号CA001)购自南京莱富赛生物科技有限公司;兔源增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、B细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)、Bcl-2 相关X 蛋白(Bcl-2-associated X protein,Bax)、胱天蛋白酶3(caspase-3)、Akt、p38 MAPK、胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)、磷酸化Akt(p-Akt)、磷酸化p38 MAPK(p-p38 MAPK)、磷酸化ERK1/2(p-ERK1/2)、β-肌动蛋白(β-actin)一抗和辣根过氧化物酶(HRP)标记的羊抗兔IgG 二抗(批号分别为ab29、ab32124、ab32503、ab32351、ab8805、ab170099、ab184699、ab38449、ab178867、ab278538、ab8245、ab6721)均购自英国Abcam公司;DMEM培养基(批号MED-1001)购自武汉赛奥斯生物科技有限公司。
1.3 细胞与动物
人神经胶质瘤细胞系U87(批号CL-0238)购自武汉益普生物科技有限公司。
SPF 级雄性BALB/c 裸鼠(30 只,5 周龄,体重约20 g)购自湖南斯莱克景达实验动物有限公司,生产许可证号为SCXK(湘)2019-0017。所有裸鼠均饲养于温度(23±3)℃、相对湿度(40±10)%、12 h 光照/12 h 黑暗交替的动物房内,自由摄食、饮水。本动物实验方案获得河北北方学院附属第一医院医学伦理委员会审核通过(批件号W2022013)。
2 方法
2.1 体外细胞实验
2.1.1 细胞培养与分组
将U87细胞接种于含10%胎牛血清、1%青霉素-链霉素的DMEM 培养基中,于37 ℃、5%CO2条件下培养,每3 d更换1次培养基。取对数生长期细胞,随机分为对照组(NC组)、低质量浓度SM组(SM-L组)、中质量浓度SM 组(SM-M 组)、高质量浓度SM 组(SM-H 组)、Akt 激活剂组(SC79 组)、高质量浓度SM 联合Akt 激活剂组(SM-H+SC79 组)。参考相关文献[9—10]及前期预实验结果设置各药物组质量浓度:SM-L 组、SM-M 组、SM-H组、SC79 组细胞分别用50、100、200 μg/mL 的SM 和20 μmol/L 的SC79 处理48 h;SM-H+SC79 组细胞用200 μg/mL的SM和20 μmol/L的SC79共同处理48 h;NC组细胞不经任何药物处理,正常培养48 h。
2.1.2 细胞增殖检测
采用CCK-8 法进行检测。取对数生长期细胞,按1×104个/孔接种于96 孔板中,按照“2.1.1”项下方法分组(每组设置6 个复孔)、处理。随后,每孔加入CCK-8试剂10 μL,于37 ℃下孵育1 h,采用酶标仪于450 nm波长处检测各孔的光密度(OD)值,用以反映细胞的增殖能力。
2.1.3 细胞克隆形成能力检测
采用克隆形成实验进行检测。取对数生长期细胞,按600 个/孔接种于6 孔板中,按照“2.1.1”项下方法分组(每组设置6 个复孔)、处理后,培养14 d。收集各组细胞,用甲醇固定,再以0.1%结晶紫染色,用磷酸盐缓冲液(PBS)洗涤后,使用显微镜观察其克隆形成情况并计算克隆形成率:细胞克隆形成率=平均细胞克隆数/每孔接种细胞总数×100%。
2.1.4 细胞凋亡检测
采用流式细胞术进行检测。取对数生长期细胞,按1×105个/孔接种于6 孔板中,按照“2.1.1”项下方法分组(每组设置6个复孔)、处理。收集各组细胞,用PBS洗涤后,按Annexin Ⅴ-FITC/PI 细胞凋亡检测试剂盒说明书方法进行染色,于37 ℃下避光孵育30 min后,采用流式细胞仪检测细胞凋亡率。
2.1.5 细胞中增殖/凋亡相关蛋白和Akt/MAPK 信号通路相关蛋白表达检测
采用Western blot 法进行检测。取对数生长期细胞,按1×104个/孔接种于96孔板中,按照“2.1.1”项下方法分组(每组设置6 个复孔)、处理。收集各组细胞,用RIPA裂解液裂解以提取总蛋白。蛋白经定量、电泳、转膜、封闭后,加入增殖/凋亡相关蛋白(PCNA、Bax、Bcl-2、caspase-3)、Akt/MAPK 信号通路相关蛋白(Akt、p-Akt、p38 MAPK、p-p38 MAPK、ERK1/2、p-ERK1/2)、内参蛋白(β-actin)的一抗(稀释比例分别为1∶1 000、1∶2 000、1∶1 000、1∶2 000、1∶2 000、1∶2 000、1∶2 000、1∶2 000、1∶2 000、1∶1 000、1∶1 000),于4 ℃下孵育过夜;洗膜后,加入相应二抗(稀释比例为1∶2 000),于室温下孵育1.5 h;再次洗膜后,加入ECL 试剂显色并使用凝胶成像系统成像。使用Image J 软件分析蛋白条带灰度值,以PCNA、Bax、Bcl-2、caspase-3 与内参蛋白的灰度值比值表示上述蛋白的表达水平,以p-Akt 与Akt、p-p38 MAPK 与p38 MAPK、p-ERK1/2 与ERK1/2 的灰度值比值分别表示Akt、p38 MAPK、ERK1/2 蛋白的磷酸化水平。
2.2 体内异种移植瘤实验
取U87细胞悬液(200 μL含细胞1×105个),皮下注射至BALB/c裸鼠的右侧腋窝内,当移植瘤体可触及(约接种后7 d)时,将裸鼠随机分为对照组(裸鼠NC组)、低剂量SM 组(裸鼠SM-L 组)、中剂量SM 组(裸鼠SM-M组)、高剂量SM 组(裸鼠SM-H 组)、Akt 激活剂组(裸鼠SC79 组)、高剂量SM 联合Akt 激活剂组(裸鼠SM-H+SC79组),每组5只。参考相关文献[9,11]及前期预实验结果设置各药物组剂量:裸鼠SM-L 组、裸鼠SM-M 组、裸鼠SM-H 组裸鼠分别灌胃25、50、100 mg/kg 的SM,同时腹腔注射等体积生理盐水;裸鼠SC79 组裸鼠腹腔注射40 mg/kg 的SC79,同时灌胃等体积生理盐水;裸鼠SMH+SC79 组裸鼠灌胃100 mg/kg 的SM,同时腹腔注射40 mg/kg 的SC79;裸鼠NC 组裸鼠灌胃并腹腔注射等体积生理盐水,每天1 次,连续28 d。末次给药24 h 后,以颈椎脱臼处死各组裸鼠,切除瘤体并称定质量,以游标卡尺测量并计算瘤体体积:瘤体体积=[0.5×(a+b)]3(式中,a、b分别为肿瘤的长径、短径)。
2.3 统计学方法
使用SPSS 18.0软件对数据进行统计分析。数据以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。检验水准α=0.05。
3 结果
3.1 体外细胞实验结果
3.1.1 SM对细胞增殖和克隆形成能力的影响
与NC 组比较,SM-L 组、SM-M 组、SM-H 组细胞的OD 值、克隆形成率均显著降低且有浓度依赖性(P<0.05),SC79 组细胞的OD 值、克隆形成率均显著升高(P<0.05);与SM-H 组比较,SM-H+SC79 组细胞的OD值、克隆形成率均显著升高(P<0.05)。结果见表1、图1。

图1 各组细胞克隆形成情况比较
表1 各组细胞OD 值、克隆形成率、凋亡率比较(±s,n=6)
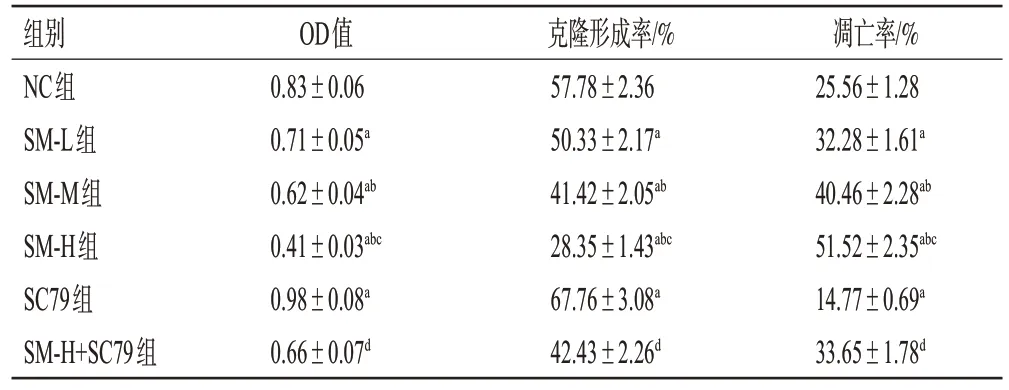
表1 各组细胞OD 值、克隆形成率、凋亡率比较(±s,n=6)
a:与NC组比较,P<0.05;b:与SM-L组比较,P<0.05;c:与SM-M组比较,P<0.05;d:与SM-H组比较,P<0.05。
凋亡率/%25.56±1.28 32.28±1.61a 40.46±2.28ab 51.52±2.35abc 14.77±0.69a 33.65±1.78d组别NC组SM-L组SM-M组SM-H组SC79组SM-H+SC79组OD值0.83±0.06 0.71±0.05a 0.62±0.04ab 0.41±0.03abc 0.98±0.08a 0.66±0.07d克隆形成率/%57.78±2.36 50.33±2.17a 41.42±2.05ab 28.35±1.43abc 67.76±3.08a 42.43±2.26d
3.1.2 SM对细胞凋亡的影响
与NC 组比较,SM-L 组、SM-M 组、SM-H 组细胞的凋亡率均显著升高且有浓度依赖性(P<0.05),SC79 组细胞的凋亡率显著降低(P<0.05);与SM-H 组比较,SM-H+SC79组细胞的凋亡率显著降低(P<0.05)。结果见表1、图2。
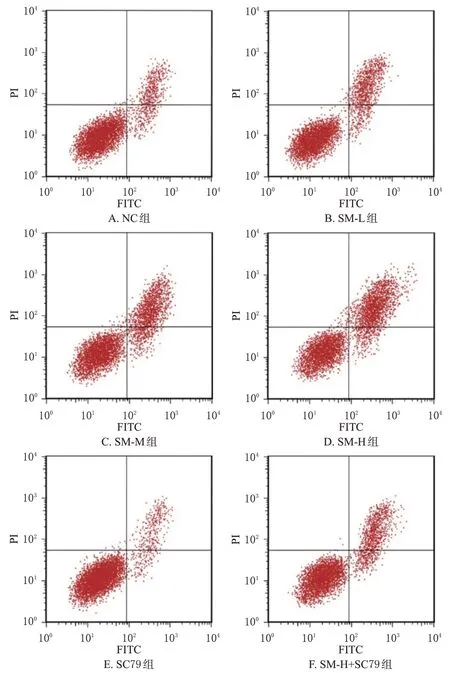
图2 各组细胞凋亡情况比较
3.1.3 SM对细胞中增殖/凋亡相关蛋白表达的影响
与NC 组比较,SM-L 组、SM-M 组、SM-H 组细胞中PCNA、Bcl-2蛋白的表达水平均显著降低,Bax、caspase-3 蛋白的表达水平均显著升高,且均有浓度依赖性(P<0.05);SC79组细胞中PCNA、Bcl-2蛋白的表达水平均显著升高,Bax、caspase-3 蛋白的表达水平均显著降低(P<0.05)。与SM-H 组比较,SM-H+SC79 组细胞中PCNA、Bcl-2 蛋白的表达水平均显著升高,Bax、caspase-3 蛋白的表达水平均显著降低(P<0.05)。结果见图3、表2。
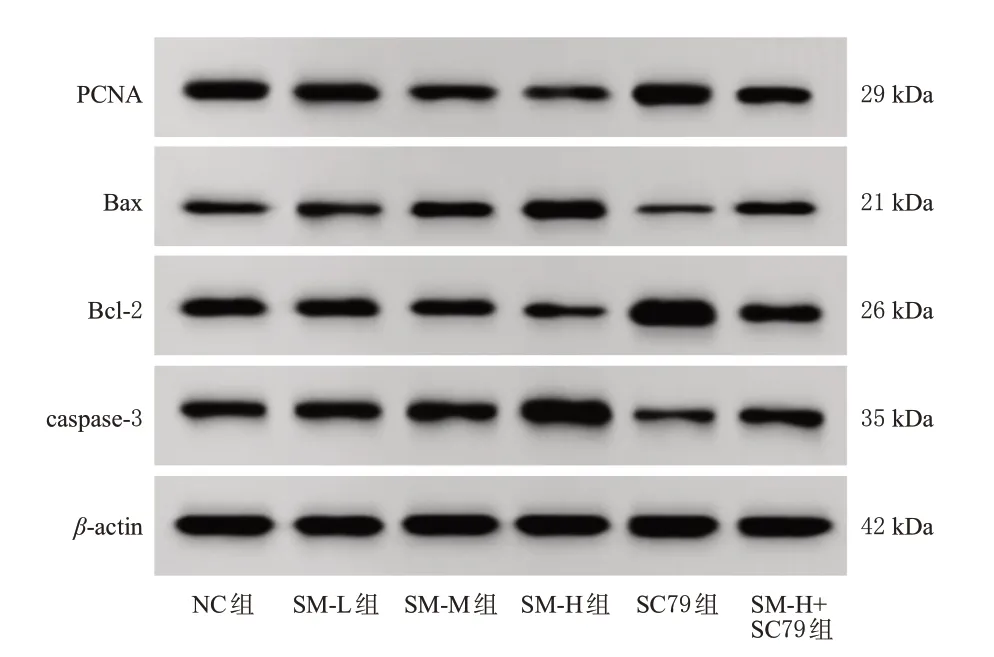
图3 各组细胞中增殖/凋亡相关蛋白表达的电泳图
表2 各组细胞中增殖/凋亡相关蛋白表达水平比较(±s,n=6)
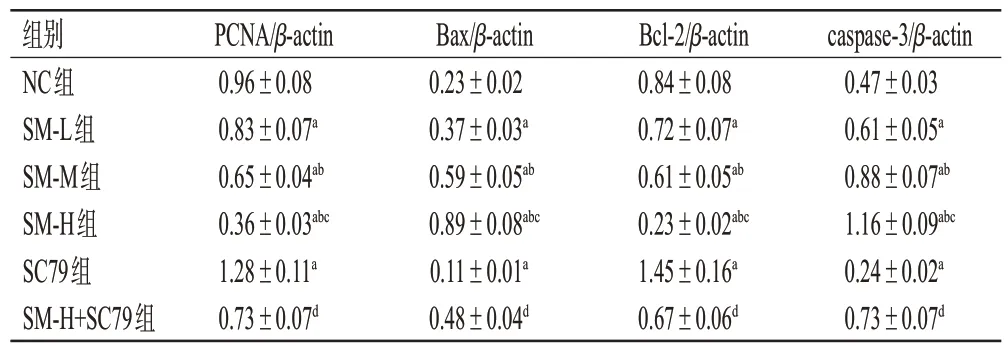
表2 各组细胞中增殖/凋亡相关蛋白表达水平比较(±s,n=6)
a:与NC组比较,P<0.05;b:与SM-L组比较,P<0.05;c:与SM-M组比较,P<0.05;d:与SM-H组比较,P<0.05。
caspase-3/β-actin 0.47±0.03 0.61±0.05a 0.88±0.07ab 1.16±0.09abc 0.24±0.02a 0.73±0.07d组别NC组SM-L组SM-M组SM-H组SC79组SM-H+SC79组PCNA/β-actin 0.96±0.08 0.83±0.07a 0.65±0.04ab 0.36±0.03abc 1.28±0.11a 0.73±0.07d Bax/β-actin 0.23±0.02 0.37±0.03a 0.59±0.05ab 0.89±0.08abc 0.11±0.01a 0.48±0.04d Bcl-2/β-actin 0.84±0.08 0.72±0.07a 0.61±0.05ab 0.23±0.02abc 1.45±0.16a 0.67±0.06d
3.1.4 SM对细胞中Akt/MAPK信号通路相关蛋白表达的影响
与NC 组比较,SM-L 组、SM-M 组、SM-H 组细胞中Akt、p38 MAPK、ERK1/2蛋白的磷酸化水平均显著降低且有浓度依赖性(P<0.05),SC79 组细胞中Akt、p38 MAPK、ERK1/2 蛋白的磷酸化水平均显著升高(P<0.05);与SM-H 组比较,SM-H+SC79 组细胞中Akt、p38 MAPK、ERK1/2 蛋白的磷酸化水平均显著升高(P<0.05)。结果见图4、表3。

图4 各组细胞中Akt/MAPK 信号通路相关蛋白表达的电泳图
表3 各组细胞中Akt/MAPK 信号通路相关蛋白表达水平比较(±s,n=6)
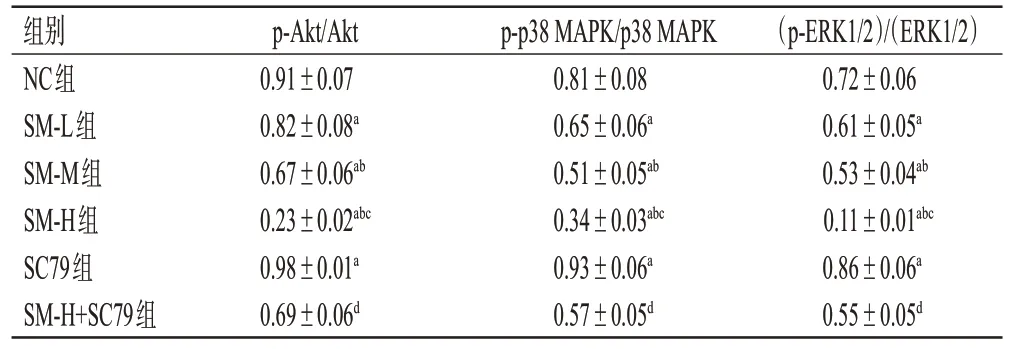
表3 各组细胞中Akt/MAPK 信号通路相关蛋白表达水平比较(±s,n=6)
a:与NC组比较,P<0.05;b:与SM-L组比较,P<0.05;c:与SM-M组比较,P<0.05;d:与SM-H组比较,P<0.05。
组别NC组SM-L组SM-M组SM-H组SC79组SM-H+SC79组p-Akt/Akt 0.91±0.07 0.82±0.08a 0.67±0.06ab 0.23±0.02abc 0.98±0.01a 0.69±0.06d p-p38 MAPK/p38 MAPK 0.81±0.08 0.65±0.06a 0.51±0.05ab 0.34±0.03abc 0.93±0.06a 0.57±0.05d(p-ERK1/2)/(ERK1/2)0.72±0.06 0.61±0.05a 0.53±0.04ab 0.11±0.01abc 0.86±0.06a 0.55±0.05d
3.2 体内异种移植瘤实验结果
与裸鼠NC组比较,裸鼠SM-L组、裸鼠SM-M组、裸鼠SM-H 组裸鼠体内瘤体的质量及体积均显著降低/减小且有剂量依赖性(P<0.05),裸鼠SC79 组裸鼠体内瘤体的质量及体积均显著升高/增大(P<0.05);与裸鼠SM-H组比较,裸鼠SM-H+SC79组裸鼠体内肿瘤的质量及体积均显著升高/增大(P<0.05)。结果见图5、表4。

图5 各组裸鼠体内肿瘤生长情况比较
表4 各组裸鼠体内瘤体质量及体积比较(±s,n=5)

表4 各组裸鼠体内瘤体质量及体积比较(±s,n=5)
a:与裸鼠NC组比较,P<0.05;b:与裸鼠SM-L组比较,P<0.05;c:与裸鼠SM-M组比较,P<0.05;d:与裸鼠SM-H组比较,P<0.05。
瘤体体积/mm3 95.83±4.26 85.42±4.11a 66.67±3.26ab 43.75±2.01abc 108.33±4.83a 77.08±2.86d组别裸鼠NC组裸鼠SM-L组裸鼠SM-M组裸鼠SM-H组裸鼠SC79组裸鼠SM-H+SC79组瘤体质量/g 0.46±0.03 0.41±0.04a 0.32±0.03ab 0.21±0.02abc 0.52±0.04a 0.37±0.03d
4 讨论
胶质瘤作为中枢神经系统最重要的原发性肿瘤,有多种亚型。临床实践显示,即使采用了积极的治疗策略(放疗和术后化疗),弥漫性胶质瘤患者生存期短的问题仍未得到解决[12]。可见,为了有效控制恶性肿瘤的进展、扩散、转移,改善患者的预后,开发新的胶质瘤治疗药物具有重要意义。
SM 是一种黄酮木脂素类活性成分,可通过诱导细胞凋亡来抑制不同肿瘤细胞系的生长。据报道,SM 可诱导子宫内膜癌细胞凋亡,并可抑制肝癌细胞系MHCC97 增殖[13—14],提示该成分有一定的抗肿瘤作用。研究指出,PCNA 对肿瘤细胞DNA 的复制至关重要,其表达水平越高表明细胞的增殖能力越强[15]。Bax、Bcl-2、caspase-3 可用于评估细胞的凋亡能力:Bax 可单独形成同源二聚体,从而促进细胞凋亡;Bcl-2、Bax与细胞凋亡密切相关,降低Bcl-2 蛋白表达、增强Bax 蛋白表达,可诱导细胞发生凋亡;此外,Bax能促使细胞色素C释放并转移至线粒体,激活caspase-3,而活化的caspase-3 可损伤核内DNA,最终导致细胞凋亡[16]。本研究结果显示,SM 可浓度依赖性地抑制U87 细胞的增殖和克隆形成,并促进其凋亡;同时,该成分可浓度依赖性地上调细胞中Bax、caspase-3 蛋白的表达,下调PCNA、Bcl-2 蛋白的表达,表明SM对人神经胶质瘤细胞有明显的抑制作用,有望成为神经胶质瘤治疗的候选药物。此外,本研究还发现,SM 可剂量依赖性地抑制异种移植瘤裸鼠的肿瘤生长,初步证实了SM对神经胶质瘤的体内抑制作用。
Akt/MAPK 信号通路是经典的肿瘤相关信号通路,其异常激活与胶质瘤细胞的恶性行为有关[17]。已有研究指出,激活MAPK 信号通路可增强卵巢癌细胞的增殖、迁移等能力[18];抑制Akt信号通路活化可抑制胃癌细胞的体外增殖[19]。这表明Akt/MAPK信号通路参与了多种肿瘤的恶性进展。本研究结果显示,与NC 组比较,SC79 组U87 细胞中Akt、p38 MAPK、ERK1/2 蛋白的磷酸化水平均显著升高,细胞增殖、克隆形成能力均显著增强,凋亡能力有所减弱,裸鼠体内瘤体质量及体积均显著升高/增大,表明Akt/MAPK信号通路参与了U87细胞的增殖、凋亡及裸鼠体内的肿瘤生长过程,与文献报道结果[18—19]基本一致。此外,本研究还发现,SM可抑制细胞中Akt/MAPK信号通路相关蛋白的表达,且呈剂量依赖性,推测该成分对U87 细胞增殖、凋亡及裸鼠体内肿瘤生长的影响可能与抑制Akt/MAPK信号通路有关。
为了验证上述作用机制,本研究在高质量浓度/高剂量SM 的基础上联合Akt 激活剂SC79 对U87 细胞及移植瘤裸鼠进行干预,结果显示,SC79 减弱了SM 对细胞增殖、克隆形成及裸鼠体内移植瘤生长的抑制作用,同时也减弱了SM 对细胞凋亡的促进作用,表明SM 可能通过抑制Akt/MAPK信号通路来发挥上述作用。
综上,SM 可能通过抑制Akt/MAPK 信号通路来促进U87 细胞的凋亡,抑制细胞的增殖、克隆形成及异种移植瘤裸鼠体内肿瘤的生长。但SM对神经胶质瘤的抑制作用可能还涉及其他通路,有待后续进一步研究。
