两种处理对西洋参根际土壤理化性质及真菌群落的影响
2023-08-28舒瑜蒋景龙陈德经李丽董艳鑫
舒瑜 蒋景龙 陈德经 李丽 董艳鑫

摘要:本试验通过西洋参根水提液(CT)和连作4年西洋参土壤浸提液(ST)定期浇灌西洋参幼苗,研究两种处理对西洋参幼苗生长及土壤理化性质和真菌群落的影响。结果表明,与CK组相比,CT和ST组死苗率明显升高;CT组碱解氮和速效钾含量、转化酶和脲酶活性显著上升,pH值和铵态氮含量均显著下降,ST组pH值和速效磷、铵态氮含量显著下降,碱解氮含量显著上升。利用Illumina Miseq测序,共获得高质量序列768 262条,PCA分析显示3组样品真菌结构存在显著差异。与CK组相比,CT组和ST组Cha01指数和ACE指数下降,Shannon指數和Simpson指数升高。在门水平,被孢霉门(MortierellomycoIa)、子囊菌门(AscomycoIa)、壶菌门(ChyIridiomycota)和担子菌门(Basidiomycota)为3组样品中的差异菌门。两处理明显抑制了西洋参幼苗的生长,并导致根际土壤理化性质和真菌群落的变化,为进一步阐明西洋参连作障碍产生机理提供了依据。
关键词:西洋参;连作障碍;微生物群落;土壤理化性质;高通量测序
中图分类号:S567.5+3:S1544 文献标识号:A 文章编号:1001-4942(2023)02-0084-08
西洋参(Panaa; quinquefofiw L)别名美国花旗参,五加科多年生草本植物,有“绿色黄金”之称,原产于美国和加拿大。20世纪80年代引入中国,并逐渐在陕西留坝、山东威海和东北吉林等地大规模栽培。目前西洋参栽培时连作障碍问题极其严重,导致西洋参生长不良,严重减产。连作障碍是指同一块耕地不能连续种植相同作物的现象,主要与土壤理化性质的改变、化感自毒作用和土壤微生物的区系变化三大因素有关,且三者之间相互影响。半夏随其重茬次数增多,可溶性蛋白增加,土壤全氮、全磷和碱解氮含量降低,微生物群落结构趋于简单,且致病菌增多,有益菌减少。根际微生物菌群的组成可对植物生长发育产生影响,植物亦能通过调节pH值、土壤养分和根系结构来塑造它们自己的根际微生物群落。真菌是土壤微生物中种类和数量最多的类群之一,在与植物互作方面发挥着一定的生态作用,有些真菌可以分解植物残渣,为植物提供营养:有些真菌会引起植物病害,影响植物生长。不同年限的植物根际微生物结构也有差异,且微生物数量随种植时间而降低。土壤中微生物种类复杂且大多数不能在条件培养基上生长,末端限制性片段长度多态性分析(T-RFIP)、变性梯度凝胶电泳(DGGE)、单链构象多态性分析(SSCP)以及实时定量PCR等传统研究土壤微生物群落多样性和组成的方法不足以获取全面的微生物群落信息。随着方法的进步,高通量测序技术已经成为分析微生物类群更全面、更准确、灵敏度更高的工具。袁源等采用高通量测序技术研究连作覆土下灵芝(Ganoderma lucidum,Karst)真菌群落变化,发现随着连作年限的增加,真菌多样性逐年降低。Miao等对2年生健康三七(Panax notoginseng)的根际真菌群落进行高通量测序分析,发现接合菌属和子囊菌属为优势菌群。
董艳鑫等证明西洋参根水提液和重茬土壤浸提液对西洋参种子萌发及幼苗生理存在显著影响,表明其中可能存在某些化感物质可影响土壤微生物的类群、数量和植物自身生长发育。很多学者研究表明,相对于西洋参水提液的化感作用,土壤浸提液更接近植物实际环境。从植物一土壤一微生物三者关系来探讨作物连作障碍已经成为一个新的研究思路和重要发展趋势。因此,本研究分析了西洋参水提液和西洋参土壤浸提液对西洋参幼苗、根际土壤理化性质以及根际土壤真菌群落的影响,以期为缓解西洋参连作障碍提供有效策略。
1材料与方法
1.1采样与材料处理
2019年11月5日于陕西省留坝县火烧店镇墩墩石村西洋参种植基地(33°57′N,106°86′E)进行采样,海拔1100 m。在连续种植西洋参4年的地块采用“五点采样法”采集土壤(土壤深度18-20 cm)和4年生健康西洋参,置于冰盒中用于土壤浸提液和西洋参根水提液的制备。清洗后的西洋参放入4℃冰箱保存,土壤样品过2 mm筛后置于阴凉处自然风干。西洋参种子购自留坝县西洋参研究所。营养土购自申之北有机土店,为长白山营养有机土,有机质≥30%,pH值为4.8-6.5,执行标准为Q/SZB001-2018。
1.2西洋参根水提液及土壤浸提液制备
称取4年生西洋参50.0 g,打碎后加0.2 L蒸馏水,混匀,超声提取1h后浸泡过夜,用4层纱布过滤2次,所得滤液在7 000 r/min下离心10min,取上清液将其稀释至0.10 g/mL,4℃低温贮藏待用。称取500 g已过筛且风干的土壤,加入1L蒸馏水,混匀后超声提取1h,浸泡过夜,用滤纸过滤得0.50 g/mL土壤浸提液,4℃低温贮藏待用。西洋参根水提液及其土壤浸提液在使用前121℃灭菌20 min,以排除病原菌影响。
1.3西洋参根水提液及其土壤浸提液对西洋参幼苗的处理
选取露白2 mm且状态健康的西洋参种子,播种到无菌营养土中,每盆(31.5 cm×24.5 cm×9.5 cm) 40粒。分别使用蒸馏水(CK)、土壤浸提液(ST)和西洋参根水提液(GT)浇灌西洋参幼苗,一周浇液3次,每次300 mL,每个处理4个重复,在昼/夜温度为24℃/21℃、光照/黑暗为12h/12 h的培养间培养西洋参幼苗。90 d后收集待测土壤,过1 mm筛,一份放置阴凉处风干,用于理化性质及酶活性测定:一份保存于-80℃冰箱,用于土壤真菌检测。
1.4土壤理化性质及酶活性测定
配制土:水为1:2.5(w/v)的溶液,充分振荡3min后静置30 min,用pH计测定pH值;采用高智能土壤养分检测仪YT-TR01(山东云唐智能科技有限公司)测定土壤碱解氮(AN)、铵态氮(AMN)、速效磷(AP)、速效钾(AK)、有机质(OM)含量;参照关松萌的方法,采用紫外分光光度法测定过氧化氢酶(CAT)活性,采用3,5-二硝基水杨酸比色法测定土壤转化酶(INV)活性,采用比色法测定土壤脲酶(URE)活性,采用磷酸苯二钠比色法测定土壤磷酸酶(PHO)活性。
1.5土壤基因组DNA提取和PCR扩增
按照TIANamp Soil DNA Kit(TIANGEN BIO-TECH)试剂盒说明书提取土壤微生物基因组DNA,利用琼脂糖凝胶电泳检测DNA纯度和浓度。将基因组DNA用超纯水稀释,用含有Bar-code的特异引物F(5_CITGGTCA,ITTAGAG_GAAGTAA-3)和R(5-GCTGCGTTCITCATCGAT-GC-3)扩增ITSl-1F区域。PCR反应体系:PHu-sion@ High-Fidelity PCR Master Mix 15 uL,模板DNA 2 uL,F、R引物(10 umol/L)各1UL,ddH20补足至30 uL。反应程序:98℃预变性1 min;98℃变性10 s,50℃退火30 s,72℃延伸30 s,30个循环:最后72℃延伸5 min。用2%琼脂糖凝胶电泳检测PCR产物,使用Qiagen公司的胶回收试剂盒对目的条带进行回收。
1.6文库构建和上机测序
使用TruSeq DNA PCR-Free Sample Preparation Kit建库试剂盒构建文库,随后经过Qubit和Q-PCR定量,检验合格后,使用NovaSeq 6000进行上机测序。委托北京诺禾致源科技股份有限公司完成。
1.7生物信息学分析
采用余妙等的方法基于Illumina NovaSeq测序平台对该文库进行双末端测序(Paired_End)及后续分析。
1.8数据处理
利用Microsoft Excel 2010软件处理数据,使用SPSS 22.0进行试验数据分析。
2结果与分析
2.1两种处理对西洋参幼苗及土壤参数影响
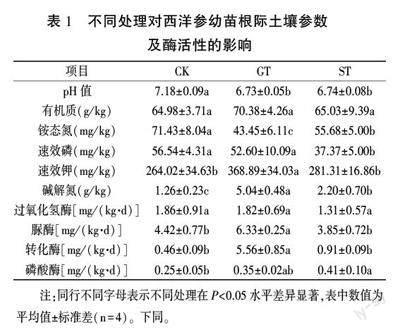
CK、GT、ST组西洋参幼苗在播种14 d后达到最大出苗率,分别为98.33%、88.33%、82.50%,继续处理后,GT组和ST组西洋参幼苗逐渐死亡。第45天时,GT组和ST组西洋参幼苗死苗率达到74.58%和64.59%(图1),分别是CK组的4.38倍和3.77倍,表明西洋参水提液及其土壤浸提液明显抑制西洋参幼苗的生长。
由表1可知,GT和ST处理组的pH值和铵态氮含量较CK组均显著下降,其中GT组和ST组pH值分别下降0.45和0.44,表明两种处理下的土壤有酸化趋势:GT组和ST组中碱解氮含量显著升高,分别为CK组的4.00倍和1.75倍:GT组中速效钾含量显著升高,为CK组的1.40倍:ST组中速效磷含量显著下降,表明两种处理对西洋参幼苗根际土壤理化性质有显著影响。与ST组相比,GT组铵态氮含量显著降低21.96%:速效磷、速效钾、碱解氮含量显著升高,分别升高40.75%、31.13%和129.09%。
GT组中转化酶和脲酶活性显著高于CK组,分别为CK组的12.09倍和1.43倍,过氧化氢酶和磷酸酶活性无明显变化,表明GT组土壤有利于西洋参对营养物质和氮的吸收:而ST组与CK组相比酶活性变化较小。与ST组相比,GT组转化酶和脲酶活性显著升高,分别为ST组的6.11倍和1.64倍,过氧化氢酶和磷酸酶活性无显著变化。
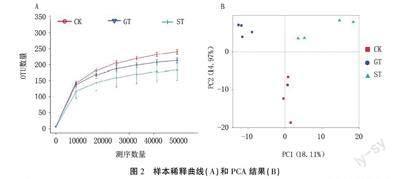
2.2真菌菌群测序深度及PCA分析
由图2A可知,12个样品的稀释曲线均趋于平坦,表明测序量趋于饱和,更多的测序对产生新的OTU数目影响较小。图2B为基于OTU水平的PCA图,PC1和PC2分别代表18.11%和14.97%的真菌群落变化,3组样品能够被明显分开,且每组样品都有组内聚集现象,表明不同处理的样品真菌群落结构差别明显,同组样品真菌群落构成差异较小。ST组与CK组和GT组的距离均较近,但CK组与GT组距离较远,说明ST组与CK组和GT组分别具有较高的真菌群落相似性。
2.3真菌菌群多样性分析
通过对高通量测序结果除杂等质控步骤后,CK组、GT组、ST组分别得到拼接序列85 318、86 957、75 112条,去除嵌合体序列得到有效序列分别为67 796、64 733、59 536条,有效率分别为79.46%、74.44%及79.26%。根据97%序列相似度进行水平聚类,CK组、GT组、ST组中各包含OTU数目为393、321、319个,3组样品中共有OTU数为212个,CK组、GT组、ST组特有的OTU分别为93、47、61个,GT组和ST组共有OTU数目最少,为223个,表明GT组与ST组物种丰度差异较大。Chao 1指数和ACE指数用来表示土壤样品中真菌群落物种总数,指数越大代表物種种类越多。CK组Cha01指数和ACE指数最高,为264.48和273.93,分别为GT组和ST组的1.12、1.40倍和1.16、1.41倍(表2)。Shannon指数和Simpson指数综合反映土壤真菌群落的丰富度和均匀度,其指数越大代表均匀度和多样性越高。CK组Shannon指数和Simpson指数最低,为3.68和0.86,3组真菌群落均匀度为CK组
2.4真菌组成及差异菌群分析
使用相对丰度柱形累加图比较3组样品在门和属水平的物种组成。图3A为3组样品在门水平最大丰度排名前10的物种,子囊菌门(Ascomy-cota)为3组样品中的优势菌群,占真菌总数的63.77%-86.53%,其次为被孢霉门(Morlierellomy-cota.0.74%-21.32%)、壶菌门(ChyUidiomycota,0.06%-5.81%)、隐真菌门(Rozellomycota,0.04%-4.80%)、担子菌门(Basidiomycota,0.07%-3.57%)和球囊菌门(Glomeromycota,0.02%-1.13%),其中被孢霉门和担子菌门在GT组中最高,分别占15.01%和2.30%;隐真菌门在ST组中最高,占2.12%:CK组中壶菌门、担子菌门、隐真菌门和球囊菌门丰度最低,均小于0.02%。梳霉门(Kickx-ellomycota)为ST组中特有菌门,但丰度最高仅为0.06%,捕虫霉门(Zoopagomycota)仅在CK组中出现,丰度不到0.01%。表明3组样品在门水平具有显著的物种丰度差异。
在属水平上3组样品总共得到173个真菌类群,图3B为丰度前10的物种,3组中优势菌属为镰刀菌属(Fusarium,23.99%-29.20%)、Gilmamella属(8.06%-37.43%)、短梗蠕孢属(Trichocladium.4.75%-8.57%)、被孢霉属(Mortierella.1.74%-8.70%)和毛壳菌属(Chaetoraium,2.65%-4.77%),其中CK组和ST组中Gilmaniella属和毛壳菌属丰度明显高于GT组,分别升高364.14%和356.67%,而镰刀菌属和被孢霉属明显低于GT组,分别降低21.90%、35.82%和56.86%、80.00%;ST组短梗蠕孢属丰度显著高于CK组和GT组,分别提高80.52%和28.75%;未鉴别属(3.41%)和被孢霉目中未鉴别属(2.90%)是GT组优势属,且明显高于CK组和ST组:Cladorrhinum,属(2.67%)和隐真菌门中未鉴别属(2.11%)是ST组优势属,其丰度显著高于CK组和GT组。表明在属水平3组样品物种丰度具有显著差异。
为了进一步探究3组真菌群落在门和属水平的结构关系,寻找组间的差异物种,利用MetaStat方法计算组间的物种丰度,发现在门水平上有4个差异物种(图4A)。CK组和ST组子囊菌门丰度显著高于GT组:担子菌门和被孢霉门丰度GT组显著或极显著高于CK组和ST组:壶菌门丰度ST组显著高于GT组(P<0.05),极显著高于CK组(P<0.01)。由图4B可知,属水平上有3个差异物种。CK组的Gilmaniella属丰度极显著高于GT组:被孢霉目未鉴别属和被孢霉科未鉴别属在GT组中丰度最高,均显著高于ST组,CK组和ST组中均无显著差异。
2.5土壤理化性质与真菌的关联分析
采用Spearman相关系数(Spearman's
rank correlation coemcients)研究土壤理化性质与微生物物种之间的相互变化关系。如图5所示,土壤pH值与曲霉属(Aspergillus,0.79)和周刺座霉属(Volutella,0.82)呈极显著正相关,而与木霉属(Trichoderma,-0.81)和Cladorrhinum属(-0.74)呈极显著负相关(P<0.01):铵态氮可显著抑制Cybedindnera属(-0.74)和未鉴别属(-0.88)真菌生长(P<0.01);速效磷含量与曲霉属(0.68)、彼得壳属(0.58)和被孢霉属(0.64)呈显著正相关,与球囊菌门未鉴别属(-0.76)、隐真菌门未鉴别属(-0.64)和Cladorrhinum,属(-0.77)呈显著或极显著负相关(P<0.05);速效钾能极显著促进担子菌门未鉴别属(0.73)、被孢霉目未鉴别属(0.80)、头梗霉属(0.84)、未鉴别属(0.78)真菌的生长,抑制Cilmanietla属(-0.83)生长(P<0.01);碱解氮含量和土壤转化酶活性导致的真菌变化规律基本一致,极显著促进木霉属(0.73)和未鉴别属(0.83)真菌生长(P<0.01):土壤脲酶活性與被孢霉属呈极显著正相关(P<0.01),与锥盖伞属(-0.60)呈显著负相关(P<0.05);土壤磷酸酶活性增加导致隐真菌门未鉴别属(0.83)极显著增多(P<0.01),周刺座霉属(-0.79)极显著减少(P<0.01)。以上结果表明,土壤理化性质和酶活性与土壤真菌密切相关。
3讨论与结论
土壤理化性质是植物正常发育的关键,植物分泌的物质会影响土壤理化性质。本研究发现,与CK组相比,GT组显著降低了铵态氮含量,显著提高了速效钾和碱解氮含量,ST组中铵态氮和速效磷含量显著降低,而碱解氮含量显著提高。王兴飞等研究发现,使用凤丹(Paeonia ostil)根际土壤浸提液浇灌玉米幼苗显著降低了根际土壤中全氮、全磷和有机碳含量:张冉用种植过西洋参1至4年的土壤水提液分别浇灌未种植过西洋参的土壤,发现4年生参龄土壤处理的新土中铵态氮和有机质含量显著提高,而速效磷含量显著降低,与本研究结果相似。土壤铵态氮、速效钾和速效磷能够被植物吸收利用,其含量下降不利于植物生长,碱解氮是衡量土壤氮素的重要指标,而两种处理下的碱解氮含量均升高,可能是由于两种水提液中的有机质高于蒸馏水,也可能是两种水提液中的某些物质影响微生物,进而提高了碱解氮含量。
土壤酶活性与土壤物质的转化密切相关,植物浸提液对土壤酶活性具有显著影响。张冉使用种植西洋参4年的土壤水提液浇灌新土,发现新土中土壤转化酶活性升高,过氧化氢酶、碱性磷酸酶和脲酶活性降低:孙雪婷等发现三七连作能显著降低其栽培土壤中蔗糖酶、过氧化氢酶、磷酸酶和脲酶活性。在本研究中,ST处理组相比于CK组碱性磷酸酶活性显著升高,过氧化氢酶、转化酶和脲酶活性没有显著变化:GT组中转化酶和脲酶活性显著升高,过氧化氢酶和磷酸酶活性没有显著变化。张亚玉等测定不同连作时长的西洋参土壤酶活性发现,相比于未种植过西洋参的土壤,种植4年西洋参的土壤过氧化氢酶和脲酶活性显著升高。本研究中两种处理均改变了上述酶活性,可能是由于两种水提液中的代谢物质直接作用于土壤酶,也可能是水提液影响了土壤理化性质和微生物结构,间接影响酶活性。
药用植物分泌代谢物质到土壤中通常会引起原本微生物种类和数量的改变。一定浓度的阿魏酸、香草酸和丁香酸等酚酸类化合物能促进西洋参立枯丝核菌和根腐菌生长:焦晓林等发现4-40 mg/mL皂苷提取液能显著抑制立枯丝核菌、尖孢镰刀菌、毁灭柱孢菌生长(P<0.05)。本研究对不同处理下土壤微生物群落组成结构的变化进行分析发现,与CK组相比,ST和GT组处理后的西洋参幼苗根际土壤真菌群落多样性降低,组成结构发生明显变化。在门水平上,子囊菌门在3组中分布最广泛。与CK组相比,GT组处理显著降低了西洋参幼苗根际土壤中子囊菌门数量,而被孢霉门、壶菌门和担子菌门丰度显著上升(P<0.05);ST组处理的西洋参幼苗根际土壤中,壶菌门和担子菌门丰度明显升高(P<0.05),这与袁源等研究发现灵芝随着连作年限的增加,子囊菌门显著减少,担子菌门显著增加的结果相似。由此可知,西洋参中存在某些代谢物质显著抑制了子囊菌门的生长,而西洋参和西洋参连作土壤中含有的某些物质有利于被孢霉门、壶菌门和担子菌门真菌的生长。以往研究认为,镰刀菌属真菌是导致西洋参患病的主要病原菌,通过高通量测序发现在属水平上,镰刀菌属在3组中广泛分布,其中,GT组丰度最高,是CK组丰度的1.28倍。此外,与CK组和ST组相比,GT组中Gilmamelta属真菌显著降低(P<0.05),被孢霉科未鉴别属和被孢霉目未鉴别属真菌显著升高(P<0.05),与唐彬彬等发现被孢霉属真菌随着三七连作年限增加而减少的结果相反,这可能与西洋参中的甾类化合物有关。以上结果表明,西洋参在种植过程中,分泌的代谢物质影响了土壤微生物群落构成,进而影响西洋参生长发育。
土壤微生物作为根际微生态系统的主要构成,不仅与植物类型有关,与土壤理化性质同样紧密联系。有学者研究发现,Sphingobacterium的丰度与pH值(R2=0.856、P<0.05)和速效钾含量显著相关(R2=-0.65、P<0.05);Helotiales(R2=0.53,P<0.01)、Hypocreales(R2=0.63,P<0.01)的丰度与土壤pH值显著相关;Sordariomycete的丰度与有效磷含量相关。本研究结果表明,西洋参幼苗根际土壤真菌群落结构受西洋参水提液及其连作土壤浸提液影响,其变化与土壤理化性质密切相关。曲霉属、周刺座霉属和Cladorrhinum属等真菌与pH值显著相关;土壤养分与Cybedindnera属、Gilmanielta属和赤霉菌属等真菌显著相关:土壤酶活性与木霉属和被孢霉属等真菌显著相关。该结果表明,土壤微生物群落变化与土壤理化性质的改变息息相关,优化土壤理化性质可缓解西洋参的连作障碍。
综上所述,西洋参水提液及其连作土壤浸提液能够抑制西洋参的生长,并改变西洋参幼苗根际土壤的理化性质和真菌群落多样性。研究结果为西洋参连作障碍发生和机理的认识奠定了基础。
