基于“苦坚肾”理念对黄柏改善糖尿病肾病足细胞损伤的机制研究*
2023-08-28王锁刚马继伟
赵 丽,王锁刚,马继伟,浩 飞
(河南中医药大学第一附属医院,河南 郑州 450000)
糖尿病肾病(diabetes nephropathy,DN)是糖尿病患者最严重的并发症之一,也是造成糖尿病患者死亡的主要原因[1]。DN的组织病理学改变包括肾小管间质纤维化、肾小管炎性浸润、肾小球硬化等[2],其中肾小球硬化可致肾小球滤过功能损伤。足细胞在维持肾小球滤过膜通透性方面起到重要作用,其数目与结构的完整性是肾小球滤过作用正常的基础,足细胞数目、形态、功能一旦出现异常会引起肾小球滤过屏障损伤而致肾小球滤过率降低,继而引起蛋白尿,并诱发肾损伤,推动DN疾病进展[3]。临床研究[4]表明:高糖环境可对肾小球滤过膜造成直接与间接损伤,可导致足细胞数目减少并从基底膜脱落。残余的足细胞为覆盖基底膜会出现足突增宽、代偿性肥大等变化,继而增加肾小球滤过膜通透性并诱发蛋白尿,引起肾功能损伤。可见,维持足细胞功能与数目的稳定性是防治DN进展的有效手段。黄柏的主要活性成分为生物碱,其中盐酸小檗碱(berberine hydrochloride,BBR)含量最高。大量临床研究均证实了BBR能够有效减轻蛋白尿,延缓DN疾病进展[5-7],但其对足细胞的影响尚无明确定论。本次研究观察黄柏BBR对高糖诱导下小鼠足细胞的保护作用,以期探讨其改善DN足细胞损伤的作用机制。
1 材料与方法
1.1 细 胞
小鼠肾小球足细胞,购自北纳创联生物技术研究院,BNCC 337685。
1.2 药品、试剂与仪器
黄柏BBR,由安徽省立医院药学实验室提供,RP-HPLC法检测纯度≥95%。精密称取40.365 g BBR粉末,加入生理盐水10 mL,加热至BBR完全溶解,配制成1.2×104μmol/L的储备液,采用0.22 μm无菌过滤器过滤后分装保存,使用前溶解稀释至所需倍数。 RPMI 1640培养液,美国赛默飞世尔科技公司产品,批号11875;小鼠重组γ干扰素,美国派普泰克公司产品,批号315-05-100;胎牛血清,以色列生物工业公司产品,批号202005152;四甲基偶氮唑盐(MTT)粉末,美国西格玛奥德里奇公司产品,批号175252;Annexin V-FITC/PI双染试剂盒,南京诺唯赞生物科技有限公司产品,批号A211-02;辣根过氧化物酶标记的山羊抗鼠二抗、辣根过氧化物酶标记的山羊抗兔二抗,美国派普泰克公司产品,批号SA00001-1、SA00001-2;磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(Akt)、磷酸化蛋白激酶B(p-Akt)、叉头框蛋白01(FOX01)、磷酸化叉头框蛋白01(p-FOX01)单克隆抗体,美国艾博抗公司产品,批号4249、4691S、4060S、2880、9461;抗肾病蛋白(nephrin)、足突蛋白(podocin)、结蛋白(desmin)、Bcl-2相互作用细胞死亡介体(Bim)蛋白多克隆抗体,美国圣克鲁斯公司产品,批号bs-1026R、sc-21009、ab-136894、sc-20235。FC500型流式细胞仪,美国贝克曼·库尔特公司产品;Elx×808型多功能酶标仪,美国伯腾仪器有限公司产品;BX53型倒置显微镜,日本奥林巴斯公司产品;DYY-10型电泳仪,北京六一仪器厂产品;LAS4000 mini型化学发光成像分析仪,美国通用公司产品。
1.3 细胞培养
将冻存的小鼠足细胞置于37 ℃水浴复苏,RPMI 1640培养液加入100 mL/L胎牛血清、10 g/L双抗、2 g/L γ干扰素,将细胞转至培养瓶内加入配制好的RPMI 1640培养液,置于CO2细胞培养箱内,在37 ℃、50 mL/L CO2条件下进行培养。隔天换液,待细胞长满75%~80%时进行传代培养。在33 ℃、50 mL/L CO2条件下进行培养,待细胞长满约30%时转入37 ℃、50 mL/L CO2条件下进行培养,加入RPMI 1640培养液(不含γ干扰素)进行细胞分化,隔天换液。10~14 d细胞分化成熟,可用于后续实验。
1.4 检测指标
1.4.1 足细胞增殖
采用MTT法检测。 取指数生长期小鼠足细胞,调整细胞密度并接种于96孔板,每孔200 μL(约104个细胞)。将获得的小鼠足细胞分为正常组(5.5 mmol/L葡萄糖)、模型组(30 mmol/L葡萄糖)、不同浓度BBR组(30 mmol/L葡萄糖+BBR 30、60、90 μmol/L)。干预24 h后,每孔加入10 μL 5 g/L MTT溶液,孵育4 h,弃除上清液,每孔加入150 μL DMSO,震荡10 min。采用酶标仪检测各孔490 nm处吸光值并计算细胞存活率。
1.4.2 足细胞凋亡
采用Annexin V-FITC/PI双染色法检测。 小鼠足细胞分组、干预方式同1.4.1,消化离心收集(1~5)×105个细胞,悬浮于500 μL 稀释5倍的结合缓冲液,加入10 μL PI和5 μL Annexin V-FITC溶液,混匀后室温条件下避光孵育5 min,采用流式细胞仪检测细胞凋亡率。
1.4.3 足细胞迁移能力
采用Transwell小室法检测。 24孔板内放置Transwell小室,其中加入RPMI 1640培养基(含100 mL/L 胎牛血清),分别给予高糖刺激与不同浓度BBR干预,加入RPMI 1640培养基(含10 mL/L 胎牛血清)配制成单细胞悬液,并接种在Transwell小室,每孔约2×104个细胞,培养箱内培养24 h。将Transwell小室取出,PBS漂洗后采用结晶紫染色,用棉签将未迁移至Transwell上室的细胞轻轻擦去,采用倒置显微镜观察小鼠足细胞迁移情况。每个样本各取5个视野计数。
1.4.4 足细胞黏附作用
采用细胞黏附实验检测。 足细胞传代消化后,分组及干预方法同1.4.1。96孔板采用Ⅰ型鼠尾胶原铺板,再将足细胞种在96孔板内(每孔约1×105个细胞)。大部分细胞贴壁后弃除培养液,未贴壁细胞用PBS洗去。配制枸橼酸缓冲液(2.5 g/L Triton X-100+3.75 mmol/L己糖激酶),每孔60 μL加入培养孔内,37 ℃下孵育1 h,加入甘氨酸缓冲液(含5 mmol/L依地酸二钠),每孔60 μL(pH值调整为10.4),测定405 nm处吸光值,并以正常组吸光值为参考计算足细胞黏附能力。
1.4.5 足细胞标志蛋白desmin、nephrin、podocin及PI3K/Akt/FOX01/Bim信号通路蛋白表达水平
采用Western blot检测。取对数生长期细胞,分组及干预方法同1.4.1。将足细胞种于6孔板(每孔1×108个细胞),处理24 h后加入预冷的PBS洗涤去除杂质与死细胞,加入预冷的RIPA裂解液100 μL,冰面上静置30 min。收集细胞,离心取上清液,加入蛋白上样缓冲液,沸水煮沸5 min,在SDS-PAGE凝胶上上样,完成凝胶电泳、转膜、封闭等操作;加入蛋白抗体孵育过夜,TPBS洗膜,加入一抗,放入4 ℃冰箱内孵育过夜;次日TPBS漂洗,加入二抗,37 ℃孵育2 h,ECL显色,进行灰度分析评估desmin、nephrin、podocin、PI3K、p-Akt、p-FOX01、Bim蛋白表达水平。
1.5 统计学分析
2 结 果
2.1 BBR对高糖损伤足细胞增殖的影响
与正常组对比,模型组足细胞存活率下降,差异有统计学意义(P<0.05)。与模型组对比,3个BBR组的足细胞存活率升高,差异有统计学意义(P<0.05)。表明BBR可以提高足细胞存活率。见表1。
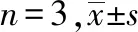
表1 各组足细胞存活率对比
2.2 BBR对高糖损伤足细胞凋亡的影响
与正常组对比,模型组足细胞凋亡率升高,差异有统计学意义(P<0.05)。与模型组对比,3个BBR组的足细胞凋亡率降低,差异有统计学意义(P<0.05)。表明BBR可以降低足细胞凋亡率,且表现出浓度依赖性。见表2、图1。

注:FITC和PI荧光作双参数散点图,细胞分为4个区,左上象限为机械性损伤细胞,左下象限为活细胞,右上象限为凋亡晚期细胞或坏死细胞,右下象限为早期凋亡细胞。

表2 各组足细胞凋亡率对比
2.3 BBR对高糖损伤足细胞迁移能力的影响
与正常组对比,模型组迁移至Transwell下室的足细胞数量增加,差异有统计学意义(P<0.05)。与模型组对比,3个BBR组的足细胞迁移数量减少,差异有统计学意义(P<0.05)。表明BBR可以减少迁移至Transwell下室足细胞数量(P<0.05)。见表3、图2。
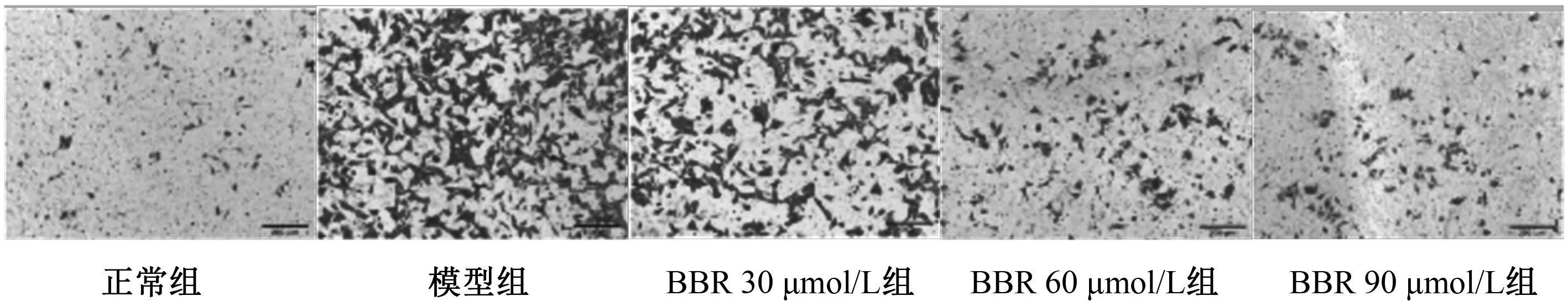
图2 各组足细胞迁移能力对比(结晶紫染色,×200)

表3 各组足细胞迁移数量对比
2.4 BBR对高糖损伤足细胞黏附作用的影响
与正常组对比,模型组黏附细胞百分数降低,差异有统计学意义(P<0.05)。与模型组对比,3个BBR组的黏附细胞百分数升高,差异有统计学意义(P<0.05)。表明BBR提高足细胞黏附能力,且呈现浓度依赖性。见表4。

表4 各组足细胞黏附能力对比
2.5 BBR对高糖损伤足细胞标志蛋白表达的影响
与正常组对比,模型组足细胞desmin蛋白表达上调,nephrin、podocin蛋白表达下降,差异有统计学意义(P<0.05)。与模型组对比,60、90 μmol/L BBR 组的标志蛋白表达水平均改善,差异有统计学意义(P<0.05)。表明BBR可以显著下调desmin蛋白表达水平,提高nephrin、podocin蛋白表达水平。见表5、图3。

注:1-5依次为正常组,模型组,BBR 30、60、90 μmol/L组

表5 各组足细胞标志蛋白表达水平对比
2.6 BBR对高糖损伤足细胞相关蛋白表达水平的影响
与正常组对比,模型组足细胞PI3K、p-Akt、Bim蛋白表达水平上调,p-FOX01蛋白表达水平下降,差异有统计学意义(P<0.01)。与模型组对比,3个BBR组的足细胞相关蛋白表达水平均改善,差异有统计学意义(P<0.05)。表明BBR可以上调p-FOX01蛋白表达水平,降低PI3K、p-Akt与Bin蛋白表达水平。见表6、图4。
注:1-5依次为正常组,模型组,BBR 30、60、90 μmol/L组

表6 各组足细胞相关蛋白表达水平对比
3 讨 论
高血糖是引起足细胞损伤的重要原因之一。在高糖诱导作用下足细胞凋亡,而足细胞凋亡发生后又会通过复杂机制诱导剩余的足细胞发生凋亡,从而形成恶性循环,推动DN疾病进展。郭维文等[8]通过研究发现:高糖环境可以诱导足细胞发生凋亡,且凋亡率随着高糖诱导时间增长而增加。可见高糖诱导足细胞凋亡是一个缓慢的病理过程,机体难以通过自我调节的方式抑制该病理过程的进展。研究证明,BBR具有良好的降糖作用,可以通过调控多元醇活化、氧化应激反应、机体血糖水平等途径减轻肾功能损伤[9]。郭维文等[8]发现BBR可以对高糖损伤的足细胞起到保护作用,有效抑制足细胞凋亡,从而延缓DN疾病进展,故推测BBR的药理作用可能与调节某种信号通路有关。
高雪等[10]发现,芪地糖肾颗粒可以抑制细胞外调节蛋白激酶信号通路,从而降低大鼠尿白蛋白水平,减轻DN足细胞损伤。曹璐璐等[11]研究发现,疏利三焦法可以抑制转化生长因子-β(TGF-β)/Smad信号通路激活,起到抑制足细胞凋亡、延缓DN疾病进展的作用。可见,各种信号通路诱导足细胞凋亡是导致DN进展的主要原因。本研究发现,高糖刺激下,小鼠足细胞PI3K、p-Akt、Bim蛋白表达水平上调(P<0.05),p-FOX01蛋白表达水平下降(P<0.05)。FOXO家族是具有调节细胞分化、代谢反应、细胞周期、糖尿病并发症等作用的调节蛋白,FOX01是可以调控细胞增殖、凋亡等过程的重要转录因子。刘青等[12]研究发现,FOX01蛋白表达水平受到PI3K/Akt信号通路磷酸化级联调节,p-FOX01表达水平上调将减少FOX01核转位并抑制凋亡基因Bim表达,Bim表达水平下调使细胞凋亡受到抑制。加入BBR干预后,高糖损伤足细胞p-FOX01蛋白表达水平显著上调,PI3K、p-Akt蛋白表达水平显著下降,提示BBR对PI3K/Akt信号通路起到调节作用,通过PI3K/Akt/FOX01/Bim信号通路下调凋亡基因Bim表达水平从而抑制足细胞凋亡。裂孔隔膜由nephrin、podocin等足细胞相关蛋白分子组成,与足突共同组成肾小球滤过屏障的关键部分[13]。马冰沁等[14]研究发现,肾小球发生病理变化时可引起如nephrin、podocin等裂孔隔膜蛋白表达异常,继而影响足细胞正常功能,引起蛋白尿。汤志奇等[15]指出,上调足细胞nephrin、podocin表达水平可以有效保护肾脏,对DN起到治疗效果。本次研究表明,高糖损伤会导致nephrin、podocin蛋白表达水平显著下降,与上述学者研究结果一致。采用BBR干预后,小鼠足细胞nephrin、podocin蛋白表达水平出现不同水平上调,提示肾小球滤过屏障功能得到修复,可以有效改善蛋白尿,延缓DN疾病进展。desmin是肌源性细胞标志物,正常情况下足细胞无明显表达,足细胞受损时由于足细胞骨架重新排列desmin表达水平会显著上调[16-17]。本研究表明,高糖诱导可显著上调小鼠足细胞desmin表达水平,采用BBR干预可以有效降低小鼠足细胞desmin表达水平,提示BBR可以减轻足细胞损伤并改善足细胞功能。此外,本研究还发现,在BBR干预下小鼠足细胞增殖能力与黏附作用显著改善,细胞凋亡率及迁移能力显著下降,推测BBR通过PI3K/Akt/FOX01/Bim信号通路等途径抑制足细胞凋亡,从而提高肾小球滤过屏障功能,继而改善蛋白尿等症状并延缓DN疾病进展。
《素问·脏气法时论篇》云:“肾欲坚,急食苦以坚之。”《珍珠囊》云:“苦能燥,能坚。”故而衍生出“苦能坚阴”之说。其含义为苦寒药物可以通过泻火起到存阴的作用,其中“坚阴”指“坚肾阴”[18-19]。《得配本草》曰:“以黄柏补水,以其能清自下泛上之阴火……不妨用苦寒者除之。”历代医家都认为:黄柏等苦寒药物可祛除火邪,使阴液不耗,间接起到滋阴之效,而非滋补肾阴[20-21]。阴伤由火热亢盛所致,故凡温热病切忌早用甘寒而宜于苦寒。《静香楼医案》云:“阴不足者,阳必上亢而内燔……徒恃清凉无益也。”《医学心悟·治法八论》曰:“大抵清火之药……必归本于滋阴。”可见欲使阴得坚,需苦寒清热药截断火热-阴伤的病理循环[22]。当前“苦坚阴”理论在临床中应用广泛,多用于治疗虚火偏旺、阴虚阳亢等证。大量临床研究证实DN病位在肾脏[23-24],其主要特征是蛋白尿大量排泄,继而出现肾功能损伤,加之糖尿病患者始终存在肾虚症状,故而认为DN发病原因在于肾气不固。DN属中医学“肾消”“肾劳”等范畴[25],中医证型演变规律为阴虚燥热-脾肾气虚-阴阳两虚[26],黄柏祛除火邪、坚固肾阴之效与之相契合。本课题从中医学经典理论“内热”出发,将“苦坚肾”理论作为切入点,以苦味中药黄柏作为代表药物,以其有效成分BBR进行体外实验,验证BBR对足细胞损伤的保护作用,并结合西医学理论,分析BBR改善DN的作用机制。研究结果表明:BBR可以有效减轻高糖诱导引起的足细胞损伤,减少足细胞凋亡并改善足细胞黏附功能,故推测黄柏通过“苦坚肾”改善DN足细胞损伤。
综上所述,BBR能减少小鼠足细胞凋亡,延缓DN疾病进展,推测与其符合“苦坚肾”的特征、能调节PI3K/Akt/FOX01/Bim信号通路有关。
