过表达veA基因对冠突散囊菌次级代谢的影响
2023-08-26王云胜陈银翠程在张锦张传博
王云胜, 陈银翠, 程在, 张锦, 张传博
(贵州师范大学生命科学学院,贵阳 550025)
丝状真菌次生代谢产物具有极强的活性成分,是天然药物分子的重要来源之一[1-3],主要包括聚酮化合物(polyketide,PK)、肽类化合物(non ribosomal peptide,NRP)、PKS-NRPS 杂合类、萜类、生物碱类等[4‑5]。近年来,随着高通量测序技术的发展,越来越多的丝状真菌基因组被公布,研究者在众多丝状真菌基因组中发现了大量的次生代谢产物表达基因簇,这些基因常常在染色体上呈线性化排列。然而,丝状真菌次级代谢产物合成基因簇在常规实验室培养条件下表达量极低或处于沉默状态[6‑7],因而,发现新型结构的次级代谢产物相对较少,仍有大量真菌次级代谢产物有待发现。
veA作为核心基因,参与丝状真菌中次级代谢产物合成的调控[8],研究发现,构巢曲霉中柄曲霉素和青霉素合成基因的表达均受到veA的控制[9]。研究中常采用过表达或敲除veA来调控次级代谢产物合成基因簇的表达,进而激发真菌产生次生代谢产物的潜力,在Aspergillus oryzae中过表达veA,导致抗菌素类次级代谢产物Penicillin产量的显著提高[10];橘青霉中过表达veA导致降脂类物质美伐他汀的产量提高了3倍[11]。
冠突散囊菌是茯砖茶中的优势益生菌,其丰富的胞外酶和次级代谢产物对茯砖茶独特风味和保健功效的形成有着巨大贡献,具有极大的研究价值[12-14]。Ge 等[15]对冠突散囊菌的基因组测序分析表明,冠突散囊菌和其他丝状真菌类似,基因组中有众多的次生代谢产物合成基因簇,表明冠突散囊菌具有合成次生代谢产物的巨大潜力。然而,关于冠突散囊菌次生代谢产物合成与调控的研究较少,严重阻碍了深入挖掘和利用冠突散囊菌次级代谢产物的进程[16]。
在冠突散囊菌中,veA被认为对氧化胁迫、性别发育等生物学过程有着重要的调控作用[17],然而,关于veA对冠突散囊菌次级代谢产物调控的报道较少。基于此,本研究使用无缝克隆及农杆菌转化法成功构建了冠突散囊菌veA过表达突变株,并通过高效液相色谱技术(high performance liquid chromatography,HPLC)和转录组测序技术初步研究了veA对冠突散囊菌次级代谢产物合成的调控作用,为深入挖掘和应用冠突散囊菌新颖结构的次级代谢产物提供新的见解和方法。
1 材料与方法
1.1 菌株
冠突散囊菌(Eurotium cristatum)GZ06 分离于贵州出产的黑茶,保存于贵州师范大学微生物资源与产业化应用研究实验室。大肠杆菌感受态细胞Stbl3、农杆菌感受态细胞 AGL1 均购自武汉源叶生物技术有限公司。过表达载体pCAMBIA1303-TrpC-Hygro-gpdA-GFP 购自丰晖生物科技有限公司。
1.2 试剂
Eastep®Super总RNA 提取试剂盒购自上海普洛麦格生物有限公司;FastKing gDNA Dispelling RT SuperMix、高保真DNA聚合酶购自天根生化拜尔有限公司;dNTPs 购自Taraka;无缝克隆试剂盒购自诺唯赞生物有限公司;胶回收试剂盒和质粒提取试剂盒购自OMEGA 公司;实时荧光定量PCR 试剂盒购自康润生物有限公司;限制性核酸内切酶BglⅡ、BstEⅡ、潮霉素B 溶液、氨苄卡那霉素、DEPC 水、乙酰丁香酮、二甲亚砜、头孢噻肟钠、2-(N-吗啉代)乙烷磺酸一水等试剂、PCR 引物均由上海生工生物有限公司提供。
1.3 试验仪器
主要试验仪器包括电热恒温培养箱(DH600 H,天津市泰斯特仪器有限公司)、PCR 扩增仪(ETC 811,东胜创新生物科技有限公司)、酶标仪(EPOCH2,BioTEK);电泳仪(DYCP-31DN,北京六一生物科技有限公司)和实时荧光定量PCR 仪(QuantStudio3,ABI)。
1.4 试验方法
1.4.1冠突散囊菌分生孢子液的制备 参照Wang 等[18]试验方法,将冠突散囊菌接种在高渗的MYA 培养基上,37 ℃恒温培养10 d 后,用无菌水冲洗分生孢子,使用血球计数板将冠突散囊菌孢子液浓度稀释为1×106cell·mL−1备用。
1.4.2veA的扩增及过表达载体的构建 将3 mL冠突散囊菌孢子液接种于150 mL PDB 液体培养基,30 ℃、180 r·min−1震荡培养3 d,过滤收集菌丝,参照植物总RNA 提取试剂盒说明书提取总RNA。 获得总RNA 后,使用FastKing gDNA Dispelling RT SuperMix 试剂盒反转录获得cDNA,参照无缝克隆试剂盒说明书和已经公布的冠突散囊菌veA的序列信息[17],使用BstEⅡ和BglⅡ限制性核酸内切酶对载体线性化,并设计veAF/veAR引物(表1),以cDNA 为模板进行扩增,片段经回收纯化后,构建gpdA-veA-Trpc 过表达元件并转入大肠杆菌Stbl3,载体序列经测序验证。
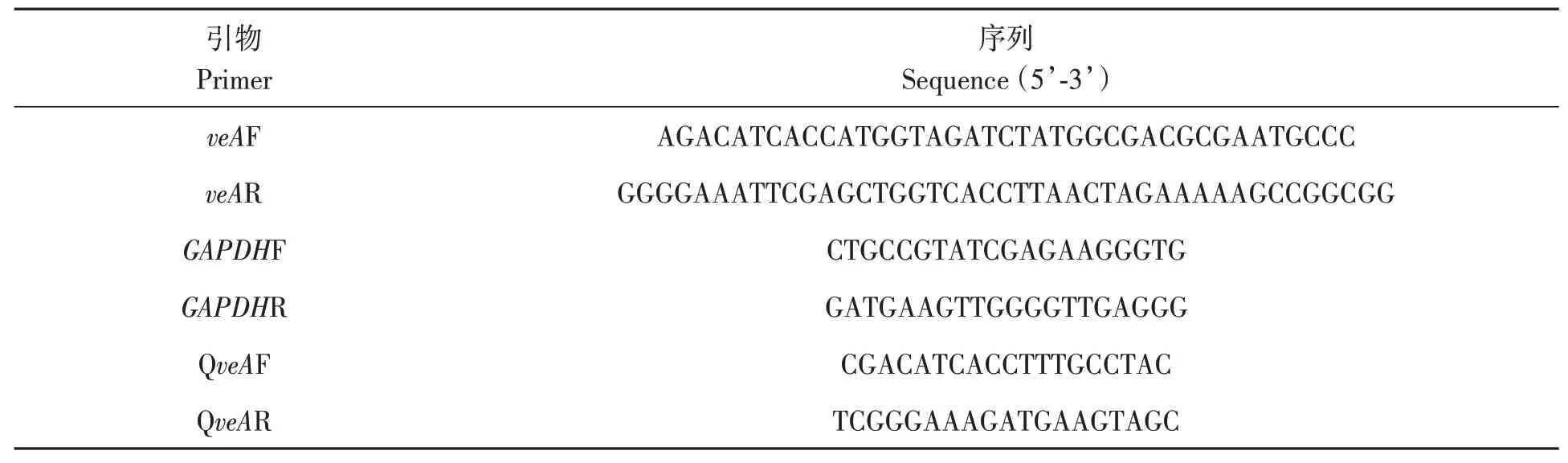
表1 本研究使用的引物Table 1 Primers used in this study
1.4.3转化 参照刘逸梅[19]的方法将过表达载体转化农杆菌感受态AGL1。农杆菌侵染冠突散囊菌实验参照朱思远等[20]的方法。
1.4.4阳性转化子鉴定 将野生型冠突散囊菌(WT)和过表达veA突变株(OE::veA1)接种到PDA平板上(含75 µg·mL−1潮霉素),28 ℃培养,观察能否正常生长。同时提取野生型冠突散囊菌和过表达突变株的总RNA,反转录获得cDNA 后使用RT-qPCR 验证veA相对表达量。参照SYBR Green PCR MasterMix 试剂盒说明书,以QveAF/QveAR 为实时荧光定量PCR 引物(表1),以GAPDH(甘油醛-3-磷酸脱氢酶)为内参基因[21‑22]。在冰上配置体系:cDNA 模板1 µL;QveAF 引物0.5µL,QveAR 引物0.5 µL;2×RealStar Green Fast Mixture 10 µL;用RNase-Free H2O 补足20 µL。反应条件为:95 ℃预变性2 min;95 ℃变性15 s,60 ℃延伸30 s,40 个循环。使用2-∆∆Ct法[15]计算基因的相对转录水平,试验设置3个重复。
1.4.5发酵产物的提取与检测 参照杜静[23]的试验方法,将等量野生型冠突散囊菌和过表达突变株的分生孢子液接种于大米培养基,28 ℃黑暗培养10 d。发酵结束后准确称取10 g 发酵产物,使用醇提法进行提取并制备成浸膏。加入10 mL 50%的甲醇溶液充分溶解并过0.22 µm 尼龙滤膜制备成HPLC待测样品。检测条件参照王琪琪[24]试验方法略有改动。色谱条件:Agilent-C18(250 mm×4.6 mm,5 µm)色谱柱;检测波长254 nm;柱温30 ℃;进样量10 µL;流速0.5 mL·min−1。流动相:纯水∶乙腈= 3∶7(体积比)。
1.4.5转录组测序 将3 mL 等量的野生型冠突散囊菌(WT)和过表达突变株的分生孢子液接种于PDB(150 mL)培养基,28 ℃震荡培养3 d。过滤收集菌丝后,用液氮快速将菌丝体研磨成粉末,使用TRIzol®Reagent kit(Invitrogen)提取总RNA,用NanoDrop 2000 分光光度计检测提取RNA 的质量和含量。利用Oligo (dT)引物和mRNA 的poly A 进行互补A-T 配对,分离总mRNA 后,使用Illumina TruseqTMRNA sample prep Kit 方法构建文库并完成测序工作。数据下机后,对原始序列(raw reads)的进行质控,然后得到质控数据(clean reads)。 将得到的clean reads 与冠突曲霉(GCA001717485.1)基因组进行比对组装。采用表达定量软件RSEM 定量分析基因和转录本的表达水平,使用DESeq2 软件筛选差异表达基因(differentially expressed genes,DEGs),筛选标准:差异倍数(fold change,FC) > 1.5 且P值<0.05。获得DEGs 后,基于GO 数据库对DEGs 进行注释,并基于KEGG 数据库对DEGs 进行通路富集分析。为进一步分析过表达veA对冠突散囊菌次级代谢产物基因簇的影响,使用antiSMASH 在线软件对转录组测序数据中预测为编码次级代谢产物的基因进行注释和分析。相关测序原始数据已提交至美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的SRA 数据库,登录号为PRJNA809521。
1.5 数据分析
采用Excel 2021 对数据进行统计分析,采用t检验对组间差异进行显著性分析。采用GraphPad Prism 8.0软件作图。
2 结果与分析
2.1 veA过表达突变株的构建
以冠突散囊菌cDNA 为模板扩增veA的开放式阅读框,使用无缝克隆技术构建veA过表达载体。将测序正确的veA过表达载体转化农杆菌感受态AGL1,经潮霉素抗性PDA 平板和veA的相对表达量检测(图1)表明,过表达突变株(OE::veA1)在潮霉素抗性PDA 平板上能正常生长,且veA的相对表达量极显著高于野生型,由此表明,过表达突变株构建成功。

图1 veA过表达突变株的鉴定Fig. 1 Screening of veA overexpression mutant
2.2 高效液相色谱分析代谢成分差异
野生型冠突散囊菌(WT)和过表达突变株(OE::veA1)的高效液相色谱图谱具有较大差异(图2)。相较于WT,OE::veA1 中物质吸收峰1 的相对峰面积提高了4.09 倍。且物质吸收峰2、3 和4 在野生型冠突散囊菌中未检测到。由此说明,过表达veA基因可能激活了冠突散囊菌中某些次级代谢产物合成基因簇,产生了新的次级代谢化合物。

图2 野生型冠突散囊菌和OE::veA1发酵产物的HPLC图谱Fig. 2 HPLC chromatograms of fermentative products of wildtype E. cristatus and OE::veA1 mutant
2.3 转录组测序质量评估
对野生型(CK)和过表达veA突变株(OE::veA1)进行转录组测序,共获得原始数据(raw reads) 337 234 764 条;质控后,获得clean reads 共334 959 602 条;各样本错配率均低于0.05%(表2),说明测序结果良好。此外,序列质控参数Q20和Q30均达95%以上,说明测序质量较高,可用于后续分析。
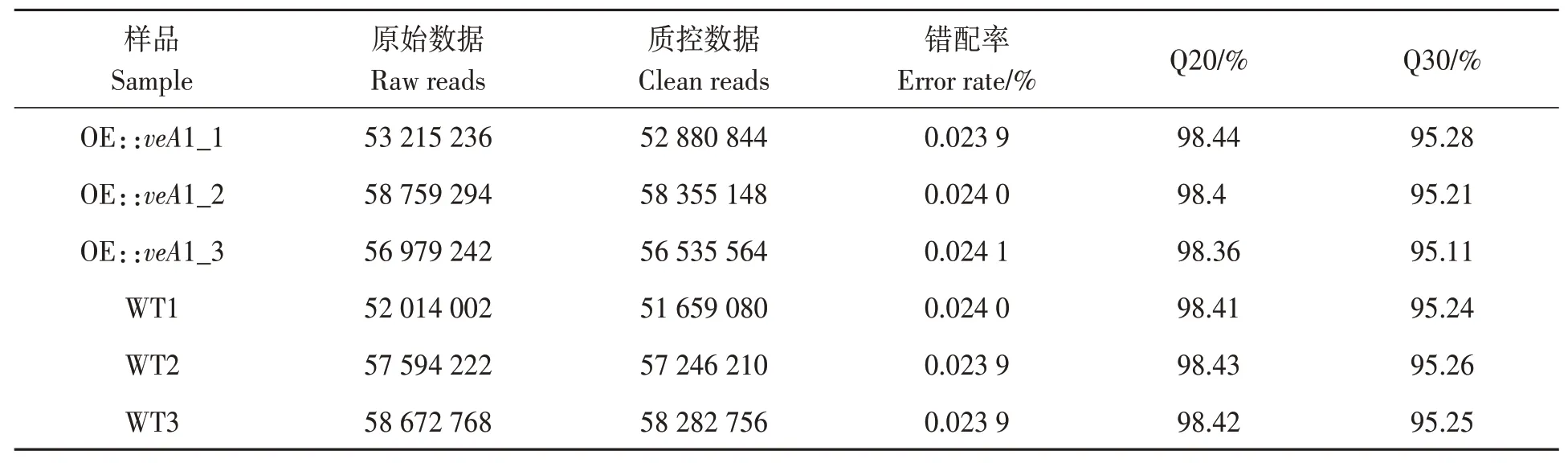
表2 转录组测序数据统计Table 2 Transcriptome sequencing data statistics
2.4 差异表达基因分析
2.4.1差异表达基因统计 以TPM 为表达量指标,使用DESeq2 软件筛选DEGs。在WT 和OE::veA1 组中共筛选出737 个DEGs,其中,282 个显著上调表达;455个显著下调表达(图3)。
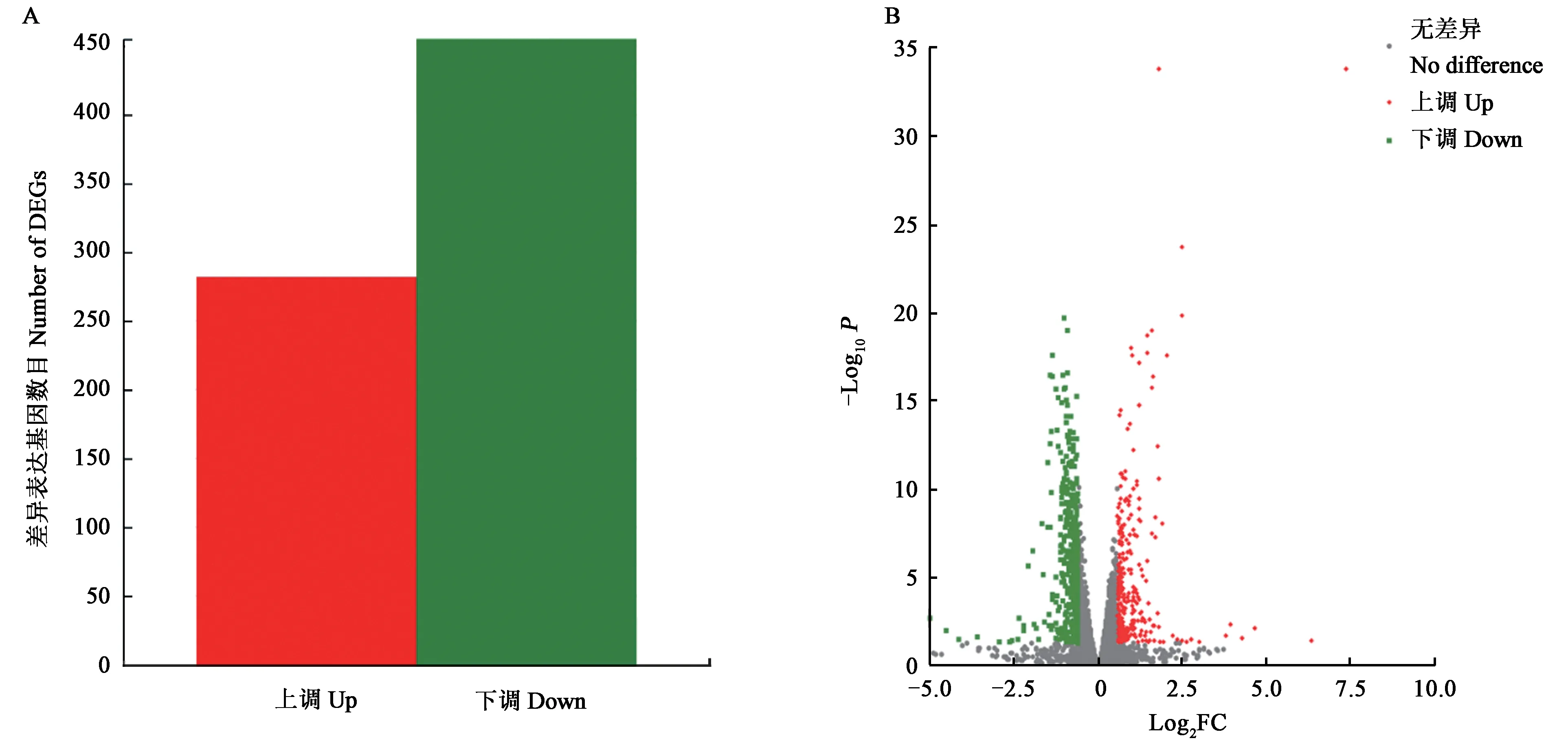
图3 野生型与过表达突变株的差异表达基因Fig. 3 Differentially expressed genes between WT and OE::veA1
2.4.2DEGs 的GO 注释 进一步使用GO 数据库对DEGs 进行注释,结果(图4)表明,GO 功能注释主要包括生物过程、细胞组分和分子功能3大类。其中,在生物过程大类中,DEGs 主要涉及细胞过程(24.29%)、代谢过程(22.25%)、定位(9.91%)和生物调控(8.41%);在细胞组分大类中,DEGs 主要涉及膜部分(30.39%)、细胞部分(20.08%)和细胞器(10.31%);在分子功能大类中,主要涉及催化活性(44.23%)和结合(39.76%)。

图4 DEGs的GO注释分类Fig. 4 GO annotation classification of DEGs
2.4.3差异基因KEGG 富集分析 使用KEGG 数据库对DEGs 进行通路富集分析(图5),结果表明,氮代谢、MAPK 信号途径、多种氨基酸代谢及乙醛酸和二羧酸代谢等通路均有富集。其中,萜类化合物合成骨架通路中有4 个基因(SI65_09721、SI65_05138、SI65_07629 和SI65_08119)被富集且均显著上调表达,分别被注释为聚戊烯基合成酶、异戊二烯基二磷酸δ-异构酶、聚戊烯基合成酶和法尼基焦磷酸合成酶。由此表明,过表达veA可能激活了冠突散囊菌萜类化合物的合成通路。
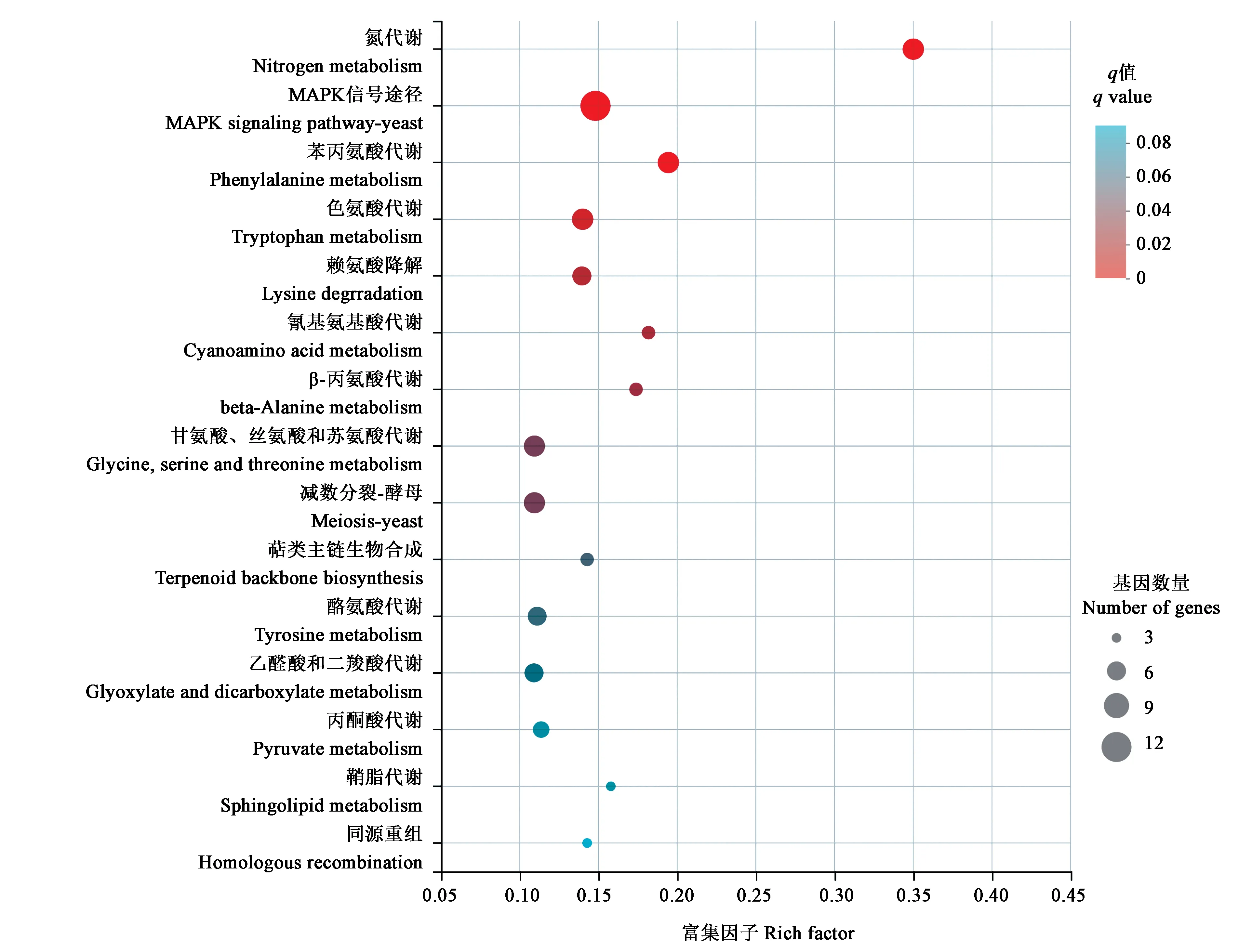
图5 DEGs的KEGG富集气泡图Fig. 5 KEGG enrichment bubble diagram of DEGs

图6 冠突散囊菌中次级代谢产物合成基因簇差异表达基因统计Fig. 6 Statistics of differentially expressed genes of secondary metabolite synthesis gene cluster in E. cristatus
2.5 基于antiSMASH 注释相关次级代谢产物合成基因的表达
基于antiSMASH软件对相关次级代谢产物合成基因进行预测分析,结果表明,共注释到37个基因簇545个次级代谢产物相关合成基因,其中,显著上调表达的基因15个,显著下调表达的基因43个,占全部基因的10.64%。在基因簇32中,有9个差异表达基因,占该基因簇的50%,经预测该基因簇编码的次级代谢产物类型为Ⅰ型PKS类。进一步对该基因簇进行功能和表达量注释,结果(表3)表明,显著上调表达的基因多与次级代谢产物修饰相关,包括氧化还原酶类(SI65_05762 和SI65_05772)、甲基转移酶(SI65_05767)、内酰胺酶(SI65_05769)、乙酰基转移酶(SI65_05773)和细胞色素P450单加氧酶(SI65_05771)。
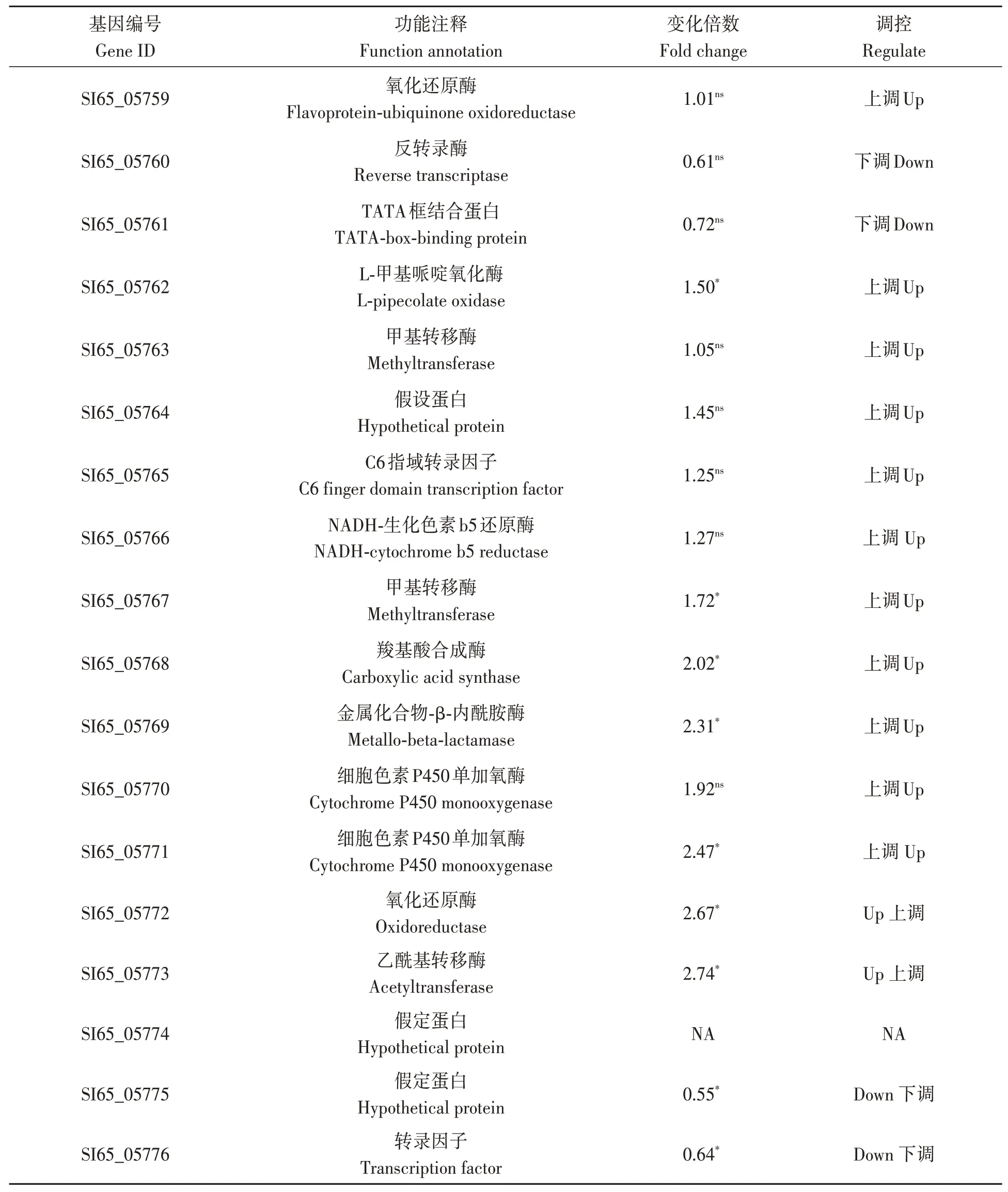
表3 次级代谢产物基因簇32中基因差异表达及功能注释Table 3 Gene expression and functional annotation in secondary metabolite gene cluster 32
3 讨论
目前,基于分子水平对冠突散囊菌的研究主要侧重于性别发育调控机制[17‑18,21‑22,25],Tan 等[17]研究表明,veA对冠突散囊菌性别发育及氧化胁迫起调控作用。然而,veA作为全局性调控因子,对于丝状真菌次级代谢产物合成基因簇的调控也有着重要作用,本研究借助农杆菌AGL1 转化系统成功构建了veA过表达突变株,表明根癌农杆菌AGL1 同样适用于侵染转化冠突散囊菌,拓宽了冠突散囊菌分子转化的实验手段和材料。
本研究从过表达veA基因突变株的发酵产物中检测到3 种新的化合物,且发现多种代谢物含量与野生型存在显著差异,表明过表达veA基因可能导致冠突散囊菌产生了某些新的次级代谢产物,进一步说明,veA作为全局性调节因子,可能也参与了冠突散囊菌次级代谢产物合成的调控,与前人研究结果一致[9−11]。转录组测序结果也表明,过表达veA基因突变株的基因表达谱与野生型有较大差异,共筛选到737 个DEGs。DEGs 注释多与催化活性、膜相关和代谢调控等过程相关。在Beauveria bassiana中敲除veA导致膜相关、催化活性、氧化还原酶活性和膜运输等成分的富集[26],与本研究结果一致,说明veA在不同菌株中的调控作用具有一定的保守性和相似性。
DEGs 的通路富集结果表明氮代谢、MAPK 信号途径、多种氨基酸代谢及乙醛酸和二羧酸代谢等通路均有富集。在冠突散囊菌veA敲除菌株的蛋白组学研究中,10.4%的差异表达蛋白富集于氨基酸代谢通路[27],与本研究结果一致,进一步说明veA基因可能对冠突散囊菌氨基酸代谢等通路起着重要调控作用。本研究发现,veA过表达突变株中,涉及萜类化合物骨架代谢通路的2 个编码聚戊烯基合成酶基因及异戊二烯基二磷酸δ-异构酶基因和法尼基焦磷酸合成酶基因的表达均显著上调,说明过表达veA可能激活了冠突散囊菌中萜类化合物合成基因簇的表达,萜类化合物是一类重要的代谢产物,具有抗菌、抗肿瘤和抗氧化等生物学活性,极具研究价值[28‑29]。
基于antiSMASH 对转录组数据进行注释,结果表明,过表达veA导致了冠突散囊菌基因组中约10.64%的次级代谢产物合成相关基因的表达发生显著变化,说明过表达veA可能激活了冠突散囊菌次生代谢产物的合成。Cary 等[30]对黄曲霉的研究表明,56个次级代谢产物基因簇中有28个基因簇的表达与veA相关。张梦薇[31]研究了过表达veA对黑曲霉转录水平的影响,发现黑曲霉中次生代谢产物基因簇中32 个核心基因的表达均受到了影响,与本研究结果一致。本研究发现,次级代谢产物基因簇32 中多个与次级代谢产物合成相关基因的表达显著上调,包括1 个核心骨架基因细胞色素P450单加氧酶基因,该酶被认为参与了多种代谢产物的合成和结构修饰,如萜类化合物、甾醇以及生物碱类化合物等[28]。蒽酮类次生代谢产物含量的显著提高同样被认为与Cytochrome P450 的表达有关[32]。由此推断,过表达veA可能激活了以Cytochrome P450 为代表的次级代谢产物合成过程中关键酶基因的表达。
综上所述,本研究为冠突散囊菌次级代谢产物的进一步开发和利用提供了新的见解和理论依据,后期可运用多种分离纯化手段和核磁共振等技术对过表达veA突变株的代谢图谱和差异化合物进行分离检测,以期发现具有新颖结构和功能的次级代谢产物。
