大鼠牙髓组织AIM2炎症体表达及其与炎症反应关系
2023-08-26王继玲吴广升王亚飞
王继玲 吴广升 王亚飞

[摘要]目的探討黑色素瘤缺乏因子2(AIM2)炎症体在大鼠牙髓组织中的分布及其在牙髓炎症发生、发展中的表达变化。方法通过开髓法建立大鼠牙髓炎症模型,采用免疫荧光染色检测AIM2炎症体在牙髓组织中的表达分布;利用实时定量PCR(RT-PCR)检测大鼠牙髓组织中AIM2炎症体基因表达量的变化。结果苏木精-伊红(HE)染色显示单纯的开髓可诱发大鼠牙髓炎症反应,开髓3 d后出现炎性反应并在7 d后出现牙髓坏死。免疫荧光染色显示,大鼠牙髓组织中有AIM2炎症体表达,开髓5 d后牙髓细胞层出现明显阳性表达。RT-PCR结果显示,开髓术后3 d AIM2基因表达显著增加(F=1 178.910,P<0.01),下游caspase-1基因表达上调(F=81.224,P<0.05),IL-1β在开髓5 d后显著上调(F=164.414,P<0.05)。结论AIM2炎症体存在于大鼠牙髓组织中,并且其表达量与牙髓炎症反应呈正相关。
[关键词]牙髓炎;黑色素瘤缺乏因子2;炎性小体;大鼠,Sprague-Dawley
[中图分类号]R781.31[文献标志码]A[文章编号]2096-5532(2023)03-0407-05
doi:10.11712/jms.2096-5532.2023.59.078[开放科学(资源服务)标识码(OSID)]
[网络出版]https://kns.cnki.net/kcms2/detail/37.1517.R.20230725.0936.003.html;2023-07-2614:05:47
EXPRESSION OF ABSENT IN MELANOMA 2 INFLAMMATORY BODY IN RAT DENTAL PULP AND ITS ASSOCIATION WITH INFLAMMATORY RESPONSE WANG Jiling, WU Guangsheng, WANG Yafei (Disease Prevention and Control Section, Qingdao Special Service Sanatorium of the PLA Navy, Qingdao 266071, China)
[ABSTRACT]Objective To investigate the distribution of absent in melanoma 2 (AIM2) inflammatory body in rat dental pulp tissue and the change in its expression in the development and progression of pulpitis. MethodsOpening of pulp chamber was performed to establish a rat model of dental pulp inflammation. Immunofluorescent staining was used to measure the expression and distribution of AIM2 inflammatory body in dental pulp tissue, and RT-PCR was used to measure the change in the mRNA expression level of AIM2 inflammatory body in rat dental pulp tissue. ResultsHE staining showed that opening of pulp chamber alone could induce inflammatory response of rat dental pulp; inflammatory response was observed on day 3 after pulp opening and dental pulp necrosis was observed on day 7 after pulp opening. Immunofluorescent staining showed the expression of AIM2 inflammatory body in rat dental pulp tissue, with marked positive expression in pulp cell layer on day 5 after pulp opening. RT-PCR showed that on day 3 after pulp opening, there were significant increases in the expression levels of the AIM2 gene (F=1 178.910,P<0.01) and downstream caspase-1 (F=81.224,P<0.05), and there was a significant increase in IL-1β on day 5 after pulp ope-ning (F=164.414,P<0.05). ConclusionAIM2 inflammatory body exists in rat dental pulp tissue, and the changing trend of its expression is positively associated with dental pulp inflammatory response.
[KEY WORDS]pulpitis; absent in melanoma 2; inflammasome; rats, Sprague-Dawley
牙髓炎是口腔常见疾病,因其能引起较为剧烈的疼痛易对工作、学习和生活等方面产生较大的影响,但其发病机制尚不完全清楚。近10余年,因为炎症体的发现,人们对牙髓炎的发生、发展及转归有了全新的认识。已有研究结果表明,在脂多糖等因素刺激下,牙髓成纤维细胞中黑色素瘤缺乏因子2(AIM2)炎症体的表达增加[1-2],并随着炎症的进展其表达量有一定的升高。然而,目前对AIM2炎症体在牙髓组织中尤其是体内研究还相对较少。本文通过构建大鼠牙髓炎模型,研究AIM2炎症体在大鼠牙髓炎症发生、发展中的作用机制,为后期寻找牙髓炎拮抗剂或治疗分子靶点提供理论依据。现将结果报告如下。
1材料与方法
1.1实验材料
低温离心机(Centrifuge 5804R,Eppendorf公司,德国);PCR仪(Mastercyler gradient,Eppendorf公司,德国);超低温冰箱(EKY0014595,三洋公司,日本);Nanodrop 2000分光光度计(ThermoScientific公司,美国);荧光定量PCR仪(ABI 7500,赛默飞公司,美国);ODYSSEY双色红外线激光成像系统(LI-COR公司,美国);Trizol(Invitrogen公司,美国);八联管(Invitrogen公司,美国);牙科高速涡轮机手机(NSK公司,日本);1/2球钻(松风公司,日本);氯仿、异丙醇、无水乙醇、RNA酶灭活水(上海士锋生物科技有限公司);Anti-AIM2(Santa-Cruz公司,美国)。
1.2实验方法
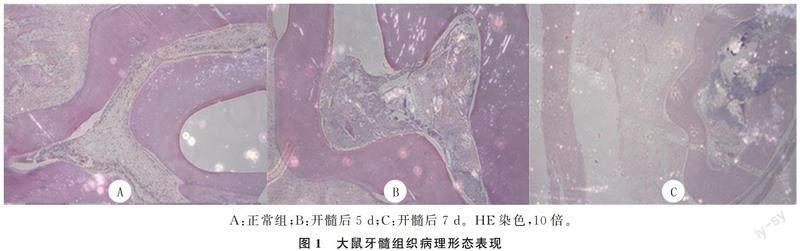
1.2.1大鼠牙髓炎症模型的建立所用实验动物为8周龄雄性SD大鼠20只,购于空军军医大学动物中心。100 g/L水合氯醛腹腔注射麻醉后,仰卧固定于鼠板上,用金属镊子撑开大鼠下颌,暴露上颌磨牙,用高速涡轮机(不喷水,1/2球钻)在大鼠上颌磨牙面开髓,开髓深度约为1 mm,待有透红点时停止磨切,用金属探针在透红点加压,形成穿髓孔。每只大鼠右侧上颌磨牙为开髓牙,左側为对照牙。每3只同样处理的大鼠为1组。开髓组仅依靠物理刺激形成牙髓炎症反应。根据苏木精-伊红(HE)染色后炎症程度,即组织切片中浸润的炎性细胞的程度不同分为正常组、3 d组(少量炎性细胞浸润)、5 d组(大量炎性细胞浸润)、7 d组(牙髓组织坏死)和10 d组(大部分牙髓组织坏死)。
1.2.2HE染色大鼠给予100 g/L水合氯醛腹腔注射,待完全麻醉后,开胸;用40 g/L 多聚甲醛行心脏灌注,待全身僵硬后,解剖大鼠上颌,取出上颌双侧磨牙及部分上颌骨。将标本置于40 g/L多聚甲醛中固定12 h。常规乙醇脱水,二甲苯透明,石蜡包埋制作切片,进行HE常规染色,观察动物模型牙髓炎症状态。
1.2.3免疫荧光染色组织固定包埋制成石蜡切片,常规脱蜡水化后,以PBS(pH值7.4, 0.01 mol/L)洗3次,每次5 min;用甲醇新鲜配制的体积分数0.003 H2O2 孵育15 min;PBS洗3次,每次5 min;胰蛋白酶行抗原修复 37 ℃下孵育30 min;PBS洗3次,每次5 min;体积分数0.10牛血清清蛋白(BSA)37 ℃孵育30 min;加入一抗AIM2(1∶500, 美国Santa-Cruz),4 ℃湿盒中孵育过夜;PBS洗3次,每次5 min;在避光条件下,加FITC标记的二抗(1∶200,英国Abcam),37 ℃孵育30 min;PBS洗3次,每次5 min;加入DIPA(细胞核染色)室温下孵育3 min;PBS洗3次,每次5 min;体积分数0.10缓冲甘油封片,4 ℃避光保存。荧光显微镜下观察切片(观察期间应处于避光环境中)。
1.2.4RT-PCR检测100 g/L水合氯醛腹腔注射麻醉后,活体进行大鼠上颌磨牙取材,将磨牙小心剥离,去净周围软组织后置于液氮罐中保存。进行mRNA提取时,将牙齿去除,用手术刀片小心刮净牙齿周围组织,放入液氮中5 min后置于匀浆器中研磨。
采用TRIzol法提取细胞总RNA,置于-80 ℃冰箱保存备用。应用Takara.RR037A反转录试剂盒将RNA逆转录为cDNA。以cDNA为模板利用PCR扩增试剂盒完成扩增。PCR的反应条件为:95 ℃下变性30 s,95 ℃下5 s,共40个循环;60 ℃下离解30~34 s。以内参照蛋白GAPDH基因水平为默认值1。PCR引物种类及其序列见表1。
1.3统计学分析
采用GraphPad Prism 5.0软件进行统计学分析。所得计量资料数据以±s形式表示,两组比较采用LSD法,多组比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2结果
2.1组织病理学观察
大鼠上颌双侧切牙的HE染色结果显示,对照侧无处理的牙齿牙髓组织正常,开髓5 d后出现炎性细胞,开髓7 d后聚集了大量的炎性细胞并有部分牙髓组织坏死。见图1A~C。
2.2免疫荧光染色观察
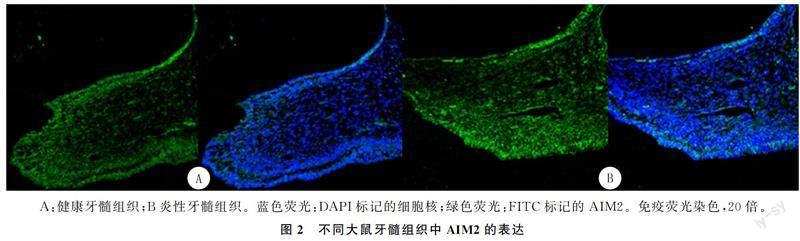
荧光显微镜下观察显示, 健康的大鼠牙髓组织中AIM2主要表达于成牙本质细胞层,而在牙髓成纤维细胞中表达较少(牙髓成纤维细胞层中绿色荧光分布较少且荧光强度较低);但在开髓5 d后的牙髓组织中,牙髓成纤维细胞中AIM2的表达量有明显的增加(牙髓成纤维细胞层中绿色荧光分布范围增加且荧光强度升高)。见图2A、B。
2.3RT-PCR检测AIM2、caspase-1和白细胞介素1β(IL-1β)的基因表达水平
单因素方差分析结果显示,5组间AIM2、IL-1β、caspase-1基因表达比较,差异均有统计学意义(F=16.345、50.373、6.217,P<0.05);两两比较结果显示,每组数据与前一组进行对比,在开髓3 d组与空白组比较,AIM2和caspase-1基因表达量差异有统计学意义(F=1 178.910、81.224,P<0.01、0.05),IL-1β基因的表达量在开髓5 d组有显著升高(F=164.414,P<0.05),并且在7 d后显著下降(F=18.786,P<0.05)。见表2。
3讨论
哺乳动物的天然免疫系统是机体受到外来微生物侵害后启动的第一道防线[3-4]。免疫细胞对感染的病原微生物及其产物的识别主要是依赖于细胞质内存在的一类被称为“炎症体”的多蛋白复合物[5-8],该蛋白复合物为炎症反应的启动者,能够感受外界信号刺激,激活caspase-1(半胱天冬酶-1),调控IL-1β、IL-18和IL-33的成熟和分泌,从而引发炎症反应[5,9-12]。炎症体是caspase活化所必需的反应平台,能够识别病原体相关分子模式[13-15],这是一种不同于宿主自身正常细胞的保守分子结构,它可以识别自身物质(例如宿主蛋白)和非自身物质(例如微生物),可以感知像病原微生物或细胞应激等“危险信号”的存在并做出反应,而对自身或共生菌的无害分子没有影响。AIM2是一种炎症体,通过识别细胞质双链DNA与凋亡相关点状蛋白结合,激活下游的caspase-1,促进IL-1β的合成及分泌,而IL-1β是一种针对感染、损伤和炎症刺激最有利的促炎因子之一[11,16-18]。
AIM2炎症体在肿瘤和自身免疫性疾病中的作用已经得到了广泛的认同,但其在牙髓炎症反应中的作用尚未完全确定。近年来,AIM2炎症体的体外研究取得了一些进展,而体内研究尤其是牙髓组织中的研究还很少。与体外实验相比,体内试验更接近生物体内实际条件,对后续深入研究以及临床转化更具有参考价值。因此,为了研究AIM2炎症体在牙髓炎症中的作用,我们采用大鼠上颌磨牙单纯开髓诱导的牙髓炎模型,该方法相对简单实用,且通过设置开髓深度具有较强的条件可控性。
本文HE染色结果显示,开髓3 d后大鼠牙髓组织中有炎性细胞浸润,发生了明显的炎症反应,随着牙髓开放时间的延长,牙髓炎症反应程度逐渐加重,并在开髓7 d后出现牙髓坏死。免疫荧光染色结果显示,在健康的大鼠牙髓组织中,AIM2主要表达于成牙本质细胞层,在牙髓细胞层中仅有少量的表达;而在开髓后的大鼠牙髓细胞层中AIM2的表达量有明显的增多。因此,我们认为在大鼠牙髓组织中存在AIM2,并且随着牙髓開放时间的延长,AIM2的表达量尤其是牙髓细胞层中有显著的升高,预示着AIM2的表达与牙髓的炎症反应有一定的联系。至此,我们证实了牙髓组织中AIM2炎症体的表达并且其表达量与炎症呈正相关。
本文RT-PCR检测结果显示,牙髓组织开髓的早期,AIM2、caspase-1和IL-1β基因表达水平均有上升的趋势,表明AIM2在大鼠牙髓组织中的表达量增加与牙髓炎症反应的程度有着密切的联系,并且AIM2和caspase-1表达显著上调的时间节点要早于IL-1β,而且上调的趋势更为显著。因此,我们推测AIM2在大鼠牙髓炎的发生、发展中起到了正调节作用。后期随着牙髓组织的坏死其表达量出现了下降的趋势,我们认为可能是由于组织坏死引起的细胞量减少继而导致AIM2表达量的下降。同时,AIM2炎症体对细胞凋亡可能也有一定的调控作用,这一点还有待进一步研究证实。
本文研究AIM2炎症体在大鼠牙髓组织中的表达,结果显示,在基因水平上其表达量与炎症反应呈正相关;对其下游因子的检测结果显示,促炎细胞因子IL-1β的表达量变化发生时间要晚于AIM2,我们认为AIM2能够在大鼠牙髓组织中对IL-1β的表达起到正调节作用,即AIM2在大鼠牙髓炎发生发展中起到了重要的促进作用。此外,AIM2炎症体表达量的上调出现的非常早,在开髓3 d即出现了显著的上升,提示AIM2可能在大鼠牙髓炎症的早期或急性期发挥重要作用。开髓7~10 d,AIM2炎症体的表达量出现了小幅度的上升,而HE染色显示这一时间段内牙髓组织开始出现坏死。我们推测除了炎症反应以外,AIM2炎症体可能与牙髓组织的坏死有着密切的联系。当然,这些结论尚需进一步的研究证实。
牙髓炎一直是困扰临床医生的一个难题[19-20],就目前的诊疗方式而言,根管治疗是治疗牙髓炎症,尤其是不可逆炎症的首选方法[21-25]。但是,在治疗过程中清除的牙髓组织难以再生,而缺少牙髓组织营养供给的牙本质因其有机物的降解而增加了其脆性,导致术后容易发生冠根折[26-32],最终引起牙齿的缺失[33]。而对于炎症反应的早期干预是否能够有效地降低不可逆性牙髓炎的发生尚不确定[34]。本研究证实了牙髓组织中存在AIM2炎症信号通路,这将会为后期寻找牙髓炎症上游的调控靶点提供研究基础,也可为后期临床牙髓炎的早期干预提供理论依据。
[参考文献]
[1]WANG Y F, ZHAI S F, WANG H J, et al. Absent in melanoma 2 (AIM2) in rat dental pulp mediates the inflammatory response during pulpitis[J]. Journal of Endodontics, 2013,39(11):1390-1394.
[2]ZHAI S F, WANG Y F, JIANG W K, et al. Nemotic human dental pulp fibroblasts promote human dental pulp stem cells migration[J]. Experimental Cell Research, 2013,319(10):1544-1552.
[3]RAY A, COT M, PUZO G, et al. Bacterial cell wall macroamphiphiles: pathogen-/microbe-associated molecular patterns detected by mammalian innate immune system[J]. Biochimie, 2013,95(1):33-42.
[4]OSHIUMI H, MATSUMOTO M, SEYA T. Role of ubiquitin ligase in innate immune response in mammal[J]. Seikagaku the Journal of Japanese Biochemical Society, 2012,84(6):455-462.
[5]SHARMA B R, KARKI R, KANNEGANTI T D. Role of AIM2 inflammasome in inflammatory diseases, cancer and infection[J]. European Journal of Immunology, 2019,49(11):1998-2011.
[6]FARSHCHIAN M, NISSINEN L, SILJAMKI E, et al. Tumor cell-specific AIM2 regulates growth and invasion of cutaneous squamous cell carcinoma[J]. Oncotarget, 2017,8(28):45825-45836.
[7]KARKI R, KANNEGANTI T D. Diverging inflammasome signals in tumorigenesis and potential targeting[J]. Nature Reviews Cancer, 2019,19(4):197-214.
[8]JACOBS S R, DAMANIA B. NLRs, inflammasomes, and viral infection[J]. Journal of Leukocyte Biology, 2012,92(3):469-477.
[9]FERNANDES-ALNEMRI T, YU J W, JULIANA C, et al.The AIM2 inflammasome is critical for innate immunity toFrancisella tularensis[J]. Nature Immunology, 2010,11(5):385-393.
[10]HORNUNG V, ABLASSER A, CHARREL-DENNIS M, et al. AIM2 recognizes cytosolic dsDNA and forms a caspase-1-activating inflammasome with ASC[J]. Nature, 2009,458(7237):514-518.
[11]WARREN S E, ARMSTRONG A, HAMILTON M K, et al. Cutting edge: cytosolic bacterial DNA activates the inflammasome via Aim2[J]. Journal of Immunology (Baltimore, Md:1950), 2010,185(2):818-821.
[12]SCHRODER K, MURUVE D A, TSCHOPP J. Innate immunity: cytoplasmic DNA sensing by the AIM2 inflammasome[J]. Current Biology, 2009,19(6): R262-R265.
[13]TANG D L, KANG R, COYNE C B, et al. PAMPs and DAMPs: signal 0s that spur autophagy and immunity[J]. Immunological Reviews, 2012,249(1):158-175.
[14]LI N, XU H B, OU Y R, et al. LPS-induced CXCR7 expression promotes gastric Cancer proliferation and migration via the TLR4/MD-2 pathway[J]. Diagnostic Pathology, 2019,14(1):3.
[15]LUDGATE C M. Optimizing cancer treatments to induce an acute immune response: radiation abscopal effects, PAMPs, and DAMPs[J]. Clinical Cancer Research, 2012,18(17):4522-4525.
[16]MASSOUMI R L, TEPER Y, AKO S, et al. Direct effects of lipopolysaccharide on human pancreatic cancer cells[J]. Pancreas, 2021,50(4):524-528.
[17]YOKOYAMA S, CAI Y, MURATA M, et al. A novel pathway of LPS uptake through syndecan-1 leading to pyroptotic cell death[J]. eLife, 2018,7: e37854.
[18]MURAKAMI K, KAMIMURA D, HASEBE R, et al. Rhodobacter azotoformans LPS (RAP99-LPS) is a TLR4 agonist that inhibits lung metastasis and enhances TLR3-mediated chemokine expression[J]. Frontiers in Immunology, 2021,12:675909.
[19]DONNERMEYER D, DAMMASCHKE T, LIPSKI M, et al. Effectiveness of diagnosing pulpitis: a systematic review[J]. International Endodontic Journal, 2022. doi:10.1111/iej.13762.
[20]BRODZIKOWSKA A, CIECHANOWSKA M, KOPKA M, et al. Role of lipopolysaccharide, derived from various bacterial species, in pulpitis-a systematic review[J]. Biomolecules, 2022,12(1):138.
[21]SKITIOUI M, SECK A, NIANG S O, et al. The treatment of mature permanent teeth with irreversible pulpitis by cervical pulpotomy: a systematic review[J]. Australian Endodontic Journal: the Journal of the Australian Society of Endodontology Inc, 2022. doi:10.1111/aej.12694.
[22]BURNS L E, KIM J, WU Y X, et al. Outcomes of primary root canal therapy: an updated systematic review of longitudinal clinical studies published between 2003 and 2020[J]. International Endodontic Journal, 2022,55(7):714-731.
[23]SADAF D, AHMAD M Z, ONAKPOYA I J. Effectiveness of intracanal cryotherapy in root canal therapy: a systematic review and meta-analysis of randomized clinical trials[J]. Journal of Endodontics, 2020,46(12):1811-1823.e1.
[24]CASTAGNOLA R, MINCIACCHI I, RUPE C, et al. The outcome of primary root canal treatment in postirradiated patients: ACaseSeries[J]. Journal of Endodontics, 2020,46(4):551-556.
[25]RUKSAKIET K, HANK L, FARKAS N, et al. Antimicrobial efficacy of chlorhexidine and sodium hypochlorite in root canal disinfection: a systematic review and meta-analysis of randomized controlled trials[J]. Journal of Endodontics, 2020,46(8):1032-1041.e7.
[26]ASGARY S, EGHBAL M J, SHAHRAVAN A, et al. Outcomes of root canal therapy or full pulpotomy using two endodontic biomaterials in mature permanent teeth: a randomized controlled trial[J]. Clinical Oral Investigations, 2022,26(3):3287-3297.
[27]BHUVA B, GIOVARRUSCIO M, RAHIM N, et al. The restoration of root filled teeth: a review of the clinical literature[J]. International Endodontic Journal, 2021,54(4):509-535.
[28]UYSAL S, AKCICEK G, YALCIN E D, et al. The influence of voxel size and artifact reduction on the detection of vertical root fracture in endodontically treated teeth[J]. Acta Odontologica Scandinavica, 2021,79(5):354-358.
[29]HILTON T J, FUNKHOUSER E, FERRACANE J L, et al. Baseline characteristics as 3-year predictors of tooth fracture and crack progression[J]. The Journal of the American Dental Association, 2021,152(2):146-156.
[30]LIAO W C, CHEN C H, PAN Y H, et al. Vertical root fracture in non-endodontically and endodontically treated teeth: current understanding and future challenge[J]. Journal of Personalized Medicine, 2021,11(12):1375.
[31]YAMAGUCHI M, FUKASAWA S. Is inflammation a friend or foe for orthodontic treatment? inflammation in orthodontically induced inflammatory root resorption and accelerating tooth movement[J]. International Journal of Molecular Sciences, 2021,22(5):2388.
[32]XU H P, YE N, LIN F, et al. A new method to test the fracture strength of endodontically treated root dentin[J]. Dental Materials, 2021,37(5):796-804.
[33]HILTUNEN K, VEHKALAHTI M M. Why and when older people lose their teeth: a study of public healthcare patients aged 60 years and over in 2007—2015[J]. Gerodontology, 2022. doi:10.1111/ger.12657.
[34]LIN L M, RICUCCI D, SAOUD T M, et al. Vital pulp therapy of mature permanent teeth with irreversible pulpitis from the perspective of pulp biology[J]. Australian Endodontic Journal, 2020,46(1):154-166.
(本文編辑牛兆山)