功能化共价有机框架材料对水体中汞离子的吸附性能研究
2023-08-25陆素芬张高荣伍丽娟杨美凤陆俊宇
陆素芬,张高荣,伍丽娟,杨美凤,陆俊宇①
(1.河池学院化学与生物工程学院,广西 宜州 546300;2.河池学院广西现代蚕桑丝绸协同创新中心,广西 宜州 546300)
在电镀、电池制造、氯碱和制药等的生产过程中会产生大量含汞离子的废水,该废水可以间接或直接方式进入水环境中,使得水体中汞离子污染日趋严重[1-2]。由于汞离子具有生物降解性较差、迁移性强、代谢缓慢且易在生物体内富集的特性,极易通过食物链进入人体或其他生物体,危害其生命安全[3-4]。当生物长期生活于较低汞浓度(0.001~0.01 mg·L-1)环境时,汞和生物体内的氨基、巯基和羧基等基团生成络合物,损坏细胞活性,从而导致各种病变[5-6]。1956年,日本发生典型的环境污染事件——水俣病,因当地居民食用受汞污染的鱼、贝类等水产品而引起汞中毒[7]。李远征[8]对华东地区印染企业的废水进行了随机抽样检测,发现其汞离子质量浓度范围为0.12~4.27 μg·L-1。陈若思等[9]通过检测发现,贵阳市红枫湖部分区域汞的潜在生态危害系数为247.57,可能会对生态环境造成严重损害。唐帮成等[10]研究发现,万山、云场坪、路腊村等地方汞矿业直接排放总汞含量高达186.2 μg·L-1的废水,对周边区域水体和农产品造成一定的影响。我国GB 18918—2002《城镇污水处理厂污染物排放标准》规定汞的最高允许排放浓度(日均值)为1 μg·L-1。因此,合理修复和防治水体中的汞离子污染已迫在眉睫。
当前去除水体中汞离子的常用方法有离子交换法、微电解-混凝法、化学沉淀法和吸附法等[11-13]。吸附法因操作简便、吸附性能良好、适用范围广和可循环利用等优点被视为处理水体中汞离子的主要方法[14-15]。相关学者对不同类型的吸附材料进行了研究[16-17],其中共价有机框架材料(covalent organic framework,COFs)具有比表面积较大、孔隙结构丰富、可用基团修饰其结构等诸多优势,在医药、化学、环境领域引起广泛关注[18-19]。其合成方法主要有超声法、自下而上法、离子热合成法、微波合成法、后修饰法和溶剂热合成法等[20-21],已应用在污染水体的修复与治理上[22-24]。LU等[25]制备了羧基官能化共价有机骨架材料并用于去除水体中的汞离子,其吸附容量为99.1 mg·g-1。SUN等[26]用1,2-乙二硫醇处理乙烯基官能化介孔COF材料(COF-V)制备巯基介孔COF(COF-S-SH),来处理水溶液中的汞离子,其Hg2+和Hg0的吸附量分别为1 350和863 mg·g-1。SEYFI等[27]制备介孔锆基金属有机骨架材料(MOF PCN-221)来去除水体中的Hg2+,最大吸附容量达到277 mg·g-1。彭灿伟等[28]研发修饰于GCE表面的卟啉基共价有机框架材料(TAPP-TPAL-COF),制备了电化学传感器用于检测水样中的Hg2+,其检出限为3.3 nmol·L-1。XIONG等[29]用羟基和酰胺基团来修饰金属有机骨架材料(MOFs)并用于吸附水体中的汞离子,其去除率为42%~84%。通过不同基团对COFs表面进行修饰后,其对水体中汞离子的最大吸附量可分别高达383、526.3、734和758 mg·g-1[30-33],对汞离子具有很好的去除效果。然而,上述高吸附量材料的制备条件苛刻、步骤繁杂、吸附时间长、基团数目少,这些因素限制了材料在水体汞离子吸附上的应用,而采用简易反应下溶剂法合成COFs材料的研究鲜有报道。因此,该研究在便捷条件下合成COFs材料并考察其在不同环境条件下对汞离子的吸附效果,探究和分析COFs材料与汞离子的反应条件和机理,以期为含汞废水的处理提供新材料及新思路。
1 材料与方法
1.1 COFs材料的合成
分别称取58.00 mg 2,5-二氨基-1,4-苯二硫酚二盐酸盐(C6H10Cl2N2S2)和25.92 mg均苯三甲醛(C9H6O3)置于50 mL离心管中,依次加入20 mL乙腈溶液,于(25±1) ℃数控超声波清洗器中超声后,将2种溶液摇匀、混合后加4 mL冰醋酸溶液(12 mol·L-1),室温静置3 d。反应期间定期振荡,使其充分反应离心后,依次用四氢呋喃、无水乙醇分别清洗材料3次,于50 ℃的真空下干燥12 h得到合成产物(COFs材料),材料的合成路线如图1所示。

图1 COFs材料的合成过程Fig.1 Schematic of the construction of COFs
1.2 材料的表征与分析
通过FT-IR、XRD、SEM等技术分别对COFs材料的形态结构、物相组成和元素组成等进行表征。溶液中的汞离子浓度采用原子荧光光度计进行测定。
1.3 吸附试验
取一定量的COFs材料置于50 mL离心管中,加入20 mL一定浓度的汞离子溶液,于25 ℃、130 r·min-1的摇床振荡器中反应一定时间后,通过4.5 μm孔径微孔滤膜后取其滤液,使用原子荧光光度计测定溶液中汞离子浓度。
1.4 数学模型
1.4.1吸附等温线模型
用Langmuir 模型和Freundlich 模型对COFs材料进行线性拟合分析。
Langmuir吸附等温式为
(1)
(2)
Freundlich吸附等温式为
(3)
(4)
式(1)~(4)中,qe为吸附反应达到平衡时的吸附量,mg·g-1;Ce为吸附反应达到平衡时水体中的汞离子质量浓度,mg·L-1;qm为饱和吸附量,mg·g-1;KL为Langmuir吸附反应的平衡常数,min-1;KF为Freundlich吸附反应的平衡常数,g·mg-1·min-1;n为Freundlich常数。
1.4.2吸附动力学模型
采用准一级和准二级动力学方程对不同时间的吸附量进行拟合。
准一级吸附动力学模型为
Qt=Qe(1-e-K1t),
(5)
ln(Qe-Qt)=lnQe-K1t。
(6)
准二级吸附动力学模型为
(7)
(8)
式(5)~(8)中,t为吸附时间,min;Qt为t时刻的吸附量,mg·g-1;Qe为平衡时间的吸附量,mg·g-1;K1为准一级动力学吸附效率常数,min-1;K2为准二级动力学吸附效率常数,g·mg-1·min-1。
2 结果与讨论
2.1 材料的表征
COFs材料的SEM扫描图如图2所示,在2 μm的放大尺寸下可以观察到其材料主要以杆状为主,COFs材料整体上不平整,较为粗糙和松散。在放大至500 nm时,可以观察到COFs材料片块状结构堆叠较为松散,中间存在孔隙结构,具有吸附材料的特征。

图2 COFs材料的SEM图Fig.2 SEM spectra of COFs material
在500 nm下观察到材料表面粗糙且分布不均匀,结构松散,缝隙及空隙增加,有效增大吸附材料表面积,有利于吸附反应的进行。将微小晶体颗粒进行能谱表面元素分析,发现其由C、N、O、S 元素组成,其质量分数分别为58.89%、15.91%、5.87%、19.32%(图3)。

图3 COFs材料的EDS能谱图Fig.3 EDS of COFs material
为进一步探究COFs材料的结构,对合成的COFs材料进行X射线扫描,图4为COFs材料的XRD图谱。由图4可知,COFs材料在2θ为5.21°处为宽峰,对应的平面处(晶面指数为100)出现了良好的特征衍射峰[34];2θ为27.1°处的宽峰主要是由于COF层之间的π-π堆叠并对应于(晶面指数为001) 平面[35]。与文献[34-35]对应的数据基本一致,这表明试验成功合成了COFs材料。
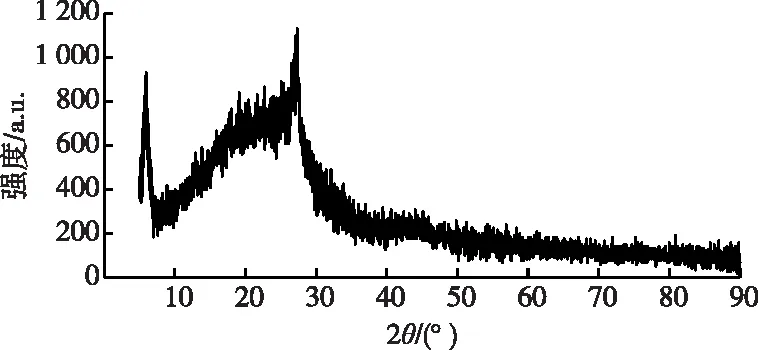
图4 COFs材料的XRD图Fig.4 XRD patterns of COFs material
由图5可知,在材料C6H10Cl2N2S2、COFs和COFs+Hg2的FTIR图中,3 460 cm-1附近出现的峰值波动是N—H键的伸缩振动。

a—C9H6O3,b—C6H10Cl2N2S2,c—COFs,d—COFs+Hg2+。

此外,COFs材料吸附水体中的汞离子后,1 390和1 100 cm-1处对应的C—H和C—N伸缩振动与吸附前相比发生改变,说明其相关基团参与汞离子的吸附反应。COFs材料对水体中汞离子的吸附反应大多为化学吸附,说明水中的汞离子与材料表面的基团发生离子交换反应。其中,在材料C6H10Cl2N2S2和COFs中,2 580 cm-1附近出现的伸缩振动为—SH键,而COFs+Hg2+在该处无吸收峰,说明材料表面的—SH在吸附过程中提供了氢键,使得汞离子占据了表面的—SH,发生了离子交换。
2.2 COFs材料对水体中汞离子的吸附性能研究
2.2.1初始浓度对吸附量的影响
由图6可知,COFs材料在不同汞离子浓度下吸附性能受到一定的影响。当初始质量浓度在5~200 mg·L-1时,材料对水体中汞离子的吸附量呈线性增长趋势,吸附率也在95%以上,说明此时材料表面还存在许多未被汞离子占据的吸附点位。当初始质量浓度达200 mg·L-1后,COFs材料对水体中汞离子的吸附率随初始浓度的上升迅速下降,但吸附量仍一直上升;初始质量浓度达600 mg·L-1时,吸附量随着初始浓度的上升逐渐趋于平缓,最大吸附量高达587.6 mg·g-1,即吸附反应已达到平衡状态,说明COFs材料表面的吸附位点已饱和。

图6 不同初始质量浓度对吸附量和吸附率的影响Fig.6 Effect of initial concentration on adsorption capacity and adsorption rate
2.2.2吸附等温线
用Langmuir和Freundlich 模型对COFs材料进行线性拟合分析(图7),拟合方程分别为y=0.001 7x+0.006 6(R2=0.997)和y=0.270 0x+2.164 0(R2=0.549)。Langmuir 模型拟合得出饱和吸附容量为588.2 mg·g-1,与试验所测定的饱和吸附容量587.6 mg·g-1接近,且Langmuir 模型的决定系数接近于1,说明COFs材料对水体中汞离子的吸附反应更符合Langmuir 模型,其反应过程是一种均质的单分子层。此外,Freundlich 模型拟合的 1/n为0.27,其值在0.1~0.5之间,说明COFs材料对汞离子的吸附过程是易于进行的。
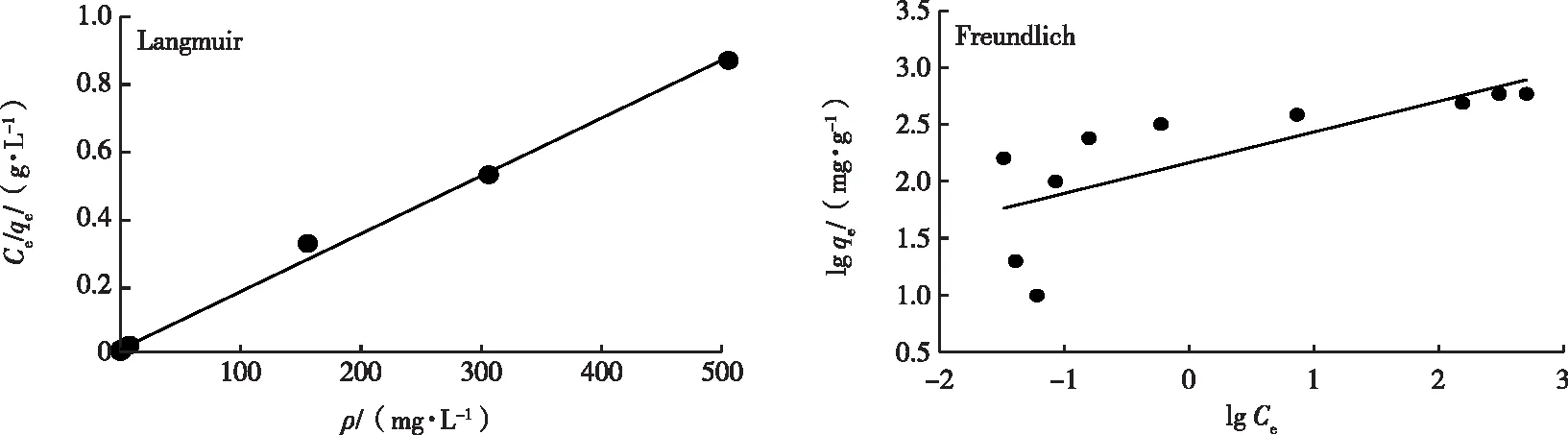
图7 Langmuir和Freundlich吸附等温线Fig.7 Adsorption isotherm of Langmuir and Freundlich model
2.2.3吸附动力学
由图8可知,在反应时间为1 min时,COFs材料对水体中汞离子的吸附量已经达到饱和,随着时间的增长其吸附量趋于平衡,说明COFs材料表面及其内部的吸附点位在短时间内快速吸附汞离子,即吸附反应已达到平衡状态。随着时间的增加其吸附量一直处于平稳状态。
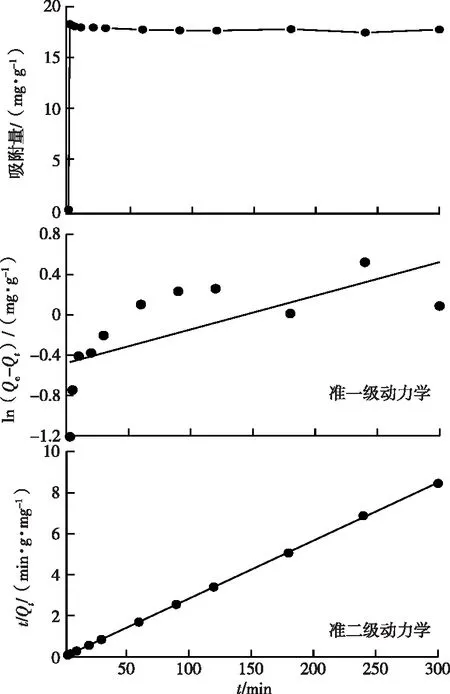
图8 吸附动力学拟合图Fig.8 Adsorption kinetics model of COFs
结合试验数据,采用准一级和准二级动力学方程拟合COFs材料对水体中汞离子的吸附过程,其拟合方程分别为y=0.003 3x-0.478 9(R2=0.470,K1=0.012)和y=0.028 3x-0.005 4(R2=0.999,K2=1.110)。准二级动力学方程的R2值远大于准一级动力学方程,且接近1,同时实验测定的平衡吸附量为36.59 mg·g-1,与准二级动力学方程拟合得到的平衡吸附量35.34 mg·g-1相近。说明准二级动力学模型更符合COFs材料对水体汞离子的吸附过程,该吸附属于化学反应。
2.2.4pH值对吸附率的影响
溶液pH值对COFs材料吸附汞离子具有一定的影响,探究该材料在不同pH值下对其吸附率的影响。当pH值为1、3、5、7、9和10时,吸附率分别为97.5%、98.9%、97.9%、93.9%、98.3%、96.5%。由数据可知,当pH值在1~10范围内时,COFs材料对水体中汞离子的吸附率并没有随pH值的改变而产生明显变化,而是处于一个较为平缓的状态,且吸附率均在95%以上。说明COFs材料结构稳定,不易受pH值的影响,这对去除水体的汞离子有更广的应用。当 pH值>5时,COFs材料对水体中汞离子的吸附率略有波动,可能是碱性条件下水体中的汞离子易发生水解反应,转换为Hg(OH)+和Hg(OH)2,又因其水解程度不一致,导致吸附率在pH值处于7~10范围,呈现不规律性的变化。总体趋势表明,不同pH值间的吸附率无显著性差异。
2.2.5共存离子对吸附率的影响
为了考察多种金属离子共存的情况下COFs材料对汞离子的吸附效果,采用20 mL初始质量浓度均为10 mg·L-1的混合液(Hg、Cu、Mn、Ni、Zn、Cd、Pb),用于探究共存离子对其吸附性能的影响。溶液中Hg、Cu、Mn、Ni、Zn、Cd和Pb离子的吸附率分别为66.4%、22.1%、12.5%、13.3%、9.81%、11.7%和11.4%。使用COFs材料吸附水体中多种重金属离子时,该材料仍可以相对高效快速地吸附水体中的汞离子,其吸附率可达66.4%,显著高于其他金属离子。一般来说,水体中共存的各种金属离子往往会对材料的吸附过程产生一定的抑制影响[36],如WU等[37]研究发现在Cu、Pb和Cd 3种离子共存下,对于各元素的吸附容量相对单离子溶液分别下降了31.1%、74.03%和37.35%。水体中的共存离子对COFs材料吸附汞离子产生一定的影响,可能是水体中的共存离子占据了吸附材料表面及其内部的吸附点位,导致汞离子获得的吸附点位比单个离子溶液少,造成其吸附率降低。共存离子溶液中,离子与材料发生的有效碰撞几率降低也会导致吸附效果降低。此外,巯基具有弱酸、易被氧化等特性,该材料在进行吸附过程中—SH容易氧化失活,这也是造成其吸附率降低的重要原因之一。
2.2.6重复利用
吸附材料的重复利用可以减少资源浪费,是衡量其吸附性能的主要指标之一。因此,对COFs材料进行5次吸附-洗脱重复测试,采用低浓度盐酸(3 mol·L-1)进行洗脱,考察该材料的连续重复利用性能。第1~5次重复利用的吸附率分别为92.6%、82.1%、66.4%、55.4%和54.4%,第5次与第1次循环相比吸附率降低了38.2百分点。随着重复利用次数的增加,COFs材料的吸附性能出现降低趋势。第4次与第5次重复测试时的吸附率相差较小,COFs材料的吸附性能不会随着重复利用次数的增加而急剧下降,连续重复5次后其吸附率仍保持原COFs材料一半的去除效果。
2.3 吸附机理

3 结论
(1)通过表征试验得出,合成的材料存在与汞离子具有亲和作用的—HS、—H和—NH2基团,这些基团对材料吸附汞离子起到重要的作用。
(2)水体汞离子初始质量浓度为600 mg·L-1时,COFs材料对其达到最大吸附量587.6 mg·g-1。反应过程符合Langmuir吸附等温方程和准二级动力学模型,表明该吸附是一种均质的单分子层且属于化学吸附。
(3)COFs材料在1 min内达到吸附平衡,且不易受溶液pH值和复合金属离子的影响。pH值在1~10范围内时,COFs材料对水体中汞离子的吸附率均为95%左右,且在多种金属离子共存时,该材料对水体中汞离子的吸附率仍可达66%,显著高于其他金属离子的吸附率。同时,COFs材料进行5 次连续循环使用后,其吸附率仍保持在54.4%。
