海水胁迫下外源海藻糖对黄秋葵幼苗耐盐性的影响
2023-08-24程玉静王小秋戴志刚谢冬微
刘 畅,程玉静,王小秋,仇 亮,刘 岩,戴志刚,谢冬微,孙 健
(1.南通大学生命科学学院 江苏南通 226019;2.江苏沿江地区农业科学研究所 江苏南通 226019;3.中国农业科学院麻类研究所 长沙 410205)
盐胁迫是全球性的非生物胁迫,中国的盐渍化土地面积已经超过1 亿hm2,沿海滩涂面积约217 万hm2,并有逐渐扩大的趋势,导致耕地面积逐渐减小,农业生产力下降[1]。在江苏沿海地区,滩涂总面积达29.5 万hm2,居各省份之首。土壤中盐分的积累对植物生长危害很大,会导致植物由于离子失衡而引起离子毒害、营养亏缺以及由失水导致的渗透胁迫[2]。提高植物的抗盐性是缓解盐胁迫对植物伤害及减少产量损失的关键措施。
海藻糖(trehalose)是一种在植物体内广泛存在的、含量较低的非还原性二糖分子。海藻糖在维持植物体内渗透压、参与信号转导过程等方面发挥了重要作用,对维持植物正常生长发育具有重要意义[3]。海藻糖是植物新陈代谢过程中的一种应激性适应物质,对生物膜、蛋白质等高分子具有非特异性保护作用[4]。研究表明,外源海藻糖对小麦幼苗的细胞质膜及膜上蛋白具有保护作用,可保护细胞质膜的稳定性,缓解盐胁迫对小麦幼苗生长的抑制作用[5]。外源海藻糖对NaCl 胁迫条件下甘草幼苗可溶性糖积累具有一定的抑制作用,有利于甘草幼苗的正常生长[6]。外源海藻糖可提高脯氨酸含量,增加盐胁迫下类胡萝卜素及酚类物质的积累,保护细胞膜,抑制脂质过氧化,减轻盐胁迫对草莓植株的抑制作用[7]。植物体内Na+、K+含量及Na+/K+是植物抗盐性的重要指标,适宜浓度的海藻糖也可以降低植物体内Na+积累,维持NaCl 胁迫下K+和Na+的相对平衡,从而减轻盐离子对植物造成的伤害[8]。
黄秋葵(Abelmoschus esculentusL.)原产于非洲,亦称秋葵、咖啡黄葵,俗名羊角豆、补肾草。在江西萍乡,当地人称之为洋辣椒,美国人叫它植物黄金金秋葵。黄秋葵的花、果实和种子中含有多种营养保健成分,具有降血糖、助消化、防治糖尿病、保护胃肠功能、抗肿瘤等多种功效[9-10]。黄秋葵还可以深加工成花茶、饮料、胶囊、干蔬、食用油等,是食用价值极高的蔬菜[11]。目前,关于黄秋葵的研究主要集中在营养品质的开发和利用以及栽培技术等方面。在耐盐性研究方面,李啟萌等[12]研究发现,无论是红秋葵种子还是黄秋葵种子对盐分的耐受程度均较低,NaCl 溶液浓度高于0.05 mol·L-1后就会对种子萌发产生一定的抑制作用。王永慧等[13]研究表明,随盐胁迫浓度增加,黄秋葵种子发芽率、发芽势、发芽指数、活力指数、上胚轴长、根长、苗鲜质量等性状指标均逐步下降,盐害系数逐步增大。郭艳超等[14]以芙蓉葵和黄秋葵为试验材料,发现黄秋葵种子发芽率随着盐胁迫浓度的增大呈逐渐降低趋势,发芽速度、发芽率、胚根长度、胚轴长度以及储藏物质转运效率和相对干质量均受到盐胁迫的影响。有关海水胁迫下外源海藻糖对黄秋葵耐盐性影响的研究则鲜有报道。笔者的研究以耐盐性不同的2 个黄秋葵品种为材料,分析海水胁迫下外源施用海藻糖对黄秋葵幼苗生长、生物量、Na+和K+含量及海藻糖含量的影响,以期为明确外源海藻糖对提高黄秋葵耐盐性的作用机制,发展沿海地区黄秋葵生产提供理论依据。
1 材料与方法
1.1 材料
黄秋葵耐盐型品种无角香蕉和盐敏感型品种非洲秋葵来自中国农业科学院麻类研究所。海水取自江苏省南通市东灶港镇,盐度为3.12%。其基本离子组成为Na+含量(ρ,下同)9.73 g·L-1、Cl-含量15.62 g·L-1、Ca2+含量0.49 g·L-1、Mg2+含量0.32 g·L-1、K+含量0.86 g·L-1、SO42-含量2.59 g·L-1、HCO3-含量0.35 g·L-1。
1.2 试验设计
1.2.1 黄秋葵幼苗的培养 试验于2021 年5 月在南通大学植物园进行。挑选大小一致、饱满的黄秋葵种子,用浓度为3%的次氯酸钠消毒10 min,再用蒸馏水将种子清洗干净。将黄秋葵种子浸种,出芽后播于装有营养土的育苗盘内。育苗盘规格为52 cm×26 cm×10 cm,每个育苗盘含50 穴,每排10 穴,每列5 穴,穴的规格为5 cm×5 cm。每个品种播2 盘,每穴播3~4 粒种子。幼苗在温室内培养,出苗后进行间苗,每穴留1 棵苗,即每个品种100 棵苗,3 次重复,共300 棵苗。待苗长至2 叶1心时进行海水处理。
1.2.2 海水胁迫处理及海藻糖喷施 将海水与蒸馏水按照1∶1 的体积比配制成50%浓度的海水溶液进行胁迫处理,蒸馏水浇灌为对照(CK)。在海水处理及外源海藻糖喷施前,将育苗盘平均分为5份,每一份幼苗用于喷施不同浓度的海藻糖。海藻糖购自上海源叶生物科技有限公司,主要成分为海藻糖,纯度为98%。试验采用完全随机设计,外源海藻糖溶液设置0(蒸馏水)、5、10、15、20 mmol·L-15个浓度,整株喷施,从开始海水处理时的每天傍晚喷施,连续喷10 d。海藻糖溶液中加入0.3%浓度的吐温20,使溶液不易挥发,以利于海藻糖被植物吸收。
1.2.3 测定指标及方法 于海水处理后的第11 天进行性状指标测定,包括苗高、地上部鲜质量、根鲜质量、地上部干质量、根干质量、地上部海藻糖含量、根海藻糖含量、地上部Na+含量、根Na+含量、地上部K+含量、根K+含量、地上部Na+/K+、根Na+/K+,3 次重复。
每个处理随机选取3 棵苗,用直尺测量苗高。将苗缓慢从育苗盘中带土拔出,注意保持根系完整,用自来水将根部泥土洗净,再用蒸馏水冲洗,吸水纸吸干水分。将苗的根和地上部剪开,用万分之一电子天平分别称取鲜质量;置于105 ℃烘箱中杀青,80 ℃烘干至恒质量,称取干质量。将样品磨成粉末,过100 目筛,准确称取0.100 0 g,放入具塞试管内,加入10 mL 100 mmol·L-1的乙酸在90 ℃的恒温水浴锅中提取2 h,用火焰光度计测定Na+和K+含量[15]。Na+/K+=Na+含量/K+含量。
采用蒽酮-硫酸法[16]测定海藻糖含量,略有改动。称取0.5 g 黄秋葵样品,与5 mL 0.5 mmol·L-1的三氯乙酸溶液在冰水浴中混合研磨,0 ℃下震荡12 h。6000 r ·min-1下 离 心15 min,取 上 清 液1 mL,加入4 mL 0.12%的蒽酮-硫酸混合试剂,沸水浴中加热5 min ,冷却后于紫外分光光度 计 590 nm 处 测 定 吸 光 值。用0~200 μ L的0.100 0 g·100 mL-1海藻糖标准品做标准曲线。
1.3 数据分析
采用Microsoft Excel 2019 进行数据整理,用SPSS 21.0 软件的Duncan 法在0.05 水平上进行差异显著性分析。
2 结果与分析
2.1 外源海藻糖对海水胁迫下黄秋葵生物量的影响

图1 不同浓度海藻糖对海水胁迫下黄秋葵苗高的影响Fig.1 Effect of different concentration of trehalose on seedling height of okra under seawater stress
在对照条件下,耐盐品种无角香蕉和盐敏感品种非洲秋葵的地上部鲜质量分别为1.11 和1.25 g,根鲜质量分别为0.34 和0.45 g,无角香蕉的植株鲜质量小于非洲秋葵(图2)。海水胁迫未施用海藻糖条件下,2 个品种的地上部鲜质量和根鲜质量均显著减少。与对照相比,海水胁迫下无角香蕉地上部鲜质量和根鲜质量的降低幅度分别为21.09%和20.94%,小于非洲秋葵地上部鲜质量和根鲜质量降幅的48.61%和52.71%,说明海水胁迫对无角香蕉幼苗鲜质量的影响小于非洲秋葵。海水处理后随着外源海藻糖浓度的升高,2 个品种的地上部鲜质量和根鲜质量均呈先升高后降低的趋势。其中,海藻糖浓度为15 mmol·L-1时2 个品种的地上部鲜质量最大,与0 mmol·L-1时差异均显著。对于无角香蕉而言,海藻糖浓度为10 mmol·L-1时根鲜质量最大,与0 mmol·L-1时差异显著;对于非洲秋葵而言,海藻糖浓度为15 mmol·L-1时根鲜质量最大,与0 mmol·L-1时差异显著。
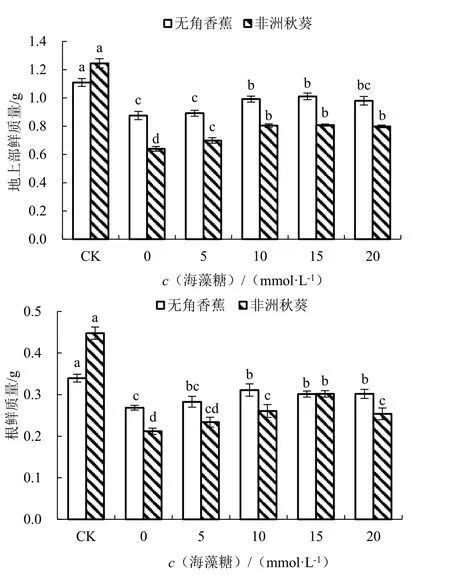
图2 不同浓度海藻糖对海水胁迫下黄秋葵地上部和根鲜质量的影响Fig.2 Effect of different concentration of trehalose on fresh weight of aerial part and root of okra under seawater
在对照条件下,无角香蕉和非洲秋葵的地上部干质量分别为0.18 和0.16 g,根干质量分别为0.036 和0.052 g;海水胁迫未施用海藻糖条件下,2个品种的地上部干质量和根干质量均显著减少,表明海水胁迫会对黄秋葵苗干质量产生显著的抑制作用(图3)。与对照相比,2 个品种的地上部干质量分别降低了12.36%和25.39%,根干质量分别降低了24.94%和32.01%,无角香蕉比非洲秋葵降低的少,说明海水胁迫对无角香蕉苗干质量的影响小于非洲秋葵。随着外源海藻糖浓度的升高,无角香蕉和非洲秋葵的地上部干质量和根干质量均呈先升高后降低的趋势,其中海藻糖浓度为15 mmol·L-1时的地上部干质量和根干质量最大,2 个品种与0 mmol·L-1时差异全部达显著水平,处理效果最好。
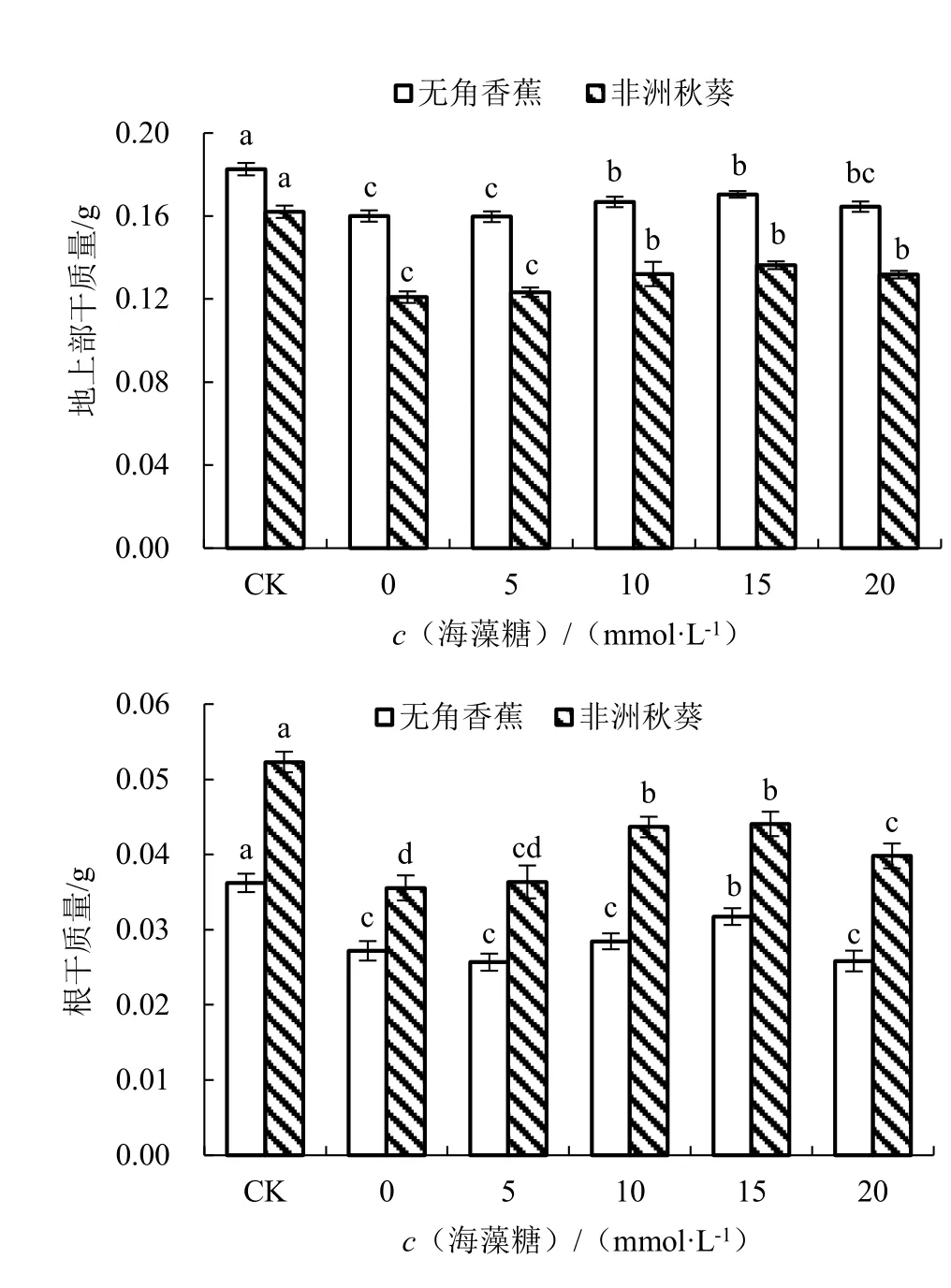
图3 不同浓度海藻糖对海水胁迫下黄秋葵地上部干质量和根干质量的影响Fig.3 Effect of different concentration of trehalose on dry weight of aerial part and root of okra under seawater stress
2.2 外源海藻糖对海水胁迫下黄秋葵Na+、K+含量的影响
为了研究外源海藻糖对海水胁迫下黄秋葵Na+和K+积累的影响,对耐盐性不同的2 个黄秋葵品种进行海水处理,并施以不同浓度的海藻糖,测定Na+、K+含量。结果由图4 所示,在对照条件下,耐盐品种无角香蕉和盐敏感品种非洲秋葵的地上部Na+含量(b,后同)分别为0.41 和0.43 mmol·g-1,根Na+含量分别为0.55 和0.44 mmol·g-1,处于含量较低的水平。海水胁迫未施用海藻糖条件下,2 个品种的地上部和根Na+含量均大幅增加,差异显著,表明海水胁迫会促进黄秋葵Na+的积累,而在根中的积累要明显多于地上部。与对照相比,2 个品种的地上部Na+含量分别增加了129.59%和167.27%,根Na+含量分别增加了250.51%和344.75%,无角香蕉比非洲秋葵增加的少,说明无角香蕉在海水胁迫下可以积累相对较少的Na+。随着外源施用海藻糖浓度的升高,无角香蕉地上部Na+含量呈先升高后降低的趋势,根Na+含量呈先降低后升高的趋势;而非洲秋葵的变化趋势与此相反。其中海藻糖浓度 为20 mmol·L-1时,无角香蕉的地上部Na+含量最 低,与0 mmol ·L-1时 差 异 显 著;海 藻 糖 浓度为15 mmol·L-1时,非洲秋葵的地上部Na+含量最低,与0 mmol·L-1时差异显著;2 个品种的根Na+含量均在海藻糖浓度为15 mmol·L-1时最低,且均与0 mmol·L-1时差异显著。
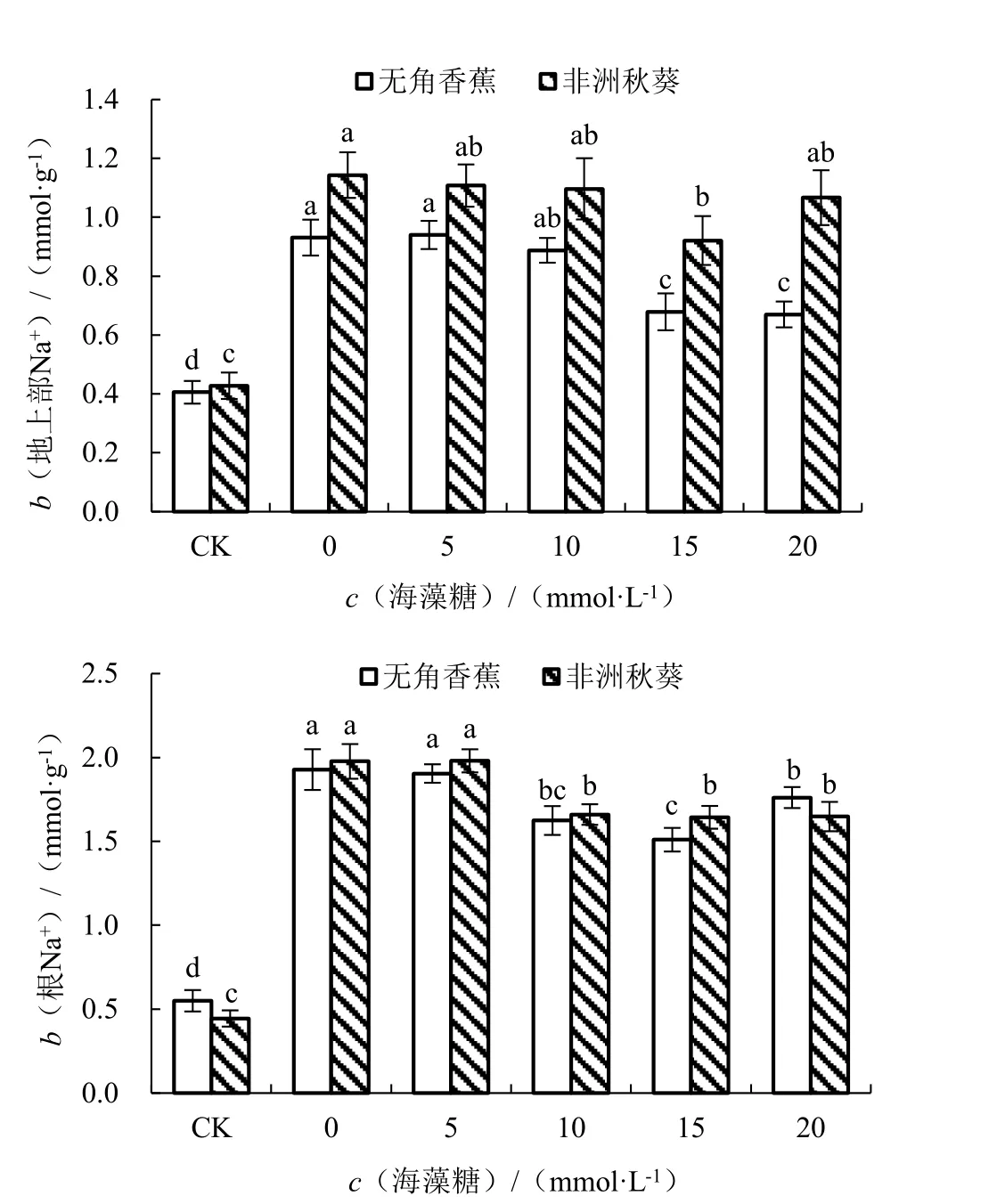
图4 不同浓度海藻糖对海水胁迫下黄秋葵地上部和根Na+含量的影响Fig.4 Effect of different concentration of trehalose on Na+content of aerial part and root of okra under seawater stress
在对照条件下,耐盐品种无角香蕉和盐敏感品种非洲秋葵的地上部K+含量分别为0.21 mmol·g-1和0.22 mmol·g-1,根K+含量分别为0.25 mmol·g-1和0.28 mmol·g-1,相差不多(图5)。海水胁迫未施用海藻糖条件下,2 个品种的地上部和根K+含量均显著降低,表明海水胁迫会抑制黄秋葵K+的积累。2 个品种地上部K+含量分别降低了36.66%和43.75%,根K+含量分别降低了39.29%和48.65%,无角香蕉比非洲秋葵降低的少,说明无角香蕉在海水胁迫下可以积累相对较多的K+。随着外源施用海藻糖浓度的升高,2 个品种的地上部K+含量和非洲秋葵的根K+含量均呈先升高后降低的趋势,无角香蕉的根K+含量呈逐渐升高的趋势。除无角香蕉在0 mmol·L-1和20 mmol·L-1海藻糖浓度下根K+含量差异显著外,2 个品种在施用各浓度海藻糖后的地上部K+含量、根K+含量差异均不显著,说明外源海藻糖对提高海水胁迫下黄秋葵K+的积累能力有限。其中海藻糖浓度为15 mmol·L-1时的地上部K+含量积累最多;浓度为20 mmol·L-1时,无角香蕉的根K+含量最高;浓度为15 mmol·L-1时,非洲秋葵的根K+含量最高。

图5 不同浓度海藻糖对海水胁迫下黄秋葵地上部和根K+含量的影响Fig.5 Effect of different concentration of trehalose on K+content of aerial part and root of okra under seawater stress
在对照条件下,耐盐品种无角香蕉和盐敏感品种非洲秋葵的地上部Na+/K+分别为1.90 和1.98,根Na+/K+分别为2.22 和1.63(图6)。海水胁迫未施用海藻糖条件下,2 个品种的地上部和根Na+/K+均比对照显著增加,地上部Na+/K+分别增加了280.26%和379.78%,根Na+/K+分别增加了486.35%和748.57%,根的增加幅度大于地上部;无角香蕉比非洲秋葵增加的少,说明无角香蕉在海水胁迫下的Na+/K+较低,具有较高的耐盐性。外源施用海藻糖可降低黄秋葵的Na+/K+,随着施用浓度的升高,2 个品种的地上部和根Na+/K+均呈先降低后升高的趋势。其中海藻糖浓度为15 mmol·L-1时,地上部和根Na+/K+最低,2 个品种与0 mmol·L-1时差异全部达显著水平,处理效果最好。
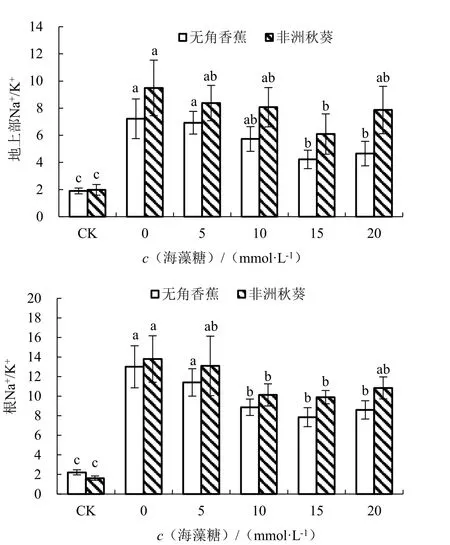
图6 不同浓度海藻糖对海水胁迫下黄秋葵地上部和根Na+/K+的影响Fig.6 Effect of different concentration of trehalose on Na+/K+of aerial part and root of okra under seawater stress
2.3 外源海藻糖对海水胁迫下黄秋葵内源海藻糖含量的影响
不同浓度海藻糖对海水胁迫下黄秋葵内源海藻糖含量的影响如图7 所示,在对照条件下,耐盐品种无角香蕉和盐敏感品种非洲秋葵的地上部海藻糖含量(w,后同)分别为51.97 和48.41 μg·g-1,根海藻糖含量分别为36.12 和31.66 μg·g-1,无角香蕉的海藻糖含量高于非洲秋葵。海水胁迫未施用海藻糖条件下,2 个品种的海藻糖含量均有所增加。地上部海藻糖含量分别增加了11.72%和9.38%,差异分别为不显著和显著;根海藻糖含量分别增加了11.83%和4.90%,差异均不显著,表明海水胁迫会使黄秋葵的内源海藻糖含量增加,且无角香蕉的增加幅度大于非洲秋葵。

图7 不同浓度海藻糖对海水胁迫下黄秋葵地上部和根海藻糖含量的影响Fig.7 Effect of different concentration of trehalose on trehalose content of aerial part and root of okra under seawater stress
随着外源施用海藻糖浓度的升高,无角香蕉和非洲秋葵的地上部海藻糖含量和对照相比均有所增加,但变化幅度较小,各处理之间差异全部不显著;其中海藻糖浓度为20 mmol·L-1时的地上部海藻糖含量最高。无角香蕉的根海藻糖含量呈先降低后升高的趋势,非洲秋葵的根海藻糖含量呈先升高后降低再升高的趋势,差异仍然全部不显著;其中海藻糖浓度为20 mmol·L-1时,无角香蕉的根海藻糖含量最高;海藻糖浓度为5 mmol·L-1时,非洲秋葵的根海藻糖含量最高。以上结果反映出,盐胁迫下外源施用海藻糖对黄秋葵内源海藻糖含量影响不显著。
3 讨论与结论
盐分是抑制植物生长的重要非生物因素,生长情况和生物量是植物抗盐性最直接的指标。曾继娟等[17]研究发现,随着NaCl 浓度的不断增加,匈牙利能源植物SZARVASI-1 的苗高、根长呈先升高后降低的趋势,同时其地上部生物量、地下部生物量和总生物量也随着盐浓度的上升呈先增加后减少的趋势。植物体内Na+和K+含量在盐胁迫后通常会发生较大的变化。韩冰等[18]研究表明,Na+作为海马齿的营养元素在一定浓度范围内可以促进植株生长,但其浓度过高时则影响K+的吸收并产生一定的毒害作用。本研究对黄秋葵幼苗进行海水胁迫处理,与对照相比,无角香蕉和非洲秋葵2 个品种的苗高、地上部和根鲜质量、干质量在处理后显著降低,K+含量显著减少;Na+含量、Na+/K+和海藻糖含量显著增高。海水处理后影响最大的两个性状分别是Na+含量和Na+/K+,2 个品种地上部Na+含量分别增加了129.59%和167.27%,根Na+含量分别增加了250.51%和344.75%。在K+含量减少的情况下,导致地上部Na+/K+分别增加了280.26%和379.78% ,根Na+/K+分 别 增 加 了486.35% 和748.57%。可见,海水胁迫可以导致黄秋葵体内积累大量的Na+,同时使Na+和K+的比例失调。这与前人研究的结果一致。
国内外对植物耐盐性的研究多是以单盐(如NaCl)或双盐(如NaCl 和Na2CO3、NaCl 和NaHCO3)模拟盐胁迫,直接用海水处理的研究较少[1]。滨海盐土的最大特点是土壤和地下水的盐分组成与海水基本一致[19],因而,采用单盐处理往往与实际盐环境有一定的差距。修妤等[20]以黑小麦为材料,发现浓度为5%、10%、20%的海水对种子萌发有轻微促进作用,30%、40%的海水处理可使种子发芽率、发芽势和发芽指数明显下降。李洪燕等[21]采用浓度为10%、20%、30%、40%、50%的海水对苦荬菜幼苗进行处理,结果表明,在10%和20%海水浓度处理下,叶绿素含量、根干质量与对照相比差异不显著。唐宁等[22]以不同浓度海水处理黄秋葵幼苗,结果显示,5%~20%浓度海水可使黄秋葵保持较高的叶绿素含量和净光合速率,抗氧化系统保护酶、可溶性糖和脯氨酸含量也相应提高。笔者的研究采用50%浓度的海水处理黄秋葵幼苗,属于中等程度的盐胁迫水平,在短时间内不会对黄秋葵幼苗造成很大的伤害。与对照相比,海水胁迫后在未施用海藻糖的情况下,2 个品种各性状的变幅范围为4.90%~748.57%。可见,50%浓度海水对黄秋葵幼苗各性状产生了不同程度的影响,且可以对耐盐和盐敏感品种均产生较大的胁迫效果,各性状又在品种间产生了明显的差异,是针对黄秋葵苗期进行海水胁迫试验的一个理想浓度。
笔者的研究设置5 个不同浓度的外源海藻糖溶液进行喷施,以研究外源海藻糖对海水胁迫下黄秋葵耐盐性的影响。结果表明,随着外源海藻糖浓度的升高,2 个品种的大部分性状值均呈先升高后降低的趋势,说明海藻糖可以恢复盐胁迫下黄秋葵的部分性状指标值。高浓度的海藻糖(20 mmol·L-1)并不利于大部分性状指标值的恢复,而15 mmol·L-1是最适宜的施用浓度。以往研究外源海藻糖对植物耐盐性的影响大都筛选出了最适海藻糖浓度,如玉米幼苗盐胁迫的最佳海藻糖施用浓度为10 mmol·L-1[23],甘草幼苗盐胁迫的最佳海藻糖施用浓度为15 mmol·L-1[6],黄瓜幼苗盐胁迫的最佳海藻糖施用浓度为10 mmol·L-1[24],2 mmol·L-1海藻糖处理对提升小麦品种扬麦19 幼苗在盐胁迫下的各项指标效果最明显[25],NaHCO3胁迫下施用20 mmol·L-1海藻糖可使南蛇藤几种与抗逆性有关的生理生化指标含量明显提高[26],而30 mmol·L-1的外源海藻糖可有效减轻盐胁迫对草莓植株的抑制效应[7]。可见,不同研究得出的最佳海藻糖浓度并不一致,从2 mmol·L-1到30 mmol·L-1,浓 度 跨 度 较大。本研究中的15 mmol·L-1最佳海藻糖施用浓度与以上一些研究结果并不一致,这可能与不同植物、不同的盐处理浓度有关,也可能是海藻糖施用方式的不同,如海藻糖溶液浸种、盐处理前海藻糖预处理、盐溶液中加入海藻糖、盐处理后海藻糖喷施等。在植物中,海藻糖参与调控植物应对多种胁迫的应答[27]。然而一些研究认为,海藻糖在保护植物中可能不起主导作用,而是诱导特定信号的转导,起到调控内源性海藻糖生物合成途径的作用[4]。有研究表明,过表达内源海藻糖合成酶基因可以提高植物的抗旱性,但内源海藻糖含量并没有明显提高。因此,在转基因植物中积累的内源海藻糖不太可能作为渗透保护剂发挥作用[28-29]。在外源海藻糖研究方面,对盐胁迫下的草莓施用外源海藻糖只提高了脯氨酸含量,而内源海藻糖含量并没有提高[7],这与本研究结果一致。但仍有研究显示外源海藻糖可以提高植物内源海藻糖的含量[30-31],说明不同植物、不同生长发育时期、不同逆境处理以及不同海藻糖施用方法和用量均可能导致内源海藻糖在植物体内变化规律的不同。
综上所述,50%浓度的海水胁迫下,黄秋葵幼苗的苗高、鲜质量和干质量显著降低,K+含量显著减少,Na+含量、Na+/K+显著增加,耐盐品种无角香蕉中各项指标的变化幅度明显小于盐敏感品种非洲秋葵。外源喷施15 mmol·L-1的海藻糖溶液可以显著提高黄秋葵幼苗在海水胁迫下的生物量和K+含量,降低Na+含量和Na+/K+。外源海藻糖不能显著提高海水胁迫下黄秋葵幼苗的内源海藻糖含量。
