草棉同源四倍体后代性状鉴定与遗传解析
2023-08-23荣二花杨亚杰李昱樱吴玉香
荣二花,杨亚杰,李昱樱,吴玉香
(山西农业大学农学院,山西 太谷 030801)
棉花属于锦葵科(Malvaceae)棉属(Gossypium)一年生或多年生草本植物,分布于热带和亚热带地区。棉属有53 个种,其中7 个为异源四倍体棉种(2n=4x=52),基因组为AD 组,其余的皆为二倍体棉种 (2n=2x=26),基因组分别为A、B、C、D、E、F、G 和K[1]。棉花有4 个栽培种,包括亚洲棉(G.arboreum)、草棉(G.herbaceum)、陆地棉 (G.hirsutum)和海岛棉 (G.barbadense)。Wendel[2]和Palmer 等[3]认为草棉是四倍体棉种A基因组的祖先供体种,但多年来普遍一致的看法是A1组的草棉和A2组的亚洲棉都可能是异源四倍体棉种A 基因组的祖先供体种[4]。草棉和亚洲棉均是二倍体栽培种,与陆地棉和海岛棉相比,草棉的种植面积较小,但草棉具有其他棉种所没有的优良性状,如极早熟性、耐高温、抗旱、抗盐碱和抗卷曲叶病毒等[5]。
多倍化是植物进化及新物种形成的重要途径。多倍体植物在自然界中普遍存在。目前关于植物多倍体的鉴定方法已有大量文献报道。例如,陈敏敏等[6]利用流式细胞术对61 份百合(Lilium brownii)品种进行染色体倍性分析,鉴定出了多个整倍体及非整倍体。Tränkner 等[7]对二倍体、三倍体、四倍体观赏作物绣球(Hydrangea macrophylla)形态性状进行比较,发现四倍体绣球器官巨型化。Li 等[8]通过诱变获得了四倍体刺槐(Robinia pseudoacacia),其气孔的长度和宽度均大于二倍体植株,但气孔密度较小。四倍体黑果腺肋花楸(Aronia melanocarpaElliot)叶片中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase, CAT)的活性较二倍体显著升高[9]。
本实验室在利用草棉进行多倍体育种方面取得了创新性的进展,首先利用秋水仙碱对二倍体草棉进行染色体诱变,成功获得草棉同源多倍体[10];并经流式细胞仪鉴定出同源三倍体和同源四倍体植株,然后对不同倍性的草棉进行了形态学、细胞遗传学分析和相关序列扩增多态性(sequence-related amplified polymorphism,SRAP)分子标记鉴定[11]。另外,通过对不同倍性的草棉叶片进行转录组测序,获得了草棉同源多倍体与二倍体间的差异表达基因信息,为研究同源多倍体的表型变化及其染色体加倍过程中遗传物质的变化提供了依据,并筛选到了与抗性相关的候选基因[12]。
本研究在前期实验的基础上,进一步对草棉同源四倍体后代S1、S2的性状进行评价和比较,以期筛选出用于遗传研究的、育性稳定且综合性状优良的草棉同源四倍体新种质,拓宽棉花种质资源。
1 材料与方法
1.1 材料
研究所用材料:二倍体红星草棉、草棉同源四倍体S1和S2代。实验室前期以二倍体红星草棉为材料,利用秋水仙碱对其进行多倍体诱变,诱变株自交结铃所得种子为S1,S1播种后长成健康植株并自交结铃,收获种子为S2。
1.2 材料种植
育苗主要有以下步骤:(1)浸种:将二倍体草棉、S1和S2种子分别置于60 ℃温水中浸泡24 h。(2)移至培养皿:在培养皿底部垫上干净湿润的滤纸,将冲洗干净的种子置于滤纸上,放恒温(36 ℃)培养箱萌发。(3)移至广口瓶:待种皮完全脱落,子叶展开时,将其移到营养水溶液(海藻浓缩植物营养液- 通用型和水的体积比为1∶400)中进行培养。(4)移至营养钵:待幼苗长出大量侧根且开始长出真叶时,可转移至营养钵培养(基质和营养土体积比为1∶3)。(5)移至花盆:待幼苗长出4~6 片真叶后,选取长势良好的幼苗,将其移栽到花盆,花盆直径为40 cm,每盆种植1株,置于温室大棚内生长。
1.3 倍性鉴定
待二倍体草棉、S1和S2长成健康植株且进入花蕾期后,将棉花叶片送至金迪智远生物科技(北京)有限公司用流式细胞仪(Sysmex CyFlow Space,德国)进行倍性鉴定。步骤如下:(1)取0.5 cm2的嫩叶切碎,放于培养皿中,加入400 μL裂解液静置10 s,用于提取完整细胞核。(2)用30 μm 微孔过滤膜将细胞核提取混合液过滤至样品管中。(3)向样品管中加入1 600 μL 染液,染色约10 s。(4)上机测试。具体步骤参照仪器使用说明书。
1.4 植株形态鉴定
对经过倍性鉴定的草棉同源多倍体植株进行长势和形态(包括整株、叶片和花等)观察并拍照,比较分析其差异性,从形态学角度鉴定不同世代草棉同源四倍体棉株的差异。
1.4.1叶片形态与面积观测。于花蕾期,在每株棉花相同节位处选择无病虫害且生长健康的叶片进行拍照,再选择3~5 片叶使用LI-3000A 便携式叶面积分析仪(浙江托普云农科技股份有限公司)测量叶面积和叶形指数(叶长与叶宽的比值),并进行统计分析。
1.4.2花的形态性状观察。在开花期,对二倍体草棉、不同世代同源四倍体植株各摘取3~5 朵当天开放的花,分析比较其苞叶、花冠、花斑、花药及散粉情况等相关性状的差异。
1.4.3种子及纤维性状观察。结铃期选取二倍体草棉、同源四倍体S1和S2的可育植株,分别进行单株结铃数的统计。吐絮期收获棉花进行铃室数、单铃种子数的统计和纤维长度的测量,并对收获的种子拍照。
1.5 细胞学观察
1.5.1单个视野下的平均气孔数量、气孔长度和保卫细胞内叶绿体数量测定。取花蕾期新鲜棉花叶片,洗净后切取主叶脉周围1 cm×1 cm 大小叶片浸泡于卡诺氏固定液(无水乙醇与冰乙酸的体积比为3∶1)中脱色10 h 以上;将脱色后的叶片用蒸馏水清洗几次,取约2 mm×2 mm 大小切片置于载玻片上,下表皮朝上,滴2 滴1%(体积分数)的I2-KI 溶液染色2~5 min,盖上盖玻片;在显微镜(目镜10 倍、物镜40 倍)下,共取10 个视野统计单个视野下的平均气孔数量;在显微镜(目镜10 倍、物镜100 倍)下,共选取30 个气孔测量气孔长度,并选取20 对保卫细胞,统计保卫细胞中的叶绿体数量,计算其平均值。
1.5.2花粉母细胞减数分裂及花粉粒统计。在草棉同源四倍体S1和S2的开花期,取新鲜的花蕾(或当天开放的花朵),用镊子剥去苞叶、花萼和花瓣,将4~6 粒花药置于干净载玻片上,滴加改良的卡宝品红染液,用解剖针将花药轻轻压碎,挤出花粉母细胞,用镊子去除肉眼可见的杂质,盖上盖玻片。在显微镜(目镜10 倍×物镜40 倍)下选取600 个花粉母细胞进行减数分裂观察,并统计多分体和花粉粒的数量。
1.6 生理生化指标测定
1.6.1抗氧化酶活性和渗透调节物质含量的测定。开花期选取草棉二倍体、同源四倍体S1和S2的幼嫩叶片迅速放入—80 ℃冰箱保存,依照王三根[13]的方法测定SOD 活性、过氧化物酶(peroxidase, POD)活性、CAT 活性和脯氨酸含量;参考高俊凤[14]的方法测定丙二醛(malondialdehyde,MDA)、可溶性蛋白和可溶性糖的含量。所有测定指标均设置3 个生物学重复。
1.6.2叶绿素含量测定。在花蕾期,对草棉同源四倍体S1和S2进行SPAD(soil and plant analyzer development, SPAD)值测定,以SPAD 值表征叶绿素含量。使用SPAD-502 手持叶绿素仪(日本柯尼卡美能达),选取每株棉花的底部、中部和顶部的健康叶片进行测量。
2 结果与分析
2.1 倍性鉴定结果
经流式细胞仪测定,二倍体草棉(材料1,对照)的主峰荧光强度为89.68,草棉同源多倍体S1植株(材料2~6)的主峰荧光强度为139.51~187.80,草棉同源多倍体S2植株(材料7~13)的主峰荧光强度为157.11~191.26(表1)。结果表明,材料2(S1植株)为三倍体,材料7(S2植株)为非整倍体,其他材料(材料3~6 和材料8~13)均为四倍体。
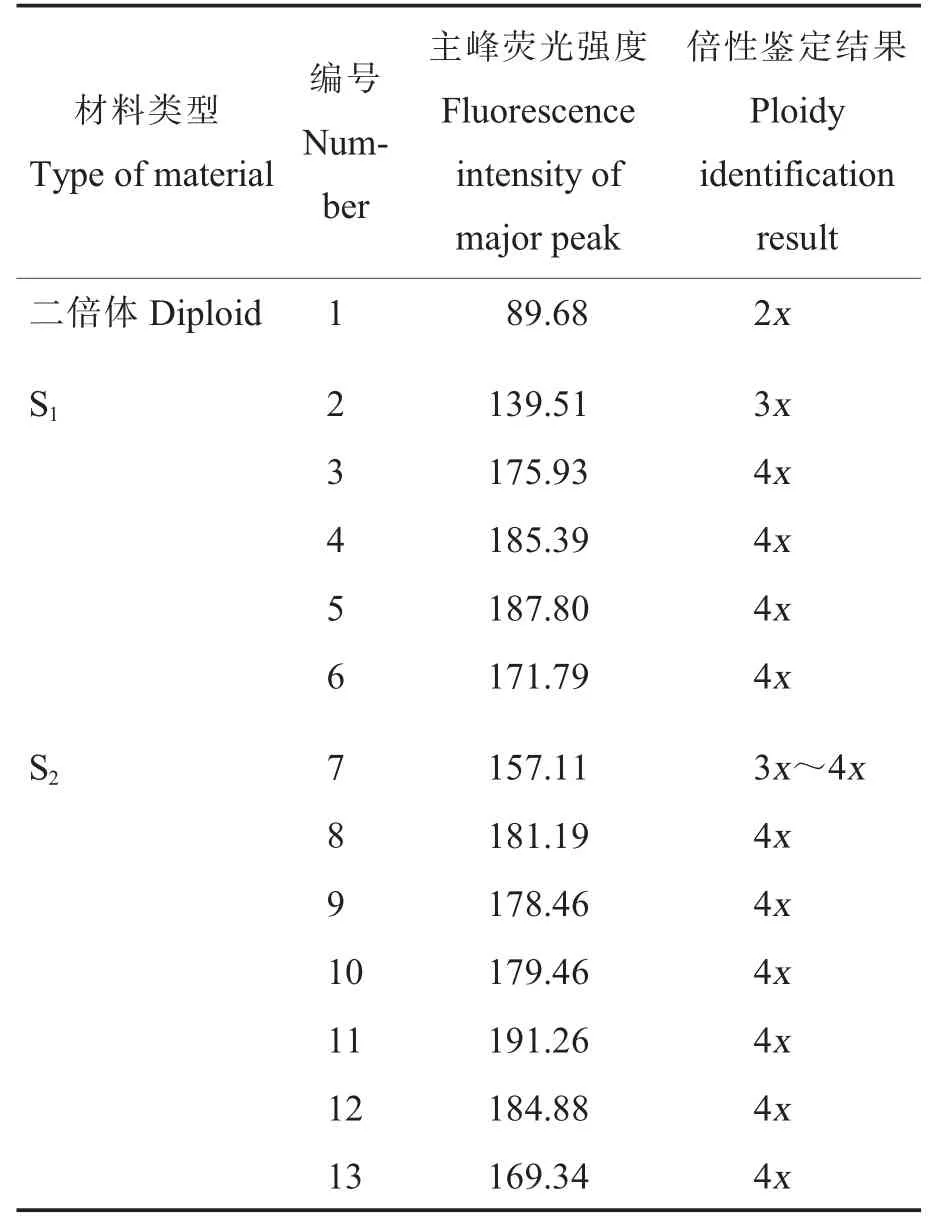
表1 草棉同源四倍体S1 和S2 的倍性鉴定结果Table 1 Ploidy identification results of autopolyploid S1 and S2 of G.herbaceum
2.2 形态学鉴定结果
2.2.1植株、叶片及花的形态比较。草棉同源四倍体S1和S2植株均直立生长。其中S1枝叶较少,叶色为浓绿色或翠绿色;S2植株枝叶茂盛,叶色均为浓绿色(图1)。S1和S2的叶片均呈阔叶状,S2较S1叶面积增加、叶片增厚,S2表现出更强的多倍体优势(图1)。

图1 草棉同源四倍体植株(A)和叶片形态(B)比较Fig.1 Comparison of autotetraploid plants (A) and leaf morphology (B) of G.herbaceum
草棉同源四倍体S2的叶面积极显著高于S1,但S1和S2的叶形指数(叶长/ 叶宽)无显著差异(表2),说明与S1相比,S2的叶长和叶宽等比例增大。上述结果在一定程度上表明同源四倍体植株叶片表型性状正在逐渐稳定。

表2 草棉同源四倍体叶片形态指标分析Table 2 Analysis of the morphologic parameters of leaves of autotetraploid G.herbaceum
对草棉同源四倍体S1和S2花的形态进行比较。S1的花冠呈黄色,紫红色花斑,花药淡黄色、数量较少、部分散粉;S2的花冠也为黄色,但较S1颜色更深,花瓣和苞叶均较S1宽大,有深紫红色花斑,花药黄色、数量较多、大部分散粉(图2)。

图2 草棉同源四倍体花的形态比较Fig.2 Comparison of flower morphology of autotetraploid G.herbaceum
2.2.2S1 与S2 代结铃数统计及种子性状比较。与二倍体亲本相比,草棉同源四倍体S1和S2的单株结铃数和单铃种子数均明显减少,铃室数也有所下降(表3)。材料3~6(S1)共收获15 个棉铃,34 粒种子,单株结铃数分别为2、3、4、6,单株种子数分别为5、9、8、12。材料8~13(S2)共收获23 个棉铃,50 粒种子,单株结铃数分别为2、3、3、4、6、5,单株种子数分别为4、6、5、11、14、10。说明S2育性较S1提高,但同一世代的不同植株之间仍存在明显差异,育性仍需进一步恢复。

表3 草棉二倍体和同源四倍体的种子性状比较Table 3 Comparison of seed characters between diploid and autotetraploid of G.herbaceum
草棉同源四倍体S1和S2种子均大于二倍体种子,且随着世代递增,种子的大小已无明显变化(图3)。草棉二倍体、同源四倍体S1和S2的纤维均细长、呈白色,四倍体S1和S2的纤维长度均显著长于二倍体,但S1和S2之间差异不显著(表3)。结果表明,草棉同源四倍体S1和S2植株在种子大小和纤维长度方面均体现了多倍体优势;且随着世代的递增,种子表型和纤维长度已趋于稳定,S1和S2的相关性状无显著差异。此外,在相同种植条件下,四倍体开始吐絮的时间比二倍体晚30 d 左右。

图3 草棉二倍体和同源四倍体的种子大小及纤维长度比较Fig.3 Comparison of seed size and fiber length between diploid and autotetraploid of G.herbaceum
2.3 细胞学鉴定结果
2.3.1叶片气孔性状和叶绿体数量。与S1相比,S2保卫细胞对的长度、宽度明显增加(图4)。单个视野下,S1和S2的平均气孔数量存在显著差异,S1显著高于S2;气孔长度和保卫细胞对中叶绿体数量的差异均达到极显著水平,S2均极显著高于S1(表4)。结果表明,草棉同源四倍体S2代的气孔大小和叶绿体数量表现出更强的多倍体优势。

图4 草棉同源四倍体的叶片气孔比较Fig.4 Comparison of leaf stomata of autotetraploid G.herbaceum

表4 草棉同源四倍体的叶片气孔性状的统计Table 4 Statistics of stomatal character of leaves of autotetraploid G.herbaceum
2.3.2花粉母细胞减数分裂及花粉粒形态。为进一步研究草棉同源四倍体不同世代的育性恢复情况,对S1和S2的减数分裂进行观察,二者的减数分裂行为均有正常和异常2 种表现,S2减数分裂见图5。在S2的600 个多分体中,分别有2个单分体(0.33%)、4 个二分体(0.67%)、20 个三分体(3.33%)、511 个正常四分体(85.17%)、7 个异常四分体 (1.17%)和56 个其他多分体(9.33%)(表5)。异常的多分体不能形成正常的花粉粒(图6),在S2的600 个花粉粒中,有524个正常花粉粒(87.33%)、76 个异常花粉粒(12.67%)。
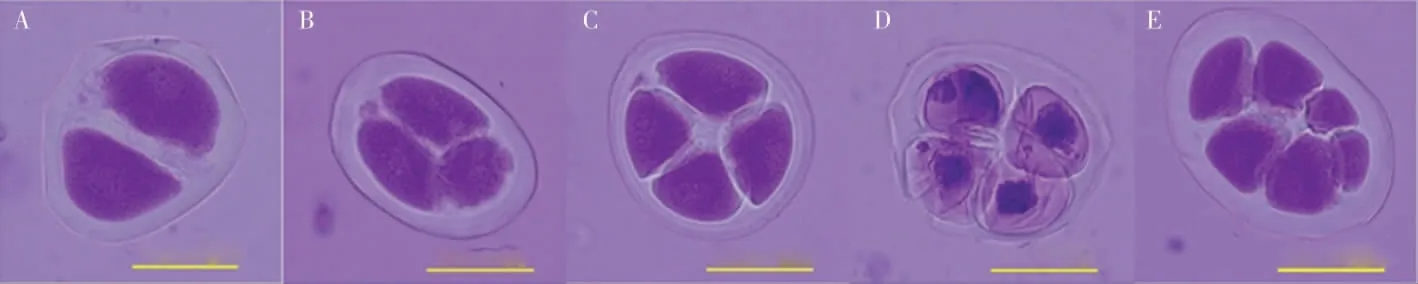
图5 草棉同源四倍体S2 代减数分裂第二次分裂末期Fig.5 Meiosis of telophase Ⅱin autotetraploid S2 generation of G.herbaceum
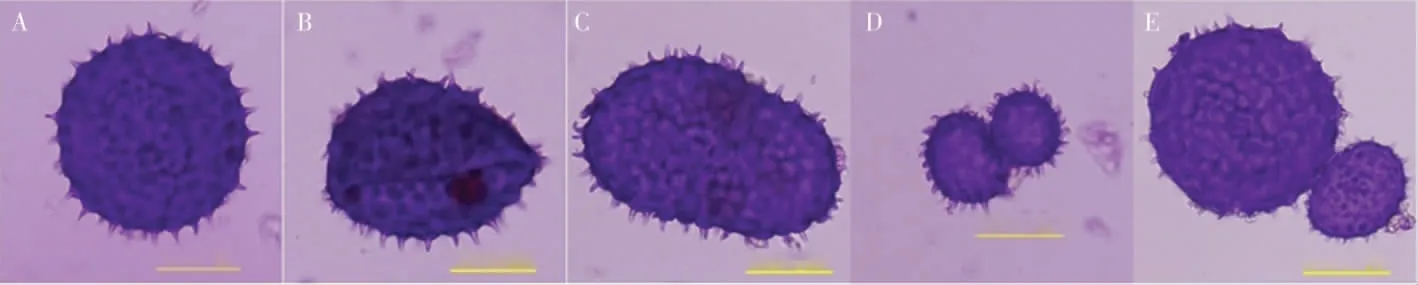
图6 草棉同源四倍体S2 代正常和异常花粉粒Fig.6 Normal and abnormal pollen grains of autotetraploid S2 generation of G.herbaceum
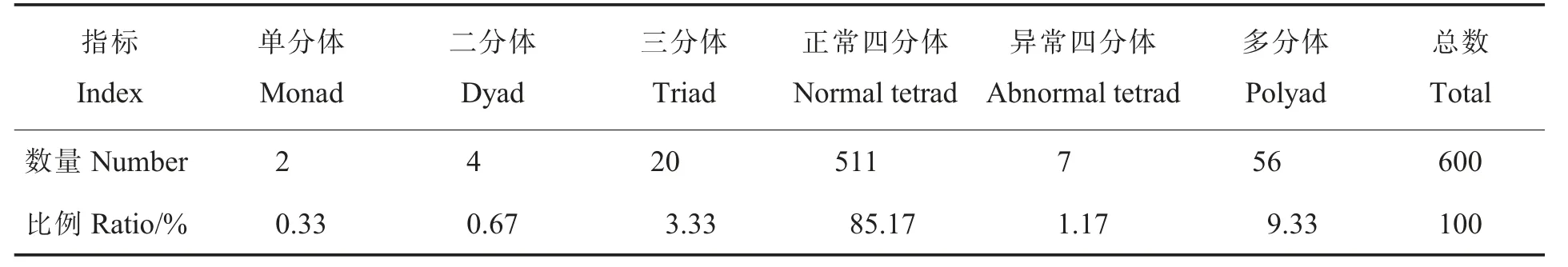
表5 草棉同源四倍体S2 代减数第二次分裂末期多分体数量统计Table 5 Statistics of polyad in telophase II of autotetraploid S2 generation of G.herbaceum
前期研究结果显示:草棉同源四倍体S1减数分裂中正常四分体比例为73.67%,正常花粉粒比例为77.67%[11]。与S1相比,S2正常四分体和正常花粉粒的比例均有明显上升,表明同源四倍体草棉的育性提高并趋于稳定。
2.4 生理生化指标测定
从二倍体到同源四倍体S1再到S2,随着世代的递增,草棉叶片的SOD 活性、POD 活性、CAT活性、MDA 含量、可溶性蛋白含量、可溶性糖含量、脯氨酸含量和叶绿素含量均呈上升趋势,且同源四倍体S2与二倍体之间上述各指标的差异均达到显著水平。与二倍体亲本相比,四倍体S2的SOD、POD 和CAT 活性分别增加了40.71%、28.49%和210.96%,MDA、可溶性蛋白、可溶性糖、脯氨酸和叶绿素的含量分别提高了72.55%、48.51%、2.42%、38.93%和44.19%。同源四倍体S1的SOD 活性、CAT 活性、MDA 含量、可溶性糖含量和叶绿素含量均显著高于二倍体亲本。同源四倍体S2的CAT 活性、MDA 含量、可溶性蛋白含量、叶绿素含量均显著高于S1(图7)。

图7 草棉二倍体和同源四倍体S1、S2 代生理生化指标的比较Fig.7 Comparison of physiological and biochemical indexes between diploid and autotetraploid of G.herbaceum
2.5 草棉三倍体变异株表型
利用流式细胞仪对S1植株进行倍性鉴定,材料2 被确定为三倍体植株。该植株叶片皱缩、外翻,花蕾合并在一起,成簇生长,苞叶很长,开花时苞叶未展开、呈筒状(图8),从表型观察也可初步判断该植株不是同源四倍体。

图8 草棉同源四倍体S1 与三倍体的表型比较Fig.8 Phenotypes comparison of autotetraploid S1 and triploid of G.herbaceum
3 讨论
3.1 草棉同源四倍体的遗传解析及利用价值
通过形态观察可以初步筛选出染色体数目变异植株,这样能大大减少工作量,也是最简单快速的方法。器官巨大化是多倍体植株重要的特性之一[15-16],同时,通过解剖叶片结构,观测气孔大小、气孔密度和保卫细胞对中的叶绿体数量也可以间接鉴定植株倍性[8]。本研究发现随着染色体倍数的增加,草棉叶片气孔密度降低、气孔变大、叶绿体数目增多。对植株生理生化指标进行测定,可以帮助我们了解植物如何适应环境变化等。其中SOD、POD、CAT 的活性可以反映植物遭受逆境伤害的程度及自身的抗氧化能力[17];可溶性糖为植物中多种物质的合成提供能量和原料;可溶性蛋白含有多种氨基酸,能为细胞发育提供保护;脯氨酸参与植物体内应激反应[18]。本研究对同源四倍体和二倍体草棉叶片的生理生化指标进行测定,结果表明同源四倍体S2叶片的SOD、POD、CAT 活性及MDA、可溶性糖、可溶性蛋白、脯氨酸和叶绿素含量均显著高于二倍体,且S2的各项测定生理指标值均高于S1,进一步说明四倍体植株发育过程中积累了更多的渗透调节物质,可能有利于提高其抵御不良环境胁迫的能力。有趣的是,通过多年在温室内的观察发现:草棉同源四倍体植株的抗寒性明显增强,在北方温室能够成功越冬;二倍体草棉不抗寒,在同样的温室环境条件下全部死亡。后期可筛选出育性稳定、抗寒、抗旱的草棉同源四倍体用于进一步研究或生产应用。
同源多倍体是遗传学和育种学研究中的重要材料,既可作为亲本以提高远缘物种间的杂交成功概率,又可通过与原二倍体杂交、回交,在其后代中筛选出各种非整倍体,从而为该物种的基因定位、连锁群分析和分子标记开发利用等研究奠定基础[19-21]。同时,由于染色体加倍导致基因产生剂量效应,多倍体植物在产量、品质和抗性等方面的表现均优于二倍体。本研究获得的草棉同源四倍体为棉花种质创新提供了新材料,也为遗传研究提供了有价值的中间材料。
3.2 多倍体育性探讨
前期研究结果表明草棉同源四倍体植株在形态学、细胞学和SRAP 分子标记鉴定方面都表现出了多倍体优势[11]。在前期研究的基础上,本研究继续对草棉同源四倍体S1和S2进行育性分析,结果表明:与S1相比,S2在株型、叶片大小、花朵形态、种子大小及纤维长度、叶片气孔性状、花粉母细胞减数第二次分裂末期正常四分体比例、花粉粒形态、叶片多个生理生化指标等方面都表现出更加明显的多倍体优势。本研究中草棉同源四倍体与二倍体相比,单株结铃数和单铃种子数均有所降低;但在种子大小和纤维长度方面,四倍体明显优于二倍体,并且S1与S2无明显差异。在同一世代的不同植株之间单株结铃数和单铃种子数差异明显,单株结铃最少2 个,最多6 个,且单铃的种子最少为2 粒、最多为5 粒。表明同源四倍体草棉的育性和产量还有待进一步稳定和提高。
与草棉同源四倍体S1相比,S2的正常四分体和正常花粉粒比例均有明显升高,说明同源四倍体减数分裂行为趋向正常。同源四倍体的产生是二倍体亲本基因组直接加倍形成的,所引发的变异通常是有利性状和不利性状结合在一起,后代表现难以预料。新形成的多倍体基因组要经历剧烈的冲击和重构过程,这个过程可被称为新多倍体的二倍化过程[22],这些冲击和重构发生在DNA序列水平[23]、基因组甲基化水平[24]、转座子水平[25]、基因表达水平上[26]的变化,这些变化的过程可能是非随机的、快速的[27],并且这些不同类型的变化之间也能够相互影响,共同调控植物新多倍体的二倍化进程[28-29]。同时,新形成的多倍体还必须经过一个细胞学的二倍化过程,以确保同源染色体严格配对,阻止非同源染色体或部分同源染色体之间的配对[30],其调控因素也有很多,包括染色体同源配对基因[31]、着丝粒和端粒[32]、细胞周期调控因子[33]、环境条件[34]等。综上,各种因素相互作用共同控制着多倍体稳定性的恢复。
4 结论
利用流式细胞仪在草棉同源四倍体后代S1中鉴定出1 株三倍体和4 株四倍体,在S2中鉴定出1 株非整倍体和6 株四倍体。形态学和细胞学分析及生理生化指标测定表明,在株型、叶片大小、花朵形态、种子大小及纤维长度、叶片气孔性状、花粉母细胞减数第二次分裂末期正常四分体比例、花粉粒形态、叶片多个生理生化指标等方面,S2较S1表现出明显的多倍体优势,且从S1到S2呈现稳定的育性恢复趋势。
