儿童异基因造血干细胞移植后闭塞性细支气管炎综合征研究进展
2023-08-23习必鑫综述刘爱国审校
习必鑫 胡 群 综述 刘爱国 审校
华中科技大学同济医学院附属同济医院儿童血液科(湖北武汉 430030)
闭塞性细支气管炎综合征(bronchiolitis obliterans syndrome,BOS)是儿童异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)后唯一被认定的肺部慢性GVHD疾病,由同种异体免疫反应引起终末细支气管和呼吸性细支气管的炎症细胞浸润,甚至管壁纤维化,小气道管腔进行性不可逆的狭窄或闭塞,最终导致阻塞性肺通气功能障碍综合征[1]。接受allo-HSCT 的患儿,BOS 通常发生于移植后100 天~2 年,临床表现没有特异性,部分患儿可表现为肺功能快速下降,而另一些患儿则表现为肺功能缓慢下降和发作性恶化[2]。本文通过综述儿童移植后BOS的相关研究进展,为allo-HSCT后儿童闭塞性细支气管炎综合征的临床诊疗提供建议。
1 流行病学特点
近年来,越来越多的儿童血液病患者接受造血干细胞移植治疗,移植后BOS 的发病率也随之升高。研究显示,儿童allo-HSCT 后BOS 的发病率为2%~2.7%,5年生存率为45%~59%,死亡率高,预后差[3]。
许多危险因素与儿童移植后BOS 的发生密切相关[2,4-5],包括原发性移植物功能不良、ABO 血型错配的allo-HSCT、供者外周造血干细胞移植、无关供者或者女性供者、人类白细胞抗原(human leukocyte antigen,HLA)错配的allo-HSCT、包含白消安(busulfan)的清髓性预处理方案、低丙种球蛋白血症、移植前肺功能下降、淋巴细胞浸润性细支气管炎、胃食管反流、预防性使用甲氨蝶呤的免疫抑制治疗、移植后+100 d内的病毒感染(CMV、EBV、副流感病毒、呼吸道合胞病毒)及移植后的慢性GVHD等。脐血移植、减低毒性的预处理方案或者包含抗胸腺细胞免疫球蛋白的预处理方案则可以降低儿童移植后BOS的发病率[2]。
2 发病机制
目前移植后BOS 主要归因于同种异体免疫反应,被认为是allo-HSCT后排除了感染等因素的晚期肺部慢性GVHD的唯一临床表现形式。移植后BOS的发生是一个复杂的免疫病理生理过程,其中供体T淋巴细胞、B淋巴细胞、T辅助(Th)淋巴细胞等均扮演着重要的生物学角色。具体的发病机制主要包含三个方面:(1)中枢免疫耐受失衡和胸腺损伤。自身反应性T淋巴细胞克隆在胸腺通过自我清除机制建立中枢免疫耐受平衡,从而阻止其发育成可以攻击自身新抗原的免疫活性细胞[6]。清髓性预处理方案、预防性或者治疗性抗GVHD药物的使用均可导致患儿免疫重建时中枢免疫耐受失衡和胸腺损伤,这是BOS发生的主要原因[7]。(2)大量B淋巴细胞活化和抗受体细胞抗原的自身反应性抗体数量增加在移植后BOS中起着关键作用,移植后BOS患者的血浆中可以检测到高水平的B 淋巴细胞激活因子(B cell activating factor,BAFF),导致BAFF/B细胞比率明显升高[8]。抗受体细胞抗原的自身反应性抗体主要包括2类[7,9]:①针对供体免疫系统不能识别的来源于受体细胞的抗原而产生的自身反应性抗体,例如,80%接受女性供者造血干细胞移植的男性受者血浆中可以检测到抗Y 染色体编码蛋白的抗体,因此女性供者是BOS的高危因素;②针对非多态性自体细胞抗原的抗体,例如,慢性GVHD 患者血浆中可以检测到针对血小板源生长因子受体的特异性抗体。(3)细支气管纤维化改变是移植后BOS的终末阶段,导致小气道闭塞和空气潴留。移植后BOS 的早期阶段主要表现为终末细支气管和呼吸性细支气管管壁的大量炎性淋巴细胞浸润[5]。随着自身免疫炎症反应的持续,活化的辅助性T 淋巴细胞分泌大量细胞因子,包括IFN-γ、TNFα、IL-4、IL-5、IL-13、IL-17、IL-26等,成纤维细胞和平滑肌细胞不断增殖,由胶原蛋白组成的细胞外基质逐渐在管壁向心性沉积,最终形成不可逆的小气道闭塞[7]。
3 诊断
儿童造血干细胞移植后BOS的临床症状没有特异性,目前国内临床主要通过肺功能检测和呼气相高分辨CT检查明确诊断[10]。
3.1 临床表现
儿童BOS的早期临床症状不明显,可仅表现为轻微咳嗽、不明原因的一过性低热(<38.0 ℃)等,及时给予治疗,可以逆转BOS 的疾病进展。≥1 项临床症状:呼吸急促费力、劳力性呼吸困难、持续性咳嗽伴喘息、吸氧情况下血氧饱和度改善不明显等,常提示患儿肺功能中至重度下降,此阶段病情一般不可逆,预后差。
3.2 肺功能检测
3.2.1 肺活量测定(pulmonary function tests,PFT)适用于移植前后的肺功能评估、移植后早期小气道功能监测、BOS的评分与分级[4](表1)、评估BOS 治疗效果,检测费用低。不适用于<5 岁的患儿,因其配合度较差,检测数值不准确。BOS的PFT诊断依据包括:①1s用力呼气容积(FEV1)/用力肺活量(FVC)的比值<0.7或<预计值第5百分位数;②支气管扩张试验后FEV1<预计值的75%,且2年内FEV1下降≥10%;③空气潴留征,残气量(RV)>120%预计值或者残气量/肺总量的比值>90%置信区间[3,5,10]。

表1 移植后BOS的评分与分级
3.2.2 一氧化碳弥散量(single-breath transfer factor of the lung,TLCO)TLCO间接测量氧气在肺泡膜上的扩散情况,BOS 患儿细支气管壁和肺泡壁纤维化增厚,导致TLCO明显降低。适用于评估肺实质病变及纤维化程度。不适用于<10 岁的患儿,因其通常不能坚持10s。
3.3 影像学检查
胸部高分辨率计算机断层扫描(high-resolution computed tomography,HRCT)是监测和鉴别肺部感染性、非感染性疾病的重要方法,敏感性较高。BOS的胸部CT诊断依据包括:④胸部呼气相HRCT表现为空气潴留、小气道壁增厚、马赛克征或者支气管扩张征[5,10]。
3.4 经纤维支气管镜肺泡灌洗术
儿童HSCT后肺功能下降最常见的原因是肺部感染性疾病,而免疫抑制治疗会加重感染,因此,移植后BOS的确诊必须包括:⑤排除呼吸道病原微生物的活动性感染,如细菌、真菌、病毒等。经纤维支气管镜肺泡灌洗术对于移植后免疫功能低下、血小板低的患儿耐受性较好,肺泡灌洗液送检病原微生物检测有助于排除肺部感染性疾病[5]。
3.5 肺组织病理学活检
开放性肺活检组织病理学检查是诊断移植后BOS 的金标准[10],但是国内临床运用较少。HSCT后BOS 患儿肺活检组织的典型病理特点是终末细支气管壁和肺泡壁间隔增厚,纤维结缔组织增生,小气道管腔狭窄甚至闭塞,肺泡腔或支气管腔内无肉芽组织及纤维组织增生、填塞;而早期阶段的BOS肺活检组织的病理学特点可以仅表现为大量淋巴细胞浸润小气道壁和肺泡壁,无明显纤维结缔组织增生[5]。
HSCT 后患儿同时满足上述①②⑤三条,且符合BOS 的肺活检组织病理学特点,即可诊断BOS;若患者不适合进行肺组织活检,但是有明确的组织或器官慢性GVHD 表现,且同时满足①②③⑤或①②④⑤四条依据时,也可诊断BOS[4,10]。
4 鉴别诊断
儿童移植后BOS的诊断需要与其他移植后肺部非感染性并发症相鉴别[2,10-11],如特发性肺炎综合征(idiopathic pneumonia syndrome,IPS)、隐源性机化性肺炎(cryptogenic organising pneumonia,COP)、间质性肺病(interstitial lung disease,ILD)等,鉴别要点见表2。
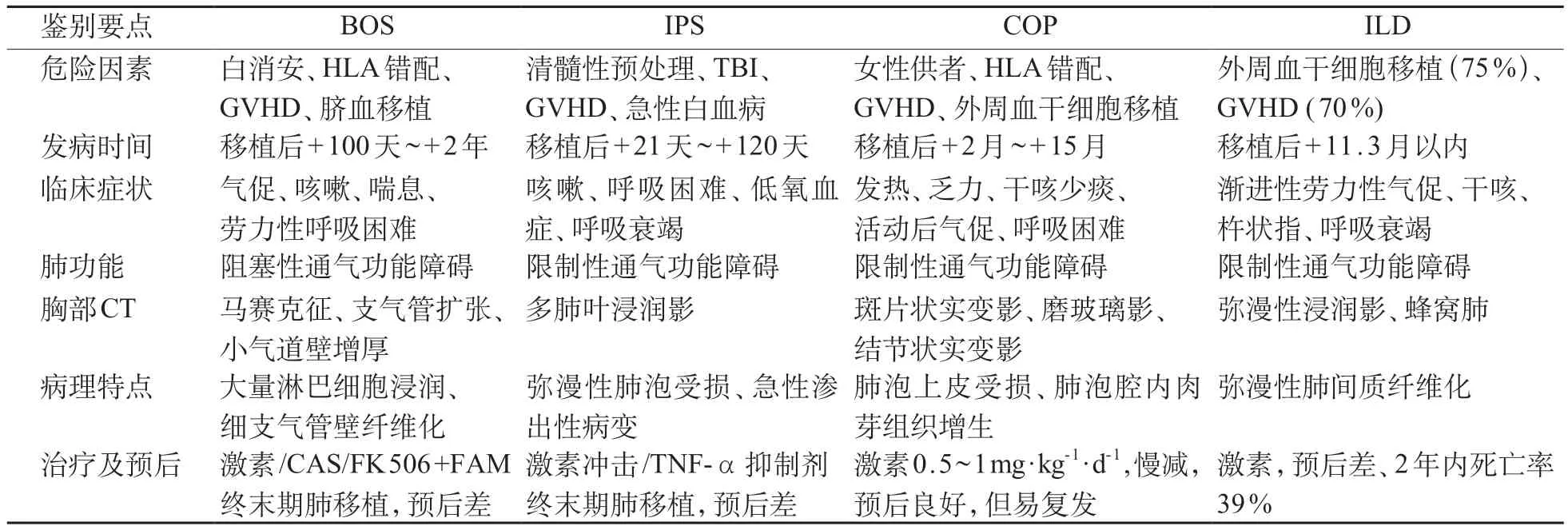
表2 儿童移植后肺部非感染性疾病鉴别要点
5 治疗进展
在造血干细胞移植后BOS的早期阶段,疾病进展隐匿,临床症状不典型,容易延误治疗,随着时间的推移,病情迅速恶化,不可逆转,因此,在小气道壁纤维化之前进行早期诊断和治疗,对于提高患儿生存率和改善预后至关重要。
5.1 一线治疗
5.1.1 轻度BOS 肺部慢性GVHD评分为0或1分时,即无或有临床症状的轻度BOS,可给予患者局部治疗,比如雾化吸入糖皮质激素、FAM方案等[1,10]。目前FAM方案应用较广泛,其中包括:①雾化吸入氟替卡松(fluticasone,F),440μg/次,bid。HSCT后BOS患者经过持续6个月的雾化吸入布地奈德或福莫特罗后,其FEV1中位增加量可达240 mL[2]。②口服阿奇霉素(azithromycin,A),5~10 mg·kg-1·d-1(最大剂量为250 mg·d-1),每周连续服用3天停4天,有抗炎和免疫调节作用。③口服孟鲁司特(montelukast,M),5 mg·d-1(≤14 岁患儿),其主要作用机制是抑制嗜酸性粒细胞炎症介质的释放,同时还具有抗纤维化作用。研究证实FAM 方案治疗儿童HSCT 后BOS,有效率为71.4%,可明显改善患儿肺功能[12]。
5.1.2 中或重度BOS 肺部慢性GVHD 评分为2或3分时,即中或重度BOS,建议给予患者大剂量甲基泼尼松龙冲击治疗[13]。全身应用糖皮质激素是治疗移植后中重度BOS的基石,临床工作中通常会联合FAM方案治疗,有助于减少激素治疗量和不良反应。激素治疗的持续时间可以根据患者的肺功能和胸部CT改善情况进行个体化调整。BOS患者接受大剂量脉冲式甲基泼尼松龙(10 mg·kg-1·d-1,连续给药3天/4周,共16周)治疗后,在第25周有7/9的患者FEV1得到改善,病情趋于稳定[4]。
5.2 二线治疗
目前针对糖皮质激素难治型或耐药型移植后BOS 的临床实践存在较大差异,大多数中心选择≥2种二线药物联合治疗,包括:①钙调神经磷酸酶抑制剂(环孢素或他克莫司)是一种强效免疫抑制剂,临床应用较广泛,可以抑制T淋巴细胞的活化和T 辅助淋巴细胞依赖型B 细胞的增殖,减少细胞因子的分泌。②芦可替尼,是一种高选择性非受体酪氨酸激酶(JAK1/2)抑制剂,通过阻遏JAK1/2信号传导途径,强效抑制免疫炎症反应,还能阻止中性粒细胞的激活和树突状细胞的分化。Redondo 等[14]回顾性研究显示,48 例糖皮质激素难治型cGVHD患者接受芦可替尼(5~10 mg·次-1,bid)治疗后,总体反应率达到77%(37/48),完全缓解率为15%,部分缓解率为62%,中位缓解时间为2 个月,21%的患者成功减停糖皮质激素。③间充质干细胞输注(mesenchymal stem cells,MSCs),MSC具有广泛免疫调节作用,已用于治疗炎症和免疫介导的疾病,可以改善激素耐药性BOS的肺功能。研究证实,MSCs治疗HSCT后BOS患者的缓解率达到71%,3年总生存率为70.6%[15]。④伊马替尼(imatinib),是一种高选择性的小分子酪氨酸激酶(TKI)抑制剂,可以通过阻断TGF-β或PDGF信号通路的传导,抑制组织纤维化的发展。研究显示,伊马替尼治疗儿童HSCT后BOS的总缓解率达到76.9 %,明显改善患儿的预后[16]。⑤TNF-α抑制剂(英夫利昔单抗/依那西普)通过与TNF-α 的特异性结合,抑制肺组织成纤维细胞的增殖,减少TNF-α 对气道上皮的炎症损伤。有病例报道显示,1 例激素治疗失败的移植后BOS患儿(8 岁)接受英夫利昔单抗(10 mg·kg-1·次-1,2次/周×2周,接着1次/周×4周,最后1次/2周×2周)治疗后,肺功能和影像学异常完全逆转,呼吸道症状也完全缓解,疗效显著[4]。⑥体外光分离置换法(extracorporeal photopheresis,ECP)是一种以白细胞分离置换为基础来治疗难治性cGVHD 的光化学疗法,它首先采集患者外周静脉血,分离并浓缩单核细胞,体外与8-甲氧沙林补骨脂素共培养,再经过紫外线A 照射后重新回输给患者。ECP 处理后的淋巴细胞将会发生凋亡,未成熟的树突状细胞将被诱导分化,并产生大量抗炎症反应的细胞因子,促进Treg细胞增殖[17]。研究证实,ECP 治疗可明显提高造血细胞移植后BOS患者的生存率,且能有效稳定患者的呼吸功能[18-19]。
5.3 终末期肺移植
对于二线治疗无效、肺功能严重恶化甚至衰竭的移植后BOS患儿,肺移植或许是挽救生命的唯一选择。研究证实,HSCT后BOS患者接受肺移植术后,5年生存率为75%~80%[4,20],为晚期BOS患者提供了一种可选择的治疗方式。
6 展望
儿童BOS是一种罕见且致命的异基因造血干细胞移植后肺部非感染性并发症。目前对该疾病的病理生理学及免疫学发病机制认识有限,临床管理方面缺乏足够的治疗证据,早期诊断和治疗也具有挑战性,因此需要进行更多的前瞻性临床研究来寻找更加敏感、特异性高的生物学诊断标志物,探索更加安全有效的治疗策略,以提高患儿的生存率,改善其远期预后。
