初始pH对餐厨垃圾生物干化脱水效率的影响
2023-08-23张奎左一琳詹亚斌邓杰张利萍陶玥玥王海候魏雨泉李季
张奎, 左一琳, 詹亚斌, 邓杰, 张利萍, 陶玥玥,王海候, 魏雨泉, 李季*
(1.中国农业大学资源与环境学院, 北京 100193; 2.中国农业大学有机循环研究院(苏州), 苏州 215100; 3.云南农业大学资源与环境学院, 昆明 650201; 4.江苏太湖地区农业科学研究所/苏州市农业科学院, 苏州 215155)
餐厨垃圾是城市生活垃圾的主要成分,且中国的餐厨垃圾产生量增长迅速,目前年产生量已超过1亿t[1]。餐厨垃圾具有高油、高盐、高含水率、易腐烂、有机成分多等特点,具有资源和废物的双重属性[2]。但高湿的餐厨垃圾使收集运输不便,并且极易腐烂变质发臭,如果不经处理直接进行好氧堆肥或厌氧发酵等资源化利用,存在处理成本高、周期长等问题,所以快速降低餐厨垃圾含水率一直是餐厨垃圾资源化利用的主要障碍[3]。
生物干化作为一种高效的前端预处理除水技术而备受关注。生物干化与传统干化技术相比,主要利用微生物分解有机物所产生的生物热蒸发水分,不仅可以节约外源热能,还可以使混合基质稳定化以便进一步资源化利用[4-5]。但生物干化效率依靠微生物活性强弱,不同的物料性质、外界条件与接种菌剂都会对微生物作用造成影响,且生物干化较热干化处理周期较长,所以通过调控工艺以提高生物干化除水效率势在必行。
餐厨垃圾因其高含油量,物料性质常呈酸性,有研究表明好氧发酵在微生物在酸碱度(pH)为6~8下较为适宜[6]。Sundberg等[7]的研究发现,低pH是好氧发酵升温期反应至高温期的抑制因子,微生物在低pH下呼吸速率较低;张云龙等[8]研究发现添加磷酸盐调控可使堆体pH可维持在6.0~8.5,此时有机物降解率最高,堆体的NH4+-N含量最大。此外脱水过程中不同形态水分去除效率不同,并且伴随着不同形态水分的转化。Zhang等[9]在污泥厌氧消化研究中发现,随着反应的进行,胞外聚合物中蛋白质的降解导致有机组分与水分之间化学键的破坏,机械结合水被加速释放;Shen等[10]把厨余垃圾中的水分分为滞化水(entrapped water,EW)、毛细管水(capillary water,CW)、多层水(multilayer water,MW),在好氧发酵反应中发现,CW和EW的含量都不断下降,但CW的百分比降低,EW的百分比升高。而目前的研究缺少对初始pH调控的工艺优化研究,将pH与水组分相结合分析除水效率鲜有报道,所以研究不同初始pH对生物干化脱水效率的影响仍有需要。
现通过添加生石灰调控餐厨垃圾与锯末混料的初始pH分别为5、6、7,研究不同初始pH对生物干化有机质降解、水组分转化及脱水效率的影响,并将理化因子与含水率及各水组分进行相关性分析以明确反应过程中脱水效率的影响因素,以期为餐厨垃圾生物干化初始pH调控提供技术参考。
1 材料与方法
1.1 实验材料
餐厨垃圾来自苏州市临湖第一中学食堂,锯末由苏州宏光木材制品厂提供,原材料的基本性质如表1所示。

表1 初始物料物理化学性质Table 1 Physical and chemical characters of raw materials
1.2 实验设备
反应器主体为容积55 L的聚氯乙烯材质发酵罐,发酵罐底部设有多孔板,可收集渗滤液并保证通风均匀。由鼓风机提供曝气,流量由气体流量计控制,顶部出气口连结洗气瓶,反应器侧面设置2个取样口,顶部装入吸水棉[3]。
1.3 试验设计
餐厨垃圾一般因存在大量脂肪酸呈酸性,添加的生石灰,主要成分为CaO,可与H+结合调节物料初始pH以解除餐厨垃圾酸性环境对微生物活性的抑制。本次试验设置3个处理,以餐厨垃圾为主料,添加少许木屑,调节初始含水率为55%,以餐厨垃圾与木屑混合后不调节pH作为对照,所测对照组物料初始pH为5,通过添加生石灰调节T1与T2处理的初始pH分别为6、7,通风速率为0.10 m3/(min·m3),通风频率为30 min/h,试验周期设计为15 d,研究不同初始pH对餐厨垃圾生物干化脱水效率的影响。
1.4 测定项目与分析方法
分别在反应第0、5、10、15天进行5点取样,所取样品一份保存于4 ℃冰箱,用于含水率、水分形态、pH、电导率(electrical conductivity,EC),另一份自然风干,粉碎后过5 mm筛,用于总碳(total carbon,TC)、总氮(total nitrogen,TN)、碳氮比(carbon to nitrogen ratio,C/N)、油脂、挥发性固体含量测定。
用数显温度计测定堆体温度,每天9:00与16:00记录。含水率采用热干燥法,烘箱中105 ℃烘干12 h至恒重;挥发性体含量采用马弗炉灼烧法,550 ℃下灼烧6 h至恒重;pH、EC采用pH计(PHS-3C)和电导率仪(DDS-307A)测定,参考《有机肥料》(NY/T 525—2021)。碳氮元素含量采用元素分析仪测定(Elementar Analysensysteme,Hanau,德国);水分形态含量测定采用梯度蒸发法[9];油脂含量测定采用酸水解法《食品中脂肪含量的测定》(GB 5009.6—2016)。每次取样前记录堆体重量与堆体高度,计算容重(bulk density,BD)。
各指标的计算方法如下。
(1)积温。有效积温(TC)代表堆体温度与外界环境温度的差异累积值,计算公式为

(1)
式(1)中:TC为堆体升温积温,℃·d;Tmi为第i天的堆体温度,℃;Tai为第i天的环境温度,℃;Δt为该温度持续时间单元,1 d。
(2)生物干化指数。生物干化指数(It)是指生物干化过程中水分去除量与有机质降解量的比值,计算公式为
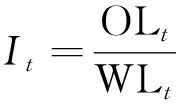
(2)
式(2)中:It为在某一时间段t的生物干化时间指数;OLt为这一时间段的有机质损失量,kg;WLt为这一时间段的蒸发水分损失量,kg。
(3)自由空域。自由空域(free air space,FAS)是指堆体中气相所占体积与堆体总体积之比,计算公式[11]为
(3)
式(3)中:FAS为自由空域,%;DM为总固体含量,%;VS为挥发性固体含量,%;BD为容重,g/cm3;LW为水的密度,取值1 g/cm3;LVS挥发性固体密度,取值2.5 g/cm3;LASH为灰分密度,取值1.61 g/cm3。
2 结果与讨论
2.1 生物干化过程中的理化性质变化
2.1.1 温度与含水率变化
生物干化过程中的温度变化如图1(a)所示:可以看出生物干化过程与好氧堆肥相同,都经历了升温期、高温期与降温期3个阶段[12]。其中,T1与T2在第2天就到高温期,温度分别为55.1、57.0 ℃,CK处理的温度为41.5℃,T1、T2与CK处理差异显著(P<0.01),说明微生物在pH为6~7的环境下生长较酸性环境为适宜,低pH会抑制微生物生长代谢,影响生物热产生[6]。自第4天,CK处理进入高温期后,各处理温度无明显差别,可能是初始pH调控会缩短升温期的时间,但随着基质内氨化反应不断发生使pH上升后,pH对有机质分解效率的影响也随之减弱。生物干化反应期间,CK、T1与T2的积温分别为:454.2、512.0、509.1 ℃,统计分析表明,T1、T2与CK处理之间的积温差异显著(P<0.01),说明调节初始pH可以促进微生物分解有机物产热。

图1 生物干化过程中温度、含水率、pH、EC、含油量的变化Fig.1 Changes of temperature,moisture content,pH,EC,lipid content during bio-drying
从图1(b)中可以看出:含水率呈现不断下降的趋势,生物干化过程物料水分散失的根本原因是有机物分解产生大量热量使水分蒸发,通过强制通风带走水分,但有机物的分解也会产生代谢水。在升温阶段,T1处理含水率下降最快,但T2处理积温高于T1,可能是T2处理产生了更多的代谢水补偿水分散失,也有可能是由于有机质分解导致堆体结构致密,抑制脱水孔道从而影响水分去除[13];同样在高温期,T2处理的积温更高,但CK处理含水率下降最快。在生物干化结束时,CK、T1与T2处理的含水率分别为:29.84%、27.06%与28.79%,含水率分别降低了26.17%、28.75%与27.14%,说明初始pH=6脱水效果最好。
2.1.2 pH与EC变化
EC整体上与pH变化趋势相同,随着生物干化反应的进行,水溶性离子浓度不断增加。由图1(d)可知:试验CK、T1、T2的EC值分别由初始的2.3、2.28、2.28 mS/cm上升至4.04、3.52、3.35 mS/cm。EC变化与水分含量和离子数量有关,在生物干化升温期和降温期,有机物矿化的同时伴随着腐殖化过程,而在降温期,可能腐殖化效应减弱,与好氧堆肥腐殖化主要在降温期不同,这可能与生物干化的高通风量有关[15-16]。
2.1.3 含油量变化
油脂是一类甘油三羧酸脂,较糖类与蛋白类物质难分解,在图1(e)中,含油量整体表现出先升高后降低的趋势,油脂主要被分解为有机酸,表现为pH在生物干化中后期上升缓慢。在生物干化结束时,CK与T1含油量高于其初始含油量,T2处理含油量低于其初始含油量,说明调控初始pH能够影响油脂降解,这可能是因为油脂在脂肪酶的作用下分解为甘油与长链脂肪酸,生石灰中CaO与酸反应,减轻了长链脂肪酸对质膜传递的影响[17]。
2.1.4 元素分析
从图2可知:各处理TC含量与C/N保持不断下降趋势,TN含量不断上升,这是由于碳源物质较氮源物质更易于降解[18]。可以看出碳素主要在生物干化后期损失较多,这可能是因为在升温期与高温期有机质的矿化与腐殖化同时进行,而在降温期,腐殖化速度较慢,表现为碳素损失较多,这与EC变化趋势相吻合,与好氧堆肥反应过程有所不同,好氧堆肥腐殖化过程在降温期更为明显。C/N与TC含量都反映了有机质的含量变化,CK、T1与T2总碳含量分别下降5.34%、8.19%、5.53%,T2的C/N下降了22.70%,显著高于CK与T1的15.57%与16.29%(P<0.01)。说明初始pH=6时,有利于微生物发生代谢活动分解有机物产热。

图2 生物干化过程中元素含量的变化Fig.2 Changes of in element content during bio-drying
2.1.5 BD与FAS变化
BD是指湿基的总体积密度,BD与FAS都反映了生物干化基质中气固相水气交换的能力。适宜的孔隙可为微生物提供更多的可附着表面,以促进有机物的降解[11]。由表2可以看出:经过生物干化反应,CK、T1、T2处理的BD分别较初始下降了20.99%、26.26%、20.54%,T1处理与CK、T2处理差异显著(P<0.01),说明T1处理在生物干化过程中水气交换更为剧烈,调节初始pH为6有利于生物干化脱水。

表2 生物干化产品的物理性质变化Table 2 Change in physical characteristics of bio-drying products
在表2中,CK、T1与T2处理的FAS分别由初始的77.15%、76.56%、76.87%增加到78.70%、79.17%、78.20%,所有处理的FAS都有所增加,说明虽然有机质降解使堆体结构更加致密,但是水分去除增加了气相空间,水分去除的效应大于有机质降解的影响效应,这与Wolney-Katarzyna等[19]的研究一致。
2.1.6 不同初始pH下生物干化效率分析
在生物热作用下去除水分使生物干化的根本目的。由表3可知:CK、T1与T2处理经过生物干化反应过程后的脱水率分别为74.20%、78.20%、76.04%,T1处理的除水效率最高。CK、T1与T2处理的有机质的降解率分别为26.91%、30.00%、29.35%,说明微生物的生理环境适宜在pH偏中性的环境下,在偏酸性环境中,有机酸会抑制微生物活性[7]。生物干化指数反映的是单位有机质降解去除的水分量,在生物干化结束时,CK、T1与T2处理的生物干化指数分别为0.24、0.26、0.26,结果差异不显著,说明生物干化效率并无明显差别,但从控制生产成本的角度,T1处理即调控初始pH=6更为经济。
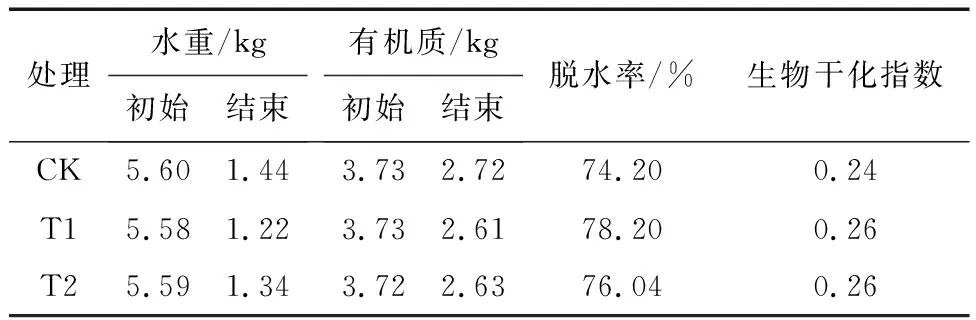
表3 不同初始pH下生物干化效率分析Table 3 Analysis of bio-drying efficiency under different initial pH
2.2 生物干化过程中的水分变化
2.2.1 水分含量变化
由图3可知:各处理初始水分含量CW>EW>MW,即与非水物质结合越紧密,其含量也越低,其中游离水是物料中的主要水分[9]。在生物干化反应结束时,CK、T1与T2处理的EW含量分别下降了49.86%、44.10%、33.42%,随着初始pH逐渐增大,EW的去除效率降低。CK、T1与T2处理的CW含量分别下降了70.60%、82.29%、79.70%,随着初始pH的逐渐增大,对于CW的去除效率有所增加。这可能是因为增大初始pH后,减小了弱酸性环境对微生物的生理抑制,使其代谢活动增强。并且随着有机质的降解,使CW与MW被释放并向CW转化,EW含量的下降比例也显著小于CW含量与MW含量的下降比例(P<0.01)[20]。在降温期,有机物质仍在被微生物降解,但产热较小,而水分蒸发的同时也伴随着CW与MW向EW的转化,所以EW在降温期保持稳定。
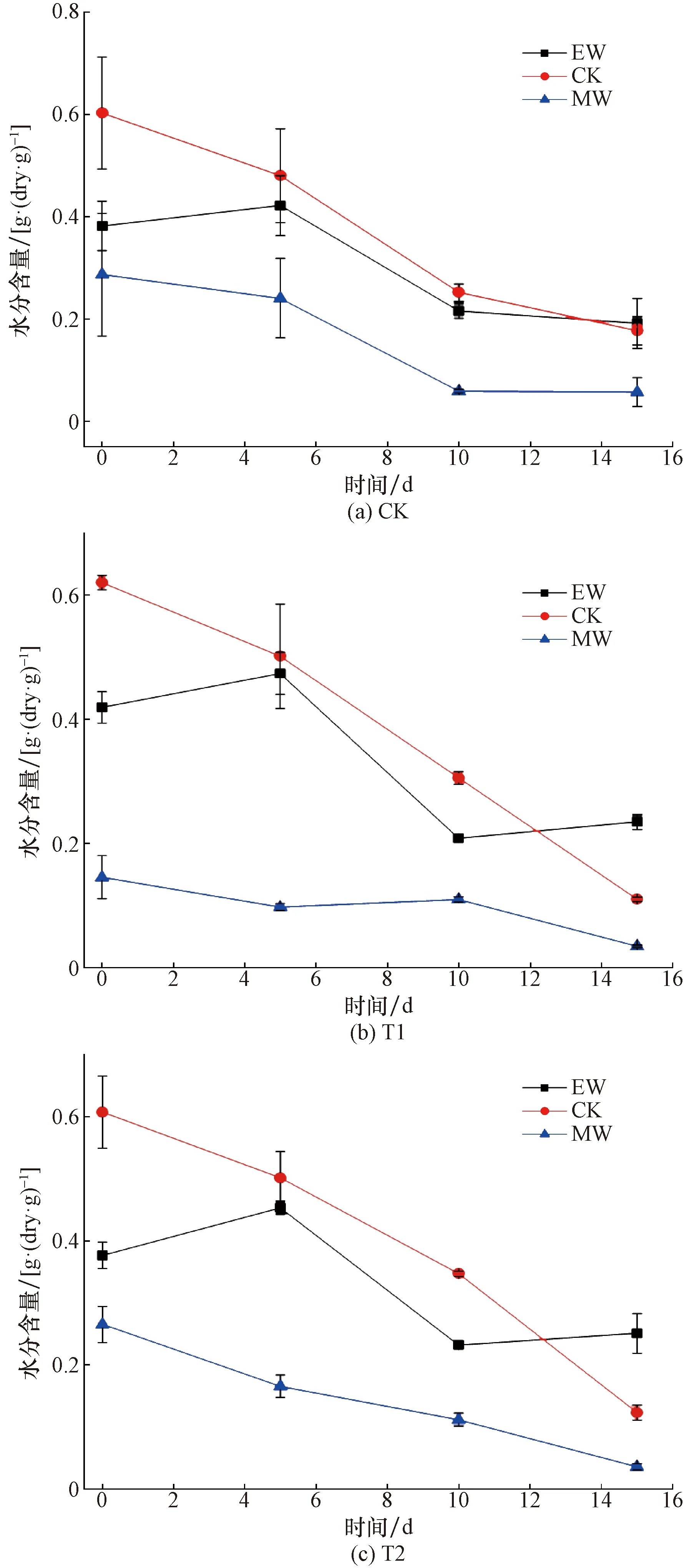
图3 生物干化过程中各形态水分含量变化Fig.3 Change of content of each water state during bio-drying
由图4可知3个处理都表现出EW比例不断上升,MW与CW的比例不断下降的趋势,说明随着生物干化反应的进行,非水物质与MW之间的化学键被破坏,随着毛细结构的变化,CW与非水物质的结合能也逐渐降低,使MW与CW不断转化为EW,这与Zhang等[21]对污泥厌氧消化过程中水分变化一致。在生物干化反应结束时,CK、T1与T2处理的EW百分比分别为44.98%、61.97%、61.04%,MW的百分比分别为13.22%、8.96%、8.83%,T1与T2处理的EW占比显著高于CK处理,MW百分比显著低于CK处理(P<0.01),说明调节物料初始pH至中性可以加速水分转化过程。

图4 生物干化过程中各形态水分百分比变化Fig.4 Change of percentage of each water state during bio-drying
2.2.2 生物干化反应中理化因子与脱水效率的关系
由图5可知,含水率与各水组分含量与VS和C/N呈极显著正相关(P<0.01),说明生物干化过程中微生物利用有机质完成矿化与腐殖化反应,所产生的高额热量是水分去除的主要因素[4]。含水率与各水组分含量与BD呈极显著正相关(P<0.01),与FAS呈负相关,说明随着反应的进行,堆体基质更加松散,脱水孔道逐渐扩张影响水分散失,且容重比自由空域与水分含量联系更加紧密[11]。TN、TC含量变化反映出碳源物质与氮源物质的变化,TN与含水率及各水组分呈极显著负相关(P<0.01),TC与含水率及各水组分含量呈现显著正相关(P<0.05),说明主要是碳源物质被分解产热,氮源物质难以分解[18],但在生物干化初期氮源物质分解使pH快速升高;油脂是碳源物质的一种,含油率与含水率及各水组分含量呈负相关,说明油脂抑制水分去除,这可能是因为餐厨垃圾中液态油中的亲水基会与水相结合,形成一层致密膜,而影响水分去除,油脂分解的脂肪酸也会影响质膜传递[17,22]。EC与含水率及各水组分含量呈极显著负相关(P<0.01),说明有机质随着生物干化的进行不断被分解为小分子物质,表现为水溶性离子浓度增加,pH与含水率、MW与CW含量呈显著负相关(P<0.05),而pH变化主要是由于氨化反应、硝化反应影响,说明MW与CW可能与氮素转化相关。

*表示显著性P<0.05;** 表示显著性P<0.01图5 理化因子与水组分相关性分析热图Fig.5 Correlation analysis heat map of physical and chemical factors and water states
MW、CW、EW是根据与非水物质结合的紧密程度而划分,由图5可以看出,生物干化过程中发生水组分转化。VS、C/N、TC与EW百分比呈显著负相关,与MW、CW呈显著正相关,TN与EW百分比呈显著正相关,与MW、CW呈显著负相关(P<0.05),说明非水物质结合最为紧密的MW与存在于微毛细管中的CW,随着有机质的降解由水分由细胞内部向表面扩散,MW与CW释放转化为EW,随后被生物热所蒸发,所以MW与CW的比例减小,EW的比例增大[20,23]。FAS与BD代表物料中孔隙空间,即可利用氧气的能力与脱水孔道大小,FAS与EW呈显著正相关,与MW与呈显著负相关;BD与EW呈显著正相关,与MW与呈显著负相关(P<0.05);说明有机质降解使堆体毛细结构松散,使MW与CW逐渐转化为EW[24]。EC与EW的百分比呈极显著负相关(P<0.01),与MW、EW的百分比呈显著负相关(P<0.05),这可能是由于有机质逐渐降解,细胞内小分子物质逐渐被释放,所以在EW百分比增加的同时,EC值也随之增加。
所以加速CW与MW向EW的转化,调控水组分行为有助于提高脱水效率,即考虑通过超声、高压、外加电磁场、粉碎破壁等促进胞内水的释放,以提高生物干化效率。
3 结论
(1)生物干化反应中,T1与T2的有效积温为512.0、509.1 ℃,高于CK处理的454.2 ℃,CK、T1与T2的脱水率分别为74.2%、78.2%、76.0%,T1处理脱水效果最好。
(2)不同初始pH调控影响有机质降解,CK、T1与T2处理的有机质的降解率分别为26.9%、30.0%、29.4%,但处理间生物干化效率无显著差异。
(3)生物干化过程中,游离水是主要的水分赋存形态,随着反应的进行,MW与CW不断向EW转化,且CW与MW对水分去除贡献较大;不同初始pH通过影响MW、CW的水分去除而影响水分转化与去除。
