血管活性药物评分评估老年脓毒性休克患者预后的价值
2023-08-22陈阳希郭蕾严妤函杨晨杨翔万文辉刘瑜
陈阳希,郭蕾,严妤函,杨晨,杨翔,万文辉,刘瑜
(东部战区总医院干部病房一科,南京 210002)
脓毒症是因感染引起宿主反应失调导致的危及生命的器官功能障碍[1],是监护病房常见的危重症之一。2017年估计全球脓毒症患者人数达到4890万,其中1100万例患者死亡,占全球死亡人数的19.7%[2]。脓毒性休克是脓毒症的严重并发症,脓毒症患者采用积极的液体复苏后,仍然需要使用升压药物使平均动脉压维持≥65mmHg(1mmHg=0.133kPa),且血乳酸>2mmol/L即可诊断脓毒性休克[1]。既往的研究显示,脓毒症死亡率达20%~30%[3],而脓毒性休克死亡率达40%~50%[4,5]。老年患者由于基础疾病多、器官功能衰退,其病死率居高不下[6]。因此,及时、准确地评估老年脓毒性休克患者至关重要。维持血流动力学稳定在脓毒症患者的治疗方面非常重要,多方位集束化治疗是目前共识治疗理念,血管活性药物是集束化治疗的重要组成部分。血管活性药物种类较多,临床上使用血管活性药物评分(vasoactive inotropic score, VIS)[7]将血管活性药物进行整合,通过评分数反映患者对于血管活性药物的依赖情况,从而评估患者心血管系统功能[8-10]。迄今为止尚缺乏VIS与老年脓毒性休克患者预后的相关性研究。本研究通过分析老年脓毒性休克患者疾病特征及VIS,探讨VIS对预测老年脓毒性休克预后的价值,以期对临床诊疗提供依据。
1 对象与方法
1.1 研究对象
回顾性分析2018年1月至2019年12月东部战区总医院呼吸与危重症医学科重症监护病房(intensive care unit, ICU)及普通外科ICU收治的93例老年脓毒性休克患者的临床资料。引起脓毒症的病因分别是肺部感染(43.01%,40/93)、腹腔感染(37.63%,35/93)、联合感染(11.83%,11/93)、肝胆系统感染(5.38%,5/93)和其他感染(2.15%,2/93)。参照2016年美国重症医学会(Society of Intensive Care Medicine, SCCM)与欧洲重症医学会(European Society of Intensive Care Medicine, ESICM)联合发布的脓毒症的新标准(Sepsis3.0)诊断脓毒症及脓毒性休克。脓毒症:感染+序贯器官衰竭评分(sequential organ failure assessment, SOFA)≥2分;脓毒性休克:在脓毒症基础上,尽管给予充分的液体复苏,仍需用升压药维持平均动脉压≥65mmHg(1mmHg=0.133kPa),且血乳酸水平>2mmol/L[1]。
纳入标准:(1)脓毒症、脓毒性休克诊断明确;(2)年龄≥60岁;(3)病例资料及检验结果齐全;(4)参照2017年1月SCCM和ESICM联合发布的脓毒症及脓毒性休克处理国际指南(2016)[11]进行治疗。排除标准:(1)失血性休克;(2)确诊后48h内发生心脏骤停及死亡;(3)参加其他临床研究项目;(4)失访或放弃治疗。本研究经东部战区总医院伦理委员会审核通过(2017NZGKJ-079),所有受试者或其家属均签署知情同意书。
1.2 方法
收集所有入组患者的人口学资料,吸烟、饮酒史,生化指标包括降钙素原(procalcitonin, PCT)、白细胞介素-6(interleukin 6, IL-6)、C反应蛋白(C-reactive protein, CRP),记录第1个24h总入量。计算脓毒症期间最高急性生理和慢性健康状态评分Ⅱ(acute physiology and chronic healthy evaluation Ⅱ, APACHE Ⅱ)及SOFA。根据治疗结局,分为死亡组(n=55)与存活组(n=38)。记录患者确诊脓毒性休克第1个48h内应用的血管活性药和强心药的最大剂量,计算VIS。VIS的计算方法参考文献[7]。VIS=血管加压素(U/min)×10000+去甲肾上腺素×100+肾上腺素×100+多巴胺、多巴酚丁胺、间羟胺×1+米力农×10。比较不同临床转归组间VIS的差异,研究VIS与老年脓毒性休克患者预后的相关性及预测价值。
1.3 统计学处理

2 结 果
2.1 研究对象的基线资料
共93例老年脓毒性休克患者纳入研究,年龄60~90(71.67±8.94)岁,其中男性68例(73.12%)。死亡组与存活组的年龄、性别、吸烟、饮酒、PCT和CRP情况比较,差异均无统计学意义;与存活组比较,死亡组具有较高的IL-6值(P<0.05)。2组间APACHEⅡ、SOFA、VIS比较,差异均有统计学意义(均P<0.05);死亡组使用3种血管活性药患者比例更高,差异有统计学意义(P<0.05);而使用去甲肾上腺素、多巴酚丁胺、多巴胺、肾上腺素、米力农、血管加压素比例比较,差异均无统计学意义;受累器官包括呼吸系统、凝血系统、肝脏、循环系统、中枢神经系统、肾脏比例比较,差异均无统计学意义;死亡组较存活组接受机械通气治疗比例更高(P<0.05),2组间外科手术、CRRT治疗比较,差异均无统计学意义(表1)。
2.2 老年脓毒性休克患者VIS与APACHE Ⅱ、SOFA的相关性
Spearman相关分析结果显示VIS评分与APACHE Ⅱ和SOFA均具有相关性(ρ=0.376、0.359,均P<0.05)。线性回归及散点图分析结果显示lg(VIS)与APACHE Ⅱ、SOFA线性相关(P<0.05;图1,图2)。
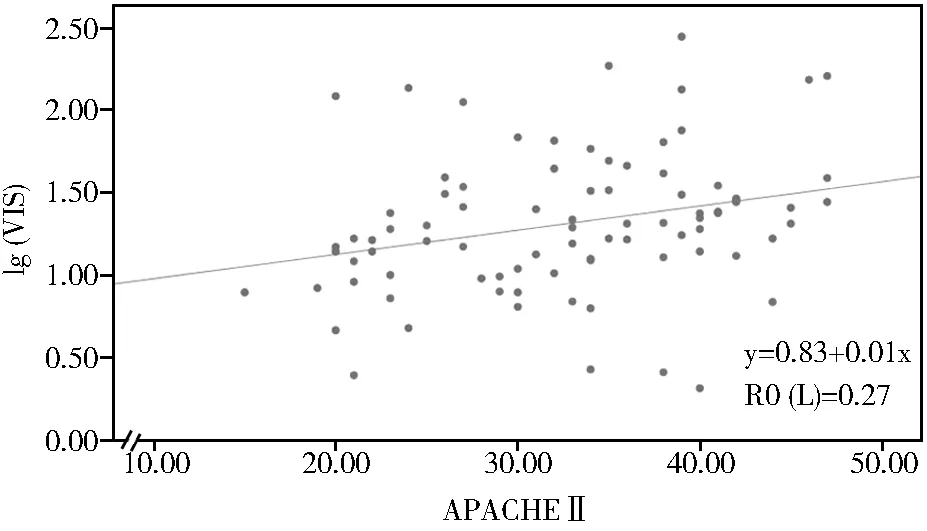
图1 老年脓毒性休克患者lg(VIS)与APACHEⅡ相关性的散点图分析Figure 1 Scatter plot of correlation between lg(VIS) and APACHE Ⅱ scoreVIS: vasoactive inotropic score; APACHE Ⅱ: acute physiology and chronic healthy evaluation Ⅱ.
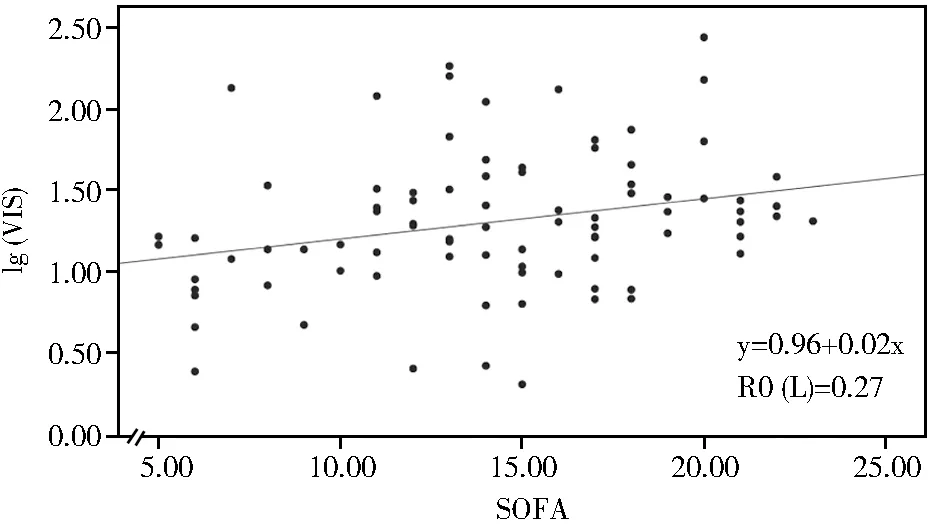
图2 老年脓毒性休克患者lg(VIS)与标准化SOFA相关性的散点图分析Figure 2 Scatter plot of correlation between lg(VIS) and standardized SOFA scoreVIS: vasoactive inotropic score; SOFA: sequential organ failure assessment.
2.3 VIS、APACHEⅡ、SOFA对老年脓毒性休克患者28d死亡的预测价值
ROC曲线结果显示,VIS评分预测老年脓毒性休克患者死亡的曲线下面积(area under curve, AUC)为0.763(95%CI0.663~0.862),灵敏度0.691,特异度0.789;APACHEⅡ评分预测老年脓毒性休克患者死亡的AUC为0.911(95%CI0.852~0.969),灵敏度0.745,特异度0.821;SOFA评分预测老年脓毒性休克患者死亡的AUC为0.895(95%CI0.825~0.964),灵敏度0.927,特异度0.763;VIS联合APACHE Ⅱ评分预测老年脓毒性休克患者死亡的AUC为0.926(95%CI0.873~0.979),灵敏度0.836,特异度0.947;VIS联合SOFA评分预测老年脓毒性休克患者死亡的AUC为0.911(95%CI0.851~0.971),灵敏度0.945,特异度0.763。VIS评分最佳截断点为17.06时,预测老年脓毒性休克患者28d死亡的灵敏度0.691,特异度0.789(图3)。

图3 VIS、APACHEⅡ、SOFA预测老年脓毒性休克患者28d死亡的预测价值Figure 3 ROC curves of forecasting risk factors of death in 28 d in elderly septic shock patientsVIS: vasoactive inotropic score; APACHE Ⅱ: acute physiology and chronic healthy evaluation Ⅱ; SOFA: sequential organ failure assessment.
2.4 老年脓毒性休克患者28d死亡影响因素的多因素logistic回归分析
多因素logistic回归分析结果显示,APACHE Ⅱ、SOFA、VIS(连续变量)、VIS≥17.06(分类变量)是老年脓毒性休克患者28d死亡的独立危险因素(P<0.05;表2)。
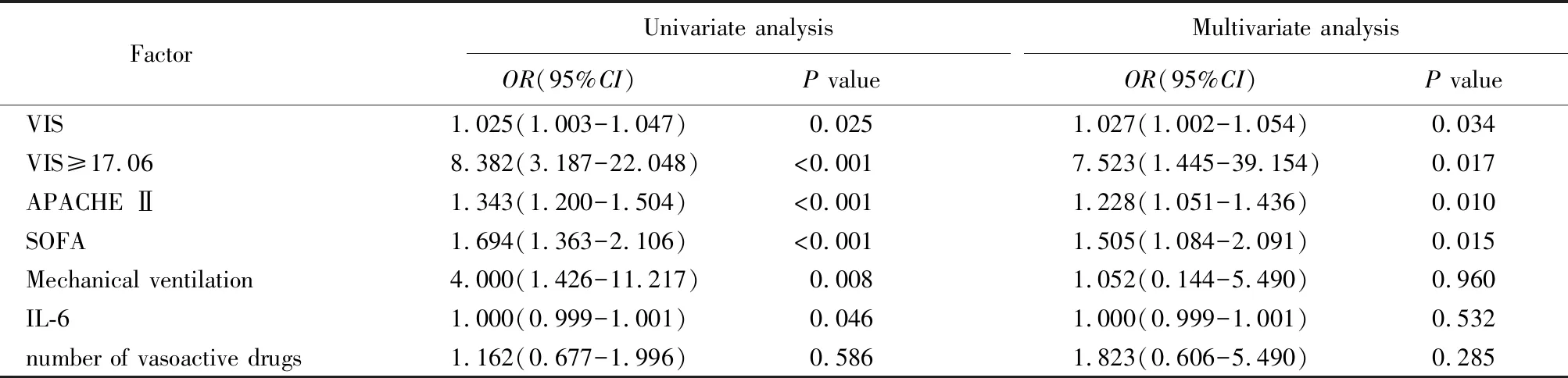
表2 老年脓毒性休克患者预后的单因素和多因素分析
3 讨 论
本研究通过回顾性分析93例老年脓毒性休克患者的临床资料,发现48h内最大VIS评分与老年脓毒性休克患者预后相关,是28d死亡的独立危险因素,可作为评价老年脓毒性休克患者预后的指标。
脓毒性休克由感染诱导,是全身炎症反应不断加剧恶化导致组织低灌注和心血管功能障碍的结果。脓毒性血流动力学改变包括:(1)血管张力下降,血流分布异常,静脉容量增加,右心充盈度下降,机体循环血容量相对减少;(2)血管内皮通透性增加,血管内液体漏出到组织间隙,机体有效循环血容量显著减少;(3)脓毒症导致心肌顿抑,心室收缩舒张功能受损,心输出量减少;(4)微循环功能障碍[12,13]。早期识别、及时诊断、尽早治疗是改善脓毒性休克预后、降低病死率的关键。确诊脓毒性休克后,应立即给予充分的液体复苏,以提高循环血容量,改善组织器官缺血、缺氧。经过积极液体复苏后,仍有约50%脓毒症发展为脓毒性休克[14]。对于液体复苏后难以纠正的失代偿型脓毒性休克,血管活性药物是纠正休克的重要治疗手段。临床上使用的血管活性药物种类较多,作用机制各有不同。尽管SOFA中包含对去甲肾上腺素、多巴胺、多巴酚丁胺及肾上腺素剂量的评估,但临床实践中,对于不同血管活性药选择、用法用量存在一定差别,SOFA不能准确评估血管活性药物在重症患者中的应用。VIS通过对患者使用的所有血管活性药物进行整合,并赋予相应权重,能够直观反映出患者对血管活性药物的依赖程度,是评估血管活性药物对心血管系统支持作用的一个有效指标。Gaies等[15]首次提出VIS并用于评估其与儿科心脏手术患者预后的相关性,发现高VIS与不良结局(死亡、机械通气、肾脏替代治疗、心脏骤停、中枢神经系统损伤)具有相关性(OR=8.1,95%CI3.4~19.2;P<0.001]。针对成人心脏手术患者的研究也证实了高VIS与不良预后的相关性[16,17]。McIntosh等[18]在儿科脓毒症需要血管活性药物支持的患者中比较入院后6、12、24、48h VIS,确定48h内最高VIS是最佳的预后指标。本研究针对老年脓毒性休克患者进行回顾性研究,发现48h内最大VIS与APACHE Ⅱ正相关,死亡组患者48h内最大VIS高于存活组,多因素logistic回归分析表明VIS是影响老年脓毒性休克患者早期死亡的独立危险因素。
本研究发现VIS联合APACHEⅡ、VIS联合SOFA预测老年脓毒性休克患者死亡的灵敏度分别大于APACHEⅡ、SOFA。表明VIS对老年脓毒性休克患者的预后具有指导作用,该指标操作简便,可进一步提高对老年脓毒性休克患者预后的预测能力。本研究还通过ROC曲线确定脓毒性休克第1个48h VIS最佳截断点为17.06时,相当于0.17μg/(kg·min)去甲肾上腺素当量,预测老年脓毒性休克患者28d死亡的灵敏度和特异度分别为0.691,0.789。本研究VIS最佳截断点较李鹏飞等[19]的VIS最佳截断点低,可能与老年脓毒性休克患者多病共存、病情复杂、对血管活性药物的耐受差、不良反应发生率高、临床使用较谨慎等有关。
2016年拯救脓毒性运动(Surviving Sepsis Campaign, SCC)的脓毒症与脓毒性休克处理国际指南推荐去甲肾上腺素为首选的血管加压药物[11],本研究中患者应用去甲肾上腺素比例为77.42%(72/93)。血管活性药物虽然能够改善灌注,但如果过量或不合理使用可能对患者造成损害,包括恶性心律失常、急性冠脉综合征、皮肤脚趾缺血、肠系膜缺血、急性脑卒中和神经功能缺失等[20]。研究显示去甲肾上腺素(5.0~26.7μg/min)严重副反应发生率为9.0%~10.2%,血管加压素(0.01~0.03U/min)严重副反应发生率为10.8%~12.6%,与患者病死率增加有关[21]。Stolk等[22]报道应用去甲肾上腺素剂量增加可能与脓毒症相关免疫麻痹发生程度及持续时间恶化相关。去甲肾上腺素通过激活β-肾上腺素受体(β-adrenergic receptor,β-AR)、促使免疫反应由辅助性T细胞1(helperTcell1,Th1)向Th2分化、减弱自然杀伤细胞(natural killer cell,NK细胞)毒性、诱导产生免疫抑制中性粒细胞及直接促进细胞生长等机制,引起脓毒症相关免疫麻痹。针对去甲肾上腺素浓度增高导致机体继发感染风险及病死率增高的相关性,目前尚无定论。对去甲肾上腺素最大剂量和最大速度无明确定义,对于顽固性休克进一步增加去甲肾上腺素单药剂量可能效果不佳且不良反应增加,SCC指南[11]建议可联用其他血管活性药物以减少去甲肾上腺素剂量。本研究发现不同预后组患者使用血管活性药物及强心药比例及单药、2种药物联用比例比较,差异无统计学意义,但联用3种血管活性药的患者预后较差。目前,针对血管活性药物合理使用、血管活性药物对宿主免疫功能的影响、避免严重副反应等仍需进一步深入研究。临床医师在使用血管活性药时应注意合理使用,包括药物选择、换用替代的血管活性药物、联合用药方案、重新评估容量状态、及时减量等。
综上,本研究基于VIS对老年脓毒性休克患者早期血管活性药物使用进行量化评价,对VIS与老年脓毒性休克患者预后进行相关性研究,发现老年脓毒性休克患者48h内最大VIS与患者预后有关,该项目操作简便,可作为评价老年脓毒性休克患者预后的指标,具有重要的临床应用价值。进一步开展前瞻性、更大样本的多中心临床研究,有助于对今后临床工作起到指导作用。
