锰基UIO-66催化气化H2O2协同氧化甲苯的研究
2023-08-21周梦长杜朝辉刘浩云徐欣蓉周长松
周梦长,杜朝辉,阮 玮,刘浩云,徐欣蓉,祁 元,周长松
锰基UIO-66催化气化H2O2协同氧化甲苯的研究
周梦长,杜朝辉,阮 玮,刘浩云,徐欣蓉,祁 元,周长松
(南京师范大学能源与机械工程学院,南京 210046)
利用原位沉积法制备了不同掺杂比例的Mn负载UIO-66材料并协同气化过氧化氢脱除甲苯气体.采用XRD、SEM、TEM、XPS、ICP等技术对Mn-UIO-66的物理化学特性进行了表征.催化实验确定了Mn-UIO-66/H2O2的最佳反应温度、过氧化氢浓度,同时还探究了质量空速变化对甲苯催化降解的影响.EPR测试揭示了Mn-UIO-66/H2O2体系中羟基自由基产量与催化剂中锰元素的负载量呈正比例关系.GC-MS分析了甲苯脱除过程中的中间产物,并提出甲苯脱除过程中可能的反应路径.
锰;UIO-66;羟基自由基;甲苯脱除
挥发性有机污染物(volatile organic compounds,VOCs)是一类来源广泛、排放量高、危害性强的大气污染物.VOCs不仅会对人体产生致癌、致畸的危害,还会与氮氧化物发生光化学作用,产生臭氧,导致空气质量的下降[1].随着我国经济社会的发展,甲苯等VOCs气体的排放量呈现出逐年增长的趋势,排放控制形势十分严峻.十四五期间,我国首次将VOCs纳入城市空气质量考核新指标,如何提高VOCs的治理能力成为当前大气污染物控制领域亟待解决的问题.
VOCs气体的处理方法主要包括吸附法、冷凝法、催化燃烧法、等离子体降解法以及高级氧化技术[2],其中高级氧化技术由于氧化性强、无二次污染、操作条件易于控制等优点引起了广泛关注.Fenton技术作为高级氧化技术的一种,可以产生氧化性仅次于氟原子的˙OH,˙OH能够高效攻击有机污染物最终生成CO2和H2O,实现有机污染物的无害化处理[3].然而,传统的均相Fenton技术存在着活性分子溢出、回收成本高等缺点.近年来学者们利用含铁化合物或采用其他载体固定金属离子,构成非均相Fenton体系或类Fenton体系应用于有机废水的治理.Bai等[4]采用热聚合法制备了Fe-g-C3N4并将其用于亚甲基蓝(MB)的脱除实验,最佳工况条件下MB在60min内实现了99%的脱除率.Li等[5]采用气体模板法制备了均匀多孔的Cu-Al2O3,Cu+/Cu2+加入γ-Al2O3骨架中呈现高度分散特性,合成材料在Fenton体系中对水中双酚A(BPA)的降解表现出优异的催化活性和稳定性.非均相Fenton技术有效克服了均相Fenton技术存在的问题,然而现有的研究局限在Fe、Cu元素上,对于其他非贵金属的研究开发较少.
由于Fenton反应涉及电子转移过程,具有多种化合价态的锰元素因其存在丰富、毒性低、pH范围宽、催化性能高等优点具有良好的应用前景[3]. Valentine等[6]发现,氧化锰在促进过氧化氢分解方面的活性明显高于氧化铁.一些学者尝试开发MnO2材料并将其用于Fenton反应中.Cao等[7]利用水热法制备了一维a-MnO2和b-MnO2单晶体纳米结构,并将其作为Fenton反应中降解低浓度罗丹明染料(20mg/L)的催化剂,在30min内取得了80%的降解效率.Ai等[8]报道微波加热法合成的γ-MnO2纳米片在降解水溶液中的罗丹明B过程中展现了较强的催化活性. 然而,这种固体催化剂活性位点分散度差、材料比表面积低,导致催化效果不佳[9].因此,开发出一种高效稳定的锰基催化材料具有重要应用价值.UIO-66作为金属有机骨架材料(MOFs)的一种,具有较高的机械稳定性、热稳定性(其分解温度在500℃)、化学稳定性、较大的比表面积和可修饰性等[10],目前,已有学者将UIO-66材料与Fenton技术结合用于污染物的治理.Pan等[11]采用浸渍法将Cu负载在UiO-66上,合成了Cu-UiO-66催化剂用于催化处理含4-氯酚废水.Cu-UiO-66催化剂对含有对4-氯酚的废水(CWPO)具有良好的催化活性,20min内转化率达98%,40min内完全降解.Yin等[12]首次开发出以UIO-66为载体的Fe3O4纳米材料,建立Fe-Zr双活性中心,发现Zr本身虽然不能催化H2O2,但它促进了Fenton反应过程中电子转移,改变活性物种的生成.因而,UIO-66材料在Fenton反应中具有良好的应用前景.
本文将常见的VOCs气体甲苯作为研究对象,采用原位沉积法制备了Mn修饰UIO-66材料,对其进行物理化学性质的表征,并协同气化过氧化氢系统催化降解甲苯气体.研究了各种工况条件下催化剂的催化效果.此外,本文还探究了反应过程中的催化机理,并对甲苯催化后的产物进行分析.
1 实验过程
1.1 Mn负载UIO-66样品制备
UIO-66的制备:用量筒量取200mL的N,N-二甲基甲酰胺溶液(DMF)于300mL的烧杯中,称量一定量的摩尔比为1∶1的ZrCl4和对苯二甲酸(PTA)并将其加入到DMF溶液中,超声并搅拌直至完全溶解.将上述溶液移入300mL的聚四氟乙烯内衬的水热反应釜中,并将水热反应釜放入120℃的马弗炉中加热24h.加热完成后用DMF、无水乙醇、去离子水清洗,然后过滤. 将得到的固体放入120℃的真空干燥箱中12h.
Mn负载UIO-66的制备[13]:将得到的UIO-66放入200℃的真空干燥箱中8h加热以移除客体溶剂.配置质量分数为9.1%、16.7%、23.1%、28.6%的乙酸锰溶液,将真空处理后的UIO-66加入到上述溶液中,搅拌并放置2h,随后向上述溶液中逐滴加入少量NaBH4溶液(10mg/mL)还原,搅拌并放置2h,然后用去离子水清洗.将得到固体放入真空干燥箱中,反应温度为200℃,反应时间为8h.将制备出来的催化剂按照加入乙酸锰溶液质量分数从小到大的顺序分别命名为1-Mn-UIO-66、2-Mn-UIO-66、3-Mn-UIO-66、4-Mn-UIO-66.
1.2 催化剂的表征
采用日本理化公司的RigakuSmartlab型X射线衍射仪(XRD)分析样品的晶相结构和成分,扫描范围为3°≤2≤90°,速度10°/min.催化剂的表面形貌由HITACHI SU8100型高分辨场发射扫描电镜(SEM)获得.透射电子显微镜(TEM)观察由FEI TALOS 200 S显微镜在200kV(Cs 0.5mm,点分辨率0.19nm)下进行.采用美国Thermo Fisher Scientific K-Alpha型X射线光电子能谱仪(XPS)对催化剂的元素特性进行分析,其中,分析室真空度5×l0-10Pa,激发源采用Alka射线,工作电压15kV,灯丝电流10mA,并进行5~10次循环的信号累加.测试通能(Passing-Energy)为50eV,步长0.05eV,并以C1s结合能为284.80eV为能量标准进行荷电校正.采用BelSorp Mini(Japan Microtrac BEL)分析仪器,在77K下用Brunauer-Emmett-Teller (BET)方程计算催化剂的孔特性和比表面积.采用德国Bruker A300纳米电子顺磁共振(EPR)光谱仪,以5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)为自由基捕获剂,测定了催化剂在H2O2溶液中的羟基自由基产率.尾气成分采用安捷伦7890B-7000C气相色谱-质谱(GC-MS)和DB-5色谱柱进行分析.
1.3 实验装置
实验装置如图1所示.系统主要由甲苯生成系统、气化H2O2生成系统、催化系统和检测系统组成.采用鼓泡法获得一定浓度的甲苯气体:将含有一定甲苯溶液的集气瓶放入恒温水浴加热的装置中.从压缩气体钢瓶流出的N2进入集气瓶,携带一定量的甲苯气体,与另一条N2路混合,生成浓度稳定的甲苯气体.N2流量由两个质量流量控制器控制.采用加热盘管加热石英管对H2O2进行蒸发,温度保持在130~150℃,注射泵(LSP01-1A)控制注射速率.采用孔径为0.1mm的气体分布器控制恒温反应器内气体的均匀分布.气相色谱-质谱联用技术用来检测反应后尾气的组成和浓度.尾气经活性炭处理后排放.甲苯去除效率由式(1)计算:

式中为甲苯进口体积分数;为甲苯出口体积分数.
2 结果与讨论
2.1 催化剂表征
2.1.1 XRD分析
用XRD测定了UIO-66和Mn-UIO-66材料的晶体结构,如图2所示.所有Mn-UIO-66催化剂在衍射角为7.3°、8.5°、12.1°和25.8°均有特征峰,分别对应于UIO-66的(111)、(200)、(220)、(440)晶面,衍射峰的强度也与UIO-66一致[14],说明利用原位沉积法负载锰后对UIO-66晶体结构影响较小.根据ICP测试结果(表1),制备的1-Mn-UIO-66、2-Mn-UIO-66、3-Mn-UIO-66和4-Mn-UIO-66的Mn元素质量分数分别为1.53%、2.84%、3.86%和5.09%,但在XRD谱图中没有明显的Mn元素特征峰,说明锰在UIO-66骨架的分散性良好,或者以无定形态的形式存在.

图2 UIO-66及Mn-UIO-6催化剂XRD谱图
表1 UIO-66及Mn-UIO-66催化剂BET及ICP数据
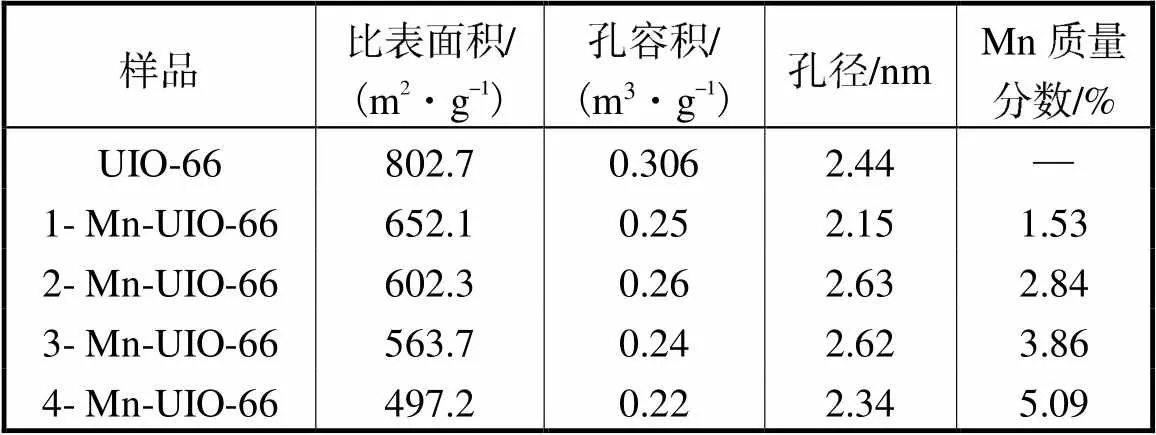
Tab.1 BET and ICP data of the UIO-66 and Mn-UIO-66
2.1.2 SEM及TEM分析
Mn-UIO-66的SEM表征如图3所示,TEM表征如图4所示.TEM图中可以发现,相较于UIO-66,Mn-UIO-66图像中出现较多的斑点,SEM图中也观察到催化剂表面的细颗粒物质,这可能是锰负载UIO-66过程中产生的锰化合物附着在材料表面.此外,SEM图像显示,随着锰负载量的增多,材料表面产生密集的锰化合物薄膜,且锰化合物的颗粒变大,这可能会导致孔隙的堵塞,造成催化剂表面孔容积和比表面积变小[15].

图3 UIO-66及Mn-UIO-66的SEM照片

图4 UIO-66及3-Mn-UIO-66的TEM照片
2.1.3 XPS分析

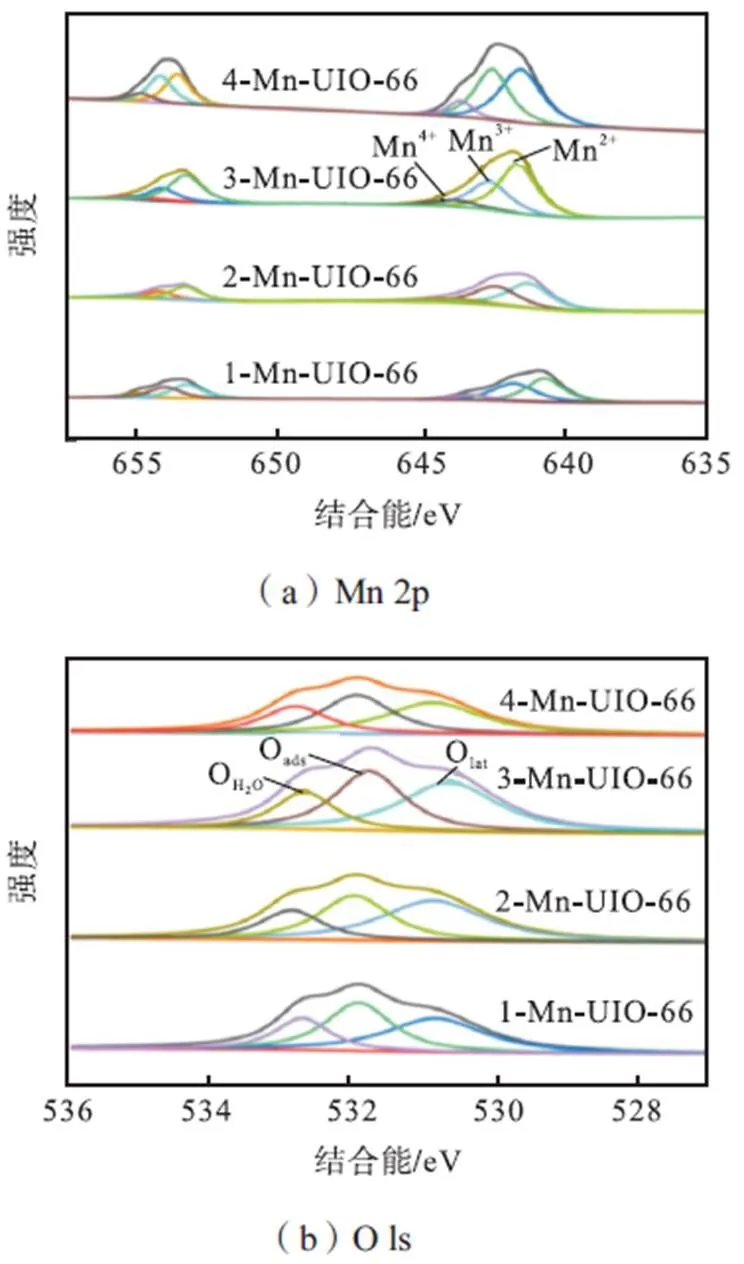
图5 Mn-UIO-66催化剂XPS谱图
表2 Mn-UIO-66催化剂各元素的原子含量
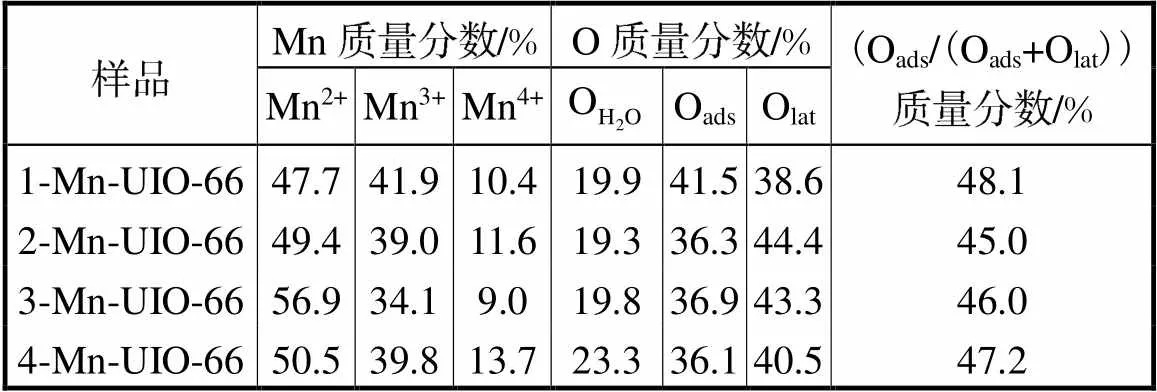
Tab.2 Atomic content of the element in Mn-UIO-66
2.2 Mn-UIO-66/H2O2氧化脱除甲苯实验分析
2.2.1 反应温度的影响
图6显示Mn-UIO-66协同气化过氧化氢对甲苯的脱除效率随温度变化情况.当反应器中的温度较低时过氧化氢容易凝结在管壁中,不利于催化反应的进行,所以本文探究的温度变化从80℃开始.
当系统中仅存在过氧化氢时,甲苯气体的脱除效率小于10%,说明单独存在H2O2时系统氧化能力较弱.当Mn-UIO-66材料和H2O2同时存在时,甲苯的脱除效率迅速增加,其中3-Mn-UIO-66/H2O2反应体系对甲苯的脱除效率最高达到92%,这证明Mn-UIO-66/H2O2系统对甲苯脱除的可行性.由图中可以看出,4种催化剂对甲苯催化降解的活性从小到大依次为:1-Mn-UIO-66<2-Mn-UIO-66<4-Mn-UIO-66<3-Mn-UIO-66.在非均相Fenton中,˙OH的产率对甲苯的催化效果产生至关重要的影响.结合EPR测试可知,4种不同负载比例的Mn-UIO-66催化剂˙OH产率从小到大依次为:1-Mn-UIO-66<2-Mn-UIO-66<3-Mn-UIO-66<4-Mn-UIO-66,3-Mn-UIO-66的催化活性大于4-Mn-UIO-66,与EPR测试中˙OH产率不相符合,这可能是因为较高的˙OH产率容易发生自消耗反应(式(2)).此外,结合BET分析,4-Mn-UIO-66的比表面积以及孔容积低于3-Mn-UIO-66,导致羟基自由基与甲苯气体接触机会降低.
˙OH+˙OH→H2O2(2)
当反应温度从80℃增加到130℃,催化剂的催化效率逐渐升高;当反应温度从130℃继续增加,催化剂的催化效率保持稳定状态甚至降低,催化反应的最佳温度区间在130~150℃.一方面,根据Arrhennius公式,随着反应温度的升高,H2O2的分解速率以及甲苯与˙OH反应的速率加快;另一方面,由于H2O2在催化剂表面分解途径主要有两种:一种是先分解产生˙OH,然后再经过中间产物反应生成H2O和O2,另一种是直接分解生成H2O和O2.当温度上升到一定程度,H2O2主要增加第二种分解方式,造成˙OH产率的降低,导致甲苯降解效率不再继续增加[19].
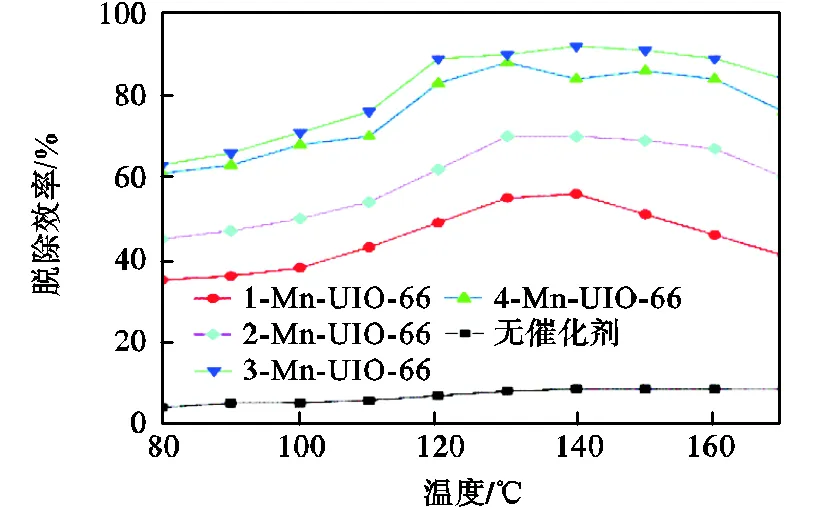
图6 反应温度对Mn-UIO-66/H2O2系统降解甲苯的影响
2.2.2 过氧化氢浓度的影响
作为甲苯氧化脱除中羟基自由基的提供源,过氧化氢在反应体系起到至关重要的作用,图7反映了过氧化氢浓度对甲苯脱除效率的影响.当通入过氧化氢溶液物质的量浓度小于2.5mol/L时,甲苯气体在Mn-UIO-66/H2O2系统中的脱除效率随着过氧化氢浓度的增加而增加.这是由于在过氧化氢溶液通入速度一定的情况下,当过氧化氢溶液浓度增加时,单位时间内更多物质的量浓度的过氧化氢分子参与到催化反应,从而提高甲苯脱除效果.当过氧化氢溶液浓度进一步增加时,甲苯的脱除效率缓慢增加甚至保持不变.这可能是当催化剂活性中心数量一定时,单位时间内催化的过氧化氢物质的量也一定,当反应过程中消耗的过氧化氢达到饱和状态时,甲苯的脱除效率不再随着过氧化氢浓度的增加而增加.根据前人研究,当过氧化氢浓度过高时,H2O2与˙OH还会产生自消耗反应生成˙OOH等低氧化性物质,不利于甲苯的催化氧化(式(2)~(5))[20-21].值得注意的是,1-Mn-UIO-66、2-Mn-UIO-66、3-Mn-UIO-66、4-Mn-UIO-66这4种催化剂在甲苯脱除效率达到稳定状态时所对应的过氧化氢物质的量浓度分别为2.5mol/L、2.5mol/L、3.5mol/L、4.5mol/L,这是因为随着催化剂中锰负载量的增加,催化反应达到饱和状态需要消耗更多物质的量浓度的过氧化氢.

图7 过氧化氢浓度对Mn-UIO-66/H2O2系统降解甲苯的影响
H2O2+˙OH→H2O+HO2˙(3)
HO2˙+˙OH→H2O+O2(4)
2H2O2→2H2O+O2(5)
2.2.3 质量空速的影响
质量空速对Mn-UIO-66/H2O2体系氧化降解甲苯效率的影响如图8所示.当质量空速从10×104mL/(g·h)增加到90×104mL/(g·h),Mn-UIO-66/H2O2体系对甲苯的氧化降解效率逐渐下降,其中,1-Mn-UIO-66催化剂下降得最为明显.当质量空速提高而通入甲苯的浓度不变时,催化反应系统单位时间内需要处理甲苯的物质的量增加,而EPR图谱显示,1-Mn-UIO-66催化剂的羟基自由基产量较低,从而可能限制了其对更多甲苯气体的氧化降解.除此之外,4-Mn-UIO-66催化剂对甲苯的催化效率下降得比3-Mn-UIO-66快,而EPR图谱显示前者的羟基自由基产率稍大.这可能是因为随着质量空速的提高,导致一部分甲苯气体来不及反应便穿透催化剂床层.而3-Mn-UIO-66具有较高的比表面积,从而具有更好的耐穿透的能力,所以其具有更好的催化表现.

图8 质量空速对Mn-UIO-66/H2O2系统降解甲苯的影响
3 反应机制
3.1 羟基自由基的生成
为了探究制备的Mn-UIO-66催化剂在过氧化氢环境下的˙OH产量,本节利用以DMPO作为捕获剂的EPR技术对催化剂进行表征分析,信号表明捕获剂与˙OH的稳定耦合,结果如图9所示.从图中可以看出,4种不同负载比例的催化剂的EPR波谱中均出现1∶2∶2∶1信号峰(DMPO-˙OH加合物的信号),表明˙OH在Mn-UIO-66/H2O2体系中产生.图中没有出现其他杂化峰,表明其中˙OH是Mn-UIO-66/H2O2体系中主要的自由基产物.因此,推测˙OH自由基是氧化降解甲苯的关键.在EPR波谱中,随着锰负载量的提高,4种催化剂产生的1∶2∶2∶1信号峰逐渐增强,表明˙OH产量逐渐增加,说明˙OH产量与4种催化剂中锰的负载量存在着正比关系.
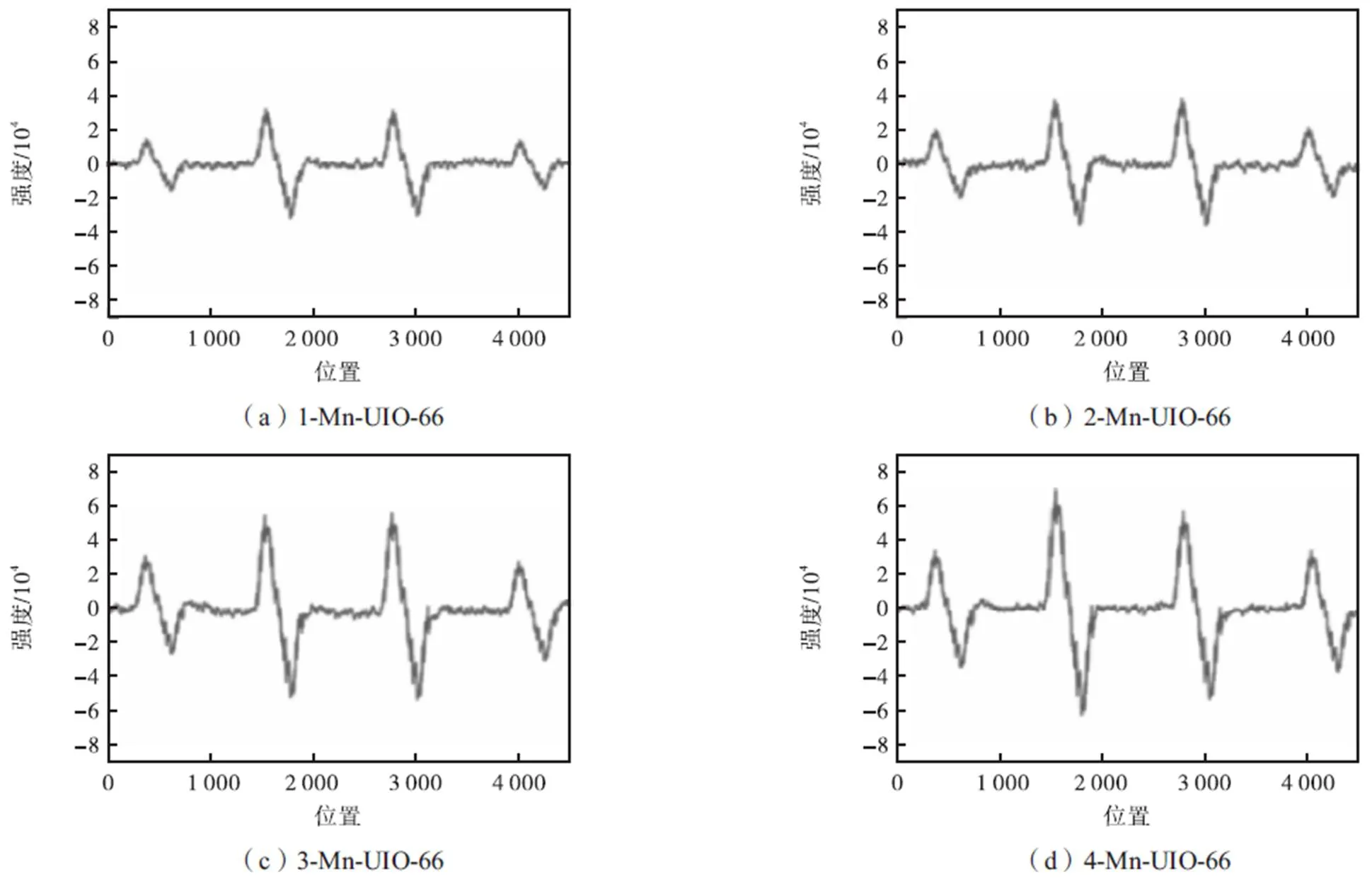
图9 Mn-UIO-66/H2O2系统的DMPO-˙OH的EPR谱图
结合XPS分析以及前人的研究,Mn-UIO-66催化剂中Mn2+/Mn3+/Mn4+的氧化还原反应导致H2O2分解产生羟基自由基,如式(6)~式(8)所示[22]:
Mn2++H2O2→Mn3+→Mn4++OH+OH-(6)
Mn4++H2O2→Mn3+→Mn2++˙O2/˙HO2+H+(7)
Mn4++˙OH→Mn3+→Mn2++˙O2/˙HO2+H+(8)
3.2 甲苯的转化过程
为了探究甲苯氧化降解路径,本节利用GC-MS分析了3-Mn-UIO-66协同气化过氧化氢体系氧化降解甲苯后的尾气成分,结果如表3所示.根据以上甲苯催化产物,甲苯的降解过程如图10所示,结合EPR分析结果可知,甲苯的催化主要是与羟基自由基反应.在甲苯产物中出现氮元素,推测这可能是作为载气的氮气被羟基自由基攻击形成氮原子,接着与中间产物发生结合.甲苯分子中存在的化学键的解离能为:甲基中的C—H(3.7eV)<苯环中的C—H(4.3eV)<苯环中与甲基相连的C—C(4.4eV)<苯环中的C—C(5.0~5.3eV)<苯环中的C=C(5.5eV).较低解离能的化学键很容易被羟基自由基攻击,形成苄基自由基、苯基自由基、和甲基自由基.苄基容易与羟基自由基反应生成给苯甲醛和苯甲醇,进而生成苯甲酸.甲基很容易与羟基自由基结合生成乙醛,接着被氧化形成烯酮,最后完全氧化生成二氧化碳和水.苯基易与羟基自由基和氮原子反应生成亚硝基苯和苯胺.此外,苯基还容易与甲基反应生成邻二甲苯[23].这些中间产物又进一步被羟基自由基氧化,苯环打开,碳链打开.此外,中间产物中还有包含十七烷和二十一烷,这些有机物的碳原子数大于甲苯,这可能是碳链断链过程中重新结合.最终,这些中间体在羟基自由基的作用下产生CO2和H2O,即甲苯气体催化氧化的最终产物[24].
表3 甲苯催化气体产物
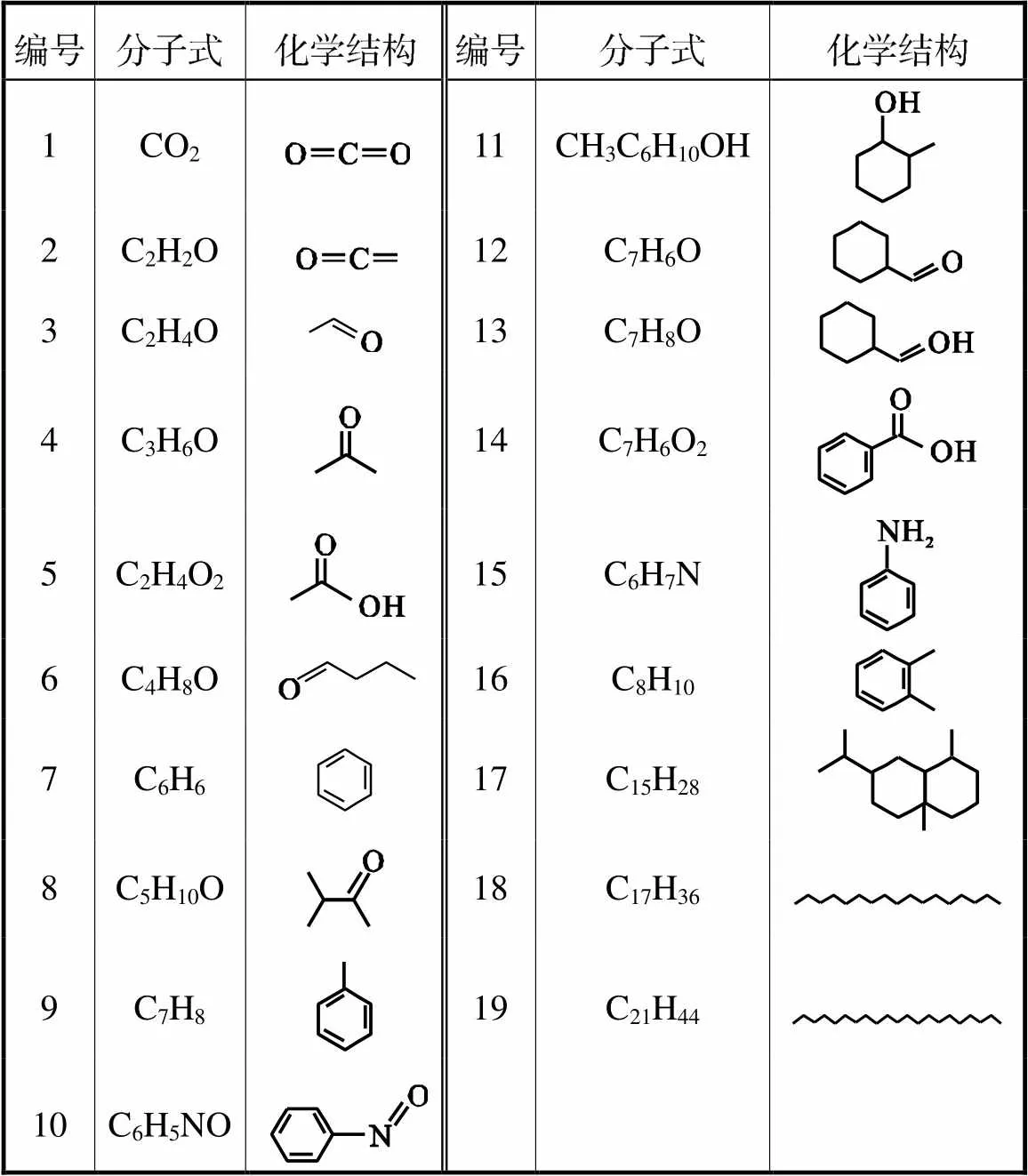
Tab.3 Gaseous products from toluene oxidation reaction
4 结 论
(1)本文采用原位沉积法制备出锰负载UIO-66材料. 通过XRD、SEM、TEM、XPS、ICP等表征手段发现,合成的Mn-UIO-66材料中锰元素高度分散在UIO-66表面,但当锰负载量过多时会在催化剂表面聚集且颗粒变大,可能会造成催化剂孔道堵塞,从而导致材料比表面积与孔体积减小. XPS结果表明,Mn-UIO-66中的低价态Mn元素含量较高,可以有效促进Fenton反应过程中羟基自由基的产生.
(2)催化实验证明了Mn-UIO-66结合气相过氧化氢脱除甲苯气体的可行性,其中3-Mn-UIO-66催化剂活性最高,取得了92%的甲苯脱除效率. 此外,反应系统的最佳温度区间在130~150℃,过高的温度可能造成过氧化氢直接分解生成H2O和O2,不利于甲苯的催化.考虑到过氧化氢在浓度过高时的自消耗反应以及催化剂中活性中心与过氧化氢反应的饱和状态,甲苯的脱除效率并不会随着过氧化氢浓度的增加而一直提高.
(3)EPR测试结果表明,Mn-UIO-66协同过氧化氢系统产生的羟基自由基数量随着锰负载量的增加而增加,这是因为催化剂表面的Mn2+/Mn3+/Mn4+氧化还原对促进羟基自由基的产生. 通过对甲苯催化产物分析,发现甲苯在羟基自由基的作用下首先分解成大分子有机物,最终转化成二氧化碳和水.
[1] Zheng Y,Liu Q,Shan C,et al. Defective ultrafine MnOnanoparticles confined within a carbon matrix for low-temperature oxidation of volatile organic compounds[J].,2021,55(8):5403-5411.
[2] Kim S B,Hwang H T,Hong S C. Photocatalytic degradation of volatile organic compounds at the gas–solid interface of a TiO2photocatalyst[J].,2002,48(4):437-444.
[3] Yang J,Ao Z,Wu H,et al. Immobilization of chitosan-templated MnO2nanoparticles onto filter paper by redox method as a retrievable Fenton-like dip catalyst[J].,2021,268:128835.
[4] Bai M J,Huang X Y,Yin H,et al. Fe-doped graphitic carbon nitride for methylene blue degradation with visible-light[J].,2021,21(11):5698-5706.
[5] Li L,Hu C,Zhang L,et al. More octahedral Cu+and surface acid sites in uniformly porous Cu-Al2O3for enhanced Fenton catalytic performances[J].,2021,406:124739.
[6] Valentine R L,Wang H C A. Iron oxide surface catalyzed oxidation of quinoline by hydrogen peroxide[J].,1998,124(1):31-38.
[7] Cao G,Su L,Zhang X,et al. Hydrothermal synthesis and catalytic properties of α- and β-MnO2nanorods[J].,2010,45(4):425-428.
[8] Ai Z,Zhang L,Kong F,et al. Microwave-assisted green synthesis of MnO2nanoplates with environmental catalytic activity[J].,2008,111(1):162-167.
[9] Ramesh M,Rao M P,Rossignol F,et al. rGO/MnO2nanowires for ultrasonic-combined Fenton assisted efficient degradation of reactive black 5[J].,2017,76(7):1652-1665.
[10] Winarta J,Shan B,Mcintyre S,et al. A decade of UiO-66 research:A historic review of dynamic structure,synthesis mechanisms,and characterization techniques of an archetypal metal-organic framework[J].,2020,20:1347-1362.
[11] Pan Y,Jiang S,Xiong W,et al. Supported CuO catalysts on metal-organic framework(Cu-UiO-66)for efficient catalytic wet peroxide oxidation of 4-chlorophenol in wastewater[J].,2020,291:109703.
[12] Yin Y,Ren Y,Lu J,et al. The nature and catalytic reactivity of UiO-66 supported Fe3O4nanoparticles provide new insights into Fe-Zr dual active centers in Fenton-like reactions[J].:,2021,286:119943.
[13] Zhang M,Huang B,Jiang H,et al. Metal-organic framework loaded manganese oxides as efficient catalysts for low-temperature selective catalytic reduction of NO with NH3[J].,2017,11(4):594-602.
[14] Stawowy M,Ciesielski R,Maniecki T,et al. CO2hydrogenation to methanol over Ce and Zr containing UiO-66 and Cu/UiO-66[J].,2019,10(1):39.
[15] Zhang X,Song L,Bi F,et al. Catalytic oxidation of toluene using a facile synthesized Ag nanoparticle supported on UiO-66 derivative[J].,2020,571:38-47.
[16] Thirupathi B,Smirniotis P G. Nickel-doped Mn/TiO2as an efficient catalyst for the low-temperature SCR of NO with NH3:Catalytic evaluation and characterizations[J].,2012,288:74-83.
[17] Wang Y,Wang C,Shi S,et al. Improved removal performance and mechanism investigation of papermaking wastewater treatment using manganese enhanced Fenton reaction[J].,2018,77(10):2509-2516.
[18] Chen L,Xu Z,He C,et al. Gas-phase total oxidation of nitric oxide using hydrogen peroxide vapor over Pt/TiO2[J].,2018,457:821-830.
[19] Song Z,Wang B,Yang W,et al. Simultaneous removal of NO and SO2through heterogeneous catalytic oxidation-absorption process using magnetic Fe2.5M0.5O4(M=Fe,Mn,Ti and Cu)catalysts with vaporized H2O2[J].,2020,386:123883.
[20] Hao R,Zhao Y,Yuan B,et al. Establishment of a novel advanced oxidation process for economical and effective removal of SO2and NO[J].,2016,318:224-232.
[21] Kim E-J,Oh D,Lee C-S,et al. Manganese oxide nanorods as a robust Fenton-like catalyst at neutral pH:Crystal phase-dependent behavior[J].,2017,282:71-76.
[22] Chang T,Shen Z,Huang Y,et al. Post-plasma-catalytic removal of toluene using MnO2-Co3O4catalysts and their synergistic mechanism[J].,2018,348:15-25.
[23] Zapata P,Faria J,Ruiz M,et al. Hydrophobic zeolites for biofuel upgrading reactions at the liquid-liquid interface in water/oil emulsions[J].,2012,134:8570-8578.
[24] Marcı̀G,Addamo M,Augugliaro V,et al. Photocata-lytic oxidation of toluene on irradiated TiO2:Comparison of degradation performance in humidified air,in water and in water containing a zwitterionic surfactant[J].:,2003,160(1/2):105-114.
Catalysis of Toluene by Manganese Based UIO-66 Synergistic Vapor Hydrogen Peroxide
Zhou Mengchang,Du Chaohui,Ruan Wei,Liu Haoyun,Xu Xinrong,Qi Yuan,Zhou Changsong
(School of Energy and Mechanical Engineering,Nanjing Normal University,Nanjing 210046,China)
Mn supported UIO-66 materials with different doping ratios were prepared by in-situ deposition method and applied to the removal of toluene gas with vapor hydrogen peroxide. The physical and chemical properties of Mn-UIO-66 were characterized by XRD,SEM,TEM,XPS and ICP. The optimal reaction temperature and hydrogen peroxide concentration of Mn-UIO-66/H2O2were determined by experiments. Meanwhile,the effect of mass space velocity on the catalytic degradation of toluene was also investigated. EPR test revealed that the yield of hydroxyl radical in Mn-UIO-66/H2O2system was positively proportional to the amount of manganese in the catalyst. The intermediate products in the reaction were analyzed by GC-MS,and the possible reaction paths were proposed.
manganese;UIO-66;hydroxyl radical;toluene removal
X511
A
1006-8740(2023)04-0467-08
10.11715/rskxjs.R202305026
2022-03-29.
国家自然科学基金资助项目(51906114);江苏省高校自然科学基金资助项目(23KJB480006).
周梦长(1995— ),男,硕士研究生,1542757642@qq.com.
周长松,博士,副教授,cszhou@njnu.edu.cn.
(责任编辑:隋韶颖)
