云香水仙WD40基因克隆及序列分析
2023-08-19陈晓静
李 欢,陈晓静
(1.蚌埠学院食品与生物工程学院,安徽蚌埠 233030;2.福建农林大学园艺学院,福建福州 350002;3.福建农林大学园艺植物遗传育种研究所,福建福州 350002)
中国水仙(Narcissus tazettavar.chinensis)是蒜科水仙属植物,是多花水仙(Narcissus tazettaL.)的一个变种。由于中国水仙品种较少、花色单一、育种资源匮乏等原因,传统育种方面进展较慢,改良中国水仙依然是广大研究者对水仙研究的重点之一[1]。
转录因子(反式作用因子)是一类能与基因启动子区域中顺式作用元件发生特异性结合的蛋白质分子,主要作用是激活或抑制基因的转录效应[2]。常见的和花色调控相关的转录因子主要有MYB、bHLH和WD40 三大类[3]。MYB 根据R 基数量可分为4 个亚群,其中含量最多的为R2R3型MYB[4]。bHLH(basic/helix-loop-helix)是植物中的第二大类转录因子,拟南芥中含有147 个bHLH 转录因子被分成21 个亚族[5]。WD40 由Fong 等[6]首次发现,van Nocker 和Ludwig[7]把拟南芥中的237个WD 转录因子分为143个亚族。植物中,花青素生物合成的转录调控受MYB-bHLH-WD40(MBW)复合体的协同调控[8]。如,拟南芥中TTG1(WD40)与bHLH 的互作有助于加强花青素的合成[9]。
云香水仙(证书标号:认2012-34-1)为福建农林大学遗传育种研究所培育出来的一种多花水仙,其形态特征(花径较大,小花量大,繁殖容易且抗病强)、花色(副冠颜色较浅)、香气(香气特别浓)等与其它两色花主栽品种不同,在一定程度上丰富了中国水仙花资源。目前,伴随生物技术的发展,利用基因工程手段改善中国水仙花色已成为可能[10]。本研究以云香水仙为实验材料,通过对WD40进行基因克隆和序列分析,并对其不同花期表达量进行研究,以期为中国水仙花色改良提供部分理论依据。
1 材料与方法
1.1 实验材料
云香水仙(白色花瓣和黄色副冠)由福建农林大学遗传育种研究所提供。分别取花苞、花蕾、始花和盛花期的花朵,去掉花丝、花药和花柱,花瓣和副冠分别置于离心管中,液氮速冻,-80 ℃保存[1-2]。
1.2 实验方法
1.2.1 总RNA的提取和反转录
采用离心柱型多糖多酚RNA 提取试剂盒(购自北京百泰克生物限公司)分别提取云香水仙4个花期的花瓣与副冠的总RNA。采用Revert AidTM First Strand cDNA Synthesis Kit(购自Fermenta)合成的cDNA用于3′-RACE[1-2]。
1.2.2 PCR引物的设计与合成
根据转录组(NCBI SRA 数控库,登录号:SRR2477578 和SRR2477579)已经获得的花色相关转录因子序列设计特异性引物(表1)。
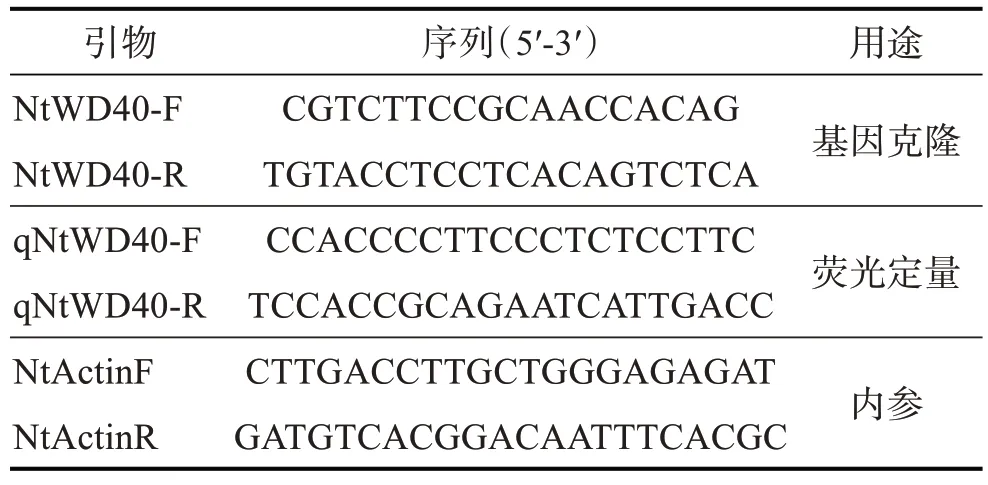
表1 引物及其序列
1.2.3WD40开放阅读框的获得
以云香水仙的cDNA 为模板,采用NtWD40-F 和NtWD40-R 为上下游引物扩增NtWD40 的ORF。PCR 扩增采用25 mL 反应体系(表2)和35 cycle、退火时间均为90 s。凝胶电泳后回收目的片段,连接18-T 载体,转化DH5α(Escherichia coli),后测序鉴定目的片段[1-2]。
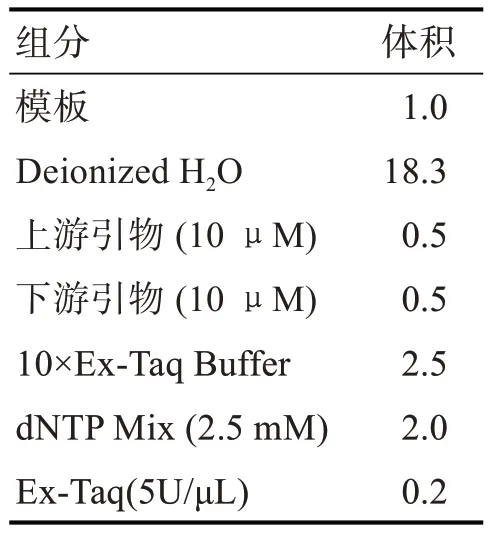
表2 PCR 反应体系/μL
1.2.4 序列拼接及生物信息学分析
使用DNAMAN 和Primer5.0 进行引物设计和序列拼接。氨基酸多重序列比对和CDD功能区域分析使用NCBI 中的BLASTX;氨基酸理化分析使用Ex-PASy-ProtParam tool;构建系统进化树使用MEGA5.05 中的邻近相法neighbor-joining tree;氨基酸信号肽预测使用SignalP 4.1Server;氨基酸跨膜预测使用TMHMM Server v.2.0;氨基酸的亲疏水特性使用ProtScale;亚细胞定位使用Softberry[1-2]。
1.2.5 实时荧光定量PCR反应
实时荧光定量特异性引物见表1 中的qNt-WD40-F 和qNtWD40-R。使用20 μL qRT-PCR反应体系:ddH2O9.2 μL;Premix ExTaqTM(2×) 8 μL;PCR Forward 和Reverse Primer (10 μmol/L) 各0.4 μL;cDNA 模板2.0 μL。设定反应程序为:94 ˚C 预变性3 min,95 ˚C 变性15 s,60 ˚C 退火15 s,72 ˚C分离20 s[1-2]。反应结束后,分析融解曲线和扩增曲线并得到Ct 值。采用2-ΔΔCT法最终得到不同基因的相对表达量[11]。
2 结果与分析
2.1 NtWD40基因开放阅读框的获得
以云香水仙RNA 反转录成的cDNA 为模板,使用特异引物进行PCR 扩增。得到一条与预测相当的约为1 000 bp 的片段(图1),开放阅读框1 020 bp,初步判断已经获得NtWD40基因的cDNA全长。
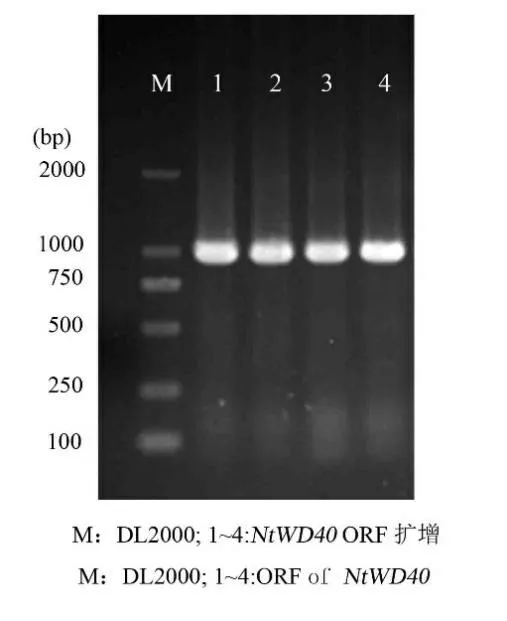
图1 NtWD40基因的凝胶电泳图
2.2 NtWD40蛋白生物信息学分析
使用DNAMAN 分析NtWD40 基因序列,结果显示NtWD40 共编码339 个氨基酸。使用ExPASy-ProtParam 等在线工具推测WD40氨基酸基本理化性质(表3),结果显示为亲水性和酸性不稳定蛋白,等电点为4.73。二级结构中最多的为无规卷曲且β-转角最少。该蛋白不存在信号肽,为非分泌蛋白。Nt-WD40蛋白跨膜螺旋数为0,预测其不属于跨膜蛋白。此外,亚细胞定位在线预测显示NtWD40位于细胞核的可能性较大。
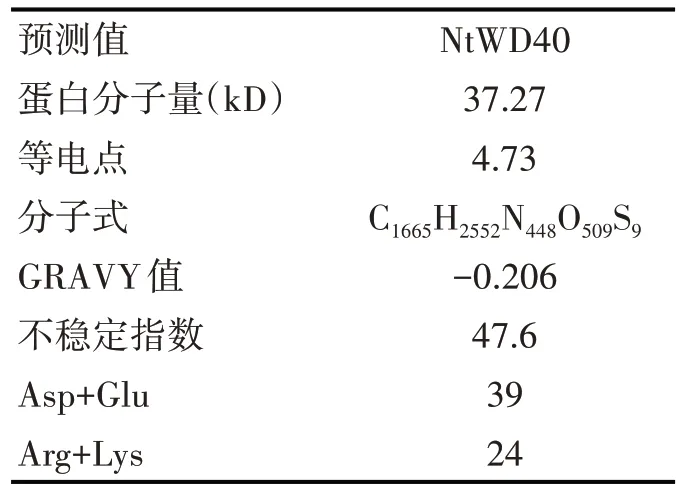
表3 NtWD40 蛋白的理化性质
将NtWD40 基因编码区的氨基酸序列在NCBI的CDD 上搜索,如图2,该基因属于典型的WD40 superfamily。对其开放阅读框所推导的氨基酸进行同源序列分析(图3),NtWD40 同拟南芥的AtTTG1、苹果的MdTTG1、矮牵牛的PhAN11 及苜蓿的Mt-WD40-1的同源性分别为68%、68%、68%和69%。为了研究NtWD40蛋白的进化关系,使用MEGA5.05中的邻近相法neighbor-joining tree 法构建了NtWD40的系统发育树(图4),分析表明,云香水仙与玉米亲缘关系最近,处于同一分支,同属于单子叶植物,其次是双子叶植物大豆、百脉根等。矮牵牛和番茄同属茄科,苹果和沙梨同属蔷薇科,小心叶薯、橙红茑萝和大花牵牛同属旋花科,处于进化树的同一分支,此进化树分析同植物分类学基本一致。

图2 NtWD40基因编码区的保守结构域
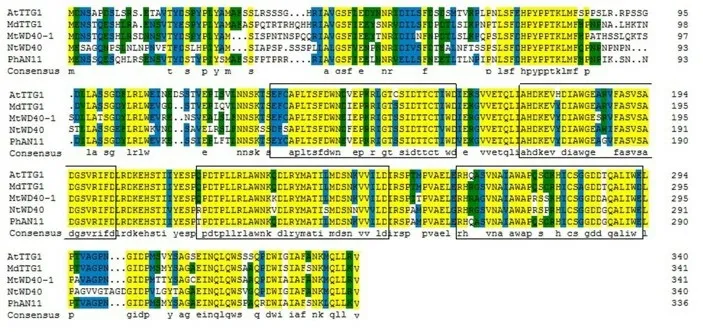
图3 NtWD40氨基酸序列多重序列比对
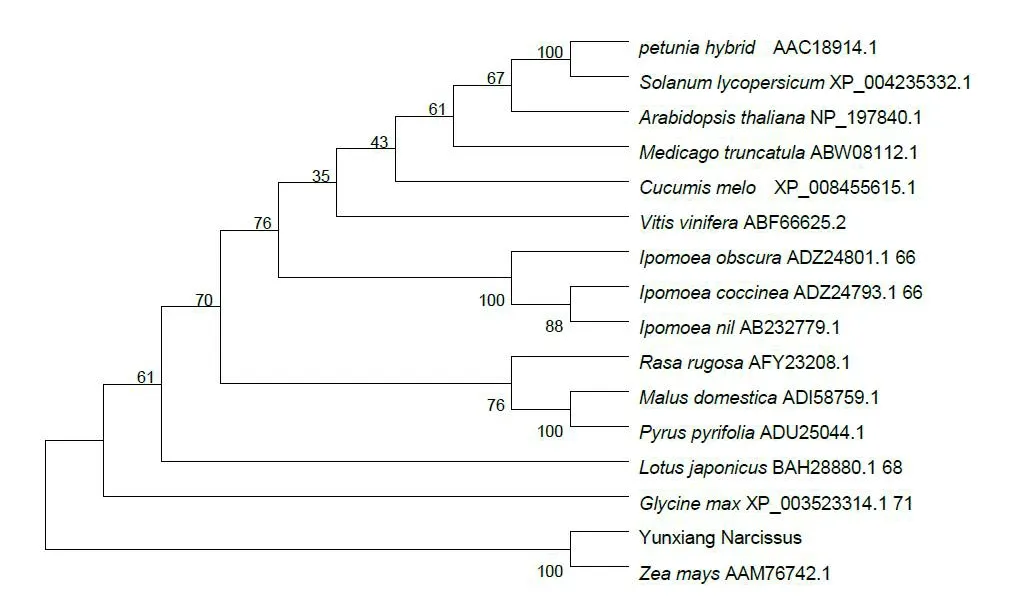
图4 NtWD40系统发育树
2.3 NtWD40蛋白生物信息学分析
随着云香水仙花朵的绽放,NtWD40在花苞、花蕾、始花和盛花期的转录水平表现为先上升后下降的趋势,始花期花瓣和副冠的相对表达量分别是花苞期花瓣和副冠的5 倍和8.1 倍(图5)。在花苞期和花蕾期,NtWD40在花瓣中的表达量稍高于副冠,而始花期和盛花期副冠中NtWD40表达量稍高于花瓣。
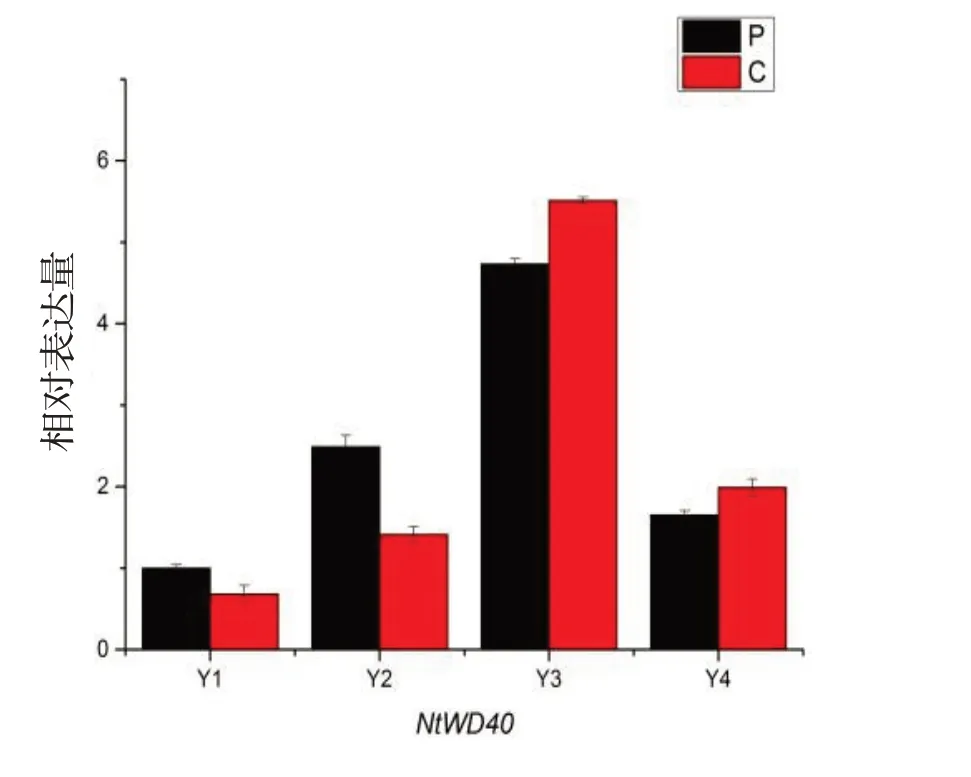
图5 NtWD40基因的表达分析
3 讨论
WD40 蛋白一般有4~16 个串联的WD40 基元,该高度保守的基元约由40个氨基酸残基组成,在不同的植物中高度保守[12-13]。WD40蛋白参与植物的多种生理活动,如参与植物的胚胎发育[14]、开花过程[13]、花的发育[15]和调控花青素的合成[16]等。
本研究中,NtWD40推导的氨基酸同MtWD40-1、AtTTG1、MdTTG1和PhAN11的氨基酸序列同源比对表明,NtWD40 同样含有4 个高度保守的WD 基序(WD、FD、LD 和WE)。研究表明MtWD40-1[17]、AtTTG1[18]、MdTTG1[19]和PhAN11[20]参与花青素的生物合成调控。因此,推测NtWD40可能参与云香水仙类黄酮及花青素的生物合成。
此外,NtWD40基因的荧光定量结果显示,Nt-WD40在云香水仙花苞期、花蕾期和始花期中呈上升趋势,这和花苞期副冠和花瓣的浅绿色至始花期的黄色和乳白色的表观相符合。盛花期NtWD40的表达量低于始花期,这和盛花期副冠和花瓣的颜色变浅相一致,因此推测NtWD40可能参与云香水仙类黄酮途径相关色素的合成。本研究的开展对中国水仙花色育种及品种改良提供了一定的基因资源和理论基础。
