预后良好的胎儿混合性Ⅲ级不成熟性骶尾部畸胎瘤1例并文献复习
2023-08-18贺娟娟沈豪飞姚延娇张学红
贺娟娟,沈豪飞,姚延娇,张学红
(兰州大学第一临床医学院 兰州大学第一医院,兰州 730000)
骶尾部畸胎瘤(sacrococcygeal teratoma,SCT)多源于骶尾骨表面Hensen细胞结中的多能干细胞[1],是一种罕见的先天性肿瘤,发生率为1/40 000~1/35 000,女性患儿是男性患儿的4倍,男性患儿的恶变率高[2]。妊娠期胎儿SCT若出现瘤体增长速度快、恶性羊水过多、胎盘增厚、胎儿水肿及心血管疾病等合并症,必要时应提前终止妊娠。本文报告1例预后良好的混合性、Ⅲ级不成熟性胎儿SCT,病例资料及分析如下。
一、病例资料
孕妇28岁,因“停经38+3周,无明显诱因阴道流液1小时”于2021年5月18日来兰州大学第一医院急诊就诊。
平素月经规律,末次月经2020年8月12日,根据胎儿颈项透明层厚度(NT)推算预产期为2021年5月29日。经产妇,本次为第2次妊娠(此前足月顺产1次,体健)。孕9+2周于我院行彩超检查提示宫内早孕;孕12+4周我院超声检查示NT 1.4 mm;孕17+2周我院血清学筛查(包括21-三体综合征、18-三体综合征和开放性神经管缺陷)提示低风险;孕32+1周于岷县人民医院彩超检查提示胎儿骶尾部大小约6.1 cm×5.3 cm×4.2 cm的实性占位,建议上级医院进一步检查;孕32+3周于甘肃省妇幼保健院复查彩超提示胎儿骶尾部见大小约6.4 cm×6.5 cm×4.4 cm的非均质团块,考虑畸胎瘤(Ⅰ型);磁共振成像(MRI)检查提示胎儿骶尾部见大小约6.0 cm×4.7 cm×5.4 cm的不规则形占位,考虑骶尾部畸胎瘤(Ⅰ型)。告知孕妇及家属后,考虑到胎儿生长参数与孕周相符,心功能未见明显异常,暂无宫内干预指征,建议每2周进行彩超检查,必要时复查MRI,拟出生后即刻准备手术治疗。若出现妊娠合并症,必要时将提前终止妊娠。孕妇及家属充分理解,自愿承担风险,继续妊娠。孕38+3周因“胎膜早破”于我院急诊行彩超检查提示胎儿骶尾部见大小约9.8 cm×7.3 cm的混合回声团。孕妇孕期各孕周超声指标详见表1,孕期体重增加14 kg。
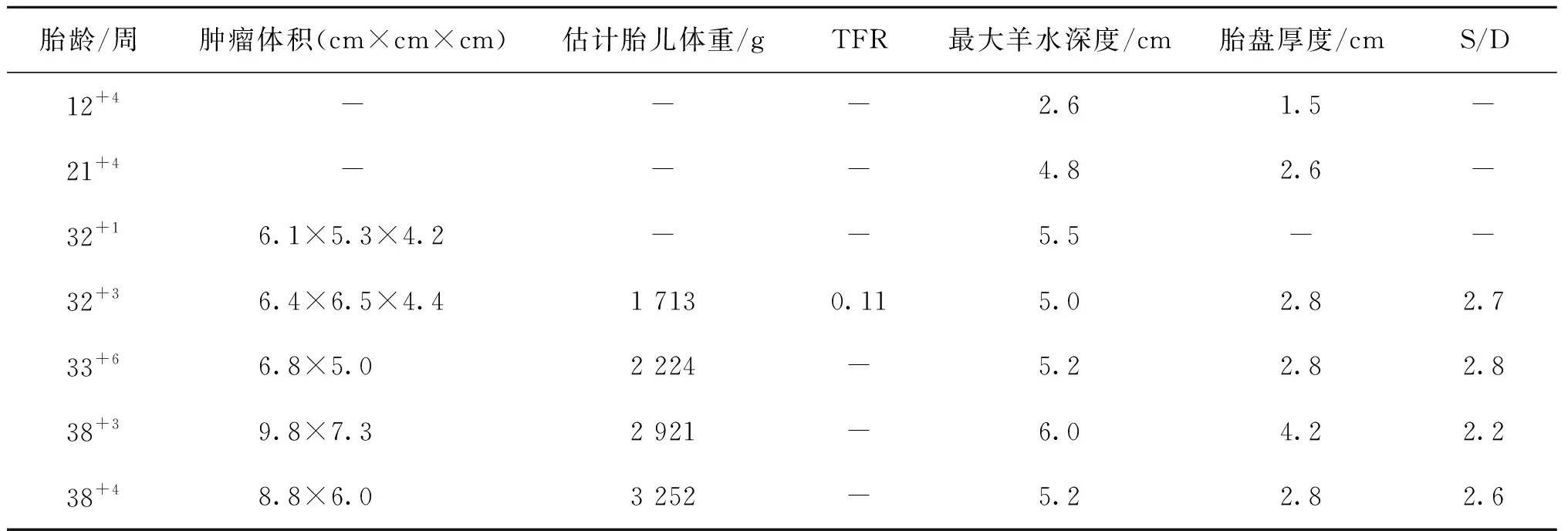
表1 本例孕妇各孕周超声指标结果
入院后积极完善相关检查,经评估无阴道分娩禁忌证后行阴道试产,于2021年5月20日(孕38+5周)以枕左前(LOA)胎位分娩一体重2 730 g活男婴,羊水Ⅲ度污染,量约500 ml。骶尾部可见直径约11 cm×9.0 cm×7.0 cm的肿物,部分无皮肤覆盖,表面凹凸不平,呈粉红色肉芽样组织,伴少量血性分泌物。于出生第1天行CT骶尾椎平扫+三维重建提示,骶尾部皮下可见大小约9.8 cm×7.1 cm的不规则囊实性肿块影,其内可见多发钙化(图1)。血清学检查提示β-HCG 73.2 U/L,甲胎蛋白(AFP)>1 000 IU/ml,糖类抗原199(CA199)163.0 U/ml,鳞状上皮细胞癌抗原(SCC)9.3 ng/ml。经完善术前准备,该患儿于出生第4天在小儿外科行肿瘤切除术(取骶尾部中央长8 cm的横行切口,切除并分离带有瘤体的尾骨)。术后瘤体病理检查结果提示:(骶尾部)形态学及免疫组化结果支持不成熟性畸胎瘤,形态学Ⅲ级,不成熟神经上皮超过3个低倍视野(×40);免疫组化结果示,CD56(++),Syn(+),NSE(++),S-100(-),GFAP(+),ki67(50%),p53(-),ckp(++)(图2)。术后给予抗感染、营养支持、补液等对症治疗,并行抗肿瘤药物化疗。病情平稳后于术后第18天顺利出院。出院诊断:(1)骶尾部不成熟性畸胎瘤(Ⅲ级);(2)新生儿贫血;(3)新生儿高血糖;(4)新生儿低血糖;(5)卵圆孔未闭。
A:骶尾部皮下可见块状阴影(箭头示);B:阴影性质为不规则囊实性;C:囊实性肿块内可见多发钙化(箭头示)。图1 新生儿1日龄CT骶尾椎平扫+三维重建所见
瘤组织内可见分化成熟的鳞状上皮及其附属器,以及支气管、腺上皮、脑组织及软骨组织等;部分区域可见不成熟神经上皮、神经管,不成熟神经上皮超过3个低倍视野;瘤组织内局部可见出血、坏死。图2 SCT患儿切除物术后病理所见(HE染色,×100)
术后57 d于我院复查B超提示骶尾部手术区瘢痕下方可探及大小约1.0 cm×5.0 cm的低回声区(考虑术后瘢痕);复查AFP 295.0 IU/ml。10月龄于当地医院查AFP<30 IU/ml,之后定期电话随访至撰稿时(约19个月),父母代诉该患儿不定期复查,现生长发育正常,未见生理功能障碍,预后良好。
二、讨论
SCT是一种罕见的先天性肿瘤,约占胎儿肿瘤的50%,在胎儿和新生儿早期通常为良性,但有恶变的可能,因此其诊断和治疗显得尤为重要[2]。SCT通常因为其高度血管化,可诱导羊水过多、胎儿水肿、母体镜像综合征及高输出量心力衰竭等妊娠期并发症的发生,造成新生儿死亡率高达50%[3]。胎儿SCT预后常取决于瘤体大小、生长速度、分布特征、瘤体形态、病理分型等。
SCT通常表现为骶尾部肿块,随着孕周变化和瘤体的生长,会出现肠道和泌尿道功能障碍(如便秘、排尿失控、膀胱排空困难、胎儿肾积水等),肿瘤较大且不成熟的SCT患儿更易出现上述症状[4]。部分胎儿SCT因瘤体生长过快,瘤体内血管丰富,容易形成动静脉瘘,引发早产、羊水过多、胎儿高输出量心力衰竭、胎儿水肿、胎儿死亡、瘤体出血及破裂等[5-6]。有研究报道,SCT新生儿出血率达3.8%,占新生儿期总死亡率的70%;高输出量心力衰竭、瘤体内部出血和围手术期出血是早期死亡的最常见原因,都与肿瘤大小密切相关[3]。
SCT根据其分布特点、组织性质和类型,有以下几种分类:(1)根据瘤体分布特征,SCT分4种类型。Altman Ⅰ型:瘤体少部分位于骶骨前,大部分突出于骶尾部;Altman Ⅱ型:瘤体位于骶骨前后,且主要位于骶后,骶前部分未进入腹腔;Altman Ⅲ型:横跨骶骨前后,主要位于骶前,瘤体向盆腔及腹腔延展,常出现直肠及尿道压迫症状;Altman Ⅳ型:瘤体全部位于骶前,向盆腔及腹腔延展,体外不显露[7]。Altman Ⅰ型和Altman Ⅱ型最常见,约占80%,检出率高,预后良好。由于Altman Ⅳ型在内部生长,容易被忽略,恶变风险高。近年来,随着影像诊断技术的提高,SCT的产前检出率已达82%,但产前诊断的新生儿死亡率高达50%,主要是由于心力衰竭或(和)肿瘤出血[8-11],且9%~24%的父母选择终止妊娠[8,12]。(2)根据影像学检查结果,SCT分为囊性、实性和囊实性(即混合性),以囊性肿瘤为主和以实体瘤为主的SCT死亡率分别为2%和33%[13]。(3)根据组织病理学特点,SCT可分为成熟畸胎瘤、未成熟畸胎瘤、混合畸胎瘤和恶性畸胎瘤,成熟性SCT以囊性为主,不成熟性或恶性SCT多以混合性或实性表现为主[14-15]。(4)根据显微镜下瘤体内成熟或不成熟组织的含量,胎儿SCT又分为0~Ⅲ级。0级:仅见成熟组织;Ⅰ级:主要是成熟组织,不成熟组织很少;Ⅱ级:每张病理切片中1~3个低倍视野可见不成熟组织;Ⅲ级:在每张病理切片中4个以上低倍视野中可见不成熟组织[16]。本例患儿为AltmanⅠ型/混合性/不成熟性(Ⅲ级)SCT。
孕期B超、MRI、超声心动图等影像学检查提示的瘤体血流信号、生长速度、肿瘤形态(囊性/混合性/实性)、瘤体有无出血/破裂等信息,对其良恶性鉴别、治疗及预后有重要意义[14-15]。病理检查是诊断SCT的金标准。成熟性SCT多呈高分化,瘤体内含皮肤、毛发、脂肪及神经组织等多种成分,通常预后较好;不成熟性SCT分化欠佳,因此多表现为预后不良[17]。
胎儿SCT常用的治疗方法包括手术和化疗,对于胎儿SCT的并发症,可以行介入治疗,包括胎儿开放手术切除瘤体、射频消融、大血管激光消融和血管硬化,以防止胎儿高输出量心力衰竭、瘤内动静脉分流,以及减少肿瘤体积和胎儿水肿,改善胎儿结局;还可以通过缩小羊膜以防止早产,通过囊肿穿刺防止分娩时肿瘤破裂等[13]。对于新生儿SCT,提倡出生后4日龄进行手术治疗,因随着年龄增长SCT有恶变可能[14-15]。接受正规手术治疗的患儿预后良好,Ⅰ、Ⅱ型SCT常采用经骶部做倒“V”切口操作,如果肿瘤深入腹腔,需采用经腹骶联合术[18]。在实性SCT中,行肿瘤内激光或射频消融术治疗的新生儿存活率约为50%,但存活率并不意味着远期预后良好[10]。SCT术后放化疗可能降低复发率,但有可能出现相关并发症。目前普遍认可未成熟SCT Ⅰ、Ⅱ型完整切除后可不放化疗,对不成熟SCT Ⅲ型是否采取术后放化疗仍有争议[19-20]。本例患儿为男性/Altman Ⅰ型/混合性/未成熟畸胎瘤(Ⅲ级),经骶尾部中央长8 cm的横行切口术式,切除并分离带有瘤体的尾骨,术后进行药物化疗,预后良好,随访至撰稿时约19个月未见生理功能异常。
SCT预后情况常用的预测因素有SCT与胎儿体积比、实体肿瘤体积指数(TVI)、肿瘤体积与胎儿质量比(TFR)、肿瘤形态(实性/囊性/混合性)及是否为实性的高血管化肿瘤等[9,21-23]。任意孕周的SCT与胎儿体积比>0.16可使高心输出量和水肿的风险增加17倍,妊娠24周前的TVI>0.12与不良预后相关,TVI>0.09可使高心输出量和水肿的风险增加120倍[21,24]。当胎儿SCT直径大于5 cm时,为避免难产和产伤、瘤间出血和肿瘤破裂,建议行剖宫产[13]。妊娠24周之前,TFR≤0.12时91%的患者预后良好,TFR>0.095时预测胎儿结局不佳,TFR>0.12时预测母体手术风险增加,选择性终止妊娠的平均TFR为0.11至1.62[23-25]。预后不良的胎儿往往比预后良好的胎儿更容易在妊娠早期被诊断出来,这可能是因为体积较大的肿瘤比较小的肿瘤更容易被检出[21]。实体瘤比囊性瘤的预后结果更差[9,26]。多变量分析显示,心脏肥大和胎儿水肿两个因素是导致不良妊娠结局的独立危险因素,其中胎儿水肿的存在预示着预后不良的风险增加3.4倍[8,13]。
儿童复发性SCT的发生率为2%~35%[26]。据报道,AFP诊断SCT的敏感性和特异性分别为79%和95%,检测恶性复发的敏感性为96%[27]。因此,SCT术后患儿长期监测AFP,对其复发及恶变的可能有重要参考价值,通常建议在术后2年内每隔3个月、5年内每隔6个月进行AFP、直肠指诊和B超检查,并定期行盆腔MRI检查[20]。本例患儿诊断为混合性/不成熟性SCT(Ⅲ级),出生时AFP明显高于正常水平,经手术及化疗后患儿血清AFP水平明显降低,10月龄时AFP<30 IU/ml,出生后随访至撰稿时约19个月,其生长发育良好,未见生理功能障碍。但未来是否会出现生理功能障碍或复发还未知,我们将继续随访观察其预后情况。关于胎儿SCT的产前和产后诊断、治疗手段及预后情况的预测指标,未来尚需更多的样本量来积累资料和深入研究,以期更好地指导临床,实现更好的预后。
