基于多模态MRI 影像学表现的logistic 回归分析模型对鉴别小肝癌和肝局灶性结节增生的应用价值
2023-08-17周晓俞
于 泳,花 村,周晓俞
(1 南京中医药大学附属盐城中医院<盐城市中医院>影像科 江苏 盐城 224001)
(2 南通大学第二附属医院<南通市第一人民医院>影像科 江苏 南通 226001)
肝细胞癌(hepatocellular carcinoma,HCC)是我国最常见的恶性肿瘤之一,其发病率在我国恶性肿瘤中排名第四[1],而肝局灶性结节增生(FNH)是肝脏内仅次于肝血管瘤的第二常见良性肿瘤,占所有肝原发性肿瘤的8%[2]。临床上通常将单个结节最大直径不超过3 c m 或两个结节直径之和不超过3 c m 的HCC 称为小肝癌(sHCC),其早期病理特征并不明显,但晚期治疗相对复杂,且治疗效果因人而异[3],临床实践中对于sHCC 通常建议手术切除,而类似大小的FNH则采取定期随访策略,由于治疗方法和预后的差异,因此准确鉴别两者的重要性不言而喻。本研究基于多模态MRI 影像学表现,采用logistic 回归分析的方法对经病理证实的sHCC 与FNH 的临床资料及多模态MRI 表现进行对比分析,旨在提高对sHCC 和FNH 鉴别诊断的水平。
1 资料与方法
1.1 一般资料
回顾性分析2015年1月—2022年12月于盐城市中医院经病理证实的79 例sHCC 和41 例FNH 患者的临床及影像学资料。sHCC 患者中男45 例,女34 例,年龄35 ~83 岁,平均(59.53±10.40)岁;FNH 患者中男21 例,女20 例,年龄16 ~73 岁,平均(51.07±11.00)岁。因体检或检查偶然发现81 例(67.5%),肝区不适49 例(40.8%),消瘦纳差11 例(9.2%),乏力呕吐等21 例(17.5%)。71 例(59.2%)患者行肝占位切除术,49 例(40.8%)行穿刺活检术,术后均行常规病理及免疫组织化学检查。
纳入标准:①经手术或穿刺活检病理证实为sHCC或FNH 者;②单发病灶,直径小于或等于3 cm 者;③无其他恶性肿瘤病史,肝功能正常者。
1.2 方法
采用Siemens Aera1.5T 超导MR 扫描仪,平扫轴位T2 加权扰相自旋回波TR 1370 ms,TE 81 ms,视野(FOV)350 mm×284 mm,矩阵320×207,层厚6 mm,层间距1.2 mm;同反相位T1 扰相梯度回波轴位TR 254.00 ms,同相位TE 2.46 ms、反相位TE 6.15 ms;动态增强扫描采用T1-VIBE 抑脂序列TR 4.36 ms,TE 2 ms,FOV 350 mm×284 mm,矩阵320×207,层厚6 mm,层间距1.2 mm;造影剂钆喷酸葡胺(Gd-DTPA)总量30 mL,经肘静脉以2 mL/s 流率注射,分别于注射后20 ~25 s、70 ~90 s、180 s 行动脉期、门静脉期及平衡期的三期扫描。
1.3 图像分析
由两位具有丰富肝脏病变诊断经验的医师在未知病理结果的情况下共同对所有患者的MRI 图像进行分析,结论如有差异经讨论并达成一致,记录信息包括病灶最大径、部位、肿瘤边界情况、有无门脉栓子、中心有无瘢痕或坏死、强化方式、病灶有无包膜/包膜样强化、周围结构侵犯情况等。动脉期明显强化,门静脉期和/或平衡期肿瘤强化程度低于周围正常肝实质即“快进快出”,门静脉期和延迟期病灶持续强化,始终高于周围正常肝实质即“快进慢出”。
定量指标:分别测量病灶T1WI 平扫信号强度值,动脉期、门脉期和平衡期病灶信号强度值,感兴趣区的选择应避开坏死、囊变、病灶边缘或血管区域,将其置于病灶强化最显著处中心。获取增强各期的信号强度值(signal intensity,SI)来计算相对强化率(rER),用以进一步量化分析。rER=[(病灶增强SI 值-病灶平扫SI 值)/病灶平扫SI 值]×100%。
1.4 统计学方法
采用SPSS 27.0 统计软件进行数据分析,符合正态分布的计量资料以均数±标准差()表示,采用t检验;不符合正态分布的计量资料以中位数(四分位间距)[M(Q25,Q75)]表示,采用Mann-WhitneyU检验。计数资料以频数(n)、百分率(%)表示,采用χ2检验。连续性数值变量首先采用受试者工作特征(receiver operating characteristic,ROC)曲线分析确定sHCC 和FNH 鉴别诊断的最佳界值,将其转化为两分类变量,然后将sHCC 和FNH 两组单因素分析具有统计学意义的变量均纳入logistic 回归模型,将独立影响因素采用ROC 曲线进一步分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 临床资料
与sHCC 患者相比,FNH 患者发病年龄更小(51.0岁vs 61.0 岁),临床症状(如肝区不适、消瘦纳差、乏力呕吐等)较少(12.2% vs 43.0%),乙肝病史患者较少(17.1% vs 79.7%),大部分患者不伴有AFP 指标升高(14.6% vs 73.4%),但病灶大部分见中心瘢痕(75.6%vs 0.0%),肿瘤边界清晰(100.0% vs 77.2%),病灶不侵犯周围结构(0.0% vs 12.7%);在MRI 平扫T2WI序列,FNH 组病灶中心易出现高信号(75.6% vs 8.9%),增强后病灶延迟强化常见(95.1% vs 15.2%),但少见包膜/包膜样强化(14.6% vs 85.1%),内部坏死率较低(4.9% vs 17.7%),门脉未见栓子形成(0.0% vs 19.0%);强化方式方面,FNH 组大部分强化方式为“快进慢出”(95.1% vs 15.2%);以上特征两组之间比较差异均具有统计学意义(P<0.05);两组在患者性别、肿瘤部位和肿瘤最大径方面对比差异均无统计学意义(P>0.05),见表1、图1、图2。

表1 sHCC 和FNH 的临床和MRI 影像学特征比较

图1 sHCC 患者MRI 增强表现

图2 FNH 患者MRI 增强表现
2.2 定量分析
sHCC 组的平衡期强化率显著低于FNH 组(P<0.001),而动脉期强化率和门脉期强化率两组差异无统计学意义(P>0.05),见表2。
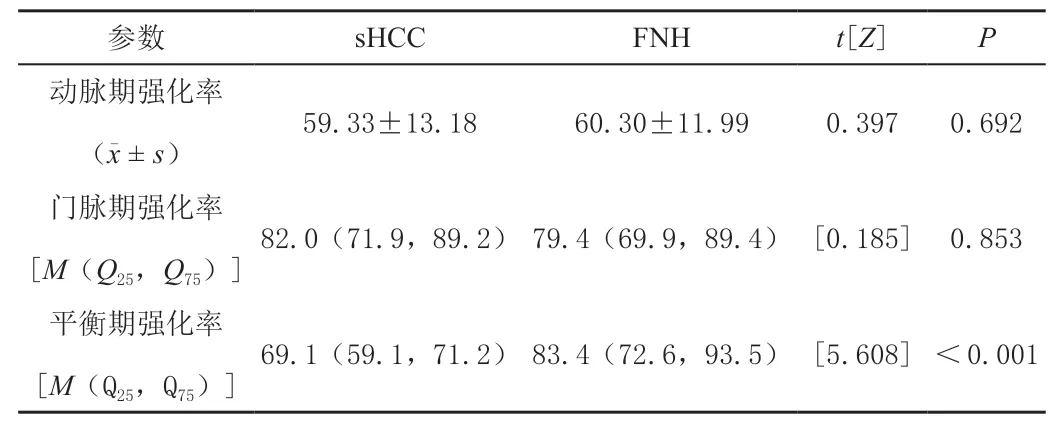
表2 sHCC 和FNH 的MRI 扫描各期病灶强化率比较
logistic 回归模型分析结果显示,鉴别sHCC 和FNH的独立危险因素包括AFP 升高(OR=22.498)、平衡期相对强化率(OR=8.189)和T2WI 病灶中心高信号(OR=0.017),见表3。

表3 logistic 回归分析鉴别sHCC 和FNH 的独立危险因素
将鉴别sHCC 和FNH 的独立危险因素进一步行ROC 曲线分析,AFP 升高、病灶延迟期相对强化率、肿瘤T2WI 序列病灶中心高信号的AUC 值分别为0.794、0.813、0.834,这些因素均具有较高的诊断敏感性和特异度,见表4、图3。
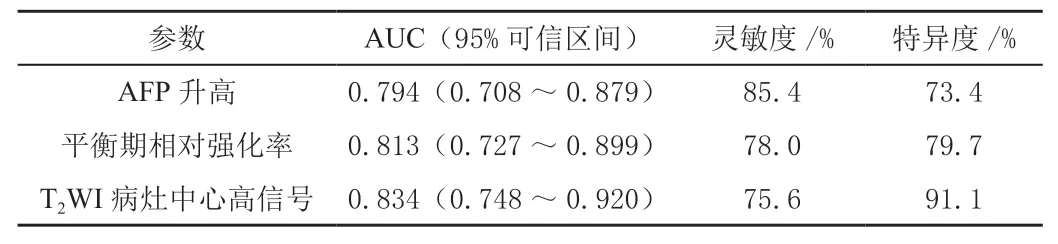
表4 多模态MRI 表现鉴别sHCC 和FNH 的ROC 曲线分析

图3 鉴别sHCC 和FNH 的独立危险因素的ROC 曲线
3 讨论
FNH 是肝脏富血供占位,在病灶较小且单发的情况下,与sHCC 部分病例影像学表现具有一定的重叠及相似性,术前准确鉴别两者较为复杂[4],在“精准医疗”的大形势下,对两者进行准确鉴别以指导临床显得尤为重要。本文显示,sHCC 患者多有乙肝病史并伴临床症状,AFP 指标升高较FNH 组差异明显,这与Virgilio 等[5]报道一致;但本文在性别、肿瘤部位和肿瘤最大径方面均无统计学差异,与前期报道[6-7]不一致,这可能与样本量较少且存在选择偏倚有关。Auer 等[8]报道FNH 是继发于肝脏先天血管畸形或后天血管损伤的良性增生结节,其内增生的纤维间隔将正常肝组织分隔成结节状,因而可在T2WI 图像见到中心瘢痕且增强后期更为清晰,这与本文一致。组织学上FNH 由正常肝细胞、Kupffe 细胞、血管和胆管等良性元素共同构成,所以对周围无侵犯表现,内部坏死概率较小,患者亦不可见门脉栓子;FNH病理上无包膜,增强后罕见包膜/包膜样强化,本研究6 例FNH 见包膜样强化,这可能是由于病灶周围正常肝组织或结缔组织受压,增强后期造影剂进入受压组织的间隙中,出现类似包膜样强化,而并非真正意义上的包膜。近年来有报道使用肝细胞特异性造影剂(Gd-EOBDTPA),可以在FNH 肝胆特异期看到造影剂特异性摄取,其较常规MRI 影像手段鉴别两者更为敏感[9],这为后期研究提供了良好的思路。logistic 回归模型的独立危险因素包括AFP 升高、平衡期相对强化率、T2WI 病灶中心高信号,这是由于两者不同的病理特点和组织学结构所致,sHCC内有丰富异形增生肿瘤细胞和菲薄血管网,肿瘤血管流速快,瘤周常形成动静脉瘘导致“快进快出”,而FNH 内有大量良性紊乱排列的正常肝细胞,其中心区域有一些纤维组织形成的瘢痕,周围有丰富的血窦样腔隙,病灶血流流速较慢导致“快进慢出”,这与周小娇等[9]研究一致。在临床工作中,还可以使用影像组学的手段[10]对HCC 与FNH 两者进行鉴别[11],Ding 等[12]建立了鉴别两者的影像组学模型,该组合模型分类准确性在训练集和验证集中分别为0.956 和0.941,而且无论是训练集(0.984 vs 0.937,P=0.002)还是验证集(0.972 vs 0.903,P=0.032),其ROC 曲线下面积均明显优于单一临床模型。
综上所述,综合分析患者的临床和多模态MRI 特征,有利于提高sHCC 和FNH 的鉴别诊断水平,对诊断困难的患者,可进一步使用肝细胞特异性造影剂(Gd-EOBDTPA)或使用影像组学方法。
