碱性吸附剂对燃煤烟气中SO3的吸附特性
2023-08-16张雪伟黄亚继许月阳程好强朱志成李金壘丁雪宇王圣张荣初
张雪伟,黄亚继,许月阳,程好强,朱志成,李金壘,丁雪宇,王圣,张荣初
(1 东南大学能源热转换及其过程测控教育部重点实验室,江苏 南京 210096;2 清洁高效燃煤发电与污染控制国家重点实验室,江苏 南京210023;3 南京常荣声学股份有限公司,江苏 南京 210018)
SO3作为一种电厂污染物,其排放不仅会损坏锅炉设备,还会对生态环境乃至人类生存安全造成威胁,SO3的排放控制因而越来越受到关注[1]。炉膛高温燃烧和选择性催化还原(SCR)催化氧化部分SO2是产生SO3的主要原因,当燃烧高硫煤时,SCR 出口处烟气SO3浓度更是可以达到100mg/m3以上[2-5]。虽然电厂中的静电除尘器、湿式静电除尘器等装置可以有效脱除SO3以避免排入大气[6-7]。但是烟道中高浓度的SO3及H2SO4蒸气会对设备产生严重损害,造成SCR催化剂及空预器堵塞、SCR催化剂失活、下游管道与设备腐蚀,甚至会腐蚀厂房中的混凝土和塑料件[8-11]。因此,降低烟气中的SO3浓度对燃煤系统的稳定运行具有重要意义。
针对烟气中SO3的控制,目前主要有调整燃料类型和燃烧方式[12]、利用除尘器和湿式静电除尘器等设备[13-14]、向烟道中喷射碱性吸附剂[3,15]三种方法。其中,烟道喷射碱性吸附剂的方法具有良好的适应性,可以在烟道中的不同位置喷射适用且适量的吸附剂,有效降低烟道中的SO3含量,保护管道、SCR和空预器等设备,由此更加受到青睐。目前使用较多的吸附剂为钙基、钠基和镁基吸附剂。Thibault 等[16]发现MgO 对SO3的吸附能力强于CaO,而Galloway 等[17]报道多种金属氧化物对SO3的吸附能力依次为NaO>CaO>MgO。Wang等[18]研究了中低温条件下Ca(OH)2、CaO 和CaCO3对SO3的吸附特性实验,发现Ca(OH)2吸附效果最好,且提高温度和Ca/SO3摩尔比均能提高吸附效率。何川等[19]发现Ca(OH)2、Mg(OH)2吸附SO3时会放出气态水增大吸附剂孔隙,因此其吸附效果明显优于CaO 和MgO。Qi 和Cao 等[20-21]研究发现钠基吸附剂对SO2和SO3等酸性气体均具有良好的吸附效果,其中NaHCO3的吸附效果最好。He 等[22]还发现钠基中碱性较弱的Na2SO3和NaHSO3也能有效吸附SO3且吸附过程受其他气体影响较小。
此外,实际情况中气氛的变化对碱性吸附剂吸附SO3影响很大。大部分吸附剂在简单的气氛下吸附SO3的能力随着温度升高会略有升高,但其总吸附量提升不多[22-24]。但是Zheng 等[24]的研究发现当温度低于300℃时,向气氛中添加水蒸气明显增强了钠基吸附剂对SO3的吸附,然而目前少有对这一现象的解释。另外,相关研究[22,24-26]发现SO2的存在也会抑制碱性吸附剂对SO3的吸附,对吸附剂的利用效率产生较大影响。
以往的研究大多集中于考察吸附剂在简单工况下对SO3的吸附效果,有关不同气氛对SO3吸附影响的研究较少,且少有对相关的影响机理作出深入探究。因此,基于前人的研究结果,本文选择Ca(OH)2、Mg(OH)2、NaHCO3、NaHSO3四种典型的碱性吸附剂,研究了它们对SO3的吸附效果和吸附机理,并考察了烟气气氛和温度对优选吸附剂的SO3吸附效果的影响,旨在寻找适合用于烟道不同位置的吸附剂以有效脱除SO3,实现保护烟道壁面及下游设备的目的。
1 实验系统和方法
1.1 实验材料
实验使用的N2和O2为高纯气体(纯度为99.99%),SO2为4%混合气体(平衡气为N2),南京上元工业气体公司。实验所用的样品Ca(OH)2、Mg(OH)2、NaHCO3、NaHSO3、Na2CO3和Na2SO3均为分析纯(≥99.8%),由上海阿拉丁生化科技股份有限公司生产,在实验前通过压片机压制和研磨制备为40~60目的颗粒。
1.2 实验装置
如图1 所示,SO3吸附实验系统主要由配气系统、反应系统、采集系统及尾气处理系统构成。其中,配气系统由气瓶、减压阀、质量流量计、混气瓶、注射泵、水蒸气发生器、伴热带和连接管路组成。实验中通过注射泵和水蒸气发生器控制模拟烟气中水蒸气浓度,混气瓶后的管路缠绕伴热带防止水蒸气冷凝。
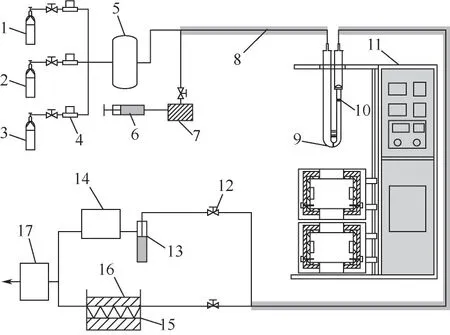
图1 SO3吸附实验系统
反应系统由一个U形石英管和双温区的立式管式炉组成,U形管内上部加热区放置一个石英吊篮砂芯(内径6mm),砂芯外表面为磨砂材质以保证气密性,U形管底部有一个石英砂芯挡板,可以在管子底部填充大量V2O5-WO3/TiO2催化剂(40~60目),催化剂各成分质量比例V2O5∶WO3∶TiO2=1.5∶8∶10。管式炉的2个加热区域可以滑动调整位置,通过调整2个加热区位置,可以使得上部的石英吊篮砂芯和管子底部的砂芯挡板位于2 个恒温区,2个恒温区分别由2个独立的PID温控系统控制以满足实验要求。
1.3 实验过程及方法
在SO3吸附实验中,控制烟气总流速为1L/min,O2体积分数为6%,水蒸气体积分数为9%,SO2浓度为200μL/L,N2作为平衡气;烟气入口加热带的温度控制为150℃以避免水蒸气凝结,并选择320℃以模拟SCR 脱硝装置和空预器之间的温度。实验中称取0.3g吸附剂放入吊篮中,吊篮上部塞石英棉以防止气流带动固体吸附剂流动。前期实验证明当填充适量钒催化剂并使下级加热区加热至450℃以上时,可以使得200μL/L的SO2全部转化为SO3,适当降低温度和减少催化剂可以使SO2被部分转化。系统中的SO2可以通过集气袋采集后使用烟气分析仪进行测试,但SO3的性质活泼难以采集、保存和测量,而且系统中SO2的存在影响SO3的测量。因此,本研究采用控制冷凝法采集SO3。烟气出口管道通过加热带控制温度为230℃以上,保证烟气进入冷凝管前SO3不会冷凝;控制恒温水浴锅温度为80℃,该温度下SO3会凝结并被蛇形冷凝管采集,同时SO2和水蒸气不会凝结,避免了对采样结果的影响[27]。
采样时间以10min为单位,总实验时长设置为60min。采集后的冷凝管用去离子水清洗并立即向清洗液中加入异丙醇,配置为含SO2-4的80%异丙醇溶液,取1mL 溶液与适量钍试剂、BaCl2溶液进行配置。配置好的溶液在2h 内使用紫外分光光度计进行测量,以80%异丙醇溶液为参比,波长调为530nm,通过提前绘制的SO2-4标准曲线即可测得溶液中SO2-4浓度,从而得到采集到的SO3总量,每组实验需要进行3 次测量。SO3吸附率ηSO3(%)计算见式(1)。
式中,ηSO3in为催化剂产生的SO3气体的物质的量,mol;ηSO3out为10min内尾部采集到的SO3气体的物质的量,mol,计算见式(2)。

2 结果与讨论
2.1 吸附剂在炉内热行为分析
首先使用STA8000 热同步分析仪对4 种吸附剂进行热重分析,气氛为N2,气体流速设置为20mL/min,从室温以5℃/min 的升温速率加热到900℃。可以得到4种吸附剂的失重TG曲线和失重速率DTG曲线,结果如图2所示。
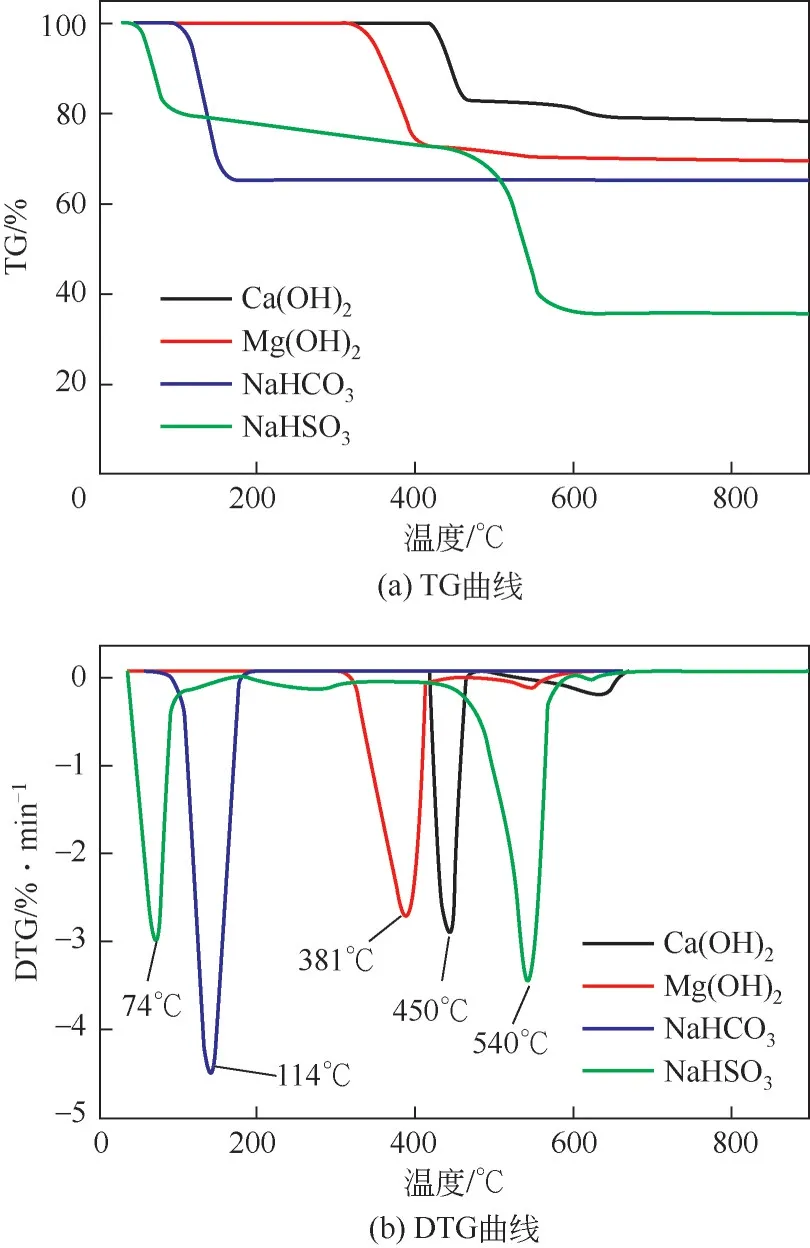
图2 吸附剂的热重分析
根据热重分析可以发现Ca(OH)2在中低温下比较稳定,432℃才开始分解并产生CaO 和水,该反应在432~467℃之间反应速率迅速增大并在450℃达到峰值,随后缓慢分解,直到630℃后Ca(OH)2才完全分解。Ca(OH)2常用于高温下并具有良好的吸附效果[18],因为分解过程放出了大量水蒸气,对吸附剂孔道结构产生了很大影响,促进反应气体与吸附剂接触。Mg(OH)2在312℃开始分解,温度到达381℃时反应速率最大,到410℃左右反应基本结束。
NaHCO3的热稳定性较差,其在低温下就能快速分解。NaHCO3在141℃时就能达到最快反应速率,且在172℃时就已经完全分解成Na2CO3。而产生的Na2CO3性质稳定,加热至900℃也没有分解。
与NaHCO3类似,NaHSO3同样在低温下就会开始分解,分解在40℃左右就已经开始,在74℃时反应速率达到最大且在95℃左右反应基本结束。DTG曲线在480℃左右开始形成一个新的峰并在540℃达峰值,表明NaHCO3热分解反应的固体产物Na2SO3开始分解,分解产物为Na2S 和Na2SO4,因此在450℃以下能保证NaHSO3对SO3的良好吸附效果。
2.2 碱性吸附剂对SO3的吸附效果
2.2.1 不同吸附剂的吸附效果
根据对4种吸附剂的热重分析可以发现,在中低温条件下Ca(OH)2及Mg(OH)2较为稳定,而NaHCO3、NaHSO3几乎完全分解并放出大量气体。为了探明4 种吸附剂在中低温下的使用效果,在320℃的模拟气氛中考察了Ca(OH)2、Mg(OH)2、NaHCO3、NaHSO3对SO3的吸附效率,实验结果如图3所示。

图3 320℃下不同吸附剂对SO3的吸附效率
从图3中可以看出NaHSO3对SO3的吸附效果显著优于其他3 种吸附剂,在前30min 内吸附效率都能达到75%以上,且在60min时吸附效率依然能达到59.20%。Mg(OH)2也表现出优异的吸附效果,在前10min可以达到77.31%,但是其吸附效果随着时间的增加迅速下降,在20min后的吸附效果显著弱于NaHSO3和NaHCO3。Mg(OH)2相较于钠基和钙基吸附剂价格较为昂贵,实验中可以发现Mg(OH)2在60min 内吸附效果不如NaHSO3,因此性价比较低。Ca(OH)2在前10min 对SO3仅有58.54%的吸附效率,且吸附效率随着时间增加至60min 快速下降至24.64%,脱除效果较差。
随着时间增长,4 种吸附剂对SO3的吸附效率都在下降,但是不同吸附剂的下降速率差距较大。为了研究这一现象,通过扫描电镜(SEM)对4种吸附剂在吸附SO3反应前后的表面形貌进行了研究,结果如图4所示。

图4 吸附SO3前后吸附剂的SEM图
通过对吸附剂表面形貌的观察可以看出,新鲜吸附剂表面结构粗糙,而吸附SO3后吸附剂均表现出较为光滑的表面结构,表明反应产物逐渐覆盖在吸附剂表面[28],阻碍了SO3与吸附剂表面接触。可以看到Ca(OH)2和Mg(OH)2吸附产物表面结构更加致密,反应中所产生的CaSO4和MgSO4会快速在吸附剂表面堆积并堵塞孔隙,阻碍SO3向吸附剂内部扩散;由于吸附过程中大部分时间催化剂内部无法参与反应,反应中释放的气态水便无法起到改善催化剂内部结构的作用,因此这两种吸附剂对SO3的吸附效率随着吸附反应时间的增长而快速下降。放大表面结构后可以看出相比于反应前,NaHCO3和NaHSO3表面出现了很多孔道,这是由于NaHCO3自身分解以及NaHCO3与SO3反应会生成CO2气体,NaHSO3自身分解以及NaHSO3与SO3反应会生成气SO2气体。这些气体在逸出过程中增加了固体吸附剂的内部孔道,改善了吸附剂的孔隙结构,增加了比表面积,且气体扩散通道不易被反应产物堵塞。
根据以上结果可以发现,吸附剂作为多孔颗粒,其与SO3的反应过程可以理解为:在反应开始时多孔吸附剂的外表面及内表面都是有效活性位点,SO3可以直接在其表面进行气固反应,或通过孔隙扩散到颗粒内部并在颗粒内表面进行气固反应。随着反应进行,各吸附剂表面及内孔都形成了反应产物,如CaSO4、MgSO4和Na2SO4,而这些反应产物逐渐覆盖在有效活性位点之上。Ca(OH)2和Mg(OH)2在表面被大面积覆盖后,SO3难以通过内部孔隙进行扩散,因此吸附效率快速下降。但是在吸附剂表面被产物覆盖后这两种吸附剂依然有吸附效果,说明SO3存在着产物层扩散[29],而随着产物层增厚,产物层扩散阻力也逐渐升高。NaHCO3和NaHSO3在分解和吸附SO3的过程中放出的气体产物改善了孔隙结构从而提高了吸附效率;同时也在一定程度上抑制了反应产物对微孔的堵塞,因此随着吸附时间的增长,这两种吸附剂的吸附效率下降较为缓慢。
2.2.2 NaHCO3、NaHSO3及其热分解产物对SO3的吸附效果
从之前的TG-DTG 分析中可以看出,NaHCO3和NaHSO3在低温下就会快速分解为Na2CO3和Na2SO3,因此使用这两种吸附剂吸附SO3时,大部分时间参与反应的是Na2CO3和Na2SO3。为了研究分解产物对这两种吸附剂的替代性,将分析纯Na2CO3和Na2SO3制备为40~60 目颗粒,在320℃条件下比较60min 内NaHCO3与Na2CO3、NaHSO3与Na2SO3对模拟烟气中SO3的吸附效果,结果如图5所示。
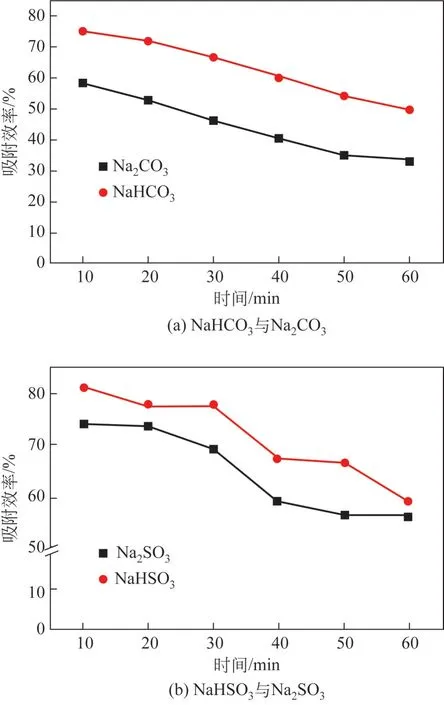
图5 320℃下不同吸附剂对SO3吸附效果对比
从图5 中可以看出,在320℃下NaHCO3对SO3的吸附效率远高于Na2CO3,最大时相差20.85%,且随着时间增加,两种吸附剂的吸附效果始终保持较大差距;NaHSO3对SO3的吸附效率也高于Na2SO3,在60min 时两种吸附剂的吸附效率仍相差2.82%。在60min 内,NaHCO3吸附的SO3比Na2CO3多42.16%,NaHSO3吸附的SO3比Na2SO3多10.55%。NaHCO3和NaHSO3都能在10min 内完全分解,但是这两种吸附剂在10~60min内吸附的SO3仍高于分析纯的Na2CO3和Na2SO3,为了研究这一现象,将4种吸附剂320℃加热60min 后进行BET 表征,结果如表1所示。
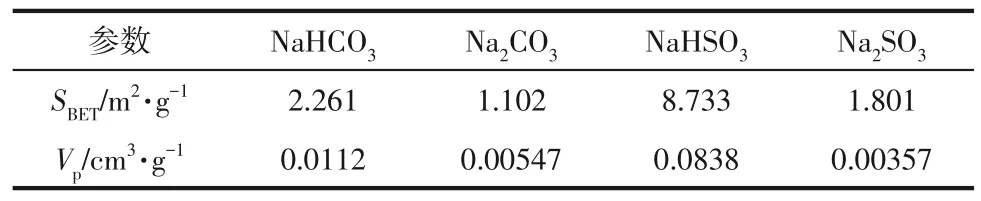
表1 4种吸附剂320℃加热后的BET表征结果
从表1 中可以看出,虽然NaHCO3加热1h 后完全分解为Na2CO3,但是其BET 比表面积和孔容都远高于分析纯Na2CO3,NaHSO3加热后BET 比表面积和孔容也远高于分析纯Na2SO3。说明这两种吸附剂在分解反应中产生的气体产物改变了吸附剂的孔道结构,比表面积和孔容的增加促进了SO3向颗粒内表面转移,因此促进了SO3与吸附剂内表面的反应,增加了SO3吸附效率。
2.3 温度对吸附剂吸附效果的影响
从上述实验结果中发现,NaHCO3和NaHSO3两组钠基吸附剂具有良好的吸附效果和较高的性价比,可以作为优秀的吸附剂以吸附烟道中的SO3。为了实现保护烟道壁面及设备的目的,吸附剂的喷射位置通常设置在省煤器到SCR之间、SCR到空预器之间和静电除尘器之前。本研究选取390℃、320℃、250℃以模拟三个位置的温度对优选吸附剂的SO3吸附性能的影响,结果如图6所示。

图6 吸附剂在不同温度下对SO3的吸附效果
在320℃下和390℃下两种吸附剂的吸附效率都没有明显变化,从吸附总量看提高温度略微提升了钠基吸附剂对SO3的吸附,因此这两种吸附剂在SCR前段的中高温区域能作为有效吸附剂使用。反应温度升高会使得反应速率常数和扩散系数升高,但是也可能导致吸附剂部分烧结阻碍吸附过程[30],两种因素的协同作用使得提升温度仅略微提升了SO3的吸附量。但是在250℃下两种吸附剂的吸附效率都明显高于其他两个温度,并且反应结束后观察到反应器内的吸附剂大部分结块并吸附于容器表面,这与部分研究得到的吸附效率随温度升高而升高的结果[22]相反。这是因为本研究为了模拟烟道中气氛增加了9%的水蒸气,在低温下会有部分SO3与水蒸气结合生成气态H2SO4,且在低温下有水蒸气存在时两种吸附剂与SO3可能会发生新的反应,如式(3)~式(6)所示。
上述反应进行时,1mol NaHCO3和NaHSO3可以 吸 附1mol SO3、1mol Na2CO3和Na2SO3可 以 吸 附2mol SO3,相较于中高温下的反应,单位物质的量吸附剂的SO3吸附量翻倍,这一理论解释了实验中250℃下SO3吸附量高于320℃和390℃。同时由吸附反应所生成的NaHSO4在180℃以上就会变成液态且在低温下难以分解[9],实验台冷却后凝固成固态并黏附在容器壁面。虽然低温下使用钠基吸附剂效果显著,但是其产物NaHSO4熔化为液态会黏附在烟道壁面造成腐蚀、加剧飞灰沉积等问题,同时对除尘器的寿命和使用安全有一定影响,因此低温环境应避免使用钠基吸附剂。
2.4 烟气中SO2对吸附剂吸附SO3的影响
2.4.1 烟气中SO2对NaHCO3吸附剂吸附SO3的影响
燃煤烟气中存在较高浓度的SO2气体,这会影响碱性吸附剂对SO3的吸附。因此研究了320℃温度下SO2的存在对NaHCO3的SO3吸附性能的影响。实验中,向模拟烟气中添加浓度为2000μL/L的SO2气体,其他工况不变,实验结果如图7所示。
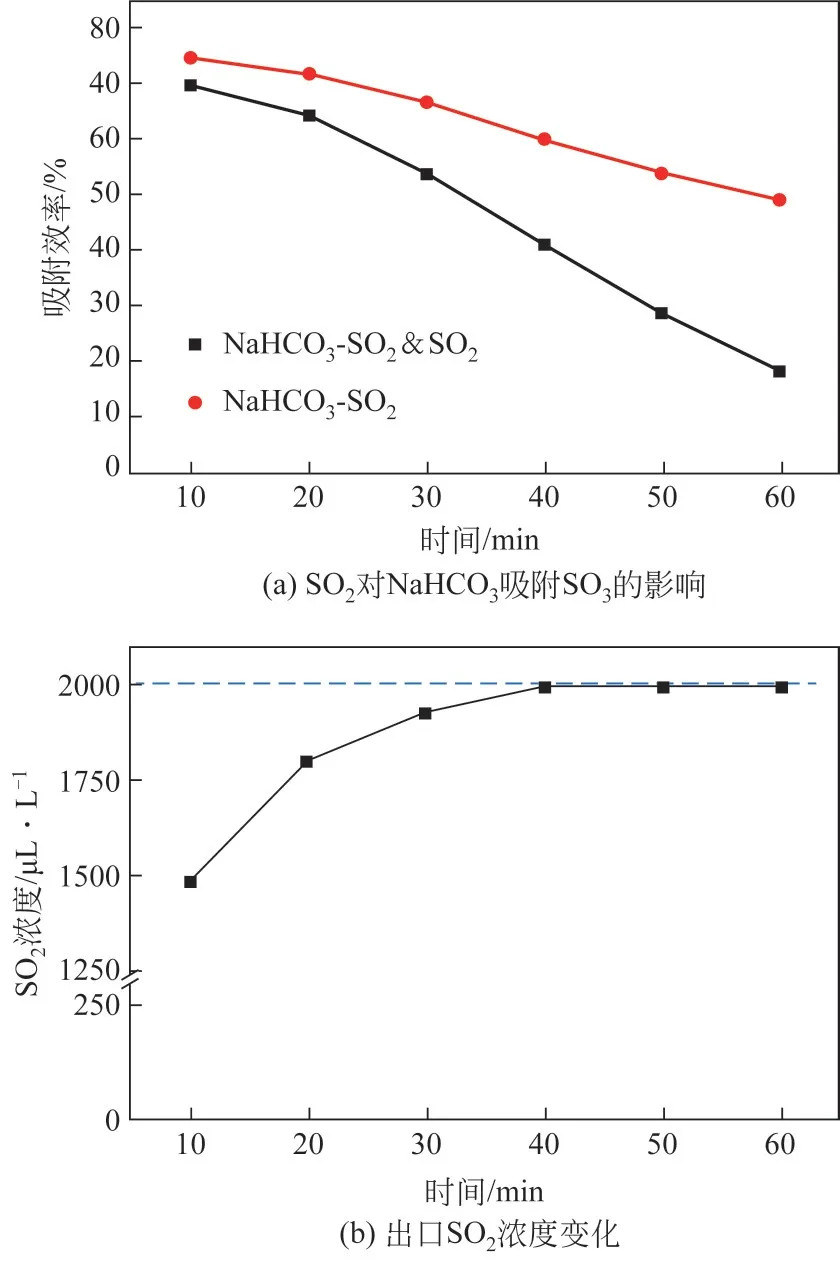
图7 NaHCO3对烟气中SOx的吸附效果
从图7(a)可以看出,SO2的加入使得NaHCO3对SO3的吸附效率降低;且两种工况下吸附效率差值随着时间不断增加,在60min时SO2的存在使得SO3吸附效率从49.08%降低到了18.11%。从图7(b)可以看出,NaHCO3也能吸附SO2,反应生成的Na2SO3部分会继续吸附SO3,部分被氧气氧化生成Na2SO4,反应如式(7)~式(10)所示。
反应过程中高浓度SO2与SO3形成竞争吸附,降低了吸附剂对SO3的选择性。为了研究SO2对吸附剂的影响,对反应产物进行了SEM 表征,结果如图8 所示。从图中可以发现,由于大量SO2与NaHCO3反应,吸附剂表面及内孔表面覆盖大量产物层,抑制了吸附剂对SO2和SO3的吸附。

图8 SO2对NaHCO3吸附产物影响的SEM图
但是从图7 中可以看出,反应进行到30min 之后时出口SO2浓度接近2000μL/L,而此时SO3仍能被吸附。SO2分子尺寸小于SO3分子,其产物层扩散阻力更小,当SO2无法与吸附剂发生反应时,说明其无法通过孔隙扩散及产物层扩散接触到吸附剂有效成分表面,SO3的吸附理论上应该已经结束。Na2SO4并不能与SO3产生反应,因此反应式(7)中的NaHCO3与SO2反应所产生的Na2SO3是SO3吸附反应继续进行的部分原因。He等[25,29]研究CaO吸附CO2、Ca(OH)2吸附SO3时发现未反应的CaO 和Ca(OH)2会以离子形式进行产物层扩散。因此推测该反应后期由于产物层表面吸附的SO3形成强电位驱动离子迁移,导致未反应的Na2SO3的Na+阳离子和SO32-阴离子通过Na2SO4产物层迁移到SO3吸附位点,使得SO3能持续吸附。
2.4.2 烟气中SO2对NaHSO3吸附剂吸附SO3的影响
NaHSO3本身并不能与SO2发生反应,但是从反应式(5)、式(6)中可以发现,SO2是NaHSO3和Na2SO3吸附SO3的产物,而增加SO2浓度有可能会影响化学反应的正向进行,从而进一步影响NaHSO3对SO3的吸附。为了研究烟气中SO2的影响,在320℃的温度下、模拟烟气中添加2000μL/L的SO2、其他工况不变的情况下研究SO2对NaHSO3的SO3吸附性能的影响,结果如图9所示。
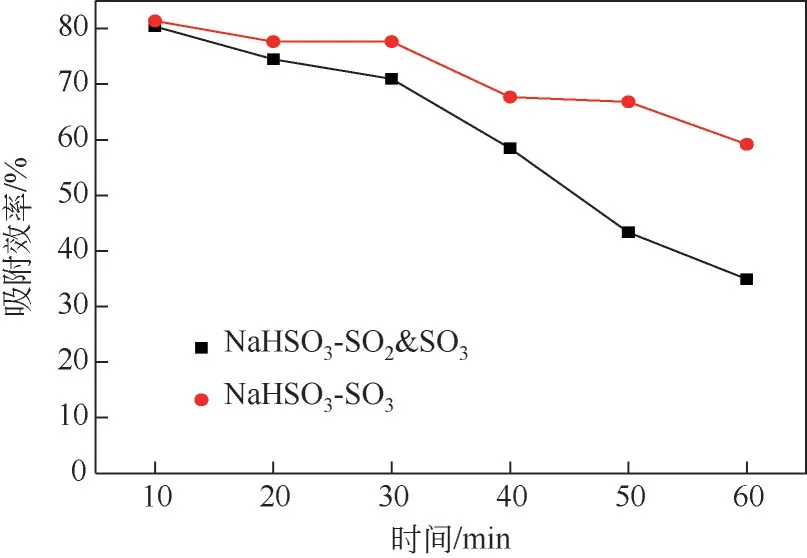
图9 烟气中SO2对NaHSO3吸附SO3的影响
从图9中可以看出,在反应前10min,SO2的加入对NaHSO3吸附SO3几乎没有影响,因为此时吸附剂表面及内部存在大量有效活性点位,且短时间内有效活性点位随着吸附剂的分解不断增加,烟气中高浓度的SO2此时无法阻止反应正向进行;但是随着时间增加,两种工况下NaHSO3吸附SO3的效率差值不断增加,到60min 时差值达到了24.26%。由于SO2并没有与吸附剂反应,SO3吸附效率的降低会使得吸附剂表面及内孔的Na2SO4产物层生成速度降低,应该有利于后续SO3的吸附,显然与实验结果不符。为了研究这一现象,对反应后的产物进行了SEM表征,结果如图10所示。
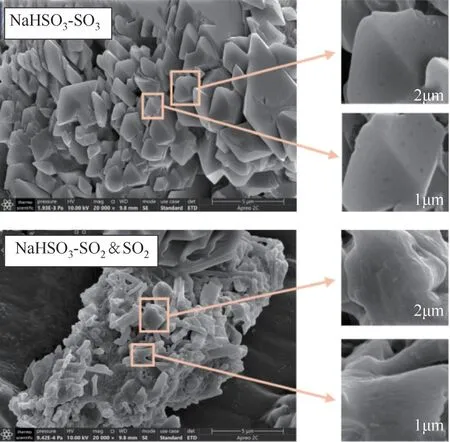
图10 SO2对NaHSO3吸附产物影响的SEM图
通过SEM 图像可以看出,当SO2存在时,NaHSO3吸附SO3后反应产物表面微孔明显减少或被堵塞。为了验证这一现象,对320℃加热1h 的NaHSO3和两种不同工况下的吸附产物进行BET 表征,结果如表2所示。
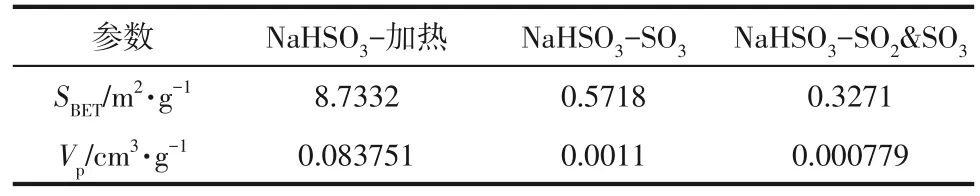
表2 不同工况下NaHSO3的BET表征结果
通过SEM 和BET 表征可以发现当气氛中存在SO2时,NaHSO3吸附的SO3减少,但是反应结束后固体产物的BET 比表面积和孔容却减小了,表面也比单独吸附SO3后的固体产物更光滑。2.2.2节提到NaHSO3在分解和吸附SO3过程中会放出气体改善吸附剂孔隙结构,而添加高浓度的SO2抑制SO3和NaHSO3的正向反应,导致吸附剂孔隙结构更加密集,阻碍了后续SO3转移到未反应的吸附剂表面,因此使得SO3吸附效率快速下降。
3 结论
本文研究了不同吸附剂的炉内热行为和在不同工况下对SO3的吸附效果,旨在寻找适合在烟道内不同位置有效吸附SO3的高效吸附剂,可以得出以下结论。
(1)Ca(OH)2和Mg(OH)2在中低温条件下较为稳定,几乎不分解,而NaHCO3、NaHSO3几乎完全分解并放出大量气体,实际与SO3反应的大部分是Na2CO3和Na2SO3。
(2)NaHCO3和NaHSO3对SO3具有良好的吸附效果,这两种吸附剂在自身分解和与SO3反应的过程中放出的气体产物改善了孔隙结构,也在一定程度上抑制了反应产物对微孔的堵塞,能在较长时间内保持对SO3的高吸附率。
(3)NaHCO3和NaHSO3在320℃和390℃下均能作为优质吸附剂,但是低温下应避免使用。
(4)SO2和SO3在NaHCO3上会形成竞争吸附,降低吸附剂对SO3的吸附效率;作为NaHSO3与SO3反应的产物,高浓度SO2会抑制反应的正向进行,使得吸附剂孔隙结构更加密集,影响SO3吸附效率。
在实际工程中,向尾部烟道中喷射适量的NaHSO3可以有效降低烟气中SO3的浓度,这有助于进一步提升SCR脱硝性能,并缓解SO3对烟道及下游设备的腐蚀。
