磷酸肌酸钠对VaD老年大鼠的学习记忆能力影响及机制*
2023-08-15林子涵崔杏何杰英石文莹曾磊程铖罗碧兰汤磊
林子涵, 崔杏, 何杰英, 石文莹, 曾磊, 程铖, 罗碧兰, 汤磊,***
(1.贵州医科大学 药学院, 贵州 贵阳 550004; 2.贵州省化学合成药物研发利用工程技术研究中心, 贵州 贵阳 550004)
血管性痴呆(Vascular dementia,VaD)是继阿尔茨海默病(Alzheimer's disease,AD)的第二大常见的痴呆类型[1]。VaD对老年患者的生活有重大影响,20%的65岁及以上人群受到影响,并且每年呈上升的趋势[2-4]。尽管VaD发病率较高,但依然缺乏有效的治疗药物,目前主要侧重于症状管理,临床上常使用多奈哌齐、加兰他敏和美金刚等治疗AD药物来治疗VaD的相关症状[5-6],并通过控制高血压和动脉粥样硬化等血管危险因素来预防进一步的脑损伤[7-8]。缺氧、脑血流灌注不足是VaD的主要特征,研究表明脑血流低灌注诱导的缺氧会促进线粒体氧化分解功能障碍,导致ATP减少和离子泵紊乱[9-10],从而诱发大量自由基的产生,出现脑组织能量缺失导致的一系列连锁反应,使得神经细胞趋向死亡[11]。海马线粒体功能异常时,会严重影响大脑能量供应,使得学习记忆的关键脑区海马、皮质受损,出现记忆力和认知功能下降[12-13],海马是全脑缺血后最脆弱的脑区之一[14-15]。相关研究也证明,减少老年大鼠海马CA1区细胞损伤,能改善老年大鼠的认知功能障碍以及学习和记忆能力[16-17]。磷酸肌酸广泛地分布于身体内各组织,90%在肌肉组织中,用于维持ATP水平,通过开放合成通路和减少分解作用、保护肌纤维膜免受缺血损害[18]。磷酸肌酸可以把高能磷酸转移给ADP生成ATP,因此磷酸肌酸是ATP的贮存形式,能够维持细胞的活性及基本功能[19]。外源性磷酸肌酸作为重要的能量补充剂,在治疗能量供应不足导致的机体病理变化中发挥着重要作用[20]。作为心肌保护剂的磷酸肌酸钠,在进入体内后以磷酸肌酸的形式存在,临床上常用来治疗心脏疾病[21]。研究表明磷酸肌酸钠能减轻脂质过氧化反应,组织清除自由基能力增强,减轻线粒体的损伤,对缺血再灌注损伤有显著的保护作用[22],并且改善大面积脑梗死患者的神经功能[23]。因此,本研究通过建立老年大鼠双侧颈总动脉结扎模型,探讨磷酸肌酸钠对VaD老年大鼠学习、记忆功能障碍的影响及可能机制。
1 材料与方法
1.1 实验材料
1.1.1实验动物 SPF级雄性SD老年大鼠(>20周龄)72只,体质量230~250 g,由贵州医科大学实验动物中心提供。在温度为(20±2)℃、湿度60%的环境中适应性饲养1周。实验前禁食6~8 h,饮水自由。
1.1.2主要试剂及仪器 Morris水迷宫仪(成都泰盟生物软件有限公司),包埋机和切片机(Leica Biosystems公司),磷酸肌酸钠(实验室自制),超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、IL-10、肿瘤坏死因子(tumor necrosis factor,TNF-α)、三磷酸腺苷(adenosine triphosphate,ATP)试剂盒均购自南京建成生物工程研究所,BCA蛋白浓度测定试剂盒购自北京索莱宝生物有限公司。全波长酶标仪购自美国Gene Company Limited,高速低温离心机购自德国SIGMA公司。
1.2 VaD大鼠模型建立及分组
72只SD大鼠随机均分为假手术组、模型组、磷酸肌酸钠低(20 mg/kg)、高剂量(40 mg/kg)组,4组老年大鼠按照3.5×10-3mL/g腹腔注射10%水合氯醛麻醉、仰卧固定、备皮消毒,在颈部正中纵切口,钝性分离双侧颈总动脉,后3组大鼠使用手术线在两侧颈总动脉近心端和远心端结扎、确保血流被完全阻断,假手术组仅分离双侧颈总动脉不结扎,缝合伤口。建模后24 h,磷酸肌酸钠低剂量组腹腔注射20 mg/kg,高剂量组腹腔注射40 mg/kg,假手术组和模型组大鼠腹腔注射0.5 mL无菌生理盐水,并连续给药28 d。
1.3 观察指标
1.3.1体质量和生长趋势 每日观察记录各组大鼠的体质量及其生长状况。
1.3.2大鼠学习记忆能力 4组大鼠在给药第24 天时进行Morris水迷宫行为检测。定位巡航实验:一个圆形水池划分成大小相等的4个象限,并在第四象限中间放置一个圆形平台,浸没在水下2 cm处。大鼠从第一象限,面向池壁放入水中,记录大鼠从入水到游上平台时间为逃逸潜伏期,以逆时针方向依次放入第二、第三、第四象限点;如大鼠60 s内没有找到平台者,将其引至平台;该练习持续进行4 d。空间探索实验:在第28 天时,将可移动平台撤掉,把大鼠从第二象限,面向池壁放入水中,记录大鼠在60 s内穿越平台次数及原平台象限所经历的时间。
1.3.3海马组织内ATP、SOD、MDA及GSH-PX水平 水迷宫实验结束后,各组大鼠随机选取6只,断头后冰上取出海马组织,按照组织∶生理盐水(g∶L)=1∶9的比例进行匀浆,3 500 r/min离心15 min,取上清液。采用BCA蛋白定量测定各组ATP、MDA、SOD、GSH-PX水平。
1.3.4海马组织内IL-1β、IL-6、IL-10、TNF-α水平 水迷宫实验结束后,各组大鼠随机选取6只,按照3.5×10-3mL/g腹腔注射10%水合氯醛麻醉大鼠,沿腹中线剪开用PBS心脏灌注后、冰上取海马组织,依据组织∶PBS(g∶L)=1∶9的比例、3 500 r/min离心15 min,取上清液加入至包埋好抗体的孔板内,ElISA法检测IL-1β、IL-6、IL-10、TNF-α水平。
1.3.5HE染色 水迷宫结束后,各组大鼠随机选取6只,按照3.5×10-3mL/g腹腔注射10%水合氯醛麻醉大鼠,沿腹中线剪开、4%多聚甲醛心脏灌注后,在冰上取海马组织,4%多聚甲醛固定。将海马组织依次放入不同浓度的乙醇进行梯度脱水,放入二甲苯中透明;石蜡包埋,制成厚度为5 μm 的切片进行染色。经过不同浓度的乙醇复水,苏木素和伊红染色,封片后在光学显微镜下观察。
1.4 统计学分析

2 结果
2.1 体质量和生长趋势
与假手术组比较,模型组大鼠的平均体质量在28 d内无明显增长,且体质量波动较大;与模型组比较,磷酸肌酸钠低、高剂量组大鼠的平均体质量在28 d内稳定增长,但差异无统计学意义(P>0.05)。该实验结果表明磷酸肌酸钠长期给药(40 mg/kg以内)对大鼠体质量和生长趋势无影响,具有较好的安全性。见图1。
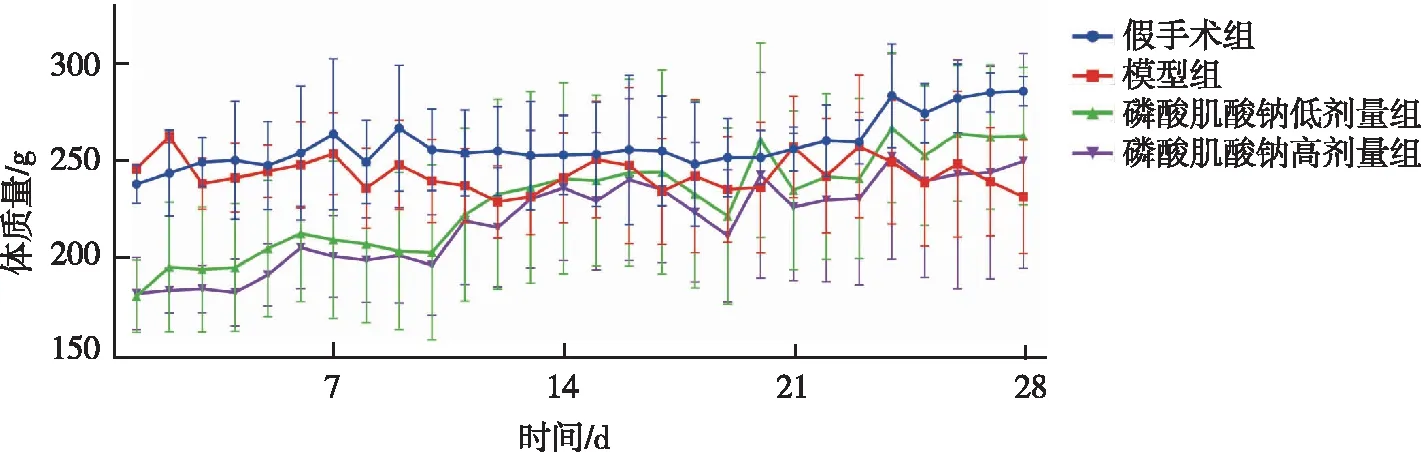
图1 各组大鼠造模28 d内的体质量变化趋势
2.2 定位巡航实验
水密宫结果显示,与假手术组比较,模型组大鼠潜伏期显著增加(P<0.05),提示模型大鼠的学习能力降低;与模型组比较,磷酸肌酸钠高剂量组大鼠的逃逸潜伏期时间减少,差异具有统计学意义(P>0.05)。见表1、图2。提示高剂量组大鼠的学习能力较模型组大鼠增高。
表1 各组大鼠逃避潜伏期比较
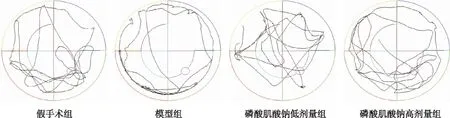
图2 各组大鼠定位巡航轨迹
2.3 空间探索实验
与假手术组比较,模型组大鼠穿越平台的次数减少(P<0.05),平台所在象限的游泳时间减少,差异具有统计学意义(P<0.05),提示模型大鼠记忆能力降低;与模型组比较,酸肌酸钠低、高剂量组大鼠穿越平台的次数和停留在目标象限的时间均增加,特别是高剂量组大鼠穿越平台的次数及呆在平台所在象限的时间显著增加(P<0.05),提示该组大鼠的记忆能力高于模型组。见表2、图3。

表2 撤除平台后大鼠空间探索试验的穿越情况
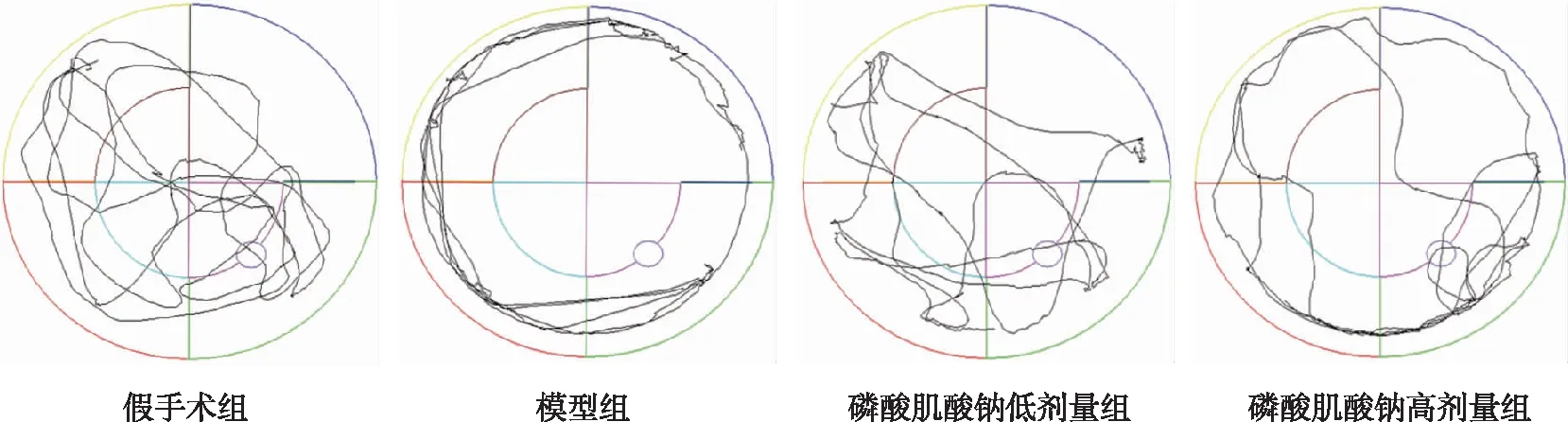
图3 撤平台后各组大鼠60 s内活动轨迹
2.4 海马组织内ATP、SOD、MDA及GSH-PX水平
与假手术组比较,模型组大鼠海马组织中ATP水平显著降低(P<0.05);与模型组比较,磷酸肌酸钠低、高剂量组大鼠海马ATP水平升高,其中磷酸肌酸钠高剂量组大鼠海马ATP水平显著升高(P<0.05);与假手术组比较,模型组大鼠海马组织内的MDA含量显著增加,并且SOD和GSH-PX活性均显著降低(P<0.05);与模型组比较,磷酸肌酸钠低、高剂量组大鼠海马组织中MDA含量均显著性减少,SOD和GSH-PX的活力显著增加,差异具有统计学意义(P<0.05)。见表3。
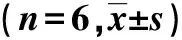
表3 各组大鼠海马组织中ATP及相关氧化应激指标
2.5 海马组织内IL-1β、IL-6、IL-10、TNF-α水平
与假手术组比较,模型组大鼠海马组织中IL-1β、IL-6、和TNF-α的含量显著升高,IL-10的含量下降(P<0.05);与模型组比较,磷酸肌酸钠低、高剂量组大鼠海马组织中IL-1β、IL-6、和TNF-α的含量显著降低,高剂量组中IL-10的含量显著增加,差异具有统计学意义(P<0.05)。见表4。
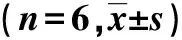
表4 各组大鼠海马组织中相关炎症指标的含量
2.6 海马HE染色
假手术组大鼠海马神经元排列紧密,细胞形态饱满,结构完整,大小正常,细胞核清晰且呈类圆形,细胞核核膜、细胞膜清晰。与假手术组比较,模型组大鼠海马区细胞形态不规则,染色不均匀,细胞边界模糊,数量减少,可见坏死的细胞,细胞核固缩,细胞膜、核膜不清晰。与模型组比较,磷酸肌酸钠低剂量组大鼠海马区细态较为完整,染色较均匀,细胞形态较为规则,但同时也还存在一些形状不规则、坏死的细胞;磷酸肌酸钠高剂量组神经元染色均匀,细胞形态规则完整,细胞核清晰呈类圆形,细胞膜、核清晰可见,细胞数量多。见图4。
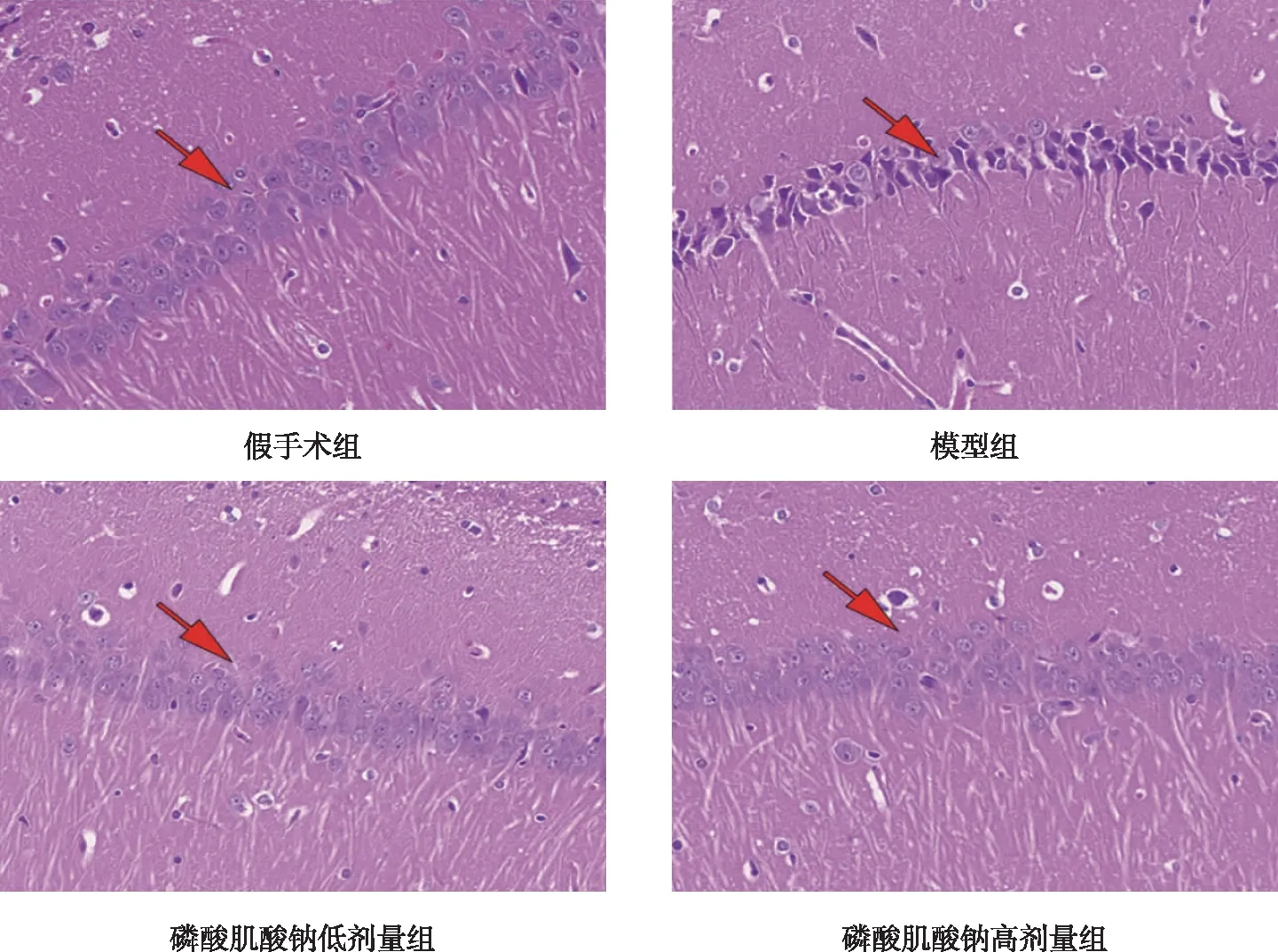
注:红色箭头为海马区神经细胞。
3 讨论
VaD是一种涉及学习、记忆和认知功能衰退的脑血管疾病[24],常常由于血管损伤阻塞导致血液供应减少,引发学习、记忆和认知功能下降。年龄、糖尿病、高血压、脑卒中(特别是与缺血性脑卒中的联系更为紧密)、以及代谢综合征等都是引起VaD的危险因素[25]。目前VaD的治疗是对症而非治愈,临床上常使用一些胆碱酯酶抑制剂、兴奋性氨基酸受体拮抗剂等临床药物辅助治疗[26]。研究表明,长期的慢性脑血流低灌注引起线粒体功能障碍是内环境紊乱的主要原因之一,包括氧化应激、神经炎症、脑水肿、神经递质系统功能的失调、脂质代谢障碍和生长因子改变等[27],从而引起内皮细胞损伤和血脑屏障功能障碍,海马神经元减少和白质损伤等,最终导致学习和记忆功能减退[28]。ATP是生物体内最直接的能量来源,其水平降低易导致细胞凋亡或坏死[29]。已有研究证实,VaD与脑缺血再灌注损伤有很大的联系,脑缺血再灌注损伤导致慢性脑灌注不足从而造成认知障碍[30],脑组织受损使得脑内ATP含量降低,Na+-K+-ATP酶降低,线粒体功能障碍,影响脑内ROS升高造成氧化应激损伤[31];小胶质细胞和星型胶质细胞等被激活,产生大量的促炎因子,造成神经炎症以及神经细胞损伤凋亡[32]。实验结果显示大鼠通过双侧颈总动脉结扎造成脑血流灌注不足[33],海马组织内ATP水平明显降低(P<0.05),进而引发一系列的级联反应:抗氧化应激酶SOD、GSH-PX活力降低(P<0.05),使得氧自由基过量,脂质过氧化产物MDA含量增加(P<0.05),造成脑组织自由基清除能力下降,产生氧化应激,同时海马组织中促炎细胞因子IL-1β、IL-6、TNF-α含量升高(P<0.05),抗炎因子IL-10降低(P<0.05)引发神经炎症,从而造成海马神经元病理性损伤,最终使得VaD老年大鼠的认知、学习和记忆功能产生障碍。在Morris水迷宫实验中,模型组大鼠的认知功能、学习和记忆功能明显下降,体现在逃逸潜伏期时间显著性增加(P<0.05),穿越平台次数和目标象限停留轨迹显著减少(P<0.05)。此外,相比于假手术组,ATP含量减少和内环境紊乱的VaD老年大鼠海马区组织结构发生明显的异常,海马区的细胞排列松散、杂乱、细胞呈现不规则状态,细胞核破裂,神经元收缩、脱色和浅染色。
磷酸肌酸钠是新一代改善心肌能量代谢的药物,它可以在心肌、骨骼肌和脑组织中储存能量,促进ATP的再合成,减少心肌缺血再灌注损伤,改善心脏功能,并减少心脏病的发生已在临床上广泛应用[34-36]。本研究发现酸肌酸钠进入老年大鼠体内可以分解成磷酸肌酸,促进VaD老年大鼠海马组织中ATP的生成,提高受损海马区组织的抗氧化应激酶SOD和GSH-PX的活力,降低VaD老年大鼠海马组织中的脂质过氧化产物MDA;同时提高抗炎因子IL-10(P<0.05)的含量,降低促炎因子IL-1β、IL-6、TNF-α的生成(P<0.05)。由此证明磷酸肌酸钠能够显著改善VaD老年大鼠组织清除自由基能力,降低自由基蓄积水平,减缓神经炎症的产生,并且有效改善线粒体功能障碍;磷酸肌酸钠在高剂量的治疗下改善海马区神经元的组织结构异常,有效改善细胞的不规则形,使得海马细胞形态趋于完整,细胞数量增加,从而提高认知、学习和记忆功能(增加VaD老年大鼠穿越平台的次数,缩短VaD老年大鼠的逃逸潜伏期);并且,本研究还表明了磷酸肌酸钠长期给药对老年大鼠体重和生长趋势无影响,具有较好的安全性。
本研究证明磷酸肌酸钠通过提高ATP的产生,改善VaD海马组织中的能量代谢障碍;增加VaD老年大鼠的抗氧化应激能力,从而减少模型制备后的脂质过氧化损伤,清除过量氧自由基;同时减少海马受损组织区促炎因子IL-1β、IL-6、TNF-α的生成,提高抗炎因子IL-10水平,抑制神经炎症,进而达到神经保护的作用;通过保护VaD老年大鼠海马神经元,从而改善VaD老年大鼠的认知、学习和记忆功能;并且磷酸肌酸钠可作为长期注射给药的选择,具有较好的安全性。总之,这些结果有效的证明磷酸肌酸钠能减少VaD老年大鼠海马神经元损伤,改善认知、学习和记忆功能障碍。也进一步探究并验证双侧劲总动脉结扎手术致老年大鼠缺氧引发的能量缺失和海马神经元内环境紊乱在VaD病理生理进程的作用,为今后临床预防与改善血管性痴呆的治疗提供新思路和有效途径,进而提升患者生存质量。
