葡萄VvGAI1与VvJAZ9蛋白互作及低温下的表达模式分析
2023-08-15刘德帅冯美孙雨桐王烨迟敬楠姚文孔
刘德帅,冯美,孙雨桐,王烨,迟敬楠,姚文孔
葡萄VvGAI1与VvJAZ9蛋白互作及低温下的表达模式分析
刘德帅,冯美,孙雨桐,王烨,迟敬楠,姚文孔
宁夏大学葡萄酒与园艺学院/宁夏现代设施园艺工程技术研究中心/宁夏优势特色作物现代分子育种重点实验室,银川 750021
【目的】DELLA蛋白属于植物特有的GRAS蛋白家族,是赤霉素信号转导途径中的重要调控因子,在植物生长发育和抵御逆境胁迫中发挥着重要作用。克隆欧洲葡萄,并对其进行亚细胞定位、蛋白互作和表达分析,为进一步研究DELLA蛋白在葡萄抗寒反应中的调控功能奠定基础。【方法】以酿酒葡萄品种‘霞多丽’叶片为试材,采用同源克隆的方法获得序列。利用生物信息学方法分析该基因的序列特征,使用DNAMAN及MEGA7.0对VvGAI1蛋白序列及拟南芥序列进行多序列比对并构建系统进化树。通过亚细胞定位确定VvGAI1蛋白在细胞中的表达位置;利用酵母试验验证VvGAI1蛋白的转录激活活性;利用酵母双杂交和双分子荧光互补试验验证VvGAI1蛋白与VvJAZ9蛋白的互作关系;利用VvGAI1原核表达蛋白制备anti-VvGAI1兔源多克隆抗体;利用Western Blot技术检测VvGAI1蛋白在低温下的表达情况;通过相对电导率分析外源喷施茉莉酸和赤霉素对葡萄抗寒性的影响。【结果】从‘霞多丽’叶片中克隆得到,其ORF为1 773 bp,编码590个氨基酸,位于第1条染色体,含有1个外显子,无内含子。VvGAI1蛋白相对分子质量为64.87 kDa,理论等电点pI为5.31,属于酸性不稳定亲水蛋白。VvGAI1具有高度保守的DELLA和GRAS结构域,属于植物GRAS家族的DELLA蛋白。蛋白聚类分析显示VvGAI1与拟南芥AtGAI和烟草NtGAI1亲缘关系较近。亚细胞定位与转录自激活结果显示VvGAI1是一个定位于细胞核中且具有转录激活活性的转录因子。酵母双杂交和双分子荧光互补试验也证实VvGAI1与VvJAZ9具有互作关系。将克隆至原核表达载体构建pET28b-VvGAI1重组表达载体,转化至大肠杆菌BL21中经16 ℃、1.0 mmol∙L-1异丙基--d-硫代半乳糖苷(IPTG)诱导表达获得VvGAI1-His融合蛋白,再经抗原免疫,血清纯化后制备得到anti-VvGAI1兔源多克隆抗体。制备的anti-VvGAI1抗体可以特异性检测‘霞多丽’葡萄中的VvGAI1蛋白。Western Blot结果表明,低温处理下葡萄原生质体中VvGAI1蛋白呈先上升后下降的表达趋势,VvGAI1蛋白响应低温诱导表达。与对照相比,50 μmol·L-1茉莉酸甲酯(MeJA)处理可以提高葡萄的抗寒性,50 μmol·L-1赤霉素(GA3)处理使葡萄对寒冷变得敏感。【结论】葡萄VvGAI1是一个与VvJAZ9相互作用的转录因子,VvGAI1对低温胁迫有响应,外源茉莉酸能够正调控冷胁迫反应,而赤霉素负调控冷胁迫反应。
葡萄;DELLA蛋白;;蛋白互作;低温;表达模式
0 引言
【研究意义】葡萄(spp.)为葡萄科葡萄属多年生落叶藤本植物,是世界上广泛栽培的经济果树之一。目前,我国用于栽培生产的葡萄品种多数为欧亚种葡萄(L.),其具有产量高、品质优,但抗逆性差的特点。葡萄作为一种低温敏感作物,在栽培生产过程中常遭受不同程度的低温或冷冻伤害,从而限制了其在我国冷凉地区的发展,也严重影响了葡萄产量,经济效益和产业发展[1-2]。在我国北方葡萄栽培地区,由于冬季寒冷干燥、春季霜冻和倒春寒频发,只能采用葡萄树体埋土防寒的措施来减少寒冷或低温对葡萄造成的伤害。埋土防寒不但增加生产成本,且对树体产生损伤,影响产量,还不利于环境保护[3-4]。因此,培育能在我国北方地区免埋土栽培的抗寒新品种十分迫切,挖掘葡萄中与抗寒相关的基因并研究其功能和作用机理,对解决葡萄冷害和冻害问题有重要的理论意义和实际应用价值。【前人研究进展】赤霉素(gibberellins,GA)作为一种广泛存在于植物中的内源生长调节物质和信号分子,在种子萌发、胚轴伸长、茎的伸长、根的生长、花芽分化以及形态建成等植物发育过程中发挥着重要调节作用[5-6]。DELLA蛋白是GA信号转导途径中的核心作用元件,参与GA信号传导并发挥负调控作用,抑制植物的生长发育[7]。当植物体内GA含量较低时,GA不会与其可溶性受体GID1(gibberllin insensitive dwarf 1)结合,从而使具有阻遏作用的DELLA蛋白与下游靶基因结合并抑制其转录,进而影响植物生长[8];当植物体内GA含量较高时,GA与受体GID1结合形成具有疏水性表面的二元复合体GA-GID1,再与DELLA蛋白形成三元复合体GA-GID1-DELLA,促使DELLA蛋白与SCFSLY1/GID2(Skp1-Cul1-F-boxSLY1/GID2)的结合导致DELLA蛋白泛素化后被26S蛋白酶降解,解除抑制并引起下游基因的响应,从而使GA发挥正常效应[9]。DELLA蛋白作为GA信号转导的一种负调节因子,主要存在于植物细胞核中,属于植物特有的GRAS蛋白家族,由DELLA和GRAS两个结构域组成,也是GRAS家族中研究较为广泛的亚族之一[10-11]。DELLA蛋白的N端含有DELLA和TVHYNP两个高度保守的酸性结构域,两者共同参与DELLA蛋白与GID1受体的结合,是GA信号感知结构域[8];中部含有一个NLS(nuclear localization sequence)核定位信号结构域[12];而在C端含有GRAS家族特有的GRAS结构域,其主要包含SAW、SH2和VHIID三个保守的阻遏结构域,是DELLA蛋白的功能结构域[8]。不同物种中DELLA蛋白成员数量及作用方式均有差异,模式植物拟南芥()最早被鉴定出含有5个DELLA蛋白家族成员(GAI、RGA、RGL1、RGL2和RGL3),其中GAI和RGA对植物茎的生长、花的发育以及叶片舒展有明显影响;RGL1与RGL2在种子萌发和休眠过程中有调控作用;RGL3具有抑制种子萌发的作用;此外,RGA、RGL1和RGL2共同参与了花和果实的发育[13-16]。葡萄中也存在DELLA蛋白,目前鉴定出的DELLA蛋白成员有VvGAI1、VvRGA和VvSLR1[17-19]。VvGAI1对葡萄花器官的发育、节间伸长和结果量有调控作用[17-18];VvRGA可能参与果实发育过程[18];VvSLR1可能通过应答GA信号调控葡萄胚乳的发育[19]。是赤霉素信号通路中的关键节点基因,在抑制植物生长发育的同时也可增强植物对逆境胁迫的抗性[20]。盐胁迫处理后的突变体小麦()通过提高超氧化物歧化酶(superoxide dismutase,SOD)的活性,减少丙二醛(malondialdehyde,MDA)的积累,增加内源DELLA蛋白的含量来增强植株的耐盐性[21]。低温响应基因(C-repeat binding factors)通过促进(gibberellin 2-oxidase)和的表达来降低内源GA的含量,增强DELLA蛋白积累,从而提高植物的抗寒能力[22]。此外,DELLA蛋白缺少DNA结合结构域,不能与DNA直接结合,只能与不同信号途径中的调控蛋白如PIFs(phytochrome interacting factors)、BZR1(brassinazole resistant 1)、JIN1(jasmonate insensitive 1)和JAZ(jasmonate ZIM- domain)相互作用发挥其分子功能,进而调控植物的生长发育与逆境抗性[23]。【本研究切入点】笔者课题组前期在欧洲葡萄VvJAZ9互作蛋白筛选中获得一个可能存在互作关系的DELLA蛋白GAI1,并通过实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)分析发现受低温诱导表达较为明显,且呈现出先上升后下降的表达趋势,在3 h时表达量达到最高[24]。目前,在葡萄中对GA信号转导的抑制因子DELLA蛋白研究较少,主要集中在模式植物。然而,对于欧洲葡萄中赤霉素不敏感型基因的抗逆性研究更是少之甚少。葡萄作为一种低温敏感植物,GAI1蛋白在欧洲葡萄中的生物功能及抗寒分子机制尚不明确。【拟解决的关键问题】本研究采用同源克隆的方法获得,并运用生物信息学、亚细胞定位、转录自激活、酵母双杂交、双分子荧光互补(bimolecular fluorescent complimentary,BiFC)、抗体制备和蛋白印迹(Western blot)等手段分析及其蛋白特性,初步明确在葡萄抗寒过程中的生物功能。同时使用外源激素喷施葡萄幼苗并进行低温处理,以了解外源激素对葡萄抗寒性的影响,为深入分析DELLA蛋白在葡萄抗寒反应中的调控功能奠定理论基础,也为参与葡萄抗寒调控机理的研究和抗寒葡萄品种的选育提供参考。
1 材料与方法
试验于2021—2022年在宁夏大学葡萄酒与园艺学院宁夏优势特色作物现代分子育种重点实验室进行。
1.1 试验材料
试验材料为2年生欧洲酿酒葡萄‘霞多丽’(cv.Chardonnay)盆栽扦插苗,于植物培养间(25℃,16 h光照/8 h 黑暗)进行培养。选取生长健壮、长势一致、无病虫害的盆栽葡萄苗,平均分为3组,一组外源喷施50 μmol·L-1茉莉酸甲酯(methyljasmonate,MeJA)处理[25-26]。一组外源喷施50 μmol·L-1GA3处理[27],一组外源喷施无菌水为对照(CK),处理12 h后放置于低温培养箱内(立德泰勀,上海)分别进行-3 ℃冷胁迫处理,光照条件一致,每个处理设置3次生物学重复。在0、3和6 h分别采集3组供试盆栽葡萄苗叶片样品,部分用于相对电导率的测定,部分用锡箔纸包好后立即放入液氮中冷冻,然后置于-80 ℃冰箱保存,用于RNA的提取。
试验中所用的RNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒、大肠杆菌()DH5和BL21(DE3)购于北京天根生化科技有限公司;无缝克隆试剂盒购于南京诺唯赞生物科技有限公司;反转录试剂盒、高保真酶、DNA Marker、限制性内切酶均购于大连宝生物工程有限公司;pMD19-T载体、pBI221载体(携带GFP标签蛋白)、pET28b(携带His标签蛋白)、pGBKT7和pGADT7载体均由本实验室原有保存;引物合成和测序均由北京奥科鼎盛生物科技有限公司完成;其余试剂均为国产或进口分析纯。
1.2 基因克隆
按照植物总RNA提取试剂盒(天根生化,北京)和反转录试剂盒(TaKaRa,大连)的说明书进行葡萄叶片总RNA的提取以及合成第一链cDNA,用于基因的克隆。以NCBI数据库(https://www.ncbi.nlm.nih.gov/)中的基因序列(GenBank No.: XM_002284612.4)为参考序列,使用Primer Premier 6.0软件设计同源克隆引物(表1)。参考俞沁含等[28]的PCR反应体系与程序进行PCR扩增获得目的片段。扩增产物经琼脂糖凝胶电泳检测、胶回收后连接至pMD19-T克隆载体,然后转化大肠杆菌()DH5感受态细胞,经蓝白斑筛选后选取阳性单克隆至北京奥科鼎盛生物科技有限公司测序确认,以获得含有目的基因的重组载体。
1.3 生物信息学分析
利用NCBI在线分析工具CDD(https://www.ncbi. nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白保守结构域;采用在线软件ExPASy ProtParam(https://web. expasy.org/protparam/)分析VvGAI1蛋白的基本理化性质;运用在线网站Grape Genome Browser(https:// www. genoscope.cns.fr/externe/GenomeBrowser/Vitis/)分析的染色体定位、内含子及外显子区域;采用DNAMAN软件对VvGAI1蛋白序列进行多重比对;利用Pfam数据库(http://pfam.xfam.org/)下载DELLA(PF12041)和GRAS(PF03514)结构域的隐马尔可夫模型文件,然后使用HMMER 3.0(http:// hmmer.org/)软件筛选出葡萄全基因组蛋白序列中含有这两个结构域的DELLA蛋白,同样按照此方法筛选出其他物种中的DELLA蛋白。使用MEGA7.0软件中的邻接法(neighbor-joining,NJ)构建蛋白系统进化树(bootstrap设为1 000)。
1.4 VvGAI1亚细胞定位观察
根据的开放阅读框(open reading frame,ORF)序列设计植物表达载体的特异性引物(表1)。以pMD19-T-VvJAZ9质粒为模板,通过PCR扩增获得目的片段。经无缝克隆构建至经I和I双酶切的植物表达载体pBI221-GFP后,转化DH5感受态细胞,经菌液PCR与酶切鉴定正确的重组质粒送公司测序分析,经公司测序验证后得到pBI221-VvGAI1- GFP融合表达载体。参考Sasamoto等[29]的方法制备拟南芥原生质体,采用PEG(polyethylene glycol)介导法分别将pBI221-VvGAI1-GFP和pBI221-GFP质粒转化至拟南芥原生质体中,转化后的原生质体在22 ℃弱光照条件下培养20 h,然后使用激光共聚焦显微镜(Leica TCS SP8 X,德国)观察VvGAI1蛋白的亚细胞定位情况并拍照记录。
1.5 转录自激活活性分析
利用Primer Premier 6.0软件设计的全长特异引物以及缺失DELLA和GRAS结构域的特异引物(表1),以欧洲葡萄‘霞多丽’叶片的cDNA为模板,按照PrimeSTAR®Max DNA Polymerase说明书(TaKaRa,大连)扩增全长及两个关键结构域缺失片段,通过R Ⅰ和H Ⅰ双酶切及同源重组反应克隆至pGBKT7诱饵表达载体上,转化DH5感受态细胞,经测序确认后获得重组载体pGBKT7-VvGAI1、pGBKT7-VvGAI1∆DELLA和pGBKT7-VvGAI1∆GRAS。以pGADT7-T+pGBKT7-p53质粒为阳性对照,pGADT7-T + pGBKT7-Lam质粒为阴性对照,pGBKT7质粒为空载体对照,重组质粒pGBKT7-VvGAI1、pGBKT7-VvGAI1∆DELLA、pGBKT7- VvGAI1∆GRAS为自激活检测组,采用PEG/LiAc法将重组质粒和空载质粒分别转入酵母Y2H Gold感受态细胞中,阴性和阳性对照共转化至Y2H Gold感受态细胞中,然后均匀涂布于单缺培养基(SD/-Trp)进行培养。经菌落PCR筛选阳性克隆后挑取单克隆接种至0.9% NaCl溶液中,混匀后调整菌液浓度OD600=0.3。各取1 μL点样于SD/-Trp和SD/-Trp/AbA/X--Gal培养基上,30 ℃倒置培养3—4 d后,观察菌落的生长和颜色变化,以确定VvGAI1蛋白是否具有转录自激活活性。
1.6 酵母双杂交验证GAI1与JAZ9蛋白互作
根据1的ORF序列设计特异性引物(表1),将其构建至pGADT7载体上形成pGADT7-VvGAI1重组载体。然后将重组载体pGADT7-VvGAI1与笔者课题组前期构建的诱饵载体pGBKT7-VvJAZ9共转化酵母Y2H Gold感受态细胞,同时将pGBKT7-VvJAZ9+ pGADT7、pGBKT7+pGADT7-VvGAI1分别转化至Y2H Gold感受态细胞中,点涂于SD/-Trp/AbA/ X--Gal培养基上,置于恒温培养箱中培养3—4 d,观察酵母菌落的生长与颜色变化情况,以确定GAI1蛋白与JAZ9蛋白是否存在相互作用。
1.7 双分子荧光互补试验(BiFC)验证GAI1与JAZ9蛋白互作
利用Primer Premier 6.0软件设计和的ORF中不含终止密码子的同源重组引物(表1),通过同源重组法将和与BiFC验证载体pB221-cEYFP(cYFP)、pB221-nEYFP(nYFP)连接,分别构成VvJAZ9-cYFP和VvGAI1- nYFP重组载体。然后将构建好的VvJAZ9-cYFP和VvGAI1-nYFP及对照载体分别大提质粒,将所获得的质粒通过乙醇沉淀法浓缩至1 500—2 000 ng·μL-1。采用酶解法分离拟南芥叶肉组织原生质体[29],通过PEG介导法分别将质粒两两组合共转至拟南芥原生质体中,共转化的原生质体于22 ℃弱光培养18 h进行瞬时表达,使用激光共聚焦显微镜(Leica TCS SP8 X,德国)观察荧光并拍照记录。
1.8 外源喷施茉莉酸甲酯(MeJA)与赤霉素(GA3)对葡萄抗寒性的影响
参考WANG等[4]的方法通过相对电导率(relative electrical conductivity,REC)评估植物抗寒性。按照相对电导率(%)=(初始电导率值/最终电导率值)×100公式计算相对电导率。使用Excel 2019整理试验数据,并采用IBM SPSS 25.0对试验数据进行统计分析,利用单因素ANOVA分析和Duncan’s test进行显著性分析(<0.05),然后使用Origin Pro 2021作图。
1.9 重组蛋白的表达与纯化
根据的ORF序列全长并使用Primer Premier软件设计出相应的引物(表1)。以pMD19- T-VvGAI1质粒为模板,通过PCR扩增获得目的片段。采用无缝克隆法将其克隆至经I/I双酶切原核表达载体pET28b-His上形成重组载体pET28b- VvJAZ9,转化DH5感受态细胞,进行菌液PCR与酶切鉴定。对鉴定正确的重组质粒进行测序,经测序公司测序后获得正确重组载体pET28b-VvGAI1。将测序正确的pET28b-VvGAI重组质粒转化至BL21感受态细胞,加入1.0 mmol∙L-1异丙基--d-硫代半乳糖苷(isopropyl--d-thiogalactoside,IPTG),16 ℃诱导表达16 h后收集200 mL菌体,经过超声破碎后,4 ℃、10 000×离心20 min,收集菌体蛋白的上清液与沉淀。然后通过SDS聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离,随后进行考马斯亮蓝染色、脱色和拍照。参照TMNi-NTA Resin试剂盒(全式金生物,北京)说明书对获得的重组蛋白进行纯化,纯化产物经SDS-PAGE检测纯度。
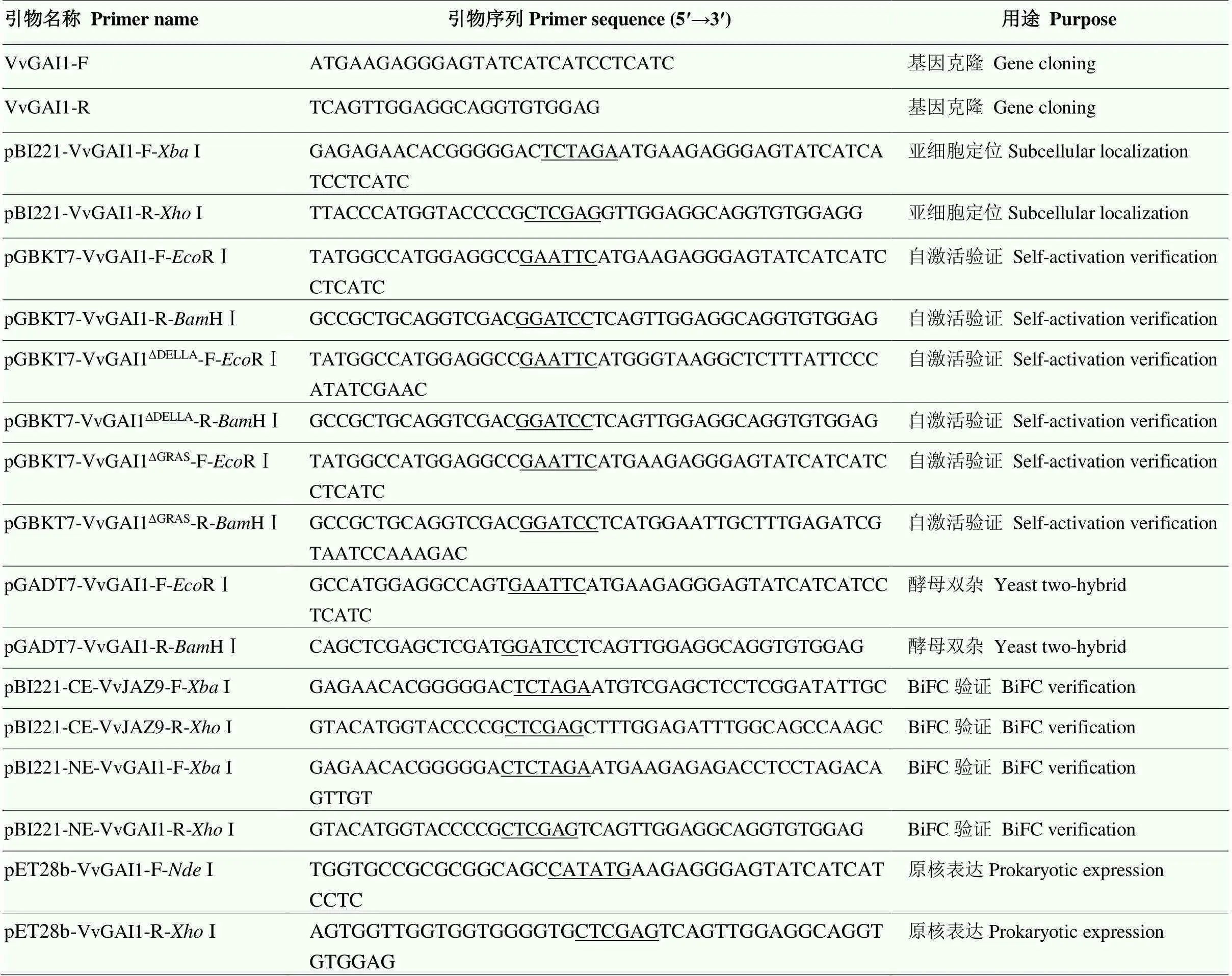
表1 引物列表
下划线部分为限制性内切酶位点 The underlined sequences are the site of restriction endonuclease
1.10 抗体的制备与亲和性检测
参考吴楠等[30]的方法进行多克隆抗体的制备与亲和性检测。将符合免疫要求浓度的重组蛋白乳化后,按照1 mg∙kg-1的剂量,对2只新西兰大白兔进行多点皮下注射,间隔7 d 注射一次。每只兔子免疫4—5次后取少量血样,采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测血清抗体效价,经检测合格后,于第1次免疫52 d后一次性采血获得抗血清。将诱导表达的蛋白进行SDS-PAGE电泳分析并凝胶湿转至硝酸纤维素膜上,以纯化的兔血清为一抗(1﹕1 000),再以荧光标记的山羊抗兔抗体为二抗进行Western Blot鉴定多克隆抗体的特异性。
1.11 VvGAI1蛋白在低温条件下表达分析
为确定制备出的anti-VvGAI1抗体能否检测到葡萄中的VvGAI1蛋白,参考BERTINI等[31]的方法制备葡萄愈伤组织原生质体,以欧洲葡萄‘霞多丽’的愈伤组织为材料,采用2%纤维素酶(cellulase onozuka R-10)、1%离析酶(macerozyme R-10)和0.05%果胶酶(pectolyase Y-23)的酶组合,在0.5 mol·L-1甘露醇溶液中,28 ℃黑暗条件下,酶解14 h后分离葡萄愈伤组织原生质体,经血球计数板测定原生质体产量为1.97×106个/g,经0.5 mg·mL-1二乙酸荧光素溶液(fluorescein diacetate,FDA)染色并在紫外光下检测原生质体的活力为80%。将制备的葡萄愈伤原生质体在细胞培养板上按照1 mL/组进行分组试验,然后置于低温培养箱内进行4 ℃低温处理,分别在0、0.5、1和2 h时收集原生质体并提取蛋白。参考YAO等[32]的方法进行Western blot分析,使用anti-VvGAI1抗体对葡萄中的VvGAI1蛋白进行检测。
2 结果
2.1 VvGAI1克隆
以提取的酿酒葡萄‘霞多丽’叶片总RNA反转录合成的cDNA为模板,通过同源克隆的方式从‘霞多丽’葡萄cDNA中克隆得到的ORF序列(图1)。将目的片段扩增产物胶回收并与pMD19-T载体连接,挑选阳性克隆进行测序。测序结果表明的ORF 长1 773 bp,编码590个氨基酸(图2-A);定位于第1条染色体,含有1个外显子,不含内含子;VvGAI1蛋白由590个氨基酸组成,其中亮氨酸占比最高,分子量约为64.87 kDa,等电点pI为5.31,不稳定性指数为45.78,GRAVY(grand average of hydropathicity)值为-0.276,属于酸性不稳定亲水蛋白。VvGAI1蛋白保守结构域预测结果表明,该蛋白在35—102和214—574氨基酸处分别含有DELLA和GRAS两个保守结构域,属于植物特有的GRAS家族的DELLA蛋白(图2-B)。
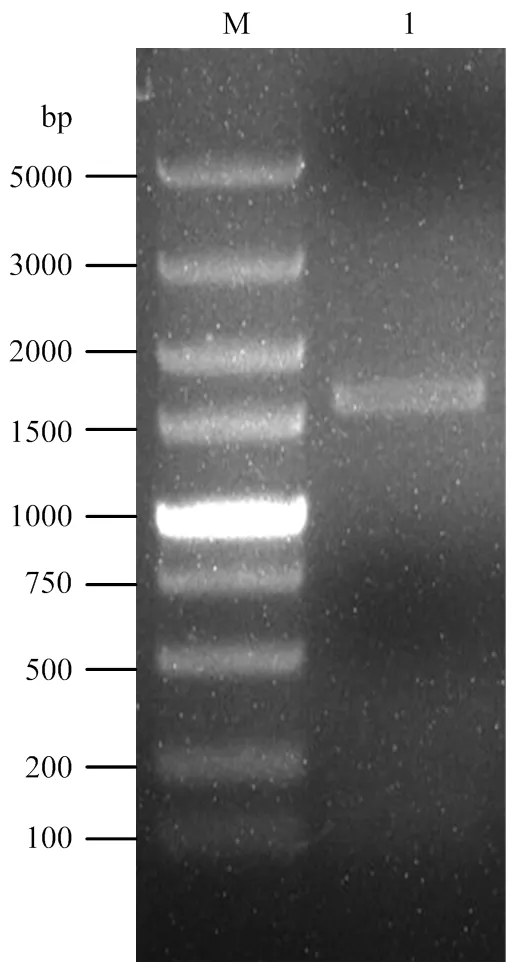
M: DL5000 bp DNA Marker; 1: VvGAI1 gene
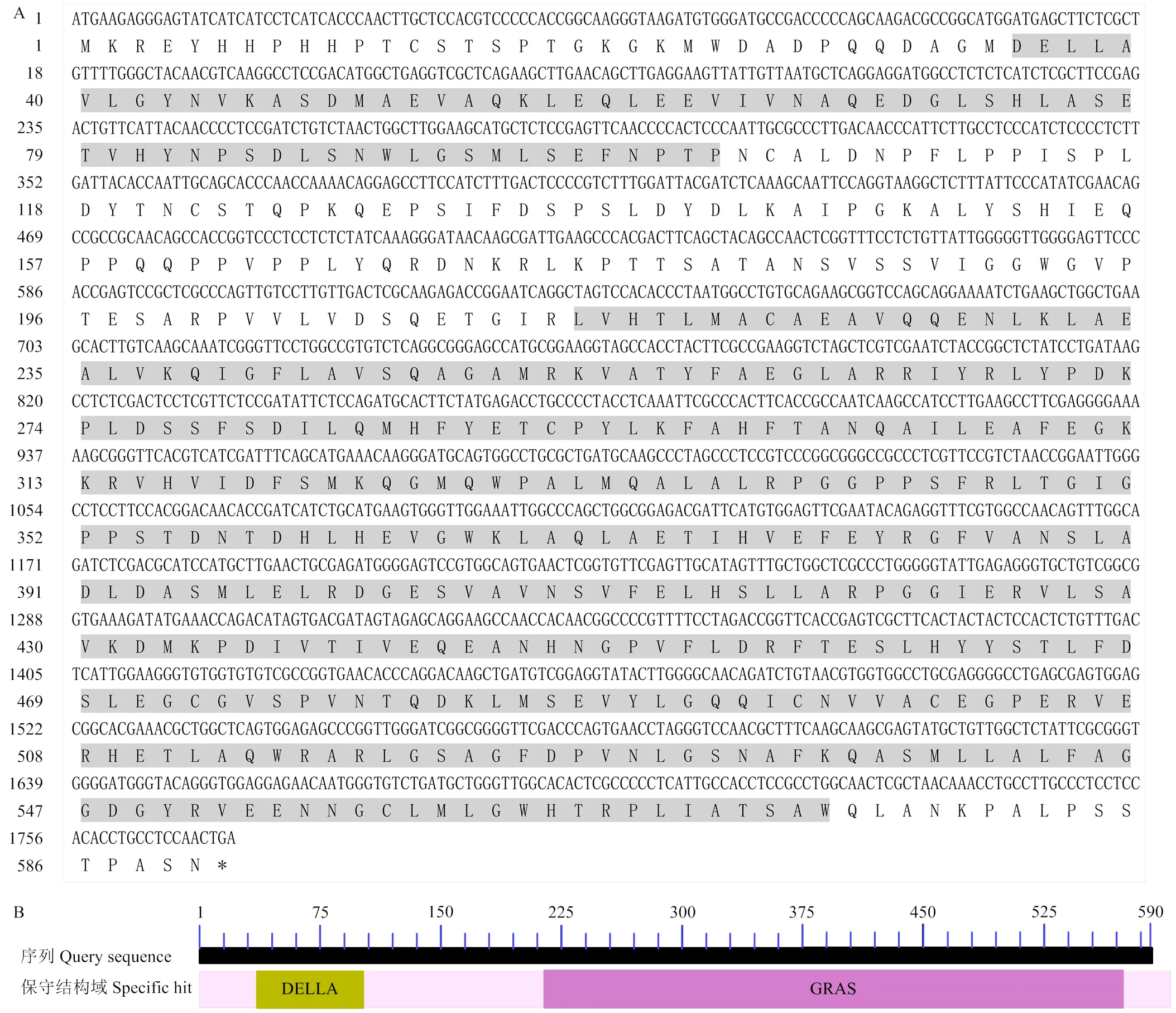
A:VvGAI1核苷酸及氨基酸序列;B:VvGAI1蛋白的保守结构域,阴影部分的氨基酸为DELLA和GRAS两个保守结构域,*代表终止密码子
2.2 VvGAI1蛋白序列比对及系统进化分析
利用DNAMAN将VvGAI1与拟南芥中5个DELLA蛋白(GAI、RGA、RGL1、RGL2和RGL3)的氨基酸序列进行多重比对分析,发现葡萄VvGAI1蛋白与拟南芥5个DELLA蛋白的氨基酸序列中都含有GRAS家族典型的DELLA和GRAS结构域。VvGAI1与拟南芥5个DELLA蛋白氨基酸序列间的相似度达57.82%,其中与AtGAI(GenBank登录号:NP_172945)、AtRGA(NP_178266)的相似度较高,分别为63.41%和62.46%(图3)。
为进一步分析VvGAI1与其他物种DELLA蛋白间的系统进化关系,以拟南芥AtGAI蛋白的DELLA和GRAS保守结构域为基础,利用HMMER 3.0软件分别从葡萄、苹果、桃、梨、橙子、甜瓜、野草莓、番茄、大豆和烟草基因组中鉴定出DELLA蛋白基因家族成员,并使用MEGA 7.0软件对鉴定出的DELLA蛋白构建系统进化树。聚类结果显示(图4),所有48个DELLA成员根据其蛋白序列特征可划分为5个亚族,即Group Ⅰ—Ⅴ。葡萄中的3个DELLA蛋白分布于Group Ⅰ、Group Ⅱ和Group Ⅳ,在亚组Ⅰ中的VvRGA(XP_002266267)与CsGAI(XP_ 006482132)和AtRGL3(NP_197251)亲缘关系较近;在亚组Ⅱ中的VvGAI1(XP_002284648)与AtGAI和NtGAI1(XP_016441385)具有较近的亲缘关系;在亚组Ⅳ中的VvSLR1(XP_002284952)与橙子CsSLR1(XP_006475770)亲缘关系最近,与甜瓜CmSLR1(XP_008463334)的进化距离较近。

图中点表示序列比对空位,蓝色线区域表示DELLA保守结构域,橙色线区域表示GRAS保守结构域
2.3 VvGAI1亚细胞定位分析
为探究VvGAI1蛋白的亚细胞定位情况,将空载质粒pBI221-GFP和重组质粒pBI221- VvGAI1-GFP通过PEG介导法转化至拟南芥原生质体进行瞬时表达。22 ℃弱光培养20 h后,在激光共聚焦显微镜下观察荧光分布情况。结果显示(图5),pBI221-GFP和pBI221-VvGAI1-GFP在原生质体表达蛋白后均能检测到绿色荧光,其中作为空载体对照pBI221-GFP的绿色荧光在原生质体的细胞膜、细胞质和细胞核中均有分布;而pBI221-VvGAI1-GFP融合蛋白只在细胞核中显示绿色荧光,说明VvGAI1在细胞核中表达并发挥功能。
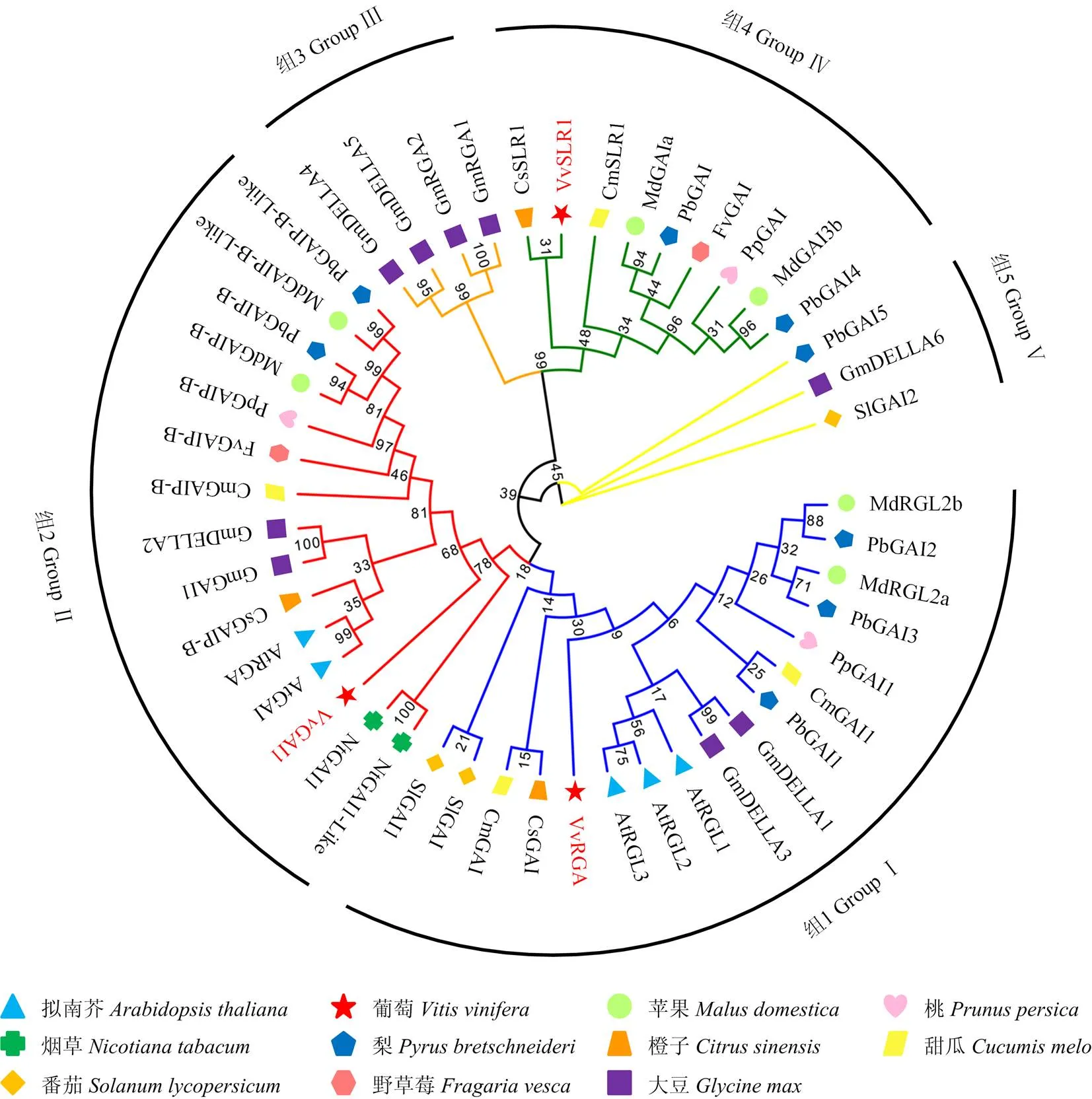
图4 葡萄DELLA蛋白系统进化分析

图 5 VvGAI1亚细胞定位
2.4 外源JA与GA对葡萄抗寒性影响的分析
为进一步分析JA与GA对葡萄抗寒性影响,选取生长一致的扦插自根苗葡萄植株为试材,分别外源喷施MeJA与GA3,12 h后进行-3 ℃冷胁迫处理,结果表明(图6),喷施MeJA的葡萄植株叶片在0 h处理的相对电导率稍有下降但无显著差异,而冷胁迫处理3 h和6 h后喷施MeJA的叶片电导率相较于喷施无菌水(CK)显著下降,说明外源JA可以降低葡萄叶片在冷胁迫下的相对电导率,能够提高葡萄的抗寒性。喷施GA3的葡萄植株叶片在0 h冷处理的相对电导率较对照无显著差异,同样在冷胁迫处理3 h后喷施GA3的叶片电导率相较于对照无显著差异,而冷胁迫处理6 h后喷施GA3的叶片电导率相较于对照显著上升,说明外源GA处理增加了葡萄叶片在冷胁迫下的相对电导率,使葡萄对冷胁迫敏感。这些结果表明JA有利于正调控冷胁迫反应,而GA则是负调控冷胁迫反应。
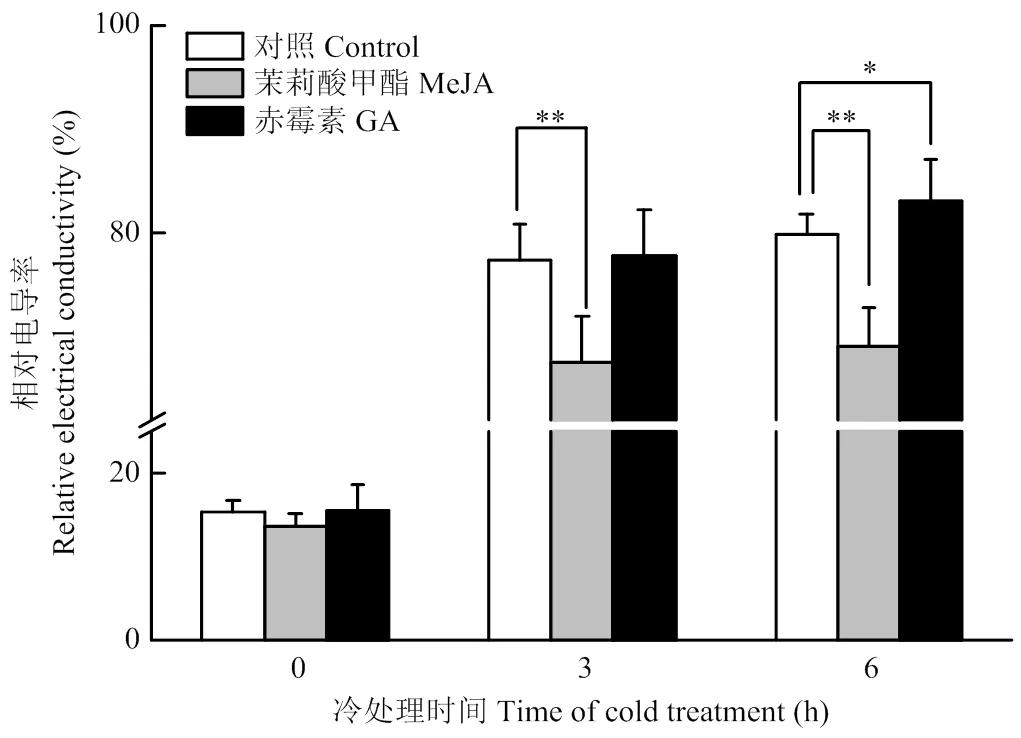
*表示差异显著(P<0.05),**表示差异极显著(P<0.01)
2.5 VvGAI1蛋白的自激活分析
将构建成功的pGBKT7-VvGAI1、pGBKT7- VvGAI1∆DELLA、pGBKT7-VvGAI1∆GRAS重组质粒分别转化至酵母Y2H Gold感受态细胞中(图7),验证VvGAI1是否具有自激活活性。3种重组载体、阳性对照(pGADT7-T+pGBKT7-p53)、阴性对照(pGADT7-T+pGBKT7-Lam)和空载对照(pGBKT7)的质粒转入酵母后在SD/-Trp培养基上均能正常生长,但在SD/-Trp/AbA/X--Gal培养基上只有阴性对照和空载体对照的菌株不能正常生长,而含有pGBKT7-VvGAI1、pGBKT7-VvGAI1∆DELLA、pGBKT7-VvGAI1∆GRAS重组质粒和阳性对照的酵母菌株均能正常生长且显现蓝色,说明3种重组质粒均已转入酵母细胞,VvGAI1蛋白的DELLA和GRAS结构域在酵母中均有自激活活性,且GRAS结构域转录激活活性弱于DELLA结构域,VvGAI1能够激活下游报告基因的转录和翻译(图7-B)。

A:VvGAI1蛋白结构示意图;B:VvGAI1蛋白的转录激活活性验证。BD:pGBKT7空载体作为空载对照;Po:pGADT7-T+pGBKT7-p53作为阳性对照;Ne:pGADT7-T+pGBKT7-Lam作为阴性对照
2.6 酵母双杂交点对点验证VvGAI1与VvJAZ9的互作关系
为进一步验证VvGAI1与VvJAZ9互作关系,将的ORF克隆至pGADT7载体,构建重组载体pGADT7-VvGAI1。然后将pGBKT7-VvJAZ9+pGADT7- VvGAI1,pGBKT7-VvJAZ9+pGADT7,pGBKT7+pGADT7-VvGAI1共转化至酵母Y2H Gold感受态细胞中,点涂于SD/-Trp/AbA/X--Gal培养基上进行点对点验证。在SD/-Trp/AbA/X--Gal培养基上只有pGBKT7- VvJAZ9+pGADT7-VvGAI1和阳性对照(pGADT7-T+ pGBKT7-p53)显现蓝色酵母菌落,而pGBKT7- VvJAZ9+pGADT7,pGBKT7+pGADT7-VvGAI1和阴性对照(pGADT7-T+pGBKT7-Lam)的菌株均不能正常生长,说明VvGAI1与VvJAZ9存在相互作用(图8)。

Po:pGADT7-T+pGBKT7-p53作为阳性对照;Ne:pGADT7-T+pGBKT7-Lam作为阴性对照
2.7 BiFC证明VvGAI1与VvJAZ9蛋白互作
利用BiFC试验进一步验证VvGAI1与VvJAZ9在植物体内的互作关系,分别将和中不含终止密码子的ORF序列通过同源重组法连接至pB221-cYFP、pB221-nYFP载体中,构成VvJAZ9-cYFP和VvGAI1-nYFP重组载体。然后将cYFPJAZ9+nYFPGAI1、cYFPJAZ9+nYFP和cYFP+nYFPGAI1共转化拟南芥原生质体。结果显示,共转化的cYFPJAZ9+nYFPGAI1在拟南芥原生质体中可以观察到黄色荧光信号,而cYFPJAZ9+ nYFP和cYFP+nYFPGAI1均未观察到黄色荧光信号,表明VvGAI1和VvJAZ9蛋白在植物体内存在互作关系(图9)。
2.8 anti-VvGAI1抗体制备
以获得的片段为模板,通过同源重组的方法将的ORF连接至带有His标签蛋白的原核表达载体pET28b上,形成融合表达载体pET28b-VvGAI1-His(图10)。
将构建成功的pET28b-VvGAI1-His重组质粒转入原核蛋白表达菌株BL21后,经IPTG诱导以获得最佳表达条件。结果表明,转入重组质粒的菌株在16 ℃下经1.0 mmol·L-1IPTG诱导16 h后,能够达到纯化目的蛋白的需求(图11-A)。然后经Ni-NTA亲和层析获得纯化的VvGAI1-His融合蛋白,再经SDS-PAGE凝胶电泳后,通过考马斯亮蓝染色鉴定出提取的蛋白大小为67.06 kDa(图11-B),确定无误后经免疫挑选健康的6周大小的新西兰大白兔两只(约2 kg),制备多克隆抗体。结果显示anti-VvGAI1多克隆抗体制备良好可用于后续试验(图 11-C)。

图9 BiFC验证VvGAI1 与VvJAZ9蛋白互作
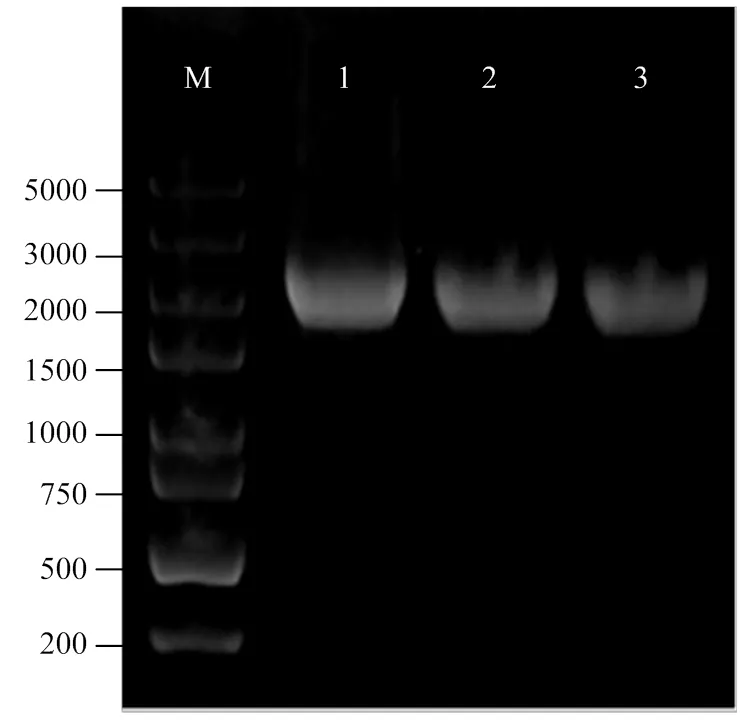
M:DL 5000 bp DNA Marker;泳道1—3:pET28b-VvGAI1-His菌液PCR检测
2.9 VvGAI1蛋白在低温条件下表达分析
为了解葡萄中VvGAI1蛋白在低温条件下表达情况,也为确定所制备的anti-VvGAI1抗体能否检测到葡萄中的VvGAI1蛋白,采用酶解法制备出葡萄愈伤组织原生质体,并进行4 ℃低温处理,在0、0.5、1和2 h时收集原生质体,提取蛋白后,分别用anti-VvGAI1抗体检测葡萄原生质体在4 ℃处理后VvGAI1蛋白的表达情况。结果显示,制备的anti-VvGAI1抗体可用于检测葡萄内源VvGAI1蛋白的表达情况,4 ℃低温处理后的原生质体中VvGAI1蛋白呈现先上升后下降的表达趋势,说明VvGAI1蛋白受低温诱导表达,且与受低温诱导表达趋势相似(图12)。
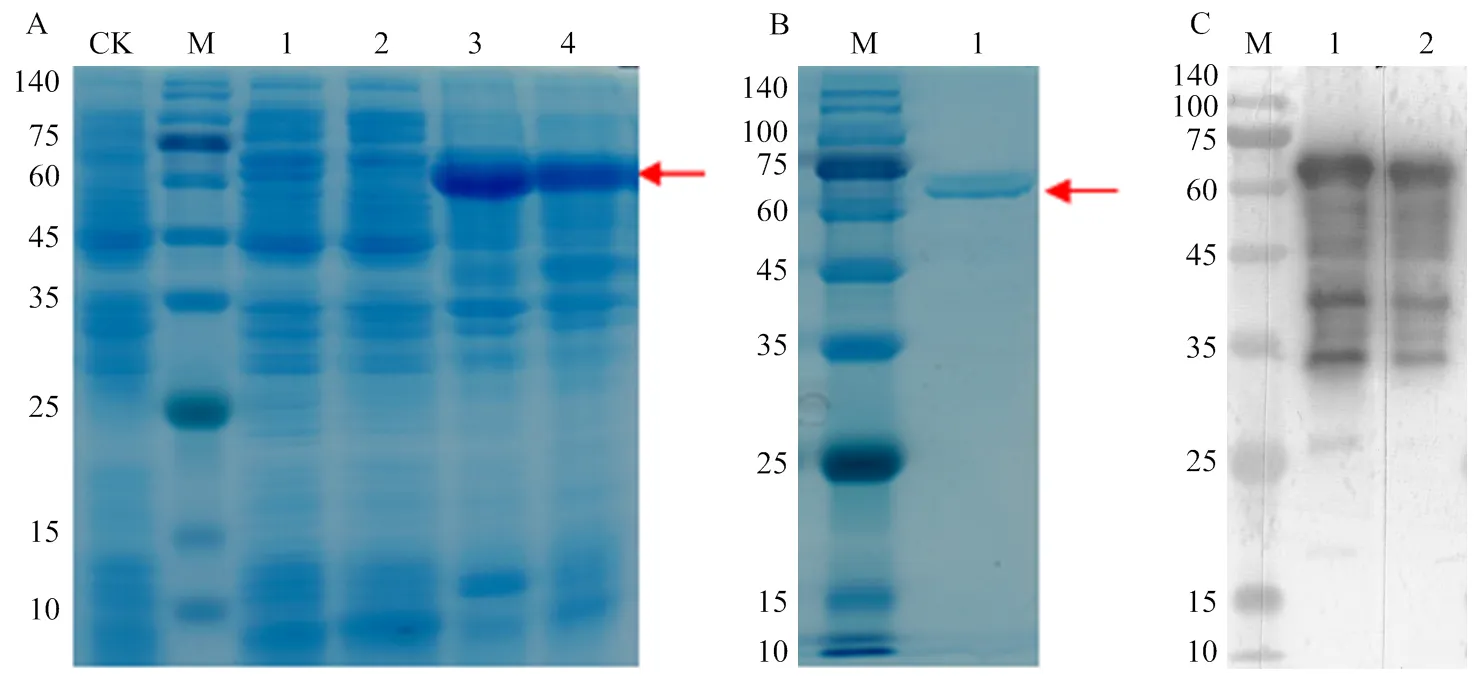
A:VvGAI1原核诱导表达;B:VvGAI1蛋白纯化;C:anti-VvGAI1制备后的检测。图中CK表示非诱导细菌培养(阴性对照),M表示蛋白分子量标准,泳道1—4分别表示E. coli BL21菌株在16 ℃条件下IPTG诱制获得的天然蛋白提取物,37 ℃条件下IPTG诱导获得的天然蛋白提取物,16 ℃条件下IPTG诱导获得的变性蛋白提取物,37 ℃条件下IPTG诱导获得的变性蛋白提取物

图12 VvGAI1蛋白在低温条件下的表达分析
3 讨论
3.1 外源植物激素JA与GA影响葡萄抗寒性
GA和JA是广泛存在于植物中的内源生长调节物质和信号分子,在植物生长发育、次生代谢以及非生物和生物胁迫的防御反应中均发挥着重要调节作用[33-34]。已有研究表明,冷胁迫会使植物体内的茉莉酸类物质含量增加,而外源施用JA可以增强抗氧化酶活性,增加抗氧化剂、防御化合物的合成,减少活性氧和丙二醛的积累,降低细胞膜的通透性以及诱导冷响应基因的表达来提高番茄()[35]、香蕉()[36]、枇杷()[37]、葡萄[38]等植物的抗寒性。本研究发现外源喷施JA后再经冷胁迫处理3 h和6 h的葡萄植株叶片的相对电导率相较于喷施无菌水处理(对照)显著下降,这与前人在葡萄上的研究结果一致[38],表明外源JA处理可有效降低葡萄叶片在冷胁迫下的相对电导率,保持细胞膜的完整性,增强抗寒能力;同时也说明JA在诱导植物对冷胁迫的适应过程中起着正调控作用。
GA也参与植物对低温胁迫的反应,GA3显著促进4 ℃低温处理后花生种子萌发和种子活力,抑制花生幼苗在低温处理后相对膜透性和丙二醛的上升,提高可溶性糖、可溶性蛋白、游离脯氨酸含量,增强花生幼苗的抗寒能力[39]。外源喷施100 mg·L-1GA3处理通过提高可溶性糖、可溶性蛋白质和游离脯氨酸的含量,延缓电解质渗出率,抑制丙二醛上升,来提高‘库尔勒香梨’树(Yu)的抗寒性[40]。本研究发现外源喷施GA3的葡萄植株在冷胁迫处理3 h后的叶片电导率与对照无差异,而冷胁迫处理6 h后的叶片电导率显著高于对照;GA3处理增加了冷胁迫下的叶片相对电导率,使葡萄对冷胁迫敏感,说明GA在诱导植物对冷胁迫的适应过程中起着负调控作用。JAZ蛋白与DELLA蛋白分别是JA和GA信号途径中的重要调控因子[20,33],且分别受植物体内JA和GA水平的影响。因此,研究冷胁迫下,JA和GA信号通路之间的相互调节,对植物的抗寒性机理研究具有很好的理论价值。
3.2 VvGAI1及其蛋白的特征
SCFSLY1/GID2泛素蛋白复合体、转录抑制因子DELLA蛋白和赤霉素受体GID1是GA信号通路的3个核心组件,其中DELLA蛋白作为E3泛素连接SCFSLY1/GID2的靶蛋白是GA信号转导途径的关键组分[12]。近年来,随着DELLA蛋白在GA信号途径中的研究不断深入,许多植物中DELLA蛋白基因被成功克隆,且DELLA蛋白在植物种子萌发、花器官形成、幼苗生长、果实发育、植株衰老和逆境抗性等方面均有影响[8]。本研究采用同源克隆的方法从欧洲葡萄中成功克隆出,隶属植物特有的GRAS家族DELLA蛋白成员。该基因位于第1条染色体,有1个外显子,无内含子,这与Acheampong等[18]从‘汤普森’无核葡萄中克隆的()结果一致。的ORF序列长1 773 bp,编码590个氨基酸,分子量约64.87 kDa,pI为5.31,是核定位蛋白,也具有DELLA和GRAS结构域;与张文颖等[19]在‘白罗莎里奥’葡萄中得到的VvGAI1蛋白性质一致;且与杨光等[41]报道的属于不同葡萄品种中的同源序列。通过与拟南芥5个DELLA蛋白序列比对分析后发现,葡萄VvGAI1蛋白和拟南芥的DELLA蛋白中都具有GRAS家族的典型结构域和保守区,且与AtGAI和AtRGA的序列一致性较高,与酿酒葡萄‘莫尼耶皮诺’中VvGAI1(VvL1)蛋白结构研究一致[17]。本研究利用HMMER软件从葡萄基因组中鉴定出3个DELLA蛋白基因家族成员,与前人研究结果一致[18-19]。本研究中葡萄与其他物种中鉴定出的DELLA成员构建的系统进化树被分为5个亚组,亚组Ⅱ中的VvGAI1与AtGAI和NtGAI1的亲缘关系较近,说明在进化过程中具有高度的序列保守性,在蛋白功能上可能具有一定的相似性。
3.3 DELLA蛋白与JAZ蛋白的相互作用
由于缺少DNA结合结构域,DELLA蛋白常与不同信号途径中的调控蛋白发生互作来发挥其分子功能[23]。WD-repeat/bHLH/MYB复合物作为DELLA和JAZ相互作用的直接靶点,介导GA和JA信号转导在调节毛状体发育中的协同作用[42]。DELLA蛋白与MYBL2和JAZ形成JAZ-DELLA-MYBL2螯合物,加快HLH/MYB亚基的释放和活性MBW复合物的形成,从而促进花青素的积累,提高植物的抗逆性[43]。DELLA和JAZ蛋白相互作用,抑制MYB21和MYB24的转录激活,进而抑制拟南芥花丝伸长[44]。水稻()DELLA蛋白SLR1、SLR1-LIKE可与OsJAZ8和OsJAZ9相互作用,以介导GA和JA对水稻高株等性状的拮抗调控[45]。本研究通过酵母双杂交试验发现DELLA蛋白VvGAI与VvJAZ9存在互作关系,进一步利用双分子荧光互补试验也证实VvGAI1和VvJAZ9蛋白在植物体内相互作用,与张晶星等[46]发现油松()中5个JAZ蛋白与DELLA-like蛋白存在相互作用的结果类似。
3.4 多克隆抗体制备
目前,运用原核表达的重组蛋白免疫鼠、兔等动物制备多克隆抗体已成为一种行之有效且常用的方法[47]。此外,通过原核表达获得大量的抗原蛋白,既可用于蛋白质性质与功能研究,也可用于蛋白质的相互作用等生化功能研究[48]。在葡萄抗寒研究方面所制备出的多克隆抗体有anti-VvHOS1[28]、anti-VaCIPK18[30]和anti-VaERD15[49],而、和在植物响应低温胁迫过程中发挥着重要作用。本研究纯化抗血清后得到了效价高且特异性好的anti- VvGAI1多克隆抗体。该抗体能够特异识别‘霞多丽’葡萄中的VvGAI1蛋白。
3.5 GAI基因响应逆境胁迫
DELLA蛋白作为GA信号转导中的关键负调节因子,主要通过参与调节植物生长来响应逆境胁迫[20]。将甜菜()在拟南芥异源表达可通过增强渗调节和抗氧化酶系统进而提高植株的耐盐性[50]。有研究表明,干旱条件下紫花苜蓿()的表达量逐渐上升并一直处于较高水平,可能通过与脱落酸相互协同参与干旱胁迫的响应[51]。笔者前期通过4 ℃低温处理2年生‘霞多丽’葡萄盆栽扦插苗,发现低温处理后的葡萄叶片中呈先上升后下降的表达趋势,在3 h时表达量达到最高,并推测该基因可能参与葡萄冷胁迫响应[24]。本研究通过制备的anti-VvGAI1抗体检测出4 ℃低温处理的葡萄愈伤原生质体中VvGAI1蛋白呈先上升后下降的表达趋势,表明VvGAI1蛋白响应低温诱导表达,且与在转录水平上受低温诱导表达趋势相似。这也说明与其蛋白的表达水平在时间段上存在差异,植物不同组织和细胞对温度的敏感性存在一定差异。植物原生质体是指植物细胞去除细胞壁后形成的只由质膜包裹的“裸露细胞”,是没有细胞壁的特殊状态,更容易感知外界刺激[52]。同样在低温处理下,葡萄原生质体对冷刺激的感知速度以及响应效率要高于葡萄植株。
4 结论
从欧洲葡萄‘霞多丽’中克隆获得,ORF长1 773 bp,编码590个氨基酸,无内含子,含有1个外显子以及DELLA和GRAS两个高度保守结构域,属于植物GRAS家族的DELLA蛋白。蛋白聚类分析发现VvGAI1与拟南芥AtGAI和烟草NtGAI1亲缘关系较近。VvGAI1是一个定位于细胞核中且具有转录激活活性的转录因子。酵母双杂交与双分子荧光互补试验结果都表明VvGAI1与VvJAZ9蛋白具有互作关系。制备的anti-VvGAI1抗体能够特异性检测出‘霞多丽’葡萄中的VvGAI1蛋白,Western blot结果表明VvGAI1响应低温诱导表达。外源JA处理可以提高葡萄的抗寒性,而GA处理使葡萄对寒冷变得敏感。
[1] 刘畅, 杨兴旺, 王小龙, 王志强, 刘凤之, 王海波. 植物防冻剂对葡萄抗寒能力的影响研究进展. 中国果树, 2022(3): 6-9.
LIU C, YANG X W, WANG X L, WANG Z Q, LIU F Z, WANG H B. Research progress on the effect of plant antifreeze on grape under low-temperature stress. China Fruits, 2022(3): 6-9. (in Chinese)
[2] 张利鹏, 刘怀锋, 辛海平. 葡萄抗寒机制研究进展. 果树学报, 2023, 40(2): 350-362.
ZHANG L P, LIU H F, XIN H P. Research progress in cold tolerance mechanism of grape. Journal of Fruit Science, 2023, 40(2): 350-362. (in Chinese)
[3] 段晓凤, 张晓煜, 张磊, 刘建文, 南学军, 李楠, 李红英. 酿酒葡萄越冬防冻技术研究发展概况. 农业工程, 2022, 12(6): 133-138.
DUAN X F, ZHANG X Y, ZHANG L, LIU J W, NAN X J, LI N, LI H Y. General situation of research and development on antifreeze technology for wine grape overwintering. Agricultural Engineering, 2022, 12(6): 133-138. (in Chinese)
[4] WANG Z L, WU D, HUI M, WANG Y, HAN X, YAO F, CAO X, LI Y H, LI H, WANG H. Screening of cold hardiness-related indexes and establishment of a comprehensive evaluation method for grapevines (). Frontiers in Plant Science, 2022, 13: 1014330.
[5] RICHARDS D E, KING K E, AIT-ALI T, HARBERD N P. How gibberellin regulates plant growth and development: a molecular genetic analysis of gibberellin signaling. Annual Review of Plant Physiology and Plant Molecular Biology, 2001, 52: 67-88.
[6] GAO X H, ZHANG Y Y, HE Z H, FU X D. Gibberellins. Hormone Metabolism and Signaling in Plants. Amsterdam: Elsevier, 2017: 107-160.
[7] LI W J, ZHANG J X, SUN H Y, WANG S M, CHEN K Q, LIU Y X, LI H, MA Y, ZHANG Z H. FveRGA1, encoding a DELLA protein, negatively regulates runner production in. Planta, 2018, 247(4): 941-951.
[8] XUE H D, GAO X, HE P, XIAO G H. Origin, evolution, and molecular function of DELLA proteins in plants. The Crop Journal, 2022, 10(2): 287-299.
[9] ZHAO B, LI H T, LI J J, WANG B, DAI C, WANG J, LIU K D.DS-3, encoding a DELLA protein, negatively regulates stem elongation through gibberellin signaling pathway. Theoretical and Applied Genetics, 2017, 130(4): 727-741.
[10] SUN T P. Gibberellin-GID1-DELLA: a pivotal regulatory module for plant growth and development. Plant Physiology, 2010, 154(2): 567-570.
[11] DAI C, XUE H W. Rice early flowering1, a CKI, phosphorylates DELLA protein SLR1 to negatively regulate gibberellin signalling. The EMBO Journal, 2010, 29(11): 1916-1927.
[12] VAN DE VELDE K, RUELENS P, GEUTEN K, ROHDE A, VAN DER STRAETEN D. Exploiting DELLA signaling in cereals. Trends in Plant Science, 2017, 22(10): 880-893.
[13] HUSSAIN A, PENG J R. DELLA proteins and GA signalling in. Journal of Plant Growth Regulation, 2003, 22(2): 134-140.
[14] TYLER L, THOMAS S G, HU J H, DILL A, ALONSO J M, ECKER J R, SUN T P. Della proteins and gibberellin-regulated seed germination and floral development in. Plant Physiology, 2004, 135(2): 1008-1019.
[15] HOU X L, HU W W, SHEN L S, LEE L Y C, TAO Z, HAN J H, YU H. Global identification of DELLA target genes duringflower development. Plant Physiology, 2008, 147(3): 1126-1142.
[16] 赵春丽, 王晓, 陈家兰, 陈何, 王乐, 赖钟雄, 刘生财. 植物DELLA蛋白家族研究进展. 应用与环境生物学报, 2020, 26(5): 1299-1308.
ZHAO C L, WANG X, CHEN J L, CHEN H, WANG L, LAI Z X, LIU S C. Progress in research on plant DELLA family proteins. Chinese Journal of Applied and Environmental Biology, 2020, 26(5): 1299-1308. (in Chinese)
[17] BOSS P K, THOMAS M R. Association of dwarfism and floral induction with a grape ‘green revolution’ mutation. Nature, 2002, 416(6883): 847-850.
[18] ACHEAMPONG A K, HU J H, ROTMAN A, ZHENG C L, HALALY T, TAKEBAYASHI Y, JIKUMARU Y, KAMIYA Y, LICHTER A, SUN T P, OR E. Functional characterization and developmental expression profiling of gibberellin signalling components in. Journal of Experimental Botany, 2015, 66(5): 1463-1476.
[19] 张文颖, 王晨, 朱旭东, 马超, 王文然, 冷翔鹏, 郑婷, 房经贵. 葡萄全基因组DELLA蛋白基因家族鉴定及其应答外源赤霉素调控葡萄果实发育的特征. 中国农业科学, 2018, 51(16): 3130-3146. doi: 10.3864/j.issn.0578-1752.2018.16.009.
ZHANG W Y, WANG C, ZHU X D, MA C, WANG W R, LENG X P, ZHENG T, FANG J G. Genome-wide identification and expression of DELLA protein gene family during the development of grape berry induced by exogenous GA. Scientia Agricultura Sinica, 2018, 51(16): 3130-3146. doi: 10.3864/j.issn.0578-1752. 2018.16.009. (in Chinese)
[20] WANG Z J, LIU L, CHENG C H, REN Z Y, XU S M, LI X. GAI functions in the plant response to dehydration stress in. International Journal of Molecular Sciences, 2020, 21(3): 819.
[21] 王润青, 樊晓聪, 宋梅芳, 肖阳, 郭林, 孟凡华, 杨青华, 吴大付, 杨建平. 小麦DELLA获得性突变体矮变1号增强了幼苗的抗盐能力. 作物学报, 2016, 42(11): 1721-1726.
WANG R Q, FAN X C, SONG M F, XIAO Y, GUO L, MENG F H, YANG Q H, WU D F, YANG J P. A wheat DELLA gain-of-function mutant aibian 1 promotes seedling salt tolerance. Acta Agronomica Sinica, 2016, 42(11): 1721-1726. (in Chinese)
[22] ACHARD P, GONG F, CHEMINANT S, ALIOUA M, HEDDEN P, GENSCHIK P. The cold-inducible CBF1factor-dependent signaling pathway modulates the accumulation of the growth-repressing DELLA proteins via its effect on gibberellin metabolism. The Plant Cell, 2008, 20(8): 2117-2129.
[23] LI Y, WANG H P, LI X L, LIANG G, YU D Q. Two DELLA- interacting proteins bHLH48 and bHLH60 regulate flowering under long-day conditions in. Journal of Experimental Botany, 2017, 68(11): 2757-2767.
[24] 刘德帅, 冯美, 樊姗姗, 孙雨桐, 迟敬楠, 姚文孔. 欧洲葡萄基因互作蛋白的筛选与验证. 果树学报, 2023, 40(7): 1294-1311.
LIU D S, FENG M, FAN S S, SUN Y T, CHI J N, YAO W K. Screening and verification ofgene interacting proteins in. Journal of Fruit Science, 2023, 40(7): 1294-1311. (in Chinese)
[25] WANG L X, NICK P. Cold sensing in grapevine-Which signals are upstream of the microtubular “thermometer”. Plant, Cell & Environment, 2017, 40(11): 2844-2857.
[26] WANG X H, GUO R R, TU M X, WANG D J, GUO C L, WAN R, LI Z, WANG X P. Ectopic expression of the wild grape WRKY transcription factor VqWRKY52 inenhances resistance to the biotrophic pathogen powdery mildew but not to the necrotrophic pathogen. Frontiers in Plant Science, 2017, 8: 97.
[27] WANG X C, ZHAO M Z, WU W M, KORIR N K, QIAN Y M, WANG Z W. Comparative transcriptome analysis of berry-sizing effects of gibberellin (GA3) on seedlessL.Genes & Genomics, 2017, 39(5): 493-507.
[28] 俞沁含, 焦淑珍, 吴楠, 张宁波, 徐伟荣. 葡萄E3泛素酶HOS1基因克隆、表达及抗血清制备. 园艺学报, 2021, 48(6): 1173-1182.
YU Q H, JIAO S Z, WU N, ZHANG N B, XU W R. Molecular cloning, expression and polyclonal antibody preparation of E3 ubiquitin ligase genefrom. Acta Horticulturae Sinica, 2021, 48(6): 1173-1182. (in Chinese)
[29] SASAMOTO H, AZUMI Y, SHIMIZU M, HACHINOHE Y K, SUZUKI S.bioassay of allelopathy ofby sandwich method and protoplast co-culture method with digital image analysis. Plant Biotechnology, 2017, 34(4): 199-202.
[30] 吴楠, 张宁波, 郑巧玲, 陈卫平, 徐伟荣. 山葡萄VaCIPK18原核表达与多克隆抗体制备. 核农学报, 2020, 34(7): 1387-1396.
WU N, ZHANG N B, ZHENG Q L, CHEN W P, XU W R. Prokaryotic expression and polyclonal antibody preparation of calcineurin B-like proteins (CBLs) interacting protein kinases protein kinase VaCIPK18 from. Journal of Nuclear Agricultural Sciences, 2020, 34(7): 1387-1396. (in Chinese)
[31] BERTINI E, TORNIELLI G B, PEZZOTTI M, ZENONI S. Regeneration of plants from embryogenic callus-derived protoplasts of garganega and sangiovese grapevine (L.) cultivars. Plant Cell, Tissue and Organ Culture, 2019, 138(2): 239-246.
[32] YAO W K, WANG L, WANG J, MA F L, YANG Y Z, WANG C, TONG W H, ZHANG J X, XU Y, WANG X P, ZHANG C H, WANG Y J., a novel gene from Chinese grapevine,, targets VpICE1 to enhance cold tolerance. Journal of Experimental Botany, 2017, 68(11): 2933-2949.
[33] GHORBEL M, BRINI F, SHARMA A, LANDI M. Role of jasmonic acid in plants: The molecular point of view. Plant Cell Reports, 2021, 40(8): 1471-1494.
[34] BAO S J, HUA C M, SHEN L S, YU H. New insights into gibberellin signaling in regulating flowering in. Journal of Integrative Plant Biology, 2020, 62(1): 118-131.
[35] DING F, WANG C, XU N, WANG M L, ZHANG S X. Jasmonic acid-regulated putrescine biosynthesis attenuates cold-induced oxidative stress in tomato plants. Scientia Horticulturae, 2021, 288: 110373.
[36] ZHAO M L, WANG J N, SHAN W, FAN J G, KUANG J F, WU K Q, LI X P, CHEN W X, HE F Y, CHEN J Y, LU W J. Induction of jasmonate signalling regulators MaMYC2s and their physical interactions with MaICE1 in methyl jasmonate-induced chilling tolerance in banana fruit. Plant, Cell & Environment, 2013, 36(1): 30-51.
[37] JIN P, DUAN Y F, WANG L, WANG J, ZHENG Y H. Reducing chilling injury of loquat fruit by combined treatment with hot air and methyl jasmonate. Food and Bioprocess Technology, 2014, 7(8): 2259-2266.
[38] 解振宇, 杨江山. 茉莉酸甲酯对高寒地区设施延后栽培葡萄生理的影响. 中国农学通报, 2016, 32(16): 66-71.
XIE Z Y, YANG J S. Effect of methyl jasmonate on physiology of delayed culture grape in alpine greenhouse. Chinese Agricultural Science Bulletin, 2016, 32(16): 66-71. (in Chinese)
[39] 常博文, 钟鹏, 刘杰, 唐中华, 高亚冰, 于洪久, 郭炜. 低温胁迫和赤霉素对花生种子萌发和幼苗生理响应的影响. 作物学报, 2019, 45(1): 118-130.
CHANG B W, ZHONG P, LIU J, TANG Z H, GAO Y B, YU H J, GUO W. Effect of low-temperature stress and gibberellin on seed germination and seedling physiological responses in peanut. Acta Agronomica Sinica, 2019, 45(1): 118-130. (in Chinese)
[40] WANG Y J, KARIM A, XIAO K. Effects of exogenous GA3on cold resistance of Korla fragrant pear. Hans Journal of Agricultural Sciences, 2014, 4(6): 123-131.
[41] 杨光, 曹雪, 房经贵, 宋长年, 王晨, 王西成. ‘藤稔’葡萄VvGAI基因的克隆、亚细胞定位及时空表达分析. 园艺学报, 2011, 38(10): 1883-1892.
YANG G, CAO X, FANG J G, SONG C N, WANG C, WANG X C. Cloning, subcellular localization and spatiotemporal expression of a VvGAI gene from grapevine ‘Fujiminori’. Acta Horticulturae Sinica, 2011, 38(10): 1883-1892. (in Chinese)
[42] QI T C, HUANG H, WU D W, YAN J B, QI Y J, SONG S S, XIE D X.DELLA and JAZ proteins bind the WD-repeat/ bHLH/ MYB complex to modulate gibberellin and jasmonate signaling synergy. The Plant Cell, 2014, 26(3): 1118-1133.
[43] XIE Y, TAN H J, MA Z X, HUANG J R. DELLA proteins promote anthocyanin biosynthesis via sequestering MYBL2 and JAZ suppressorsof the MYB/bHLH/WD40 complex in. Molecular Plant, 2016, 9(5): 711-721.
[44] HUANG H, GONG Y L, LIU B, WU D W, ZHANG M, XIE D X, SONG S S. The DELLA proteins interact with MYB21 and MYB24 to regulate filament elongation in. BMC Plant Biology, 2020, 20(1): 64.
[45] UM T Y, LEE H Y, LEE S, CHANG S H, CHUNG P J, OH K B, KIM J K, JANG G, DO CHOI Y. Jasmonate zim-domain protein 9 interacts with slender rice 1 to mediate the antagonistic interaction between jasmonic and gibberellic acid signals in rice. Frontiers in Plant Science, 2018, 9: 1866.
[46] 张晶星, 马彦广, 王辉丽, 刘红梅, 李伟. 油松基因家族特征及其与DELLA蛋白互作的功能域鉴定. 北京林业大学学报, 2022, 44(12): 12-22.
ZHANG J X, MA Y G, WANG H L, LIU H M, LI W. Characteristics ofgene family ofand identification of functional domain of its interaction with DELLA protein. Journal of Beijing Forestry University, 2022, 44(12): 12-22. (in Chinese)
[47] 程彦伟, 李亮, 沈嵘, 齐耀程, 刘晓宇, 王宁, 张炜. 水稻LRR型类受体蛋白激酶胞外区的原核表达及多克隆抗体制备. 生物化学与生物物理进展, 2008, 35(9): 1077-1083.
CHENG Y W, LI L, SHEN R, QI Y C, LIU X Y, WANG N, ZHANG W. Prokaryotic expression and polyclonal antibody preparation of the extracellular domain about rice LRR receptor-like protein kinase. Progress in Biochemistry and Biophysics, 2008, 35(9): 1077-1083. (in Chinese)
[48] 王增, 代茹, 张江巍, 陈尚武, 张文, 马会勤. 拟南芥WUSCHEL蛋白的原核表达、亲和纯化和多克隆抗体制备. 生物工程学报, 2009, 25(9): 1409-1416.
WANG Z, DAI R, ZHANG J W, CHEN S W, ZHANG W, MA H Q. Induced expression ofWUSCHEL in, affinity protein purification and polyclonal antibody preparation. Chinese Journal of Biotechnology, 2009, 25(9): 1409-1416. (in Chinese)
[49] 张剑侠, 翟焕, 牛茹萱, 李瑞民. 中国野生山葡萄VaERD15基因的原核表达及多克隆抗体制备. 西北林学院学报, 2014, 29(6): 100-105.
ZHANG J X, ZHAI H, NIU R X, LI R M. Prokaryotic expression and polyclonal antibody preparation of the VaERD15 gene from Chinese wild. Journal of Northwest Forestry University, 2014, 29(6): 100-105. (in Chinese)
[50] 马慧敏, 孙培琳, 马春泉. 转录因子BvM14-GAI耐盐功能研究. 中国农学通报, 2021, 37(34): 34-42.
MA H M, SUN P L, MA C Q. Salt tolerance function of transcription factor BvM14-GAI. Chinese Agricultural Science Bulletin, 2021, 37(34): 34-42. (in Chinese)
[51] 张涵, 王学敏, 刘希强, 马琳, 温红雨, 王赞. 紫花苜蓿MsGAI的克隆、表达及遗传转化. 中国农业科学, 2019, 52(2): 201-214. doi: 10.3864/j.issn.0578-1752.2019.02.002.
ZHANG H, WANG X M, LIU X Q, MA L, WEN H Y, WANG Z. Cloning expression analysis and transformation of MsGAI gene fromL.. Scientia Agricultura Sinica, 2019, 52(2): 201-214. doi: 10.3864/j.issn.0578-1752.2019.02.002. (in Chinese)
[52] 吴月燕, 陈天池, 邱甜, 沈乐意, 谢晓鸿. '夏黑'葡萄组织培养、原生质体分离和瞬时表达体系的建立. 植物生理学报, 2021, 57(11): 2128-2144.
WU Y Y, CHEN T C, QIU T, SHEN L Y, XIE X H. Establishment of tissue culture, protoplast isolation and transient expression system in ‘Summer Black’ grape. Plant Physiology Journal, 2021, 57(11): 2128-2144. (in Chinese)
Analysis of the Interaction Between VvGAI1 and VvJAZ9 Proteins in Grape and Its Expression Pattern Under Low Temperature
LIU DeShuai, FENG Mei, SUN YuTong, WANG Ye, CHI JingNan, YAO WenKong
College of Enology and Horticulture, Ningxia University/Ningxia Modern Facility Horticulture Engineering Technology Research Center/Ningxia Key Laboratory of Modern Molecular Breeding of Dominant and Characteristic Crops, Yinchuan 750021
【Objective】DELLA protein belongs to plant-specific GRAS protein family, which is a significant regulatory factor in GA signal transduction pathway and plays important roles in plant growth, development and resistance to different stresses. In this study, the European grapevinegene was cloned and the analysis of subcellular localization, protein interaction and expression were performed, so as to lay the foundation for the further study of the function of DELLA protein in response to cold stress in grapevine.【Method】Thegene sequence was obtained by homologous cloning from the leaves ofcv. Chardonnay. Thesequence was analyzed by bioinformatics method, and the multiple sequence alignment and phylogenetic trees were performed by DNAMAN and MEGA7.0, respectively. The location of VvGAI1 protein in cells was determined by subcellular localization, and the transcriptional activation activity of the VvGAI1 protein was confirmed by a yeast assay. The interaction between VvGAI1 protein and VvJAZ9 protein was verified by yeast two-hybrid and BiFC assays. The VvGAI1 protein polyclonal antibodies from rabbit was prepared by VvGAI1 protein purified from prokaryotic expression. The VvGAI1 protein expression at low temperature was detected by Western blot method. The effect of exogenous MeJA and GA3on the cold resistance in grape was analyzed by relative electrical conductivity.【Result】Thegene was cloned from Chardonnay leaves, with carrying an ORF of 1773 bp, encoding 590 amino acids, locating on chromosome 1, and containing only one exon. The VvGAI1 protein had a molecular weight of 64.87 kDa and pI of 5.31, which was an acidic unstable hydrophilic protein. The VvGAI1 belonged to GRAS family and had the conserved DELLA and GRAS domains. Protein clustering analysis showed that VvGAI1 was closely related toGAI and tobacco GAI1. The results of subcellular location and transcriptional activation showed that VvGAI1 was a transcription factor localized in the nucleus and had transcriptional self-activation activity. The interaction between VvGAI1 and VvJAZ9 was confirmed by yeast two-hybrid andBiFC assays. Thegene sequence was cloned into the prokaryotic expression vector to form a pET28b-VvGAI1 recombinant vector, and theBL21 carrying pET28b-VvGAI1 recombinant vector was incubated in culture medium with 1.0 mmol∙L-1isopropyl--d-thiogalactoside (IPTG) at 16 ℃ to obtain VvGAI1-His fusion protein. The anti-VvGAI1 polyclonal antibody (rabbit-derived) was prepared by antigen immunization and serum purification and used to specifically detect VvGAI1 protein in Chardonnay grapes. Western blot results showed that the VvGAI1 protein in grape protoplasts under low temperature treatment showed an increasing first and then decreasing trend, which indicated the expression of VvGAI1 protein was induced at a low temperature. For 50 μmol·L-1MeJA and 50 μmol·L-1GA3treatments, compared with the control group exogenous MeJA treatment could improve the cold resistance of grape, whereas GA3treatment made grapes more sensitive to cold.【Conclusion】Grape VvGAI1 protein was a transcription factor and interacts with VvJAZ9. The VvGAI1 responded to low temperature stress, and exogenous MeJA was able topositively regulate the cold stress, while GA3negatively regulated the cold response.
; DELLA protein;; protein interaction; low temperature; expression pattern

10.3864/j.issn.0578-1752.2023.15.012
2023-01-12;
2023-03-31
国家自然科学基金地区科学基金(31960586)、宁夏回族自治区重点研发项目(2018BEB04004)、宁夏回族自治区青年科技人才托举工程项目
刘德帅,E-mail:lds201220@163.com。通信作者姚文孔,E-mail:yaowenkong@163.com
(责任编辑 赵伶俐)
