欧亚类禽H1N1猪流感病毒抗原性变异关键氨基酸的鉴定与分析
2023-08-15张乃心许程志杨玉莹张亚萍万云飞乔传玲陈化兰
张乃心,许程志,杨玉莹,张亚萍,万云飞,乔传玲,陈化兰
欧亚类禽H1N1猪流感病毒抗原性变异关键氨基酸的鉴定与分析
张乃心,许程志,杨玉莹,张亚萍,万云飞,乔传玲,陈化兰
中国农业科学院哈尔滨兽医研究所/动物疫病防控全国重点实验室,哈尔滨 150069
【背景】流感病毒的抗原性主要是由病毒的表面糖蛋白HA决定的,前期利用欧亚类禽型H1N1猪流感病毒(EA H1N1 SIV)HA蛋白单克隆抗体(mAb)筛选抗原逃逸株发现,HA蛋白190、230和269位(H3编码)氨基酸的改变能够导致病毒发生抗原逃逸,并发现在新近分离的EA H1N1 SIV HA蛋白广泛存在这3个氨基酸的变异。【目的】进一步探索哪些氨基酸对病毒的抗原性具有关键作用,为流感的防控提供科学依据。【方法】选取一株病毒A/swine/Liaoning/SY72/2018(H1N1) SY72为模式病毒,建立该病毒的反向遗传系统(RGS),又以SY72为骨架,拯救含有HA基因190、230和269单点突变重组病毒;利用rSY72病毒制备灭活疫苗,分别免疫SPF鸡和非免疫猪制备其相应的血清,通过中和试验和血凝抑制(HI)试验分析病毒的抗原性,确定影响病毒抗原性的关键氨基酸位点;继而评估HA蛋白不同位点氨基酸的改变对病毒复制特性及受体结合特性等的影响。【结果】分析SY72病毒的HA氨基酸序列发现,该病毒HA蛋白分别含有190D、230M和269R。利用反向遗传技术,分别拯救了病毒rSY72及单点突变病毒rSY72HA/D190N、rSY72HA/M230I和rSY72HA/R269M;中和试验结果表明,与rSY72相比较,3株突变病毒均能够与两株mAbs发生一定反应;HI试验结果显示,与rSY72相比较,突变病毒rSY72HA/D190N与rSY72免疫鸡血清和猪血清的反应减弱,HI抗体效价分别出现了4倍和8倍的差异,而病毒rSY72HA/M230I和rSY72HA/R269M与两种血清的反应差异不明显,表明HA蛋白190位氨基酸改变对病毒的抗原性影响最为明显;病毒蚀斑测定及复制动力学研究结果发现D190N 的氨基酸替换导致病毒rSY72HA/D190N在MDCK细胞上形成的蚀斑减小,而R269M的氨基酸替换导致病毒rSY72HA/R269M在MDCK细胞上的复制能力下降;3个位点的氨基酸替换均未影响病毒的受体结合特性。【结论】HA蛋白190位氨基酸对EA H1N1 SIV抗原性具有决定作用,269位氨基酸突变使得病毒在MDCK细胞上的复制能力降低。这提示在后续开展的病原学监测中要密切关注这些氨基酸的变异情况,提高对动物流感的预警预报。
猪流感病毒;HA蛋白;抗原性
0 引言
【研究意义】猪作为A型流感病毒感染的重要宿主,一直以来在流感病毒的进化及新型流感病毒的产生过程中扮演着重要角色[1-2]。近年来开展的猪流感(swine influenza,SI)监测结果表明欧亚类禽型H1N1 (Eurasian avian-like H1N1,EA H1N1)猪流感病毒(swine influenza virus,SIV)在猪群中广泛流行,而且出现了对人的零星感染[3-9]。尤其是2009 /H1N1流感病毒出现以后,它作为流感病毒内部基因的供体,持续地与猪群中早先流行的H1N1、H3N2及H1N2 流感病毒发生新的重组[8,10]。同时,已有研究发现新型重组EA H1N1 SIV存在抗原漂移的现象。这些不断出现的新毒株给疫苗研制及疫情防控带来了新挑战[11-13]。因此,开展流感病毒抗原变异分析,探索其分子基础,将为EA H1N1 SIV的风险评估和有效防控提供重要的科学依据。【前人研究进展】流感病毒依赖于其持续的抗原性变异不断突破宿主界限和逃避宿主的免疫保护,抗原漂移和抗原转变是流感病毒抗原性变异的两种主要方式[14-16]。流感病毒的各个基因中发生持续性变异的是血凝素(hemagglutinin,HA)基因,其次为神经氨酸酶(neuraminidase,NA)基因[17]。前期研究结果发现HA 158位氨基酸的改变能够显著影响EA H1N1 SIV的抗原性[18]。笔者所在实验室前期利用EA H1N1 SIV A/swine/Henan/11/2005(简称HeN11)HA蛋白单克隆抗体(monoclonal antibody,mAb)筛选了两株抗原逃逸株,HeN11-2B6-P5逃逸株在190和230位同时发生氨基酸改变,HeN11-4C7-P8逃逸株在269位发生氨基酸改变。通过对SIV HA 基因系统的序列分析也发现新近分离的EA H1N1 SIV毒株大多数携带HA 190D、230M和269R[13,19]。【本研究切入点】本研究拟借助反向遗传系统(reverse genetics system,RGS)构建单点突变病毒,并制备相关病毒的免疫血清,利用HI试验测定病毒的抗原性,进一步分析决定病毒抗原性变异的关键氨基酸位点,同时测定HA蛋白相关突变位点对病毒生物学特性的影响。【拟解决的关键问题】明确近年来导致我国H1N1 SIV抗原漂移的重要氨基酸突变,确定影响病毒抗原性的关键氨基酸位点。研究结果将有助于加深对流感病毒抗原性变异规律的了解,为流感病毒的监测与防控提供重要依据和参考。
1 材料与方法
试验于2021年5月至2022年7月在中国农业科学院哈尔滨兽医研究所动物疫病防控全国重点实验室完成。
1.1 病毒、抗体、质粒、细胞和实验动物
一株H1N1亚型SIV A/swine/Liaoning/ SY72/2018(简称SY72)为中国农业科学院哈尔滨兽医研究所动物疫病防控全国重点实验室分离、鉴定并保存;两株HeN11 HA蛋白的mAbs(2B6和4C7)为该试验室制备和保存[19];双向表达质粒pHW2000由美国St. Jude儿童医院Richard Webby教授惠赠;MDCK细胞和293T细胞均由中国农业科学院哈尔滨兽医研究所动物疫病防控全国重点实验室保存;9—11日龄无特定病原体(specific pathogen-free,SPF)鸡胚及8周龄SPF鸡均购自哈尔滨兽医研究所实验动物中心,6周龄非免疫猪(经HI试验检测H1和H3亚型SIV抗体阴性)购自哈尔滨市郊农场。
1.2 试剂和试剂盒
TIANamp病毒RNA提取试剂盒、质粒小提试剂盒购自天根生物公司,反转录试剂盒购自Invitrogen 公司;PrimeSTAR® Max DNA 聚合酶购自大连宝生物公司;限制性内切酶BsmBⅠ购自NEB公司;同源重组试剂盒Clon Express® II One Step Cloning Kit购自南京诺唯赞生物公司;Gene color II非EB荧光染料购自北京金博益生物公司;胶回收试剂盒购自OMEGA公司;DNA测序试剂购自Applied Biosystems公司;转染试剂盒LipofectamineTMLTX and Plus Reagent购自Invitrogen公司;培养基Opti-MEM、DMEM购自 Gibco 公司;受体实验一抗为SY72病毒的鸡血清,二抗兔抗鸡IgG-HRP 购自Sigma-Aldrich公司;受体破坏酶(receptor destroying enzyme,RDE)购自日本生物科技株式会社。
1.3 病毒拯救
1.3.1 引物设计 依据毒株 SY72序列及文献[20]分别设计PB2、PB1、PA、HA、NP、NA、M 和 NS 8个基因片段的上、下游扩增引物(引物序列略)。反转录引物为 Uni-12 :5'-AGCRAAAGCAGG-3',均由吉林库美生物科技有限公司合成。
1.3.2 病毒SY72反向遗传系统的建立 重组质粒的构建按照文献[21-22]的方法进行,获得重组质粒后通过测序进行鉴定。依据LipofectamineTMLTX and Plus Reagent说明书进行转染,将8个重组质粒各取250 ng共转染于混合培养的293T细胞和MDCK细胞。转染48 h后,收取细胞培养物经尿囊腔接种于SPF鸡胚增殖病毒。对救获病毒进行全基因组序列测定,与野生型病毒基因序列分别进行比对,确定拯救病毒与亲本病毒的核苷酸序列完全一致。
1.3.3 SY72单点突变病毒的拯救 针对190、230和269等3个差异位点设计相应的点突变引物(表1),以质粒pHW-SY72 HA为模版,通过PCR分别构建含有HA基因190、230和269等3个单点突变的质粒。将制备的HA突变质粒与病毒其他7个基因的重组质粒各取250 ng共转染于混合培养的293T和MDCK细胞。转染48 h后,收取细胞培养物经尿囊腔接种于SPF鸡胚增殖病毒。对救获病毒进行全基因组序列测定,与野生型病毒基因序列分别进行比对,确保所拯救病毒仅HA基因含有目标位点的突变,其他基因片段无突变。将病毒分装、保存于-80℃,用于后续试验。
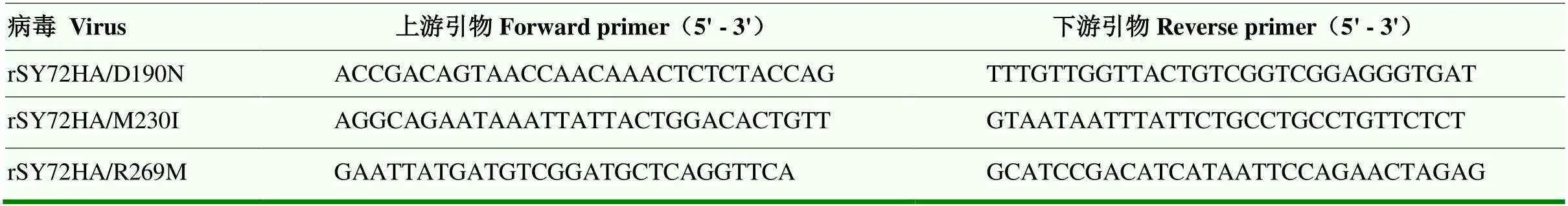
表1 差异位点的点突变引物
1.4 免疫血清的制备
分别将拯救的重组病毒接种10日龄SPF 鸡胚,收获尿囊液,β-丙内酯灭活,佐剂乳化后制备灭活疫苗,接种8周龄SPF鸡,0.3 mL/只,免疫后3周,采血分离血清,用于HI试验,与此同时,将制备的灭活疫苗接种于非免疫猪,2 mL/头,免疫后2周采血分离血清,血清经RDE处理后用于HI检测。
1.5 病毒的复制特性测定
将1.3.3中所述各病毒分别以感染复数(multiplicity of infection,MOI)为0.001的病毒量接种于85%铺满的MDCK细胞板,37℃孵育1 h后,更换为含有1 μg·mL-1的TPCK-胰酶的DMEM培养基,并于感染后12、24、36和48 h收集上清,将所获上清于-80℃保存备用。待所有样品收集完成后,在MDCK细胞中用终点滴定法测定病毒滴度,以平均log10TCID50/mL±标准差表示。
1.6 蚀斑测定
分别将拯救的重组病毒进行10倍倍比稀释后接种于85%铺满的MDCK细胞板,37 ℃孵育1 h后,弃去病毒液,将2×MEM(0.6% BSA, 1 μg·mL-1TPCK-胰酶)与2%低熔点琼脂糖等体积混合后加入细胞孔中,室温放置20 min待琼脂糖完全凝固后,倒置于细胞培养箱中培养72 h,用福尔马林固定细胞,0.1%结晶紫染色观察并计数斑块。
1.7 病毒受体结合特性的测定
1.7.1 病毒蛋白纯化 将1.4中所述增殖灭活后的尿囊液进行蔗糖密度梯度离心。首先8 000 r/min、4 ℃高速离心30 min后取上清。其次将上清30 000 r/min、4 ℃超速离心2 h后弃上清取沉淀并用磷酸缓冲盐溶液(phosphate buffered saline,PBS)溶解。在超速离心管中分别加入20%、40%、60%蔗糖,将上述病毒液缓慢置于顶层。 28 000 r/min、4 ℃超速离心2 h后取40%—60%浓度梯度之间的白色絮状物。最后加入适量PBS进行脱糖,30 000 r/min 、4 ℃超速离心2 h后弃上清取沉淀,将病毒用适量PBS重新悬浮后测定病毒浓度及效价。
1.7.2 病毒受体结合特性检测 将SA α-2,3 Gal和SA α-2,6 Gal两种糖链使用PBS稀释至100 ng,倍比稀释至第10孔包被于96孔板中,置于紫外下交联10 min;弃上清,用300 μL冰上预冷的PBS洗涤4遍。用含0.5% BSA的0.05% PBST(PBS中含0.05% Tween 20)稀释纯化的病毒至HA效价为6 HAU,每孔加入100 μL,4℃包被过夜,弃上清,用冰上预冷的0.5% PBST清洗3遍,再用冰上预冷的PBS清洗1遍。加入4%多聚甲醛灭活NA,之后用PBST 清洗3遍,PBS清洗1遍。按照1﹕600的比例稀释抗rSY72的鸡血清作为一抗,每孔100 μL,37℃孵育1 h;弃上清,PBST清洗3遍,PBS清洗1遍。每孔加入100 μL 1﹕1 000 稀释兔抗鸡 IgG-HRP作为二抗,37℃孵育1 h;PBST清洗3遍,PBS清洗1遍。OPD显色后用0.5 mol·L-1H2SO4终止显色,490 nm读取数值。
1.8 数据统计分析
应用GraphPad Prism 8.0软件对病毒在细胞上的复制滴度及受体结合特性进行统计学分析(Two-way ANOVA法)并作图。<0.05表示统计学差异显著,<0.01表示差异极显著。
2 结果
2.1 病毒SY72 HA蛋白氨基酸序列的分析
将病毒SY72 与HeN11 HA基因的序列进行比对,结果发现两株病毒HA蛋白氨基酸序列共存在16个氨基酸的差异(H3编码),SY72病毒HA蛋白分别携带190D、230M、269R(表2)。
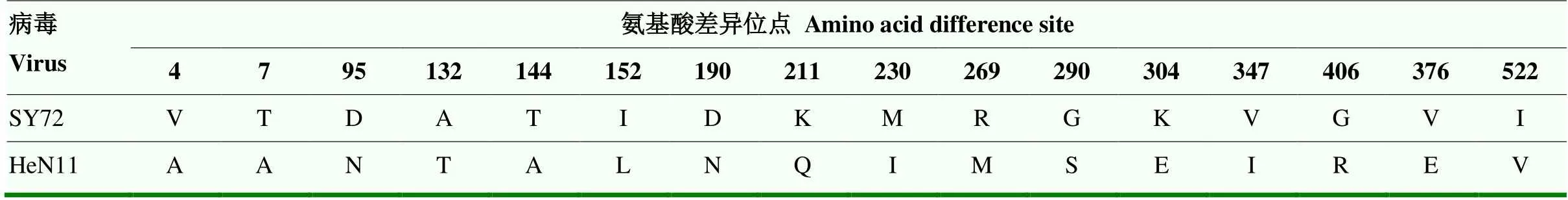
表2 SY72和HeN11病毒 HA 蛋白氨基酸差异位点
2.2 重组病毒的拯救
以SY72病毒为骨架,分别获得了SY72重组病毒和含有其HA基因190、230和269位单点突变的3株重组病毒,分别命名为rSY72、rSY72HA/D190N、rSY72HA/M230I和rSY72HA/R269M。通过复制动力学和蚀斑试验验证了重组病毒rSY72和野生型病毒SY72的部分生物学特性是否一致。结果显示两株病毒在MDCK细胞中保持相同复制特性,形成蚀斑的大小和形态类似,两者部分生物学特性一致(图1)。
2.3 病毒与mAbs和多克隆血清的反应性
中和试验结果发现两株mAbs对rSY72病毒均不具有中和活性。为进一步确定导致病毒抗原性发生变化的关键氨基酸位点,测定了3株单点突变病毒与mAbs的反应性。结果rSY72HA/D190N病毒与2B6的反应性明显提高,中和效价为320;rSY72HA/ R269M病毒与4C7的反应性也有所提升,中和效价为160;rSY72HA/M230I病毒也获得了一定的反应性。
以rSY72病毒和3株单点突变重组病毒为抗原,利用rSY72病毒制备的鸡血清和RDE处理后的猪血清进行HI试验。结果显示亲本病毒rSY72与血清的HI效价均较高,分别为512、2 560;rSY72HA/D190N病毒与血清进行反应,HI效价分别为128、320,而rSY72HA/M230I病毒和rSY72HA/ R269M病毒与血清进行反应,鸡血清的HI效价分别为256和512,猪血清HI效价均为2 560(表3)。
表3 利用两株mAbs和rSY72的多克隆血清检测氨基酸突变对病毒抗原变异的影响
*NT, 未检测 Not tested
2.4 突变氨基酸对病毒复制特性的影响
测定rSY72病毒和3株单点突变重组病毒(rSY72HA/D190N、rSY72HA/M230I和rSY72HA/ R269M)在MDCK细胞中的复制能力。结果发现,与rSY72病毒相比,rSY72HA/R269M病毒在感染MDCK细胞后的36和48 h复制滴度均有所下降(<0.01、<0.05),190和230位点的氨基酸改变并未对病毒在各检测时间点的复制滴度产生明显影响(图2)。
2.5 蚀斑测定
对rSY72病毒和3株单点突变重组病毒(rSY72HA/ D190N、rSY72HA/M230I和rSY72HA/R269M)进行蚀斑试验,测定病毒在MDCK细胞中形成蚀斑的能力。结果与rSY72病毒相比,rSY72HA/D190N病毒形成的蚀斑明显减小且蚀斑空洞不明显,rSY72HA/ M230I和rSY72HA/R269M病毒形成的蚀斑经观察未见明显变化(图3)。
*: P<0.05; **: P<0.01
2.6 受体结合特性的分析
通过测定rSY72病毒和3株单点突变重组病毒(rSY72HA/D190N、rSY72HA/M230I和rSY72HA/ R269M)的受体结合特性,确定氨基酸改变是否对结合特性产生影响。结果3株单点突变重组病毒与rSY72保持相同的受体结合特性,同时具有对禽型受体SA α-2,3 Gal和人型受体SA α-2,6 Gal的结合(图4)。
3 讨论
3.1 HA蛋白190位氨基酸是决定病毒抗原性的关键位点
在本研究团队前期的研究中,我们利用mAb筛选抗原逃逸株的方法获得了两株逃逸株HeN11-2B6-P5和HeN11-4C7-P8,其HA蛋白190、230和269位氨基酸发生了改变。为了进一步确定导致抗原性变异的关键氨基酸位点及抗原逃逸发生的机制,本研究选取病毒SY72作为模式毒株通过反向遗传技术拯救了rSY72重组病毒和3株单点突变重组病毒,在保证rSY72与亲本病毒SY72 具有相同生物学特性的前提下进行了后续试验。

A:rSY72;B:rSY72HA/D190N;C:rSY72HA/M230I;D:rSY72HA/R269M
利用中和试验和HI试验分析病毒的抗原性变化,中和试验结果表明rSY72病毒与两株mAbs均不具有中和活性,但rSY72HA/D190N病毒与2B6的中和反应性较rSY72增强;HI试验结果表明,rSY72HA/D190N病毒与rSY72病毒制备的鸡血清和猪血清的反应性减弱,HI抗体效价分别出现4倍和8倍的差异。因此rSY72HA/D190N病毒与rSY72病毒具有较大抗原差异,表明190位氨基酸突变对抗原性变异影响较大。
3.2 HA蛋白上突变位点对病毒生物学特性的影响不同
流感病毒的抗原漂移常产生伴随效应,导致部分生物学特性发生改变[23]。为验证3个氨基酸改变是否影响抗原表位的部分生物学特性,测定重组病毒在MDCK细胞上的复制能力、蚀斑形态大小和受体结合特性。结果表明rSY72HA/D190N病毒形成的蚀斑明显减小,因此该位点的改变会使病毒对细胞的毒力产生变化。rSY72HA/R269M病毒在感染该细胞后的36和48 h的复制能力降低,表明其体外复制能力在MDCK细胞的不同感染阶段可能减弱。据报道,受体结合位点区域的各种氨基酸突变会影响HA对唾液酸受体的亲和力,受体亲和力的改变也可能是HA发生抗原性变异的重要原因[24-26]。其中190位点在1918/H1N1、禽H1N1和2009/H1N1病毒的受体结合特性中发挥重要作用[27-30]。在本研究中,我们通过对rSY72及其3株单点突变病毒的受体结合特性测定,发现HA蛋白190、230和269位点氨基酸的改变均没有对病毒的受体结合特性产生影响。
图4 病毒的受体结合特性
3.3 抗原性差异分析具有重要公共卫生学意义
由于EA H1N1 SIV可在猪群体内广泛存在和持续零星的感染人类,又因流感病毒通过改变其HA头部结构域的氨基酸残基,不断逃逸抗体的中和作用,从而诱导抗原漂移[31-34]。因此对HA蛋白的氨基酸突变进行密切监测是必要的,从而预测具有流行潜力的抗原变异位点,保障公共安全。
4 结论
进一步确定了EA H1N1 SIV HA蛋白所发生的3个氨基酸的变异中190位氨基酸的改变对抗原性影响最大,并影响病毒形成蚀斑的能力。269位氨基酸的改变使得病毒在MDCK细胞上的复制滴度有所下降。3个变异位点均未改变病毒的受体结合特性。这也提示在密切关注这些氨基酸位点的变异情况可以更好地防控监测动物流感甚至人流感的大流行。
[1] ITO T, COUCEIRO J N, KELM S, BAUM L G, KRAUSS S, CASTRUCCI M R, DONATELLI I, KIDA H, PAULSON J C, WEBSTER R G, KAWAOKA Y. Molecular basis for the generation in pigs of influenza A viruses with pandemic potential. Journal of Virology, 1998, 72(9): 7367-7373.
[2] MA W J, KAHN R E, RICHT J A. The pig as a mixing vessel for influenza viruses: human and veterinary implications. Journal of Molecular and Genetic Medicine, 2008, 3(1): 158-166.
[3] YANG H L, QIAO C L, TANG X, CHEN Y, XIN X G, CHEN H L. Human infection from avian-like influenza A (H1N1) viruses in pigs, China. Emerging Infectious Diseases, 2012, 18(7): 1144-1146.
[4] WANG D Y, QI S X, LI X Y, GUO J F, TAN M J, HAN G Y, LIU Y F, LAN Y, YANG L, HUANG W J, CHENG Y H, ZHAO X, BAI T, WANG Z, WEI H J, XIAO N, SHU Y L. Human infection with Eurasian avian-like influenza a (H1N1) virus, China. Emerging Infectious Diseases, 2013, 19(10): 1709-1711.
[5] ZHU W F, ZHANG H, XIANG X Y, ZHONG L L, YANG L, GUO J F, XIE Y R, LI F C, DENG Z H, FENG H, HUANG Y W, HU S X, XU X, ZOU X H, LI X D, BAI T, CHEN Y K, LI Z, LI J H, SHU Y L. Reassortant Eurasian avian-like influenza a (H1N1) virus from a severely ill child, Hunan Province, China, 2015. Emerging Infectious Diseases, 2016, 22(11): 1930-1936.
[6] LI X Y, GUO L R, LIU C X, CHENG Y H, KONG M, YANG L, ZHUANG Z C, LIU J, ZOU M, DONG X C, SU X, GU Q. Human infection with a novel reassortant Eurasian-avian lineage swine H1N1 virus in Northern China. Emerging Microbes & Infections, 2019, 8(1): 1535-1545.
[7] ZELL R, GROTH M, KRUMBHOLZ A, LANGE J, PHILIPPS A, DÜRRWALD R. Cocirculation of swine H1N1 influenza A virus lineages in Germany. Viruses, 2020, 12(7): 762.
[8] ANDERSON T K, CHANG J, ARENDSEE Z W, VENKATESH D, SOUZA C K, KIMBLE J B, LEWIS N S, DAVIS C T, VINCENT A L. Swine influenza A viruses and the tangled relationship with humans. Cold Spring Harbor Perspectives in Medicine, 2021, 11(3): a038737.
[9] PARYS A, VANDOORN E, KING J, GRAAF A, POHLMANN A, BEER M, HARDER T, VAN REETH K. Human infection with Eurasian avian-like swine influenza a (H1N1) virus, the Netherlands, September 2019. Emerging Infectious Diseases, 2021, 27(3): 939-943.
[10] QIAO C L, LIU L P, YANG H L, CHEN Y, XU H Y, CHEN H L. Novel triple reassortant H1N2 influenza viruses bearing six internal genes of the pandemic 2009/H1N1 influenza virus were detected in pigs in China. Journal of Clinical Virology, 2014, 61(4): 529-534.
[11] DE JONG J C, PACCAUD M F, DE RONDE-VERLOOP F M, HUFFELS N H, VERWEI C, WEIJERS T F, BANGMA P J, VAN KREGTEN E, KERCKHAERT J A M, WICKI F, WUNDERLI W. Isolation of swine-like influenza a(H1N1) viruses from man in Switzerland and The Netherlands. Annales De L’Institut Pasteur / Virologie, 1988, 139: 429-437.
[12] YANG H L, CHEN Y, QIAO C L, HE X J, ZHOU H, SUN Y, YIN H, MENG S S, LIU L P, ZHANG Q Y, KONG H H, GU C Y, LI C J, BU Z G, KAWAOKA Y, CHEN H L. Prevalence, genetics, and transmissibility in ferrets of Eurasian avian-like H1N1 swine influenza viruses. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(2): 392-397.
[13] XU C Z, ZHANG N X, YANG Y Y, LIANG W H, ZHANG Y P, WANG J F, SUZUKI Y, WU Y P, CHEN Y, YANG H L, QIAO C L, CHEN H L. Immune escape adaptive mutations in hemagglutinin are responsible for the antigenic drift of Eurasian avian-like H1N1 swine influenza viruses. Journal of Virology, 2022, 96(16): e0097122.
[14] WEBSTER R G, LAVER W G, AIR G M, SCHILD G C. Molecular mechanisms of variation in influenza viruses. Nature, 1982, 296(5853): 115-121.
[15] NELSON M I, HOLMES E C. The evolution of epidemic influenza. Nature Reviews Genetics, 2007, 8(3): 196-205.
[16] WU N C, WILSON I A. Influenza hemagglutinin structures and antibody recognition. Cold Spring Harbor Perspectives in Medicine, 2020, 10(8): a038778.
[17] SHIMIZU K. Mechanisms of antigenic variation in influenza virus. Nihon Rinsho, 2000, 58(11): 2199-2205.
[18] WANG Z, CHEN Y, CHEN H Y, MENG F, TAO S Y, MA S J, QIAO C L, CHEN H L, YANG H L. A single amino acid at position 158 in haemagglutinin affects the antigenic property of Eurasian avian-like H1N1 swine influenza viruses. Transboundary and Emerging Diseases, 2022, 69(4): e236-e243.
[19] 梁文花, 贾云慧, 许程志, 吴运谱, 陈艳, 杨焕良, 乔传玲, 陈化兰.两株H1N1亚型猪流感病毒HA蛋白中和性单克隆抗体的制备及抗病毒活性研究. 畜牧兽医学报, 2018, 49(7): 1460-1466.
LIANG W H, JIA Y H, XU C Z, WU Y P, CHEN Y, YANG H L, QIAO C L, CHEN H L. Preparation and antiviral activity of two neutralizing monoclonal antibodies against HA protein of H1N1 swine influenza virus. Chinese Journal of Animal and Veterinary Sciences, 2018, 49(7): 1460-1466. (in Chinese)
[20] HOFFMANN E, STECH J, GUAN Y, WEBSTER R G, PEREZ D R. Universal primer set for the full-length amplification of all influenza A viruses. Archives of Virology, 2001, 146(12): 2275-2289.
[21] XU C Z, XU B F, WU Y P, YANG S M, JIA Y H, LIANG W H, YANG D W, HE L K, ZHU W F, CHEN Y, YANG H L, YU B L, WANG D Y, QIAO C L. A single amino acid at position 431 of the PB2 protein determines the virulence of H1N1 swine influenza viruses in mice. Journal of Virology, 2020, 94(8): e01930-19.
[22] 杨时鳗, 许程志, 许榜丰, 吴运谱, 贾云慧, 乔传玲, 陈化兰. H1N1亚型猪流感病毒HA蛋白225位氨基酸对病毒致病性的影响. 中国农业科学, 2022, 55(4): 816-824. doi:10.3864/j.issn.0578-1752. 2022.04.016.
YANG S M, XU C Z, XU B F, WU Y P, JIA Y H, QIAO C L, CHEN H L. Amino acid of 225 in the HA protein affects the pathogenicities of H1N1 subtype swine influenza viruses. Scientia Agricultura Sinica, 2022, 55(4): 816-824. doi:10.3864/j.issn.0578-1752.2022.04.016. (in Chinese)
[23] RUDNEVA I, IGNATIEVA A, TIMOFEEVA T, SHILOV A, KUSHCH A, MASALOVA O, KLIMOVA R, BOVIN N, MOCHALOVA L, KAVERIN N. Escape mutants of pandemic influenza A/H1N1 2009 virus: variations in antigenic specificity and receptor affinity of the hemagglutinin. Virus Research, 2012, 166(1/2): 61-67.
[24] DANIELS P S, JEFFRIES S, YATES P, SCHILD G C, ROGERS G N, PAULSON J C, WHARTON S A, DOUGLAS A R, SKEHEL J J, WILEY D C. The receptor-binding and membrane-fusion properties of influenza virus variants selected using anti-haemagglutinin monoclonal antibodies. The EMBO Journal, 1987, 6(5): 1459-1465.
[25] FLEURY D, WHARTON S A, SKEHEL J J, KNOSSOW M, BIZEBARD T. Antigen distortion allows influenza virus to escape neutralization. Nature Structural Biology, 1998, 5(2): 119-123.
[26] VACHIERI S G, XIONG X L, COLLINS P J, WALKER P A, MARTIN S R, HAIRE L F, ZHANG Y, MCCAULEY J W, GAMBLIN S J, SKEHEL J J. Receptor binding by H10 influenza viruses. Nature, 2014, 511(7510): 475-477.
[27] GLASER L, STEVENS J, ZAMARIN D, WILSON I A, GARCÍA- SASTRE A, TUMPEY T M, BASLER C F, TAUBENBERGER J K, PALESE P. A single amino acid substitution in 1918 influenza virus hemagglutinin changes receptor binding specificity. Journal of Virology, 2005, 79(17): 11533-11536.
[28] TUMPEY T M, MAINES T R, VAN HOEVEN N, GLASER L, SOLÓRZANO A, PAPPAS C, COX N J, SWAYNE D E, PALESE P, KATZ J M, GARCÍA-SASTRE A. A two-amino acid change in the hemagglutinin of the 1918 influenza virus abolishes transmission. Science, 2007, 315(5812): 655-659.
[29] AYORA-TALAVERA G, CETINA-MONTEJO L, MATOS-PATRÓN A, ROMERO-BELTRÁN L. Hemagglutinin variants of influenza a (H1N1)pdm09 virus with reduced affinity for sialic acid receptors. Archives of Virology, 2014, 159(5): 1207-1211.
[30] TENG Q Y, XU D W, SHEN W X, LIU Q F, RONG G Y, LI X S, YAN L P, YANG J M, CHEN H J, YU H, MA W J, LI Z J. A single mutation at position 190 in hemagglutinin enhances binding affinity for human type sialic acid receptor and replication of H9N2 avian influenza virus in mice. Journal of Virology, 2016, 90(21): 9806-9825.
[31] LEWIS N S, DALY J M, RUSSELL C A, HORTON D L, SKEPNER E, BRYANT N A, BURKE D F, RASH A S, WOOD J L N, CHAMBERS T M, FOUCHIER R A M, MUMFORD J A, ELTON D M, SMITH D J. Antigenic and genetic evolution of equine influenza A (H3N8) virus from 1968 to 2007. Journal of Virology, 2011, 85(23): 12742-12749.
[32] KOEL B F, BURKE D F, BESTEBROER T M, VAN DER VLIET S, ZONDAG G C M, VERVAET G, SKEPNER E, LEWIS N S, SPRONKEN M I J, RUSSELL C A, EROPKIN M Y, HURT A C, BARR I G, DE JONG J C, RIMMELZWAAN G F, OSTERHAUS A D M E, FOUCHIER R A M, SMITH D J. Substitutions near the receptor binding site determine major antigenic change during influenza virus evolution. Science, 2013, 342(6161): 976-979.
[33] KOEL B F, VAN DER VLIET S, BURKE D F, BESTEBROER T M, BHAROTO E E, HERLIANA I, LAKSONO B M, XU K M, SKEPNER E, RUSSELL C A, RIMMELZWAAN G F, PEREZ D R, OSTERHAUS A D M E, SMITH D J, PRAJITNO T Y, FOUCHIER R A M. Antigenic variation of clade 2.1 H5N1 virus is determined by a few amino acid substitutions immediately adjacent to the receptor binding site. mBio, 2014, 5(3): e01070-14.
[34] 安艺萌, 周旭, 王佑春, 黄维金. 流感病毒抗原性进化及对流感疫苗研发的启示. 中华预防医学杂志, 2021, 55(11): 1339-1345.
AN Y M, ZHOU X, WANG Y C, HUANG W J. Antigenic evolution of influenza virus and the implications for influenza vaccine development. Chinese Journal of Preventive Medicine, 2021, 55(11): 1339-1345. (in Chinese)
Identification of Key Amino Acids in the Antigenic Variation of Eurasian Avian-Like H1N1 Swine Influenza Viruses
ZHANG NaiXin, XU ChengZhi, YANG YuYing, ZHANG YaPing, WAN Yunfei, QIAO ChuanLing, CHEN HuaLan
Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences/State Key Laboratory of Animal Disease Control and Prevention, Harbin 150069
【Background】The antigenicity of influenza virus is mainly determined by the hemagglutinin (HA), a surface glycoprotein of the virus. Our previous study indicated that amino acid changes at positions 190, 230 and 269 (H3 numbering) of HA protein resulted in antigenic escape by using the monoclonal antibody (mAb) against the HA protein of Eurasian avian-like H1N1 swine influenza virus (EA H1N1 SIV). These three amino acid substitutions widely existed in the HA protein of the recentlyisolated EA H1N1 SIVs. 【Objective】This study aimed to explore which amino acids played a key role in the antigenicity of the virus, and further provide scientific basis for the control of influenza. 【Method】In this study, A/swine /Liaoning /SY72/2018 (H1N1) (SY72) was selected as the model virus, and its reverse genetic system (RGS) was established. Then, using SY72 virus as backbone, three reassortant viruses were rescued by introducing the respective single amino acid mutation at position 190, 230, and 269 into HA protein. Antisera were raised by inoculating the rSY72-inactivated vaccine into specific-pathogen-free (SPF) chickens and non-immunized pigs. The effects of each of these substitutions on viral antigenicity were determined by measuring the neutralization and hemagglutination inhibition (HI) titers with mAbs and polyclonal sera raised against the rSY72 virus. Then their effects on viral replication capacities and receptor binding properties were further evaluated. 【Result】Sequence analysis showed that the HA of SY72 virus carried 190D, 230M, and 269R, respectively. The viruses, including rSY72, rSY72HA/D190N, rSY72HA/M230I, and rSY72HA/R269M, were rescued by RGS. The results of neutralization test showed that all the three mutant viruses could react with two mAbs, to some extent, compared with the rSY72 virus. The HI results indicated that the HI antibody titers of the rSY72HA/D190N reacted with the rSY72–immunized chicken and pig sera were 4- and 8-fold lower than those of the rSY72 virus with the respective sera. However, the rSY72HA/M230I and rSY72HA/R269M virus reacted well with these two sera. The results indicated that residue 190 in the HA had the important effects on the viral antigenicity. Results of the viral plaque assay and growth curve experiments demonstrated that plaque sizes generated by the rSY72HA/D190N virus were smaller than those by the rSY72 virus in MDCK cells. The replication ability of the rSY72HA/R269M virus was significantly decreased in MDCK cells, compared with that of the rSY72 virus. Furthermore, the three amino acid mutations had no impact on the viral receptor-binding preference. 【Conclusion】 The amino acid at position 190 of HA protein played an important role in determining the antigenicity of EA H1N1 SIV. The mutation of amino acid at position 269 reduced the viral replication ability in MDCK cells. These results suggested that more attentions should be paid for monitoring these residue changes in the influenza surveillance, so as to improve early warning of influenza in animals.
swine influenza virus; HA protein; antigenicity

10.3864/j.issn.0578-1752.2023.14.016
2022-12-06;
2023-02-13
国家自然科学基金面上项目(31872472)
张乃心,Tel:0451-51051684;E-mail:1246665754@qq.com。通信作者乔传玲,Tel:0451-51051686;E-mail:qiaochuanling@caas.cn
(责任编辑 林鉴非)
