过表达拟南芥NPR1增强黄瓜对枯萎病和白粉病的抗性
2023-08-15冯向君王宏宇于静池春玉丁国华
冯向君,王宏宇,于静,池春玉,丁国华
过表达拟南芥增强黄瓜对枯萎病和白粉病的抗性
冯向君,王宏宇,于静,池春玉,丁国华
哈尔滨师范大学生命科学与技术学院,哈尔滨 150025
【背景】黄瓜易感多种病害,特别是枯萎病和白粉病,化学药物防治虽然有效但因残留高和不易降解而被限制使用,培育广谱、持久抗病的黄瓜品种是解决这一难题的根本策略。病程相关基因非表达子1(nonexpressor of pathogenesis- related genes 1,NPR1)是系统获得性抗性(systemic acquired resistance,SAR)中的关键调控因子,参与调控多种防御相关基因的表达,影响植物的抗病能力。【目的】在黄瓜中过表达,探究转基因黄瓜对枯萎病和白粉病的抗性,为培育抗病能力更强、更持久的黄瓜品种提供试验依据。【方法】通过克隆拟南芥,构建过表达载体,利用农杆菌介导法转化黄瓜,获得过表达的转基因黄瓜植株,利用实时荧光定量PCR方法测定转基因植株中相关防御基因的表达量。选择T0代转基因植株进行枯萎病的抗性鉴定,T1代转基因植株进行白粉病的抗性鉴定,测定转基因植株接种枯萎病菌(f. sp.)和白粉病菌()后,超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)等抗氧化酶活性变化及丙二醛(malondialdehyde,MDA)、活性氧(reactive oxygen species,ROS)含量的变化。【结果】成功获得8株T0代转基因植株,OE#4和OE#5为高表达植株,OE#3为低表达植株;通过对转基因植株中相关防御基因的表达量分析发现,过表达的转基因植株中多个相关防御基因表现更强、更快的表达,并且防御基因的表达量与在转基因植株中的表达量呈正相关。其中,、和的表达量上调极为显著。转基因植株的抗病性鉴定结果表明,在枯萎病和白粉病的胁迫下,转基因植株表现出更显著的抗性,发病缓慢、症状轻微,病斑面积显著低于野生型(WT)植株。转基因T0代植株OE#4和OE#5在接种枯萎病菌3 d后未出现明显病斑,接种7 d后出现灰褐色病斑,但未呈现萎蔫等状态;WT植株在接种3 d时出现灰褐色病斑并且轻微萎蔫,7 d时叶片出现严重萎蔫。接种白粉病菌7 d后,T1代植株OE#2和OE#7和WT植株均出现病斑,但OE#2和OE#7植株病斑面积显著低于WT植株;接种15 d后WT植株出现叶片黄化失绿,而转基因植株OE#2和OE#7病情较轻。与WT植株相比,接种病原菌后,转基因植株中MDA含量较低,SOD、POD、CAT活性保持较高水平,ROS含量累积较少。【结论】黄瓜中过表达可以提高黄瓜对枯萎病和白粉病的抗性。
黄瓜;;枯萎病;白粉病;抗病性
0 引言
【研究意义】黄瓜()是重要的蔬菜作物,其产量水平已跃居全球第四大蔬菜作物[1]。随着种植技术及方式的提升,黄瓜的产量不断增加,但在北方温室内极易滋生白粉病菌,使黄瓜叶片褪绿,严重时可导致叶片完全枯死,造成黄瓜减产或绝收[2]。此外,枯萎病也是黄瓜生产中主要的真菌病害,同样会导致黄瓜减产甚至绝收[3]。目前,针对白粉病和枯萎病的防治策略主要集中在化学防治和生物防治等方面[4-5],但化学农药的使用容易产生抗药性使防治效果逐渐降低,并且会引起环境和安全问题;近年来,利用有益、高效的生防细菌来防治黄瓜病害更加绿色环保,但生物防治见效慢且不具有长效性,在生产上应用于黄瓜病害防治的高效生防菌株比较有限[6-7]。因此,培育抗病品种是比较经济有效的防治黄瓜白粉病、枯萎病等病害的策略。【前人研究进展】植物为了抵御病原菌会诱导一系列防御机制。其中,系统获得性抗性(systemic acquired resistance,SAR)是一种依赖于水杨酸(SA)的防御反应,SAR的发生伴随着SA含量的增加和大量抗病相关基因(pathogenesis-related gene,)在局部和全身组织中的表达增加,从而增强植物的抵抗力[8],为植物提供更加长久有效的保护机制。病程相关基因非表达子1(nonexpressor of pathogenesis-related genes 1,NPR1)是依赖SA的SAR途径中的关键调控因子,其下游所调控的基因主要是与抗病相关的防御基因[9]。Cao等[10]在SA缺陷的拟南芥()突变体中发现,基因功能缺陷的拟南芥植株的表达受损,几乎不能建立起有效的SAR,表明拟南芥是SA诱导的表达和抵抗病原体所必需的。正常状态下,NPR1以寡聚体的形式存在于细胞质中[11]。病原体感染后,宿主植物迅速积累SA诱导产生大量抗氧化剂,进而诱导NPR1寡聚体解体为单体化,NPR1单体进入细胞核与TGA(TGACG motif-binding factor)转录因子相互作用,然后激活下游靶基因如的表达[12]。在拟南芥中组成型表达,转基因拟南芥对霜霉病菌和丁香假单胞菌的抗性增强,PR蛋白的表达量也有所提高[13]。随后,拟南芥陆续被转入多种植物中,在多种植物中过表达与植物的抗病性呈现直接相关[14]。转的小麦对镰孢菌头枯病抗性显著增强与真菌攻击时防御反应的更快激活有关[15];转基因油菜表现出对丁香假单胞菌的抗性[16];转基因胡萝卜对核盘霉等病菌的抗性均明显提高[17]。目前已从多种植物中分离到了及同源基因,并证实了这些植物中及其同源基因的作用。葡萄中超表达能够增强对白粉病的抗性,诱导PR蛋白的积累[18];谷子中在抵御禾生指梗霉侵染方面发挥重要作用[19];猕猴桃中在猕猴桃抗病胁迫方面具有积极作用[20];此外,南瓜中克隆到同源基因,该基因与美洲南瓜中同源基因亲缘关系较近,但研究发现该同源基因对南瓜雌花尤其是雌蕊的发育具有重要作用[21]。【本研究切入点】关于黄瓜及其同源基因的研究较少,目前黄瓜未见公开报道。本实验室对黄瓜及其同源基因进行全基因组鉴定,未发现,但鉴定到了3条同源基因、和,同源性分析发现,和与和的同源性最高,与和的同源关系最近。鉴于调控SAR的重要作用,拟将拟南芥转入黄瓜,验证过表达的黄瓜植株对枯萎病和白粉病的抗性。【拟解决的关键问题】明确黄瓜中过表达对枯萎病和白粉病的诱导抗性,探究对黄瓜枯萎病和白粉病的诱导抗性机理,为有效利用该抗病材料,培育黄瓜复合抗病新品种提供理论依据。
1 材料与方法
试验于2021年3月至2023年1月在哈尔滨师范大学生命科学与技术学院植物生物学省高校重点实验室完成。
1.1 材料
野生型拟南芥种子为本实验室保存,黄瓜品种采用‘长春密刺’,黄瓜枯萎病菌种H46-5为尖孢镰孢菌黄瓜专化型(f. sp.),由东北农业大学张艳菊教授提供。白粉病孢子采集于哈尔滨师范大学试验田,鉴定为二孢型白粉病菌()。
1.2 仪器与试剂
低温高速离心机、PCR仪(eppendorf);高温灭菌锅(致微仪器有限公司);电热恒温培养箱(上海一恒科技有限公司);超净工作台、紫外分光光度计、MS培养基、特美汀;植物总RNA提取试剂盒、植物DNA提取试剂盒(康为世纪公司)等。
1.3 表达载体的构建与黄瓜转化
根据NCBI中的CDS序列设计全长扩增引物5′CGGGATCCATGGACACCACCATTGATGGA TTCG3′和5′CGAGCTCTCACCGACGACGATGAGA GAGTTTA3′,内含H I和I酶切位点,以野生型拟南芥总RNA反转录cDNA为模板,PCR扩增获得。测序验证序列后,H I和I酶切与pBI121质粒连接,构建CaMV 35S启动的表达载体,冻融法转入根癌农杆菌LBA4404。农杆菌侵染发芽培养基上生长5—6 d的‘长春密刺’黄瓜子叶节,培养基加卡那霉素进行筛选培养,15 d后转入伸长培养基培养,待再生植株生长至2—3 cm高后转入生根培养基培养至根系粗壮时,驯化培养。
1.4 转NPR1植株的PCR鉴定及PR表达量测定
提取转化植株幼叶基因组DNA,使用扩增引物进行PCR扩增鉴定。PCR反应程序:预变性94 ℃,5 min;变性94 ℃,30 s;退火62 ℃,30 s;延伸72 ℃,2 min;重复35个循环后,4 ℃保存。提取待测植株总RNA,反转录合成cDNA,实时荧光定量PCR(qRT-PCR)测定、抗病相关基因、、、防御相关基因、、、及NPR1下游因子靶基因的表达量,上述基因的荧光定量PCR引物见表1。
1.5 枯萎病抗性鉴定
在PDA平板上继代培养3次,挑取白色菌丝在PDB培养基中振荡培养5—7 d后,用灭菌纱布过滤菌丝,将过滤后的菌液4 ℃,3 000 r/min,离心15 min,弃去上清液;PDB液体培养基重悬菌体沉淀后,用血细胞计数板测定菌液浓度为1×106个孢子/mL即可。接种方法参考刘缙等[22]苗期人工接种方法,后进行了改良采用点滴法,将菌液滴于T0代转基因植株和WT植株叶片上,进行苗期人工接种。观察T0代转基因植株和WT植株接种枯萎病菌后发病情况,病情严重程度参考周红梅等[23]方法。分别取发病初期3 d和发病后期7 d时的叶片,利用Image J软件测定转基因植株和WT植株的病斑面积[24]。以WT植株为对照,测定转基因植株接种枯萎病菌前后不同时间转基因植株叶片内MDA含量、SOD、POD、CAT活性,测定方法详见李小方等[25];摘取WT植株和转基因植株发病3和7 d时的叶片进行NBT和DAB染色,分析转基因植株染病后叶片内超氧阴离子(O2-)和过氧化氢(H2O2)的变化,上述试验均进行3次生物学重复。

表1 下游相关基因的qPCR引物
1.6 白粉病抗性鉴定
用干毛笔扫去病叶上的白粉病孢子于含有无菌水的培养皿中,用10 μg·mL-1的SDS溶液配制成孢子数量为1×106个/mL的孢子悬浮液,使用喷雾接种法接种于T1代转基因植株和WT植株叶片上[26]。在相同条件下培养,观察T1代转基因植株和WT植株接种白粉病菌后叶片的症状,病情鉴定参照病情分级标准[27]。取T1代转基因植株和WT植株发病7和15 d时的叶片,使用Image J软件测定T1代转基因植株和WT植株的病斑面积,鉴定T1代转基因植株对白粉病的抗性。以WT植株为对照,测定T1代转基因植株接种白粉病菌前后不同时间叶片内相关生理指标,方法同上所述。
1.7 数据处理与分析
qPCR分析基因表达量中以进行标准化,数据均为具有标准差的3个生物重复的平均值,采用2-ΔΔCt法分析。采用excel软件对数据进行处理,Graphad Prism软件对数据进行显著性分析。
2 结果
2.1 转基因黄瓜植株的培育及鉴定
为了在黄瓜中表达拟南芥,构建了一个重组质粒,由CaMV 35S启动子驱动(图1-A);通过农杆菌介导的转化方法将重组质粒转化至黄瓜中,共得到10棵转化植株,提取转化植株叶片的DNA,以的特异性引物进行PCR检测,其中8个单株中检测到(1 782 bp),与阳性对照一致,共获得8株转基因阳性植株(图1-B);以WT植株为对照,随机选取3株转基因阳性植株OE#3、OE#4和OE#5,利用qRT-PCR检测转基因植株叶片内目的基因的表达量,其中OE#4和OE#5植株中目的基因的表达量显著高于WT植株,分别达到24和63倍,被认为具有相对较高的表达水平;而OE#3株系植株中目的基因的表达量低,仅为1.7倍,与WT植株相比无显著差异(图1-C)。OE#4和OE#5两个植株的亲本自交获得的T1代植株可用于后续抗病性研究。
2.2 AtNPR1过表达提高了转基因植株NPR1下游基因的表达
选择OE#3、OE#4和OE#5转基因植株作为代表,qRT-PCR详细评估了防御相关基因的表达量(图2)。病程相关基因被诱导表达,在OE#4和OE#5转基因植株中观察到的表达量显著上调。在OE#4和OE#5转基因植株中观察到表达量的显著提高,是WT植株中表达量的13和18倍。与对照相比,在转基因植株OE#4和OE#5中的表达量极显著上调,达到5和23倍。在转基因植株OE#5中的表达量显著上升,达到5.7倍;作为JA介导的植物抗病信号通路的关键基因,在转基因植株中的表达量降低。清除活性氧相关基因在OE#4和OE#5中的表达量分别达到3.9和5倍;在OE#5中的表达量达到7.8倍。结果表明,上述防御相关基因在各转基因植株中表达水平不同。在转基因植株OE#4和OE#5中,的过表达导致下游防御相关基因表达水平的显著提高;然而在OE#3中没有观察到这些防御相关基因与表达的相关性。并且,在高表达水平转基因植株(OE#4和OE#5)中,转基因表达水平的提高会诱导防御相关基因表达水平更显著上调,的表达水平与防御相关基因表达水平呈正相关。

A:AtNPR1表达载体结构示意图The structure of AtNPR1 expression vector。B:转化植株的PCR鉴定PCR identification of transformed plants。M:DNA Marker 2000;1:模板为水the template is water;2:模板为pBI121:AtNPR1 the template is pBI121: AtNPR1;3:模板为非转化植株DNA non-transgenic cucumber materials;4—13:模板为转化植株DNA Transgenic plants。C:转基因植株中AtNPR1表达量分析Analysis of AtNPR1 expression in transgenic plants。WT:野生型wild type;OE#3、OE#4、OE#5:转基因植株transgenic lines;*:与WT的显著性Significance with WT;:组内差异显著性分析intra-group difference significance analysis;*:p<0.05,**:p<0.01,***:p<0.001,****:p<0.0001。下同The same as below
2.3 转基因植株对枯萎病的抗性增强
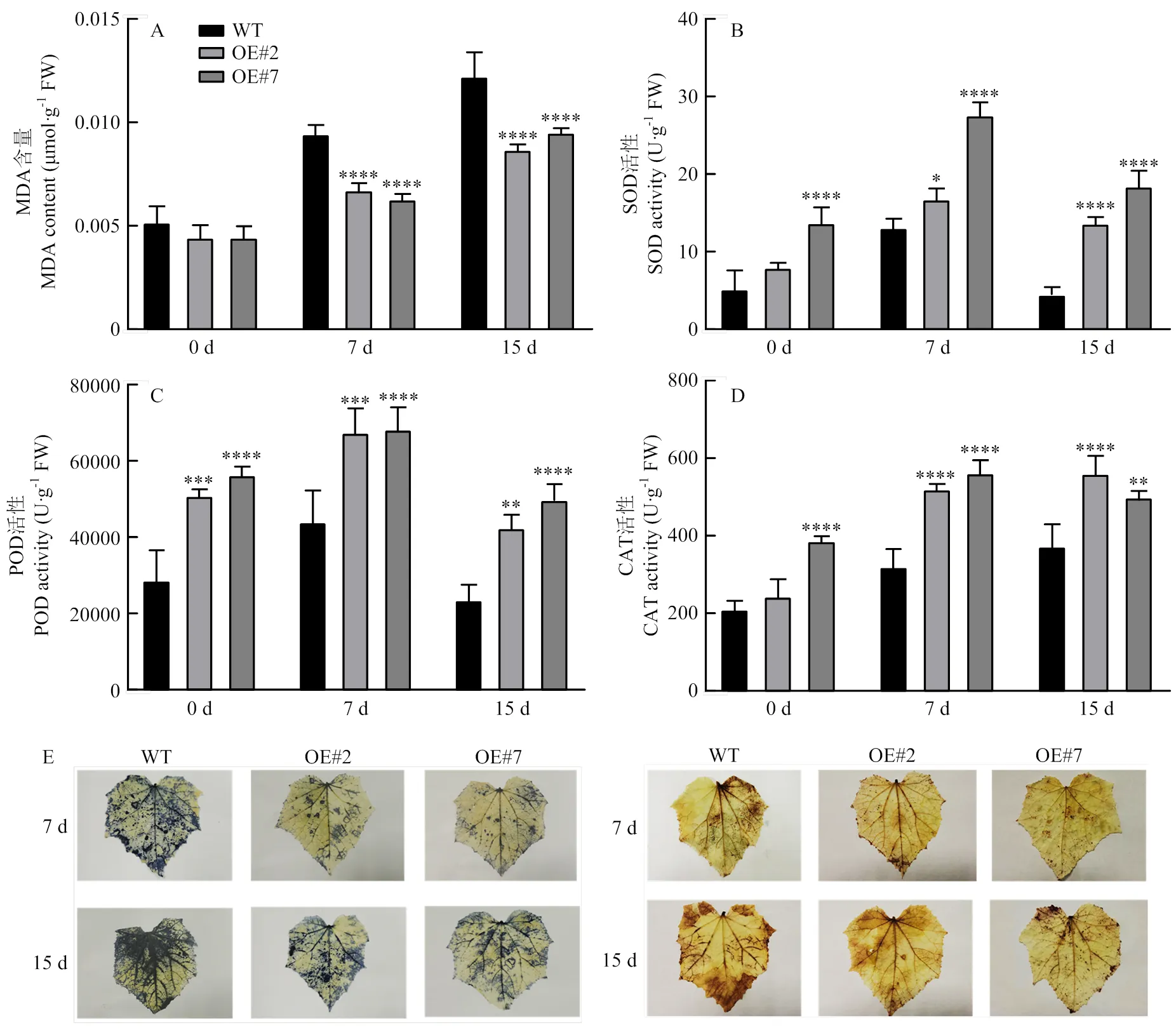
以WT植株作为对照,选取转基因植株OE#3、OE#4和OE#5接种枯萎病菌。接种3 d后,WT植株出现明显的褐色病斑,并且呈轻微萎蔫,叶片发黄状态;转基因植株叶片上出现灰色霉层,未呈现明显的褐色病斑;接种7 d时,转基因植株和WT植株均呈现不同程度的病情加重,WT植株叶片出现严重萎缩,叶柄基部呈现严重灰褐色病斑;OE#3、OE#4、OE#5植株叶片病斑面积扩大,病灶处呈现轻微萎蔫状态(图3-A)。测定转基因植株和WT植株叶片接种枯萎病菌后不同时间的病斑面积,发现接种枯萎病菌后转基因植株的病斑面积显著低于WT植株(图3-B)。与WT植株相比,转基因植株在接种枯萎病后症状较轻、病斑面积较小、发病较慢并且在OE#4和OE#5中更加显著,表明在黄瓜中的表达可以提高黄瓜对枯萎病的抗性。
从对枯萎病表现出抗性增强的转基因植株中选出OE#4和OE#5,测定接种枯萎病菌前后转基因植株和WT植株叶片内MDA含量及SOD、POD、CAT活性的变化。接种枯萎病菌后,WT植株和转基因植株的MDA含量均呈逐渐升高趋势,但转基因植株的MDA含量始终低于WT植株,特别是在接种7 d时,转基因植株的MDA含量显著低于WT植株(图4-A)。接种枯萎病菌前后,转基因植株叶片内SOD、POD、CAT活性均高于WT植株(图4-B、4-C、4-D)。接种枯萎病菌3 d时,转基因植株和WT植株叶片内均产生了O2-和H2O2,WT植株叶片内积累的ROS含量略高于转基因植株,但差异不明显;接种7 d时,转基因植株叶片NBT染色和DAB染色的情况均比WT植株更轻,这表明转基因植株叶片内积累的O2-和H2O2含量均低于WT植株,且差异明显(图4-E)。

图2 转基因植株下游防御基因的表达量
2.4 转基因植株对白粉病的抗性增强
接种白粉病菌7 d时,WT植株叶片上出现明显的白粉病病斑,病斑面积达到17%;转基因T1代植株OE#2和OE#7叶片上出现小面积的白粉病病斑,病情较轻,病斑面积分别为9%和8.5%,显著低于WT植株。接种15 d时,随着病情的加重,转基因植株和WT植株叶片上均呈现明显的白粉病病斑,然而与转基因植株相比,WT植株叶片出现边缘黄化失绿等特征,病情更为严重;并且,转基因植株OE#2和OE#7叶片的病斑面积极显著低于WT植株(图5)。
未接种白粉病菌时,转基因植株和WT植株叶片内MDA含量无明显差异;接种白粉病菌后,转基因植株和WT植株叶片内MDA含量均呈上升趋势,与WT植株相比,OE#2、OE#7植株叶片内MDA含量上升幅度较慢,且始终显著低于WT植株(图6-A)。接种白粉病菌前后,转基因植株叶片内SOD、POD、CAT活性均高于WT植株(图6-B、6-C、6-D)。接种白粉病菌7、15 d时,OE#2和OE#7叶片内ROS含量均低于WT型植株,但接种15 d时差异达显著水平(图6-E)。结果表明,T1代转基因植株OE#2和OE#7对白粉病的抗性提高。

A:表型观察Phenotypic observation;B:病斑相对面积Relative area of disease spots

A:表型观察Phenotypic observation;B:病斑相对面积Relative area of disease spots
A—D:分别为接种白粉病菌前后T1代转基因植株叶片MDA含量,SOD、POD、CAT活性MDA content, SOD, POD and CAT activities in leaves of T1 generation transgenic plants before and after G. cichoracearum inoculation, respectively;E:T1代转基因植株接种白粉病菌后ROS含量的变化(NBT染色:叶片染色后呈现深蓝色,表示O2-含量;DAB染色:叶片染色后呈现棕褐色,表示H2O2含量)Changes of ROS content in T1 transgenic plants after inoculation with G. cichoracearum (NBT staining: the leaves show dark blue after dyeing, indicating O2- content; DAB staining: leaves are brown after staining, indicating H2O2 content)
3 讨论
3.1 转基因植株的分子鉴定及相关防御基因的表达分析
在本研究中,通过农杆菌介导的遗传转化,在CaMV35S启动子的控制下将转入黄瓜,获得过表达转基因黄瓜。研究发现,在3个T0代转基因植株中表达水平有差异,OE#4和OE#5植株为高表达植株,OE#3植株为低表达植株。在本研究中,根据的不同表达水平,评估了参与植物防御信号通路的下游基因的表达量。作为病程相关基因,与植物的抗病性密切相关。先前的研究表明,、和在转基因植物中的组成性高水平表达赋予了转基因植物对真菌感染更高的耐受性[28-29],表明这些基因具有抗真菌感染的功能。本研究发现,转基因植株中、、、的表达量整体呈上升趋势。其中,和的表达量上调极为显著,这可能是因为和为SA介导的SAR途径中的主要标志基因。
位于的下游,是的直接作用目标,在SA介导的抗病途径中发挥积极作用。在柑橘中过表达引起的表达上调,并且显示出对黄龙病更高的抗性[30]。本研究发现,的过表达使得转基因植株OE#4和OE#5中的显著上调表达。、是JA介导的信号途径中的关键基因,此外还参与植保素和ROS的产生来抵抗病原体的侵染,与植物的防御反应紧密相关[31-32]。本研究中,转基因植株OE#4和OE#5中呈下调表达,表明在黄瓜中的过表达对JA介导的抗病信号途径没有显著激活作用。和是清除ROS相关基因,可以分解H2O2从而降低氧自由基浓度,减轻对细胞的伤害,增强植物抗性。本研究发现,的过表达使转基因植株OE#4和OE#5中和的表达量上调。这表明,转基因株系中抗氧化酶基因的上调表达可能会导致其抗氧化酶活性的升高。此外,本研究表明,与非转基因植株相比,转基因植株OE#3中下游防御基因的表达没有呈现出显著差异,这可能与在转基因植株OE#3中的表达水平较低有关。总之,的过表达诱导了转基因黄瓜中下游防御基因的上调表达,这可能与转基因黄瓜抗病性的提高直接相关。
3.2 AtNPR1在黄瓜中的过表达提高转基因植株对枯萎病、白粉病的抗性
研究表明,在植物中的过表达与植物的抗病性直接相关。转基因番茄不仅对番茄花叶病毒产生抗性,而且对多种真菌性和细菌性病害表现出广谱抗性;积累较高水平的转基因番茄品系表现出更广谱的抗病性,并且增强的抗病性稳定遗传[33]。转基因棉花对黑根腐病有显著程度的耐受性,过表达的转基因植物根部可更强、更快地诱导大多数防御相关基因[34];本研究结果与这些报道一致,在黄瓜中过表达提高了对真菌病原体的抗病性,表现为转基因植物症状出现的延迟、病灶面积的减少。这些结果证明,至少在枯萎病和白粉病感染的早期,过表达延迟了发病进程。
通过测定转基因植株感染枯萎病及白粉病后相关生理指标,进一步研究转基因植株的抗病生理机制。结果表明,接种枯萎病菌和白粉病菌导致转基因植株和WT植株叶片内MDA含量均上升,但转基因植株内MDA含量显著低于WT植株。秦智伟等[35]研究表明,霜霉病菌处理后,过表达的转基因黄瓜植株中MDA含量显著低于对照组。本研究中,转基因植株在接种枯萎病菌及白粉病菌后SOD、POD、CAT活性均显著高于WT植株。朱金成等[36]对过表达转基因棉花株系接种枯萎病菌后发现,转基因棉花叶片内SOD、POD、CAT活性逐渐增高,并且其酶活性显著高于野生型材料;沙仁和等[37]发现转基因苹果在接种白粉病菌后,抗氧化酶活性显著提高,产生的ROS显著低于WT植株,对白粉病的抗性增强。本研究结果与上述报道的结果一致,表明转基因植株中抗氧化酶系统对植株的抗病性起到积极调控作用。此外,本研究表明,转基因植株在受到病原菌侵染的早期,SOD活性迅速上升、POD和CAT活性上升速度较慢;但在病原菌侵染的后期,与WT植株相比,转基因植株叶片内SOD、POD、CAT活性的下降速度慢,维持较高的酶活性,更有利于积累抗性物质,从而增强植物抗性。
ROS可以作为一种信号分子启动植物的抗病反应,适量ROS的产生与积累可以增强植物的抗病性,但ROS的过量产生与积累会对植物造成损害,植物会通过抗氧化酶来清除ROS,维持ROS的动态平衡[38]。在黄瓜霜霉病菌的侵染下,黄瓜的过表达植株中抗氧化酶表达水平较对照植株更高,积累的ROS较少[39]。本研究发现,在接种枯萎病菌和白粉病菌早期,转基因植株叶片内ROS含量较少;在接种病原菌的后期,转基因植株叶片内累积的ROS含量显著少于WT植株。病原菌侵染植物体后,会诱导植物体内ROS的产生,ROS的平衡对植物起着重要作用。转基因植株中抗氧化酶活性的提高,有利于转基因植株清除累积的ROS,维持ROS的动态平衡,从而进一步提高抗病能力。
植物体内的防御机制比较复杂,通过多种途径来抵抗病原菌的入侵。NPR1作为植物不同抗病信号途径的交叉点,在植物防御信号途径中起到调节作用。其中,研究较为清晰的SA介导的SAR途径中,NPR1起到关键作用,通过激活下游防御相关基因提高植物对病原菌的抗性。此外,黄瓜对枯萎病和白粉病的抗性还与结构抗性和生理抗性相关。当枯萎病菌侵染植株后,黄瓜抗病材料较感病材料会更早形成一系列防卫反应[40]。黄瓜抗病品种‘津研7号’感染白粉病后,其POD、PPO和PAL活性较感病品种均明显升高[41]。本研究表明,在黄瓜中的组成型表达赋予了黄瓜对枯萎病和白粉病更强的抵抗力。转基因黄瓜抗病能力的提高,是通过SA介导的防御信号途径来提高下游防御相关基因的表达以及通过提高抗氧化酶活性,维持ROS的动态平衡,调控植物积极参与抗病反应。然而,关于在黄瓜中的表达对提高黄瓜抗病性的具体分子机制需要结合多组学分析进行深入研究,并且进一步挖掘更多潜在的广谱抗病基因。本研究证实了通过转基因手段将转入黄瓜,有助于黄瓜抗病性的遗传改良,为培育更强、更持久的抗病黄瓜品种提供了理论依据。
4 结论
在黄瓜中过表达诱导了转基因植株中下游防御基因的上调表达。白粉病菌和枯萎病菌处理后,与WT植株相比,转基因植株中MDA含量降低,抗氧化酶活性升高,ROS含量的累积较少,病斑面积显著降低,病情较轻,表明过表达提高了转基因黄瓜对枯萎病和白粉病的抗性。
[1] 刘兴旺, 翟许玲, 张亚琦, 尹帅, 冯钟萱, 任华中. 黄瓜果实形态建成的遗传及分子基础研究进展. 园艺学报, 2020, 47(9): 1793-1809.
LIU X W, ZHAI X L, ZHANG Y Q, YIN S, FENG Z X, REN H Z. A review on genetic and molecular biology of fruit morphogenesis in cucumber. Acta Horticulturae Sinica, 2020, 47(9): 1793-1809. (in Chinese)
[2] 沈虹, 尤超, 张营营, 程芳梅, 郭世荣, 孙锦. 黄瓜白粉病综合防治研究进展. 黑龙江农业科学, 2017(8): 133-137.
SHEN H, YOU C, ZHANG Y Y, CHENG F M, GUO S R, SUN J. Advances in integrated control of cucumber powdery mildew. Heilongjiang Agricultural Sciences, 2017(8): 133-137. (in Chinese)
[3] 毛爱军, 张峰, 张丽蓉, 王永健. 黄瓜品系WIS2757对黄瓜枯萎病生理小种4和黑星病的抗性遗传与连锁分析. 中国农业科学, 2008, 41(10): 3382-3388. doi: 10.3864/j.issn.0578-1752.2008.10.062.
MAO A J, ZHANG F, ZHANG L R, WANG Y J. Analysis on the inheritance of resistance to Fusarium wilt race 4 and cucumber scab and their linkage in cucumber wis2757. Scientia Agricultura Sinica, 2008, 41(10): 3382-3388. doi: 10.3864/j.issn.0578-1752.2008.10.062. (in Chinese)
[4] 石延霞, 徐玉芳, 谢学文, 柴阿丽, 王微微, 李宝聚. 氟唑活化酯对黄瓜抗枯萎病的诱导作用. 中国农业科学, 2015, 48(19): 3848-3856. doi: 10.3864/j.issn.0578-1752.2015.19.007.
SHI Y X, XU Y F, XIE X W, CHAI A L, WANG W W, LI B J. Effects of FBT on induction of systemic resistance in cucumber against cucumber Fusarium wilt caused byf. sp.Owen. Scientia Agricultura Sinica, 2015, 48(19): 3848-3856. doi: 10.3864/j.issn.0578-1752.2015.19.007. (in Chinese)
[5] 许敏, 王戎杰, 王丽萍, 王美琴. 10种杀菌剂防治黄瓜白粉病田间药效试验. 山西农业科学, 2022, 50(7): 1050-1055.
XU M, WANG R J, WANG L P, WANG M Q.Field efficacy trials of 10 fungicides for controlling cucumber powdery mildew. Journal of Shanxi Agricultural Sciences, 2022, 50(7): 1050-1055. (in Chinese)
[6] 王海利, 张晓慷, 王滢秀, 韩金涛, 张新刚. 黄瓜白粉病拮抗细菌的筛选鉴定及其生防效果. 江苏农业科学, 2019, 47(24): 64-66, 69.
WANG H L, ZHANG X K, WANG Y X, HAN J T, ZHANG X G. Screening and identification of antagonistic bacteria against cucumber powdery mildew and its biocontrol effect. Jiangsu Agricultural Sciences, 2019, 47(24): 64-66, 69. (in Chinese)
[7] 蒲子婧, 张艳菊, 刘东, 代丽婷, 王文博. 黄瓜枯萎病生物防治策略研究进展. 中国蔬菜, 2011(6): 9-14.
PU Z J, ZHANG Y J, LIU D, DAI L T, WANG W B. Research progress in biological control strategies for cucumber wilt. China Vegetables, 2011(6): 9-14. (in Chinese)
[8] Gaffney T, Friedrich L, Vernooij B, Negrotto D, Nye G, Uknes S, Ward E, Kessmann H, Ryals J. Requirement of salicylic acid for the induction of systemic acquired resistance. Science, 1993, 261(5122): 754-756.
[9] 闫晓寒, 王向尧, 刘培源, 姬朝光, 王丽, 刘雪晴, 李晓瑞, 严汉池. NPR1结构与功能的研究进展. 江苏农业科学, 2021, 49(3): 46-52.
YAN X H, WANG X Y, LIU P Y, JI C G, WANG L, LIU X Q, LI X R, YAN H C. Research progress on structure and function of NPR1. Jiangsu Agricultural Sciences, 2021, 49(3): 46-52. (in Chinese)
[10] Cao H, Bowling S A, Gordon A S, Dong X. Characterization of anmutant that is nonresponsive to inducers of systemic acquired resistance. The Plant Cell, 1994,6(11): 1583-1592.
[11] Wu Y, Zhang D, Chu J Y, Boyle P, Wang Y, Brindle I D, De Luca V, Després C. TheNPR1 protein is a receptor for the plant defense hormone salicylic acid. Cell Reports, 2012, 1(6): 639-647.
[12] Fu Z Q, Yan S, Saleh A, Wang W, Ruble J, Oka N, Mohan R, Spoel S H, Tada Y, Zheng N, Dong X. NPR3 and NPR4 are receptors for the immune signal salicylic acid in plants. Nature, 2012, 486(7402): 228-232.
[13] Cao H, Li X, Dong X. Generation of broad-spectrum disease resistance by overexpression of an essential regulatory gene in systemic acquired resistance. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(11): 6531-6536.
[14] 刘琳琳, 甄军波, 刘迪, 欧阳艳飞, 迟吉娜. NPR1调控植物抗病机制及功能研究进展. 中国棉花, 2020, 47(7): 1-6, 19.
LIU L L, ZHEN J B, LIU D, OUYANG Y F, CHI J N. Advances of the mechanism and function of disease resistance regulated by NPR1 in plants. China Cotton, 2020, 47(7): 1-6, 19. (in Chinese)
[15] Makandar R, Essig J S, Schapaugh M A, Trick H N, Shah J. Genetically engineered resistance to fusarium head blight in wheat by expression of. Molecular Plant-Microbe Interactions, 2006, 19(2): 123-129.
[16] Potlakayala S D, DeLong C, Sharpe A, Fobert P R. Conservation of non-expressor of pathogenesis-related genes1 function betweenand. Physiological and Molecular Plant Pathology, 2007, 71(4/6): 174-183.
[17] Wally O, Jayaraj J, Punja Z K. Broad-spectrum disease resistance to necrotrophic and biotrophic pathogens in transgenic carrots (L.) expressing angene. Planta, 2009, 231(1): 131-141.
[18] Le Henanff G, Farine S, Kieffer-Mazet F, Miclot A S, Heitz T, Mestre P, Bertsch C, Chong J.is the functional ortholog ofand its overexpression in grapevine triggers constitutive activation ofgenes and enhanced resistance to powdery mildew. Planta, 2011, 234(2): 405-417.
[19] 刘旭, 张诺, 徐林, 孙卓楠, 张宝俊. 谷子基因特征及响应禾生指梗霉侵染的表达分析. 山西农业科学, 2022, 50(9): 1233-1239.
LIU X, ZHANG N, XU L, SUN Z N, ZHANG B J. Characteristics ofgene in foxtail millet and expression analysis in response toinfection. Journal of Shanxi Agricultural Sciences, 2022, 50(9): 1233-1239. (in Chinese)
[20] 曲东, 燕飞, 刘欣瑞, 彭雪, 张羽, 秦公伟. 猕猴桃基因克隆及抗病响应表达分析. 西北农业学报, 2022, 31(6): 718-728.
QU D, YAN F, LIU X R, PENG X, ZHANG Y, QIN G W. Cloning ofgene in kiwifruit and expression analysis of disease resistance response. Acta Agriculturae Boreali-Occidentalis Sinica, 2022, 31(6): 718-728. (in Chinese)
[21] 陈培雯, 张立, 陈学进, 李新峥, 李庆飞. 中国南瓜基因的克隆和表达分析. 西北植物学报, 2021, 41(12): 2038-2045.
CHEN P W, ZHANG L, CHEN X J, LI X Z, LI Q F. Cloning and expression analysis ofgene in. Acta Botanica Boreali-Occidentalia Sinica, 2021, 41(12): 2038-2045. (in Chinese)
[22] 刘缙, 田花丽, 王亚红, 郭蔼光. 黄瓜转新型抗菌蛋白基因及其抗枯萎病的研究. 植物学报, 2010, 45(4): 411-418.
LIU J, TIAN H L, WANG Y H, GUO A G. Overexpression of a novel antifungal protein generesults in elevated resistance of transgenic cucumber to. Chinese Bulletin of Botany, 2010, 45(4): 411-418. (in Chinese)
[23] 周红梅, 毛爱军, 张丽蓉, 张峰, 王永健, 杨文才. 黄瓜枯萎病接种方法及抗性遗传的研究. 华北农学报, 2010, 25(4): 186-190.
ZHOU H M, MAO A J, ZHANG L R, ZHANG F, WANG Y J, YANG W C. Research on inoculation method and the inheritance of resistance tof. spon cucumber. Acta Agriculturae Boreali-Sinica, 2010, 25(4): 186-190. (in Chinese)
[24] Schindelin J, Rueden C T, Hiner M C, Eliceiri K W. The ImageJ ecosystem: an open platform for biomedical image analysis. Molecular Reproduction and Development, 2015, 82(7/8): 518-529.
[25] 李小方, 张志良. 植物生理学实验指导. 5版. 北京: 高等教育出版社, 2016: 320-322.
LI X F, ZHANG Z L. Experimental Instruction of Plant Physiology. 5th ed. Beijing: Higher Education Press, 2016: 320-322. (in Chinese)
[26] 贾忠明, 刘峰, 慕卫, 魏光, 刘彦良. 黄瓜白粉病菌接种及对杀菌剂敏感性测定方法. 植物保护学报, 2006, 33(1): 99-103.
JIA Z M, LIU F, MU W, WEI G, LIU Y L. Study on the inoculation and fungicide sensitivity assay method ofon cucumber. Journal of Plant Protection, 2006, 33(1): 99-103. (in Chinese)
[27] 黄瓜主要病害抗病性鉴定技术规程第2部分: 黄瓜抗白粉病鉴定技术规程: NY/T 1857. 2-2010. 北京: 中国农业出版社, 2010: 3-4.
Cucumber main disease resistance identification technical regulations- Part 2: Cucumber powdery mildew resistance identification technical regulations: NY/T 1857. 2-2010. Beijing: China Agriculture Press, 2010: 3-4. (in Chinese)
[28] Intana W, Wonglom P, Suwannarach N, Sunpapao A.induced expression of pathogenesis- related protein genes against gummy stem blight of muskmelon () in field evaluation. Journal of Fungi, 2022, 8(2): 156.
[29] 栗小英, 高琳, 张艳俊, 王海燕, 刘大群. 叶锈菌及信号分子诱导小麦TcLr35中-1,3-葡聚糖酶基因的表达分析. 中国农业科学, 2014, 47(14): 2774-2783. doi: 10.3864/j.issn.0578-1752.2014.14.008.
LI X Y, GAO L, ZHANG Y J, WANG H Y, LIU D Q. Expression and analysis of-1, 3-glucanase gene in wheat TcLr35 induced by wheat leaf rust pathogen and signal molecule. Scientia Agricultura Sinica, 2014, 47(14): 2774-2783. doi: 10.3864/j.issn.0578-1752.2014.14.008. (in Chinese)
[30] Dutt M, Barthe G, Irey M, Grosser J. Transgenic citrus expressing angene exhibit enhanced resistance against Huanglongbing (HLB; citrus greening). PLoS One, 2015, 10(9): e0137134.
[31] 任秋红, 黄军艳, 毛晗, 田保明, 刘胜毅. 甘蓝型油菜基因在MeJA、BTH和核盘菌诱导下的表达. 河南农业科学, 2010, 39(7): 22-25.
REN Q H, HUANG J Y, MAO H, TIAN B M, LIU S Y.gene expression induced by methyl jasmonate (MeJA), benzothiadiazole (BTH), and. Journal of Henan Agricultural Sciences, 2010, 39(7): 22-25. (in Chinese)
[32] 解军辉, 寇艳君, 沈祥陵, 邱结华. 水稻茉莉酸合成基因在稻瘟病抗性中的功能分析. 分子植物育种, 2022, 20(20): 6631-6637.
XIE J H, KOU Y J, SHEN X L, QIU J H. Functional analysis of rice jasmonic acid synthesis gene
[33] Lin W C, Lu C F, Wu J W, Cheng M L, Lin Y M, Yang N S, Black L, Green S K, Wang J F, Cheng C P. Transgenic tomato plants expressing thegene display enhanced resistance to a spectrum of fungal and bacterial diseases. Transgenic Research, 2004, 13(6): 567-581.
[34] Kumar V, Joshi S G, Bell A A, Rathore K S. Enhanced resistance againstin transgenic cotton plants expressinggene. Transgenic Research, 2013, 22(2): 359-368.
[35] 秦智伟, 王奕童, 刘东, 辛明, 周秀艳. 黄瓜克隆及其对霜霉病和棒孢叶斑病抗性功能的初步验证. 东北农业大学学报, 2018, 49(2): 39-47.
QIN Z W, WANG Y T, LIU D, XIN M, ZHOU X Y.cloning of cucumber and preliminary verification of resistance to downy mildew and leaf spot disease. Journal of Northeast Agricultural University, 2018, 49(2): 39-47. (in Chinese)
[36] 朱金成, 刘戈辉, 张鹏飞, 郭文婷, 张薇. 转基因棉花抗枯萎病机理研究. 西北农业学报, 2022, 31(7): 846-853.
ZHU J C, LIU G H, ZHANG P F, GUO W T, ZHANG W. Resistance function of transgenic cotton withgene to Fusarium wilt. Acta Agriculturae Boreali-Occidentalis Sinica, 2022, 31(7): 846-853. (in Chinese)
[37] 沙仁和, 兰黎明, 王三红, 罗昌国. 苹果转录因子MdWRKY40b抗白粉病的机理. 中国农业科学, 2021, 54(24): 5220-5229. doi: 10.3864/j.issn.0578-1752.2021.24.005.
SHA R H, LAN L M, WANG S H, LUO C G. The resistance mechanism of apple transcription factorMdWRKY40bto powdery mildew. Scientia Agricultura Sinica, 2021, 54(24): 5220-5229. doi: 10.3864/j.issn.0578-1752.2021.24.005. (in Chinese)
[38] Peng M, Kuc J. Peroxidase-generated hydrogen peroxide as a source of antifungal activityand on tobacco leaf disks. Phytopathology, 1992, 82(6): 696-699.
[39] Luan Q Q, Chen C H, Liu M, Li Q, Wang L, Ren Z H.mediates defense responses toinfection in. Plant Science, 2019, 279: 59-69.
[40] 马艳玲, 吴凤芝, 刘守伟. 抗感枯萎病黄瓜品种的病理组织结构学研究. 植物保护, 2008, 34(1): 81-84.
MA Y L, WU F Z, LIU S W. Pathologic structures of cucumber cultivars with different resistance to. Plant Protection, 2008, 34(1): 81-84. (in Chinese)
[41] 董毅敏, 徐建华, 郭季芳. 抗病和感病黄瓜品种感染白粉病菌后几种酶活性的变化. 植物学报, 1990, 32(2): 160-164.
DONG Y M, XU J H, GUO J F. The changes of some enzymes activities from cucumber leaves after inoculation with cucumber powdery mildew. Acta Botanica Sinica, 1990, 32(2): 160-164. (in Chinese)
Overexpressingfromenhanced resistance to Fusarium wilt and Powdery mildew in
Feng XiangJun, Wang HongYu, Yu Jing, Chi ChunYu, Ding GuoHua
School of Life Science & Technology, Harbin Normal University, Harbin 150025
【Background】Cucumber () is susceptible to many diseases, especially Fusarium wilt and powdery mildew. Although chemical control is effective, it is limited due to high residue and difficult degradation. Breeding cucumber varieties with broad-spectrum and long-lasting disease resistance is the fundamental strategy to solve this problem. nonexpressor of pathogenesis-related genes 1 (NPR1) is a key regulator in systemic acquired resistance (SAR), which is involved in regulating the expression of a variety of defense-related genes and affecting plant disease resistance.【Objective】Overexpression ofto explore the resistance of transgenic cucumber to Fusarium wilt and powdery mildew, and to provide experimental basis for breeding cucumber varieties with stronger and more lasting disease resistance.【Method】Theofwas cloned, theoverexpression vector was constructed, and the cucumber was transformed by-mediated method to obtain transgenic cucumber plants with overexpression of. The expression levels of related defense genes in transgenic plants were determined by real-time fluorescence quantitative PCR (qRT-PCR) method. Transgenic plants of T0generation were selected for resistance identification of Fusarium wilt, and transgenic plants of T1generation were selected for resistance identification of powdery mildew. After inoculation transgenic plants withf. sp.and, the activities of antioxidant enzymes, including superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT) , as well as the levels of malondialdehyde (MDA) and reactive oxygen species (ROS) were quantified.【Result】Eight transgenic plants of the T0generation were successfully obtained, among which OE#4 and OE#5 exhibited high expression levels of, while OE#3 showed low expression levels. Analysis of the expression level of related defense genes in transgenic plants revealed that those plants overexpressingexhibited stronger and faster expression of several defense genes. Furthermore, there was a positive correlation between the expression levels of defense genes andAmong them, the expression levels of,andwere significantly up-regulated.The results of disease resistance identification of transgenic plants showed that the transgenic plants exhibited more significant resistance, slower onset, mild symptoms, and significantly lower lesion area than wild type (WT) plants when subjected to the stress of Fusarium wilt and powdery mildew.The transgenic T0plants OE#4 and OE#5 exhibited no discernible lesions 3 days post-inoculation withf. sp., but displayed gray-brown lesions after 7 days without any signs of wilting. Conversely, the WT plants showed gray-brown lesions and slight wilting at 3 d post-inoculation, followed by severe leaf wilting at 7 d. After 7 days of inoculation with, both T1generation plants OE#2 and OE#7 as well as wild type (WT) plants exhibited lesions. However, the lesion area in OE#2 and OE#7 was significantly smaller than that in WT. After 15 days of inoculation, chlorosis appeared on the leaves of WT plants while the transgenic plants remained mildly affected.Compared with WT plants, transgenic plants exhibited lower MDA content and maintained higher levels of SOD, POD and CAT activities after inoculation. Additionally, the accumulation of ROS was less.【Conclusion】Overexpression of
cucumber ();; Fusarium wilt; powdery mildew; disease resistance

10.3864/j.issn.0578-1752.2023.14.006
2023-04-17;
2023-05-17
国家自然科学基金面上项目(31770350)、哈尔滨师范大学研究生创新科研项目(HSDBSCX2021-02)
冯向君,E-mail:fxj258091@126.com。王宏宇,E-mail:wanghongyu0828@163.com。冯向君和王宏宇为同等贡献作者。通信作者丁国华,E-mail:hsddgh@hrbnu.edu.cn
(责任编辑 岳梅)
