1-甲基环丙烯结合苯丙氨酸处理对桃花色苷合成的影响
2023-08-12邵小达马立杰张映曈李鹏霞周宏胜
赵 婧,邵小达,赵 晟,潘 泓,马立杰,张映曈,凌 军,李鹏霞,4,黄 雯,周宏胜,,4,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.昆山益群农产品有限公司,江苏 苏州 215300;3.江苏省农业科学院,农业农村部农产品冷链物流技术重点实验室,江苏 南京 210014;4.江苏省高效园艺作物遗传改良重点实验室,江苏 南京 210014;5.南京市蔬菜科学研究所,江苏 南京 210042)
桃(Prunuspersica(L.)Batsch.)是深受人们喜爱的核果类水果。外观颜色是决定桃商品价值的重要指标,而花色苷决定着桃果实的外观颜色,其生物合成受温度、光照等环境因素调控,其中合理的光照有利于花色苷的合成[1]。研究表明套袋栽培可以改善桃的外观品质,包括果面光洁度和颜色[2],但也有研究认为套袋会抑制花色苷的生物合成,即套袋采收影响了桃果皮花色苷的合成和色泽的呈现[3-4]。因此,寻求一种有效的促进套袋采收桃果实花色苷合成的方法具有重要的意义。
花色苷由苯丙烷途径和黄酮类化合物生物合成途径产生[5],受多个结构基因和调节基因的控制[6]。苯丙氨酸(phenylalanine,Phe)是花色苷生物合成的直接前体[6-7],研究表明在培养基中适当添加Phe能促进野生型拟南芥合成更多的花青素[8];采后Phe处理的李果实具有较高的花色苷和酚类物质含量[9]。外源Phe处理可能是一种有效增加果实花色苷含量和提升果实抗病性的方法[7]。
乙烯是植物产生的最重要的激素之一,能够直接影响果实的成熟衰老[10]。1-甲基环丙烯(1-methylclopropene,1-MCP)是植物组织中乙烯受体的竞争性抑制剂,1-MCP处理可有效抑制桃果实的呼吸和乙烯释放,从而延缓果实的软化,保持果实品质,在桃保鲜中应用广泛[11-12]。研究表明,1-MCP处理可以抑制蔷薇科的苹果[13]、李[14]、油桃[15]果实着色,但会促进部分梨[16]和桃[3]果实着色。
本课题组前期的研究发现,1-MCP处理可以促进早熟套袋桃的着色[3],但其对中晚熟套袋桃着色效果的影响尚不明确。目前尚鲜有关于1-MCP结合Phe处理对桃果实花色苷合成影响的相关报道。本研究拟通过Phe、1-MCP及Phe+1-MCP处理采收后的中晚熟套袋桃果实,研究不同处理对桃果实表型、果皮色差、花色苷含量等的影响,为Phe和1-MCP在桃采后保鲜和色泽提升中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
套“内黑外黄”双层果袋栽培的‘新川中岛’桃果实于商业化成熟时采收于山东某商业化果园,当天运至江苏省农业科学院,挑选成熟度一致、大小形状均一、无病虫害和机械伤的桃果实进行实验。
DL-Phe(99%) 北京百灵威科技有限公司;1-MCP 山东奥维特生物科技有限公司;氯化钾、六水氯化铝、盐酸 国药集团化学试剂有限公司;甲醇上海凌峰化学试剂有限公司;氢氧化钠 西陇科学股份有限公司;无水乙酸钠 广州市金华大化学试剂有限公司;以上试剂均为分析纯。FastPure Plant Total RNA Isolation Kit、HiScript III RT SuperMix for qPCR(+gDNA wiper)逆转录试剂盒、GreenTaqMix和ChamQ Universal SYBR qPCR Master Mix 南京诺唯赞生物科技股份有限公司;甲醇、乙腈(均为色谱纯)美国JTBaker公司;矢车菊素3-葡萄糖苷标准品、矢车菊素-3-O-芸香糖苷标准品 上海源叶生物科技有限公司。
1.2 仪器与设备
Seven multi pH计 梅特勒-托利多仪器(上海)有限公司;HH-S数显恒温水浴锅 常州万达升实验仪器有限公司;BSA124S电子天平 赛多利斯科学仪器(北京)有限公司;FM40型雪花制冰机 北京长流科学仪器有限公司;UV-1780型紫外-可见分光光度计 日本岛津公司;A11 Basic液氮研磨器 艾卡(广州)仪器设备有限公司;CR-400全自动测色色差仪 日本Konica Minolta公司;7820A气相色谱仪、QTRAP高效液相色谱-质谱(high-performance liquid chromatography-mass spectrometry,HPLC-MS)仪 美国Agilent公司;3K-15离心机 德国SIGMA公司;EDC-810型聚合酶链式反应(polymerase chain reaction,PCR)仪北京东胜创新生物科技有限公司;CFX 96 实时荧光定量PCR(quantitative PCR,qPCR)仪 美国伯乐公司。
1.3 方法
1.3.1 桃果实的处理
将桃果实随机平均分为4 组,分别进行4 种处理:1)对照组(Control):清水浸泡10 min后晾干,用0.03 mm厚聚乙烯(polyethylene,PE)保鲜袋扎口密封空气处理24 h;2)Phe处理组(Phe组):8 mmol/L Phe溶液中浸泡10 min后晾干,用0.03 mm厚PE保鲜袋扎口密封空气处理24 h;3)1-MCP处理组(1-MCP组):清水浸泡10 min后晾干,用0.03 mm厚PE保鲜袋扎口密封1.0 μL/L 1-MCP处理24 h;4)Phe结合1-MCP处理组(Phe+1-MCP组):8 mmol/L Phe溶液中浸泡10 min后晾干,用0.03 mm厚PE保鲜袋扎口密封1.0 μL/L 1-MCP处理24 h。密封处理结束后通风散气15 min后分别将各组桃果实置于打孔的保鲜箱内贮藏。处理和贮藏均在常温环境((22±2)℃)下进行,每个处理组单个生物学重复处理桃果实50 个,每2 d取样,每次随机选取8 个果实用于拍照和测定相关品质指标,其中0 d的样本为处理前的桃果实,每个处理均进行3 次生物学重复。
取样时采用美工刀分离桃果皮与果肉,尽量保持桃果皮厚度一致(约1 mm),并迅速置于液氮中冷冻,每个生物学重复的样本混匀后分别放入-80 ℃冰箱中保存,测定指标时用液氮研磨器粉碎混匀,以保证取样具有代表性。
1.3.2 桃果实色泽的测定
参照Zhang Yingtong等[3]的方法,采用CR-400色差仪测定每个果实赤道线上十字交叉4 个点的色泽(亮度(L*值)、红度(a*值)、黄度(b*值)),并计算颜色指数(color index of red grape,CIRG)与色差值(ΔE),每个处理组取24 个桃果实,结果取平均值。
1.3.3 总花色苷含量的测定
采用pH示差法[17]测定桃果皮中总花色苷含量。取研磨碎的0.5 g桃果皮样品,加入2.5 mL 95%的酸化甲醇(0.1 mol/L HCl),4 ℃避光振荡提取4 h后离心(12 000 r/min、4 ℃、15 min)提取上清液。上清液分别加入0.025 mol/L氯化钾缓冲液(pH 1.0)和0.4 mol/L醋酸钠缓冲液(pH 4.5)稀释,室温静置15 min后测定溶液在520、700 nm波长处吸光度,按下式计算总花色苷含量。重复测定3 次,结果取平均值。
式中:ΔA=(A520nm-A700nm)pH1.0-(A520nm-A700nm)pH4.5;Mw为矢车菊素-3 -O-葡萄糖苷的摩尔质量(449.2 g/mol);DF为稀释倍数;V为提取液总体积/mL;δ为矢车菊素-3-O-葡萄糖苷摩尔消光系数(26 900 L/(mol·cm));m为样品质量/g;L为比色皿宽度(1 cm)。
1.3.4 花色苷单体含量的测定
取研磨碎的果皮0.5 g,加0.5 mL 50%甲醇溶液(含0.1% HCl),样品涡旋5 min,浸提20 min,超声5 min,离心10 min,吸取上清液,残渣内加入0.5 mL 50%酸化甲醇溶液,再将上述操作重复一次,合并两次上清液,过0.22 μm有机滤膜,采用HPLC-MS技术测定花色苷单体物质并用相应的标准品外标法定量,花色苷单体含量单位为mg/kg[3]。
1.3.5 桃果皮花色苷与乙烯合成代谢相关基因表达水平的测定
采用FastPure Plant Total RNA Isolation Kit从桃果皮组织中提取总RNA。采用琼脂糖凝胶电泳法和Nanodrop 2000超微量分光光度计测定RNA的质量和浓度。采用HiScript III RT SuperMix for qPCR反转录试剂盒进行反转录,反转录后的cDNA存放于-20 ℃待用。
qPCR检测操作按照ChamQ Universal SYBR qPCR Master Mix说明书进行,引物序列设计如表1所示,以TEF2作为内参基因[18-20]。采用2-ΔΔCt法分析qPCR结果。
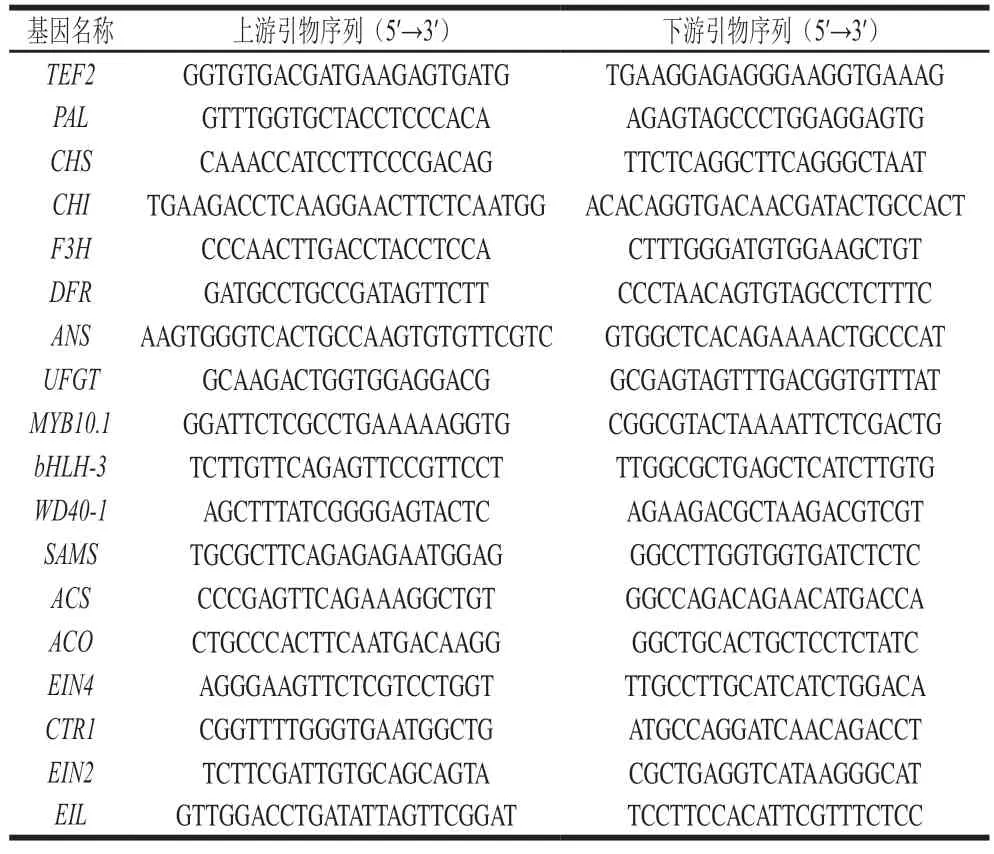
表1 qPCR引物序列Table 1 Primer sequences used for qPCR
1.3.6 呼吸速率和乙烯生成速率的测定
参考曹建康[21]和阚娟[22]等的方法测定桃果实呼吸速率和乙烯生成速率。将待检测样本常温((22±2)℃)放置在密封罐中密闭2 h,抽取10 mL气样,采用气相色谱仪进行测定。
1.4 数据处理与分析
本实验中数据取3 个重复的平均值。使用Excel 2010软件进行数据统计,SPSS 24.0软件进行差异显著性分析(Duncan法多重比较,以P<0.05表示差异显著),Origin 2021软件制作图表。
2 结果与分析
2.1 Phe和1-MCP处理对桃果实外观色泽的影响
果皮色泽是评价桃果实外观品质的重要指标。由图1可知,随着贮藏期的延长,桃果实果面逐渐变红;贮藏第2天时果面开始逐渐着色,贮藏第6、8天时果面颜色最红。采后不同处理对果皮着色程度有不同的影响:与Control组相比,Phe、1-MCP和Phe+1-MCP处理均可促进果实着色,其中Phe+1-MCP组着色效果最佳,果面最为鲜红。贮藏第6天时,处理组果实均已明显着色,果面的着色程度排序依次为Phe+1-MCP组>1-MCP组>Phe组>Control组。

图1 Phe和1-MCP处理对桃果实外观色泽的影响Fig.1 Effects of Phe and/or 1-MCP treatments on the appearance of peach fruits
2.2 Phe和1-MCP处理对桃果皮色泽的影响
色差是反映桃果皮着色情况最直观的指标,其中,a*值可反映果皮颜色红绿度的变化,CIRG可反映与花色苷含量有关的果实色泽变化,ΔE能够反映颜色的总体变化[1,3]。由图2可知,贮藏过程中果皮a*值、CIRG和ΔE总体均呈上升的趋势。整个贮藏期间,各处理组果皮的a*值均显著高于对照组(P<0.05),且Phe+1-MCP处理组果实的a*值始终最高(图2A)。贮藏期果皮CIRG的变化趋势与a*值一致(图2B),整个贮藏期果面的CIRG由大到小依次为Phe+1-MCP组>1-MCP组>Phe组>Control组。贮藏第8天时,Phe+1-MCP处理组的a*值分别是Control、Phe组和1-MCP组的13.63、1.68 倍和1.33 倍,CIRG分别为Control、Phe组和1-MCP组的1.61、1.16 倍和1.10 倍,说明Phe+1-MCP处理可以有效地促进果皮红色的形成,增色效果优于Phe和1-MCP单独处理。在整个贮藏期间,各处理组果皮的ΔE均显著高于对照组(P<0.05),且Phe+1-MCP处理组果实的ΔE始终最高,说明Phe+1-MCP处理组果实的色泽变化最明显。
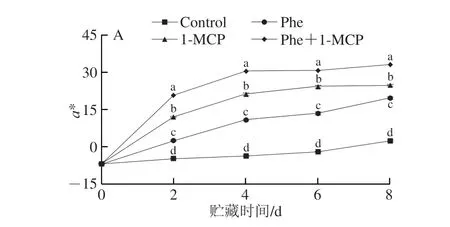

图2 Phe和1-MCP处理对桃果皮a*值(A)、CIRG(B)和ΔE(C)的影响Fig.2 Effects of Phe and/or 1-MCP treatments on a* value (A),CIRG (B) and ΔE (C) of peach peel
2.3 Phe和1-MCP处理对桃果皮总花色苷含量的影响
如图3所示,在整个贮藏期间,桃果皮总花色苷含量呈逐渐上升的趋势;贮藏第4天时总花色苷含量开始明显增加。整个贮藏期间,各处理组果皮的总花色苷含量均显著高于对照组(P<0.05),总花色苷含量由大到小依次为Phe+1-MCP组>1-MCP组>Phe组>Control组。Phe和1-MCP处理均可显著促进桃果皮总花色苷含量的增加,且Phe+1-MCP处理的促进效果最好,明显优于Phe和1-MCP单独处理。贮藏第4天时,Phe+1-MCP处理组的总花色苷含量已明显高于其他组,分别是1-MCP、Phe组和Control组的1.24、3.71 倍和6.83 倍;贮藏第6天时,Phe+1-MCP处理组果皮的总花色苷含量为76.71 mg/kg,分别是1-MCP、Phe和Control组的1.33、3.36 倍和7.29 倍。
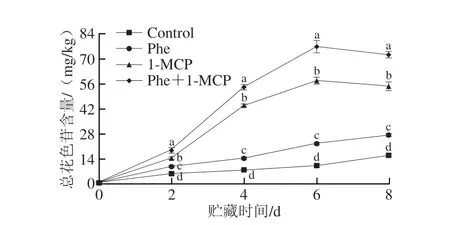
图3 Phe和1-MCP处理对桃果皮总花色苷含量的影响Fig.3 Effects of Phe and/or 1-MCP treatments on the content of total anthocyanins in peach peel
2.4 Phe和1-MCP处理对桃果皮主要花色苷类物质含量的影响
矢车菊色素是桃果实最主要的花色苷类物质[23-24]。本研究检测了第6天时桃果皮中主要的矢车菊色素类物质含量(表2),发现矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香糖苷是果皮主要的呈色物质,其中矢车菊素-3-O-葡萄糖苷含量最高。贮藏第0天时,矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香糖苷含量均较低;贮藏第6天时,矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香糖苷含量明显上升。贮藏第6天时,Phe+1-MCP处理组的矢车菊素-3-O-葡萄糖苷含量分别是1-MCP、Phe组和Control组的1.35、3.39 倍和7.49 倍,矢车菊素-3-O-芸香糖苷含量分别是1-MCP、Phe组和Control组的1.16、2.81 倍和6.87 倍。
表2 Phe和1-MCP处理对桃果皮花色苷单体含量的影响Table 2 Effects of phenylalanine and/or 1-MCP treatments on the content of anthocyanin monomers in peach peel
2.5 Phe和1-MCP处理对花色苷合成相关基因表达的影响
Phe和1-MCP处理后,桃果皮中大多数花色苷合成相关基因的表达量发生改变(图4)。贮藏第2天时,与Control组相比,Phe、1-MCP和Phe+1-MCP处理均显著促进了花色苷合成结构基因(PAL、DFR、ANS和UFGT)和调节基因(bHLH-3和WD40-1)的表达,Phe+1-MCP处理组的基因表达量最高,且显著高于其他处理组(P<0.05)。贮藏第4天时,Phe+1-MCP处理显著提升了所有花色苷合成相关基因的表达,PAL、CHS、CHI、F3H、DFR、ANS、UFGT、MYB10.1、bHLH-3和WD40-1基因的表达量分别为Control组的3.61、2.19、2.23、3.81、3.41、4.00、2.22、1.89、2.38 倍和1.51 倍。贮藏第8天时,大多数花色苷合成相关基因的表达量与贮藏前期相比明显降低,但Phe+1-MCP处理组的CHS、F3H、DFR、UFGT、MYB10.1、bHLH-3和WD40-1基因表达量仍显著高于Control组(P<0.05)。
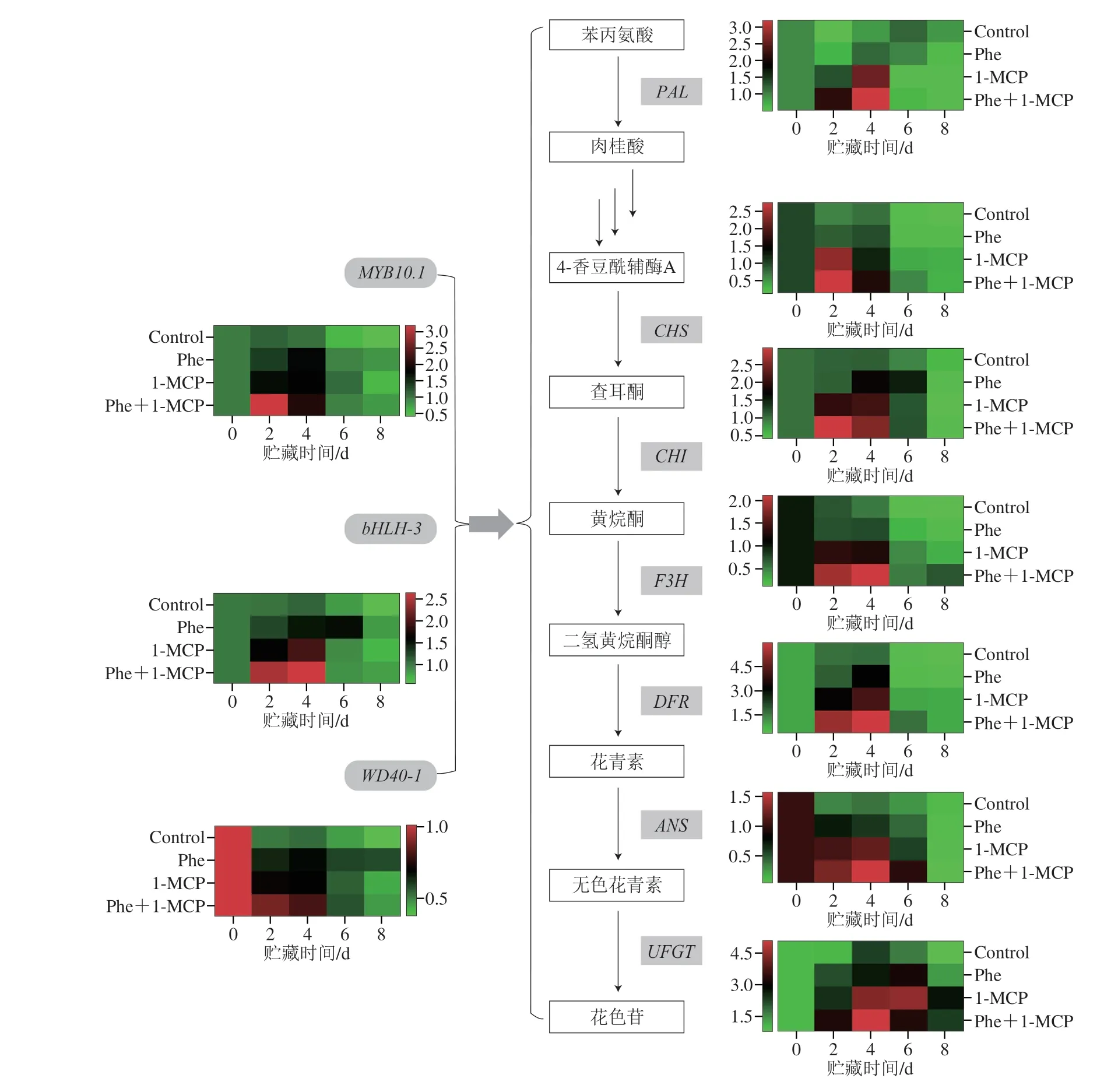
图4 Phe和1-MCP处理对桃果皮花色苷合成相关基因表达的影响Fig.4 Effects of Phe and/or 1-MCP treatments on gene expression associated with the synthesis of anthocyanins in peach peel
2.6 Phe和1-MCP处理对桃果实采后生理的影响
由图5A可知,各组桃果实的呼吸速率在整个贮藏期间均呈现先上升后下降的变化趋势,桃果实的呼吸速率在贮藏第6天时达到峰值。Control组桃的呼吸速率一直维持在相对较高的水平,1-MCP和Phe+1-MCP处理可以有效抑制果实的呼吸速率上升(P<0.05),且其整个贮藏期均显著低于Control组。由图5B可知,采后桃果实乙烯生成速率随贮藏时间的延长呈逐渐上升的趋势。与Control组相比,1-MCP和Phe+1-MCP处理均可明显抑制乙烯生成速率的上升,且其整个贮藏期均显著低于Control组,Phe处理组乙烯生成速率在第4、6天时显著低于Control组。
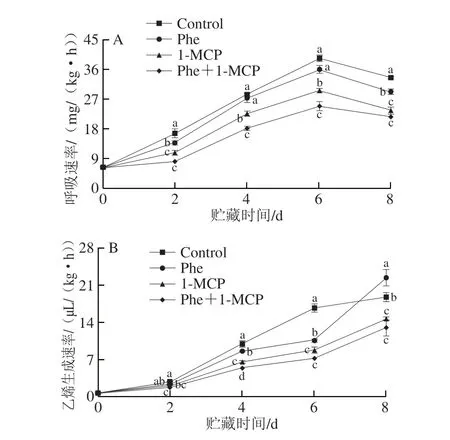
图5 Phe和1-MCP处理对桃果实呼吸速率(A)、乙烯生成速率(B)的影响Fig.5 Effects of Phe and/or 1-MCP treatments on the respiration intensity (A) and ethylene production rate (B) of peach fruits
2.7 Phe和1-MCP处理对桃果实乙烯合成和信号转导相关基因表达的影响
为探究Phe和1-MCP处理的桃果实采后乙烯生物合成减少的原因,对乙烯生物合成和信号转导相关基因的表达量进行分析。乙烯代谢相关基因表达量在贮藏过程中大多呈现先升高后降低的趋势(图6)。与Control组相比,Phe和1-MCP处理明显降低了贮藏前期(第2、4天)多个乙烯代谢相关基因的表达量,其中Phe+1-MCP处理组多个乙烯代谢相关基因的表达量显著低于其他各处理组(图6)。贮藏第2、4天时,Phe+1-MCP处理组中乙烯合成(SAMS、ACS和ACO)和乙烯下游信号元件(CTR1、EIN4、EIN2和EIL)相关基因表达量均显著低于Control组。贮藏第8天时,Phe+1-MCP处理组中ACS、CTR1、EIN2和EIL基因的表达量显著低于Control组。
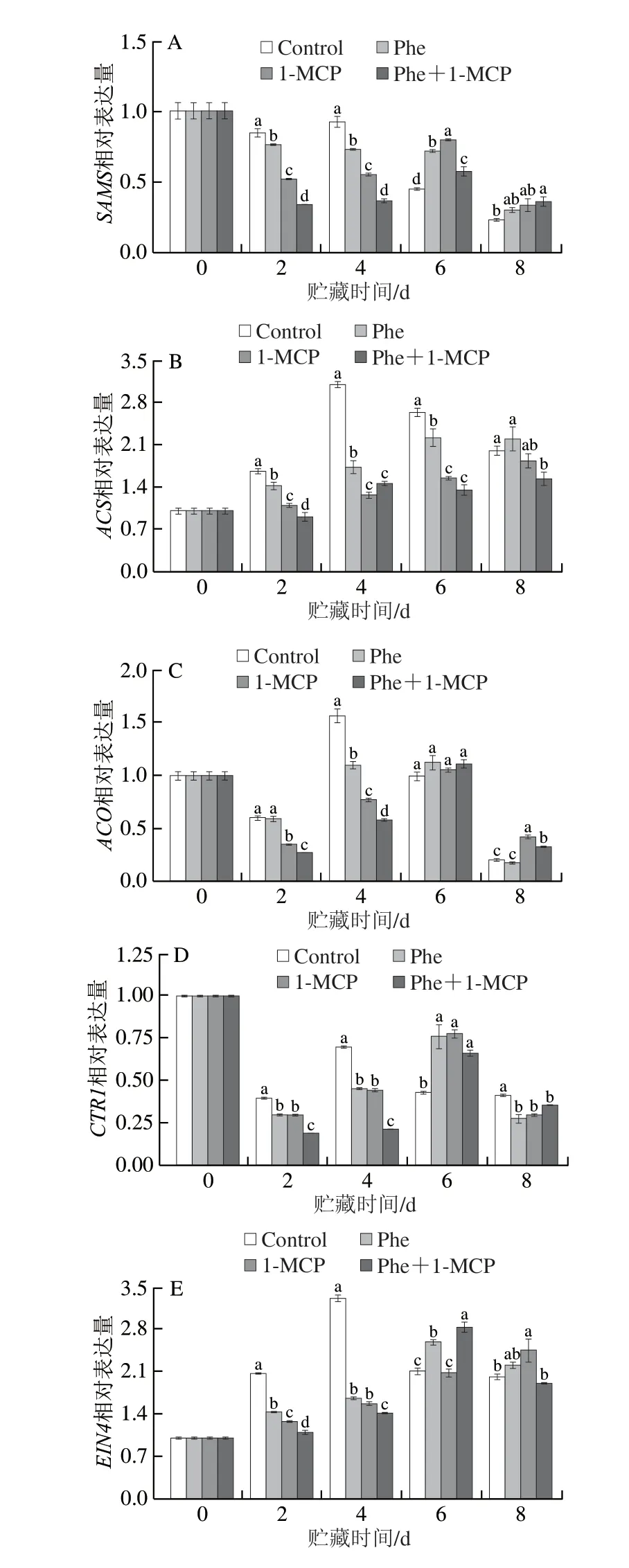
图6 Phe和1-MCP处理对桃果皮乙烯代谢相关基因表达的影响Fig.6 Effects of Phe and/or 1-MCP treatments on gene expression associated with ethylene metabolism in peach peel
3 讨论
花色苷是桃果皮主要的呈色物质,本课题组前期研究发现双层纸袋套袋会降低桃果实采收时的花色苷含量,导致果实外观偏白[3-4];且花色苷的生物合成不仅与光和温度有关,也可能与乙烯、糖信号等密切相关[3,25]。传统观点认为乙烯会促进花色苷的生物合成,1-MCP处理会延缓果实的成熟和衰老,还会抑制果实的着色。例如李秀芳等[13]发现采后1-MCP处理会抑制苹果花色苷含量的上升;徐燕红[14]发现1-MCP处理会延缓‘桃形李’果实花色苷含量的增加;Zhang Wanli等[15]发现1-MCP处理会抑制油桃果肉花色苷的积累。但本研究以套袋采收的中晚熟桃品种为实验材料,发现采后1-MCP处理可以有效地促进桃果实的着色,1-MCP处理后桃果皮的色泽a*值、CIRG和ΔE显著提高,花色苷含量也显著高于对照组(P<0.05)。这与本课题组前期的研究结果一致:乙烯处理会抑制套袋早熟桃‘春美’的着色,1-MCP处理可以缓解其抑制效应[3]。本研究结果说明1-MCP处理可能在套袋采收的早熟和中晚熟桃品种中发挥着相似的作用,即促进桃果实的采后着色。近年来,乙烯对果实花色苷生物合成的负面影响也在一些物种中有所报道,如Ni Junbei等[16]发现乙烯对红梨花色苷的生物合成具有抑制作用,本研究结果与其一致,可为乙烯对不同果实花色苷积累有负面影响这一结论进行补充。1-MCP处理对苹果[13]、李[14]、桃[3]、梨[16,26]等水果花色苷含量有不同的影响,这说明1-MCP处理对不同果实中花色苷的形成可能存在不同的作用机制。
Phe是花色苷生物合成的前体物质[6,26],在花色苷生物合成通路中发挥重要的作用。Aghdam等[27]发现Phe处理能够促进番茄果实酚类、黄酮类化合物与番茄红素的积累;Sogvar等[9]的研究证明外源Phe处理促进李果实花色苷及黄酮类化合物含量增加。本研究发现Phe处理可以有效促进桃果实的着色(图1)和花色苷的积累(图3),与前人研究结果一致。虽然1-MCP和Phe单独处理均可促进套袋桃果实花色苷的合成,但本研究发现Phe结合1-MCP处理可以更有效地促进桃果皮色泽的形成,使其花色苷含量明显高于Phe和1-MCP单独处理组。在植物培养过程中,适当添加Phe能促进野生型拟南芥合成更多的花青素,说明Phe含量对花青素合成起重要作用[8]。这可能是因为Phe结合1-MCP处理增加了桃果实中花色苷合成前体物质的含量,因此其花色苷合成能力明显高于1-MCP处理组。本研究还发现Phe和1-MCP处理均可有效促进花色苷合成相关基因(PAL、CHS、CHI、F3H、DFR、ANS、UFGT、MYB10.1、bHLH-3和WD40-1)的表达,且Phe+1-MCP组基因表达量显著高于Phe和1-MCP单独处理组,这可能是Phe+1-MCP处理能够更有效地促进桃果皮花色苷含量升高的直接原因。桃属于呼吸跃变型果实,在采后贮藏期间呼吸强度和乙烯释放量会迅速提高[17]。本研究中1-MCP处理可以有效抑制桃果实的呼吸强度和乙烯释放速率,且显著抑制贮藏前期桃果实乙烯合成和信号转导相关基因的表达,与周慧娟等[28]的研究结果一致。本研究还发现Phe+1-MCP处理可以有效降低桃果实乙烯释放速率和乙烯合成和信号转导相关基因的表达,这也可能是其能更有效地促进桃果实花色苷含量升高的原因。本课题组前期研究发现抑制乙烯后桃果实花色苷合成量明显增加[3]。Phe+1-MCP处理对花色苷合成的协同效应还需要进一步验证和阐明其机制。
Phe、1-MCP和Phe+1-MCP复合处理均能不同程度地改善套袋桃采后着色困难的问题,有效提升桃总花色苷含量及花色苷单体含量,Phe结合1-MCP处理对花色苷的合成具有协同效应。Phe+1-MCP处理可有效提升桃果皮花色苷合成相关基因的表达量,且降低部分乙烯合成和信号转导相关基因的表达量,本研究可为1-MCP结合Phe在桃采后色泽调控中的应用提供理论依据和技术参考。
