陈年武夷岩茶对葡聚糖硫酸钠诱导小鼠结肠炎的缓解作用及肠道菌群的影响
2023-08-12曾鸿哲方雯雯唐静怡欧阳建陈金华王英姿黄建安刘仲华
曾鸿哲,方雯雯,周 方,唐静怡,岳 林,欧阳建,陈金华,王英姿,黄建安,刘仲华
(湖南农业大学 茶学教育部重点实验室,国家植物功能成分利用工程技术研究中心,植物功能成分利用省部共建协同创新中心,农业农村部园艺作物基因资源评价利用重点实验室,湖南 长沙 410128)
炎症性肠病(inflammatory bowel disease,IBD)是一类常见的慢性胃肠道疾病,包括克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)[1-2],其中UC最为常见。在过去的30 年内,IBD发病率在全球呈上升趋势,尤其在发达国家表现明显[3-4]。葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠炎小鼠是一个被广泛使用的模型,其主要特征是小鼠体质量减轻、腹泻、便血、结肠长度缩短、炎症标志物表达水平增加和肠道菌群紊乱等[5-7]。IBD复杂的发病机制和多种环境因素的干扰[8]对于设计有效的IBD治疗方法是一个巨大挑战,考虑到目前治疗IBD中存在的困难,通过饮食干预等措施降低IBD发生的风险变得尤为重要。目前的研究表明,肠道菌群紊乱包括某些保护性细菌(如Akkermansia)数量的减少或致病细菌(如Escherichia)数量的增加等,从而导致肠道炎症的发生[9-10]。近年来,有研究进一步证明IBD特征肠道菌群的出现先于IBD的发病[11],因此,肠道菌群可作为预测IBD发生以及评价IBD治疗效果的重要指标。
武夷岩茶是中国传统名茶,因其独特的“岩骨花香”而闻名于世,属于半发酵的乌龙茶类。长期的民间饮用实践表明,武夷岩茶具有调理肠胃不适、缓解腹泻等作用[12],但目前还鲜见武夷岩茶对DSS诱导小鼠结肠炎影响的相关研究报道。近年来,随着我国茶叶产量不断提高,茶产业供过于求的趋势不断加剧,大量茶叶因未能及时销售而被存放,成为陈茶。在贮藏过程中[13],茶叶中的茶多酚等功能成分的含量发生了变化。因此,本实验选择了2 种不同年份(2001年、2011年)的陈年武夷岩茶和1 种非陈年武夷岩茶(2020年),通过建立DSS诱导的小鼠结肠炎模型,评估陈年武夷岩茶对小鼠结肠组织病理学特征、结肠炎性细胞水平、血清炎症因子水平和肠道菌群的影响,以期为通过健康属性驱动陈年武夷岩茶的科学消费提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
50 只SPF级6~7 周龄雌性C57BL/6JGpt小鼠购自江苏集萃药康生物科技有限公司,实验动物生产许可证号:SCXK(苏)2018-0008。
武夷岩茶(2001年大红袍、2011年大红袍和2020年大红袍)由福建武夷山市茶产业发展中心提供,为同一茶树品种、同一级别的鲜叶原料加工精制而成,包装后贮存于干燥、无异味、清洁、阴凉的茶叶贮存室中,环境温度常年控制在25 ℃以内,相对湿度控制在50%以内。
白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等酶联免疫分析试剂盒(enzyme-linked immunosorbent assay,ELISA)购于武汉华美生物工程有限公司;DSS购于美国MP Biomedicals公司。
1.2 仪器与设备
多功能酶标分析仪 深圳市汇松科技发展有限公司;ECLIPSE Ci正置显微镜 日本尼康公司;聚合酶链式反应仪(polymerase chain reaction,PCR) 美国赛默飞公司;NovaSeq6000测序仪 美国Illumina公司。
1.3 方法
1.3.1 武夷岩茶提取物的制备及灌胃剂量的选择
武夷岩茶提取物制备:称取25 g茶样,加入500 mL的沸水,在100 ℃水浴中提取45 min,过滤后,重复提取茶样30 min,将滤液合并后冷冻干燥。将制备的武夷岩茶提取物按照每天450 mg/kgmb的剂量灌胃小鼠,根据体表面积归一化方法按式(1)推算[14-15],灌胃剂量相当于人体每日约饮茶7.8 g,一般而言,武夷岩茶每泡茶为8 g,这相当于每人每天喝1 泡茶,在合理范围内。
式中:D为灌胃剂量(0.45 g/kgmb);m为人体质量(60 kg);C为换算系数(12.33);R为浸提率(28%)。
1.3.2 动物实验
动物实验经湖南农业大学动物实验委员会批准,批准号:[伦审科2021第(2138)号],动物房温度24~26 ℃,12 h/12 h明暗循环,小鼠自由饮水进食。
50 只雌性C57BL/6JGpt小鼠适应性喂养1 周后,以每组10 只随机均分为5 组:正常对照组(Control);DSS模型组;DSS+OT01组(灌胃20 年陈茶即2001年武夷岩茶提取物);DSS+OT11组(灌胃10 年陈茶即2011年武夷岩茶提取物);DSS+OT20组(灌胃非陈茶即2020年武夷岩茶提取物)。除对照组之外,其他组通过连续7 d采用在饮水中加入质量分数3% DSS的方法构建小鼠建立肠炎模型[7,16],所有小鼠在处死前的最后2 d饮用蒸馏水。DSS+OT01组、DSS+OT11组和DSS+OT20组在实验过程中接受剂量为450 mg/kgmb武夷岩茶的干预,共持续9 d。每天监测小鼠结肠炎症状,包括粪便特征、出血状况和体质量情况。解剖后,收集结肠组织、盲肠内容物和血清并贮存以便后续分析。
1.3.3 指标测定
1.3.3.1 武夷岩茶提取物的化学成分分析
武夷岩茶提取物的成分测定:依据GB/T 8313—2018《茶叶中茶多酚和儿茶素类含量的检测方法》进行茶多酚总质量分数测定,采用高效液相色谱法[17]检测6 种儿茶素组分质量分数;根据系统分析法测定茶三素(茶黄素类(theaflavins,TFs)、茶红素类(thearubigins,TRs)和茶褐素(theabrownine,TB))质量分数。
1.3.3.2 实验小鼠日常指标观测
根据文献[18-19]描述的方法观测实验小鼠的日常指标,按动物体质量下降率(大于15%为4 分,10%~15%为3 分,5%~10%为2 分,1%~5%为1 分,体质量不变为0 分)、粪便黏稠度(腹泻为4 分,粪便松散为2 分,正常为0 分)和粪便出血(显性出血为4 分,隐性出血阳性为2 分,正常为0 分)情况进行综合评价。以上述各项评分为相应指数,按式(2)计算疾病活动指数(disease activity index,DAI)。
1.3.3.3 实验小鼠结肠组织病理学分析
首先取小鼠结肠组织并固定在质量分数4%多聚甲醛固定液中,包埋之后做切片,使用苏木精-伊红(hematoxylin-eosin,H&E)染色。根据文献[7,20]描述的方法进行组织病理学分析及结肠炎症相关组织学评分(表1)。

表1 结肠炎症相关组织学评分标准Table 1 Criteria for evaluation of inflammation-associated cecal histological changes
1.3.3.4 实验小鼠血清和结肠炎症因子检测
小鼠眼珠取血后,室温静止2 h后,4 ℃离心1 次(3 500 r/min、15 min),收集血清,置于-80 ℃冰箱保存。取50 mg结肠组织,用1×磷酸盐缓冲液洗去血污。剪成小块放入组织研磨器(匀浆管)中,加入0.5 mL 1×磷酸盐缓冲液,制成匀浆,然后置于-20 ℃过夜。经过反复冻融2 次处理破坏细胞膜后,将组织匀浆于2~8 ℃、5 000×g条件下离心5 min并取上清液。严格按照ELISA试剂盒说明书检测各组小鼠血清和结肠炎症因子IL-6、IL-1β、TNF-α的水平。
1.3.3.5 小鼠盲肠内容物菌群分析
采用十六烷基三甲基溴化铵(hexadecyltrimethylammonium bromide,CTAB)法对样本的基因组DNA进行提取,之后通过琼脂糖凝胶电泳进行分析,取适量样品用无菌水稀释至1 ng/μL,选择V3~V4高变区作为目标测序区,正向引物为341F(5’-CCTAYGGGRBGCASCAG-3’),反向引物为806R(5’-GGACTACNNGGGTATCTAAT-3’)。构建好的文库经过Qubit定量和文库检测,合格后使用NovaSeq6000测序仪进行测序,序列分析通过QIIME2软件包进行[21]。
1.4 数据统计与分析
所有数据使用SPSS Statistics 20.0软件进行分析,实验结果采用平均值±标准差表示。各组比较应用方差分析法,运用Tukey检验两两比较,当P<0.05时具有统计学显著性差异。
2 结果与分析
2.1 陈年武夷岩茶水提物主要成分含量分析结果
陈年武夷岩茶水提物的主要成分含量如表2所示。茶多酚、儿茶素总量、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、表没食子儿茶素(epigallocatechin,EGC)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、表儿茶素(epicatechin,EC)、没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)和儿茶素(catechin,DL-C)质量分数随着贮存时间延长整体呈下降趋势;TB质量分数呈现整体上升趋势;此外,TFs和TRs质量分数呈现出先上升再下降的趋势。
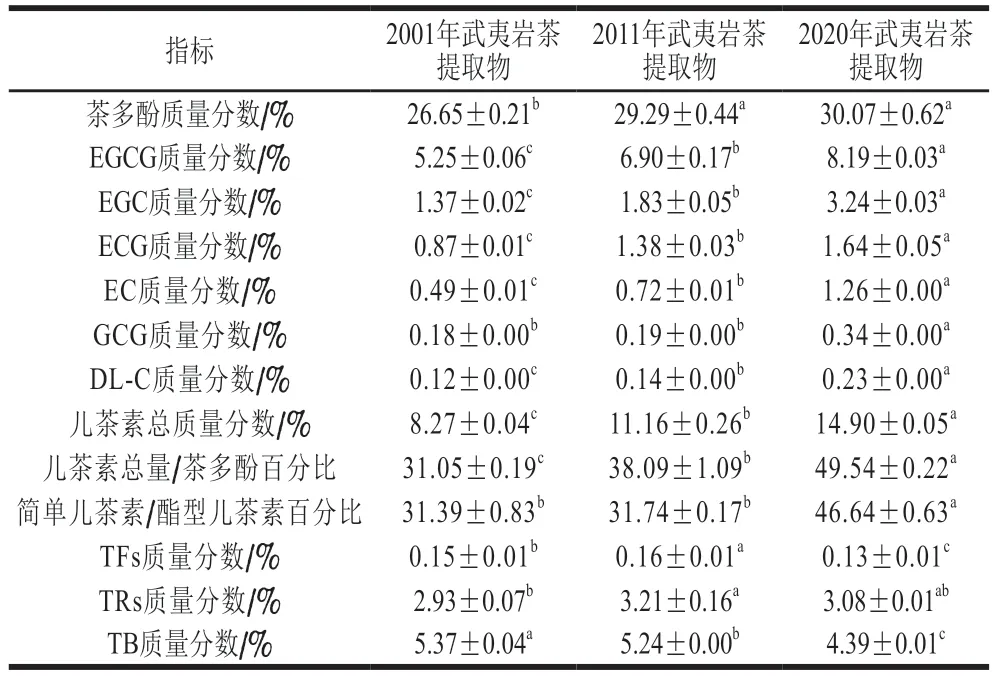
表2 陈年武夷岩茶提取物主要成分质量分数Table 2 Contents of phenolic components in infusion of aged Wuyi rock tea
2.2 小鼠的体质量、腹泻评分和DAI变化
小鼠的体质量变化情况如图1A所示,实验前期,小鼠的体质量变化较为稳定。从第5天开始,经过DSS处理的4 组小鼠体质量开始下降,其中DSS组体质量下降最为明显;经过9 d的武夷岩茶干预后,DSS+OT11组和DSS+OT20组小鼠体质量均与DSS组出现显著性差异(P<0.05)。实验结束时(第9天)各组小鼠的腹泻程度如图1B所示,Control组小鼠均未出现腹泻情况,与经过DSS处理的4 组小鼠有显著差异(P<0.05);DSS组小鼠均出现严重腹泻情况,与经过陈年武夷岩茶干预的2 组小鼠有显著差异(P<0.05)。小鼠的疾病严重程度变化如图1C所示,由于DSS引发的肠道炎症反应,小鼠粪便从第3天开始呈松散状;到第4天,粪便开始隐性出血,并随着DSS处理时间的延长;到第6天粪便已无具体形态,并且部分小鼠有明显粪便带血和轻微的脱肛现象;小鼠经过DSS处理和陈年武夷岩茶干预后,腹泻情况和便血情况得到显著缓解(P<0.05)。虽然陈年武夷岩茶干预能够一定程度缓解DSS带来的不良反应,但是综合来看,缓解效果DSS+OT11组≈DSS+OT20组>DSS+OT01组。

图1 陈年武夷岩茶对DSS诱导结肠炎小鼠体质量、腹泻评分及DAI的影响Fig.1 Effect of aged Wuyi rock tea on body mass,diarrhea score and DAI of mice with DSS-induced colitis
2.3 陈年武夷岩茶对DSS诱导小鼠结肠的影响
如图2A和图2B所示,DSS组小鼠结肠长度较Control组显著缩短(P<0.05);陈年武夷岩茶干预的2 组小鼠结肠长度有所恢复,并与模型组相比差异显著(P<0.05),但DSS+OT20组结肠长度恢复情况最好,与Control组相比基本恢复正常。图2C的H&E染色结果表明,陈年武夷岩茶干预能够缓解DSS引起的肠道黏膜、隐窝损坏和炎性细胞浸润;基于H&E染色的结肠炎症组织学评分进一步显示,陈年武夷岩茶干预的效果有所不同,其中DSS+OT20组与DSS+OT11组效果接近,且优于DSS+OT01组(图2D)。

图2 陈年武夷岩茶对DSS诱导结肠炎小鼠结肠长度、结肠组织学和炎症相关组织学评分的影响Fig.2 Effect of aged Wuyi rock tea on colon length,colon histology and inflammation-associated histological score of mice with DSS-induced colitis
2.4 陈年武夷岩茶对DSS诱导小鼠炎症因子的影响
由图3可知,与Control组相比,DSS组血清和结肠中的IL-6、TNF-α和IL-1β水平都显著提高(P<0.05);与DSS组相比,经过武夷岩茶干预的3 组小鼠血清和结肠中的IL-6、TNF-α和IL-1β水平都呈不同程度地显著下降(P<0.05),其中DSS+OT01组血清中的TNF-α水平,DSS+OT11组血清中的TNF-α、IL-1β水平,DSS+OT20组血清中的TNF-α、IL-1β水平,DSS+OTs结肠中的IL-6、TNF-α水平均恢复正常。综合来看,对炎症因子影响效果DSS+OT11组≈DSS+OT20组>DSS+OT01组。
2.5 陈年武夷岩茶对DSS诱导小鼠肠道菌群的影响
2.5.1 陈年武夷岩茶对DSS诱导小鼠肠道菌群结构的影响
微生物对于结肠炎的发展至关重要,通过调节肠道菌群改善结肠炎是目前的研究热点[22]。因此,本研究利用实验结束时收集的盲肠内容物进行了16S rDNA的V3~V4区PCR扩增后测序,以检测肠道微生物的变化。由图4A和图4B可知,与DSS组相比,陈年武夷岩茶干预组的Shannon指数以及Simpson指数均无统计学差异。如图4C所示,主坐标分析结果显示不同组间微生物群落结构有明显差异,陈年武夷岩茶干预使DSS诱导小鼠肠道菌群结构向Control组变化。
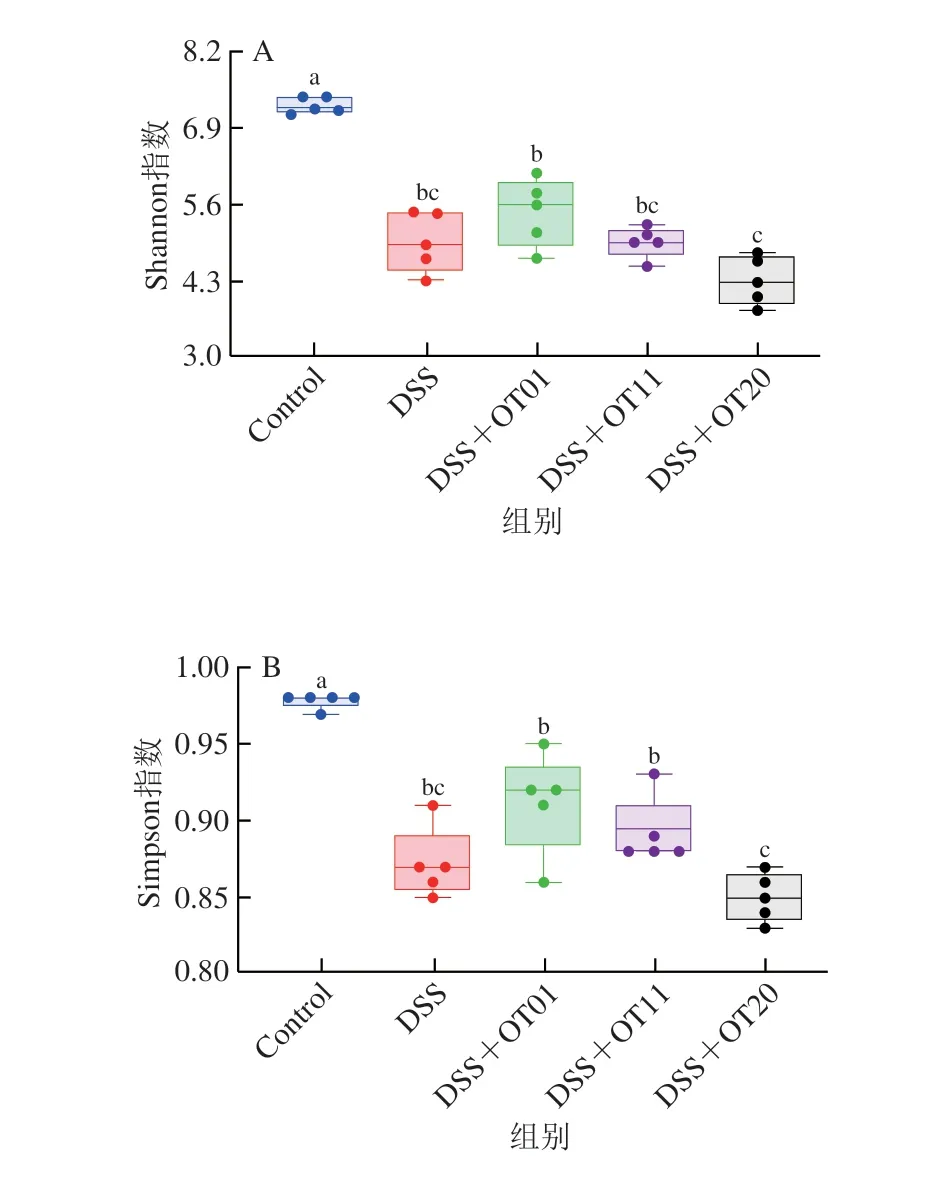
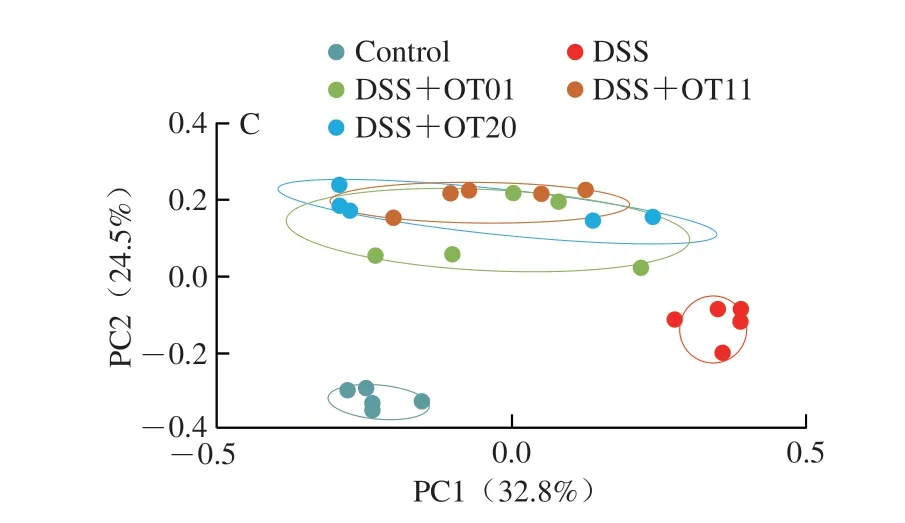
图4 陈年武夷岩茶对DSS诱导结肠炎小鼠肠道微生物区系组成的影响Fig.4 Effect of aged Wuyi rock tea on gut microbiota composition of mice with DSS-induced colitis
图5A~C反映了肠道微生物在门、科、属3 个层面的相对丰度,以区分微生物类群。如图5A所示,小鼠肠道微生物主要由5 个门组成,包括Firmicutes、Bacteroidetes、Verrucomicrobia、Proteobacteria和Deferribacteres。与Control组相比,DSS组的Proteobacteria和Deferribacteres的相对丰度增加,而Firmicutes、Bacteroidetes和Verrucomicrobia的相对丰度降低。在科水平上,与Control组相比,DSS组的Enterobacteriaceae、Rikenellaceae和Deferribacteraceae的相对丰度增加,而Verrucomicrobiaceae、Odoribacteraceae和Coriobacteriaceae的相对丰度降低(图5B)。在属水平上,与Control组相比,DSS组的Unspecified_Enterobacteriaceae、Oscillospira、Unspecified_Rikenellaceae、Unspecified_Bacteroidales、Mucispirillum、Unspecified_Desulfovibrionaceae、Escherichia、Parabacteroides、Enterococcus和Alistipes的相对丰度增加,而Akkermansia、Odoribacter、Desulfovibrio和Adlercreutzia的相对丰度降低(图5C),陈年武夷岩茶干预明显影响了肠道菌群的构成,特别是逆转了DSS导致的Verrucomicrobia、Proteobacteria、Enterobacteriaceae、Verrucomicrobiaceae、Odoribacteraceae、Unspecified_Enterobacteriaceae、Oscillospira、Unspecified_Bacteroidales、Escherichia、Enterococcus、Akkermansia和Odoribacter相对丰度变化。新型的元基因组学分析方法线性判别分析效应大小(linear discriminate analysis size effect,LefSe)分析(图5D)和线性判别分析(linear discriminant analysis,LDA)(图5E)显示了各组中的优势菌群,Firmicutes、Lachnospiraceae、Desulfovibrionaceae、Ruminococcus、Coprococcus、Desulfovibrio和Roseburia是Control组的优势菌群;Deferribacteres、Proteobacteria、Ruminococcaceae、Deferribacteraceae、Lactobacillaceae、Enterobacteriaceae、Escherichia、Oscillospira、Mucispirillum、Lactobacillus和Enterococcus是DSS组的优势菌群;Bacteroidetes、Odoribacteraceae和Odoribacter是DSS+OT01组的优势菌群;Turicibacteraceae、Turicibacter和AF12是DSS+OT11组的优势菌群;Verrucomicrobia、Verrucomicrobiaceae和Akkermansia是DSS+OT20组的优势菌群。
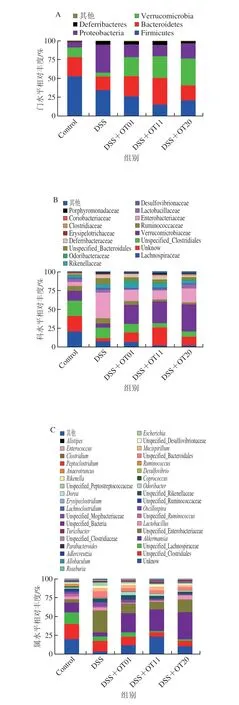
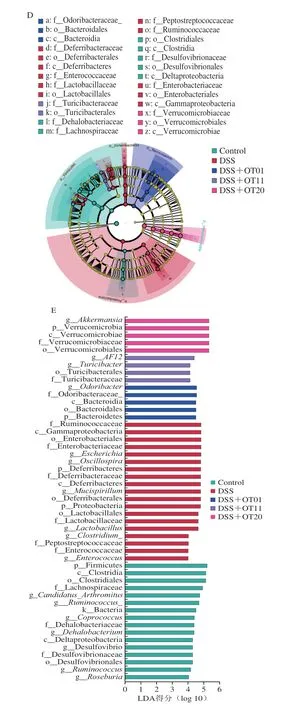
图5 陈年武夷岩茶对DSS诱导结肠炎小鼠肠道微生物相对丰度及LEfSe分析的影响Fig.5 Effect of aged Wuyi rock tea on the relative abundance of gut microbiota and LEfSe analysis of mice with DSS-induced colitis
2.5.2 特定类群微生物变化与结肠长度相关性分析结果
在DSS诱导的结肠炎模型中,结肠炎小鼠结肠长度往往明显缩短,结肠长度与腹泻、炎症因子过表达和肠道菌群失调密切相关,而通过特定的菌株灌胃干预可以有效地增加结肠长度,缓解体质量减轻,降低炎症水平[23-25]。为了进一步分析武夷岩茶和DSS对不同菌的影响,本实验评估了武夷岩茶干预后小鼠肠道菌群的变化。通过斯皮尔曼相关性分析进一步研究了特定细菌群相对丰度与结肠长度之间的相关性。如图6所示,结肠长度与Actinobacteria(r=0.523 5;P=0.003 6)(图6C)、S24_7(r=0.571 7;P=0.001 0)(图6E)、Coriobacteriaceae(r=0.603 0;P=0.000 5)(图6G)、Desulfovibrio(r=0.496 4;P=0.005 3)(图6J)和Adlercreutzia(r=0.613 8;P=0.000 4)(图6K)的相对丰度呈显著正相关;结肠长度与Proteobacteria(r=-0.535 6;P=0.002 3)(图6A)、Deferribacteres(r=-0.475 1;P=0.008 0)(图6B)、Enterobacteriaceae(r=-0.530 8;P=0.002 5)(图6D)、Deferribacteraceae(r=-0.475 1;P=0.008 0)(图6F)、Mucispirillum(r=-0.475 1;P=0.008 0)(图6H)和Escherichia(r=-0.566 5;P=0.001 1)(图6I)的相对丰度呈显著负相关。
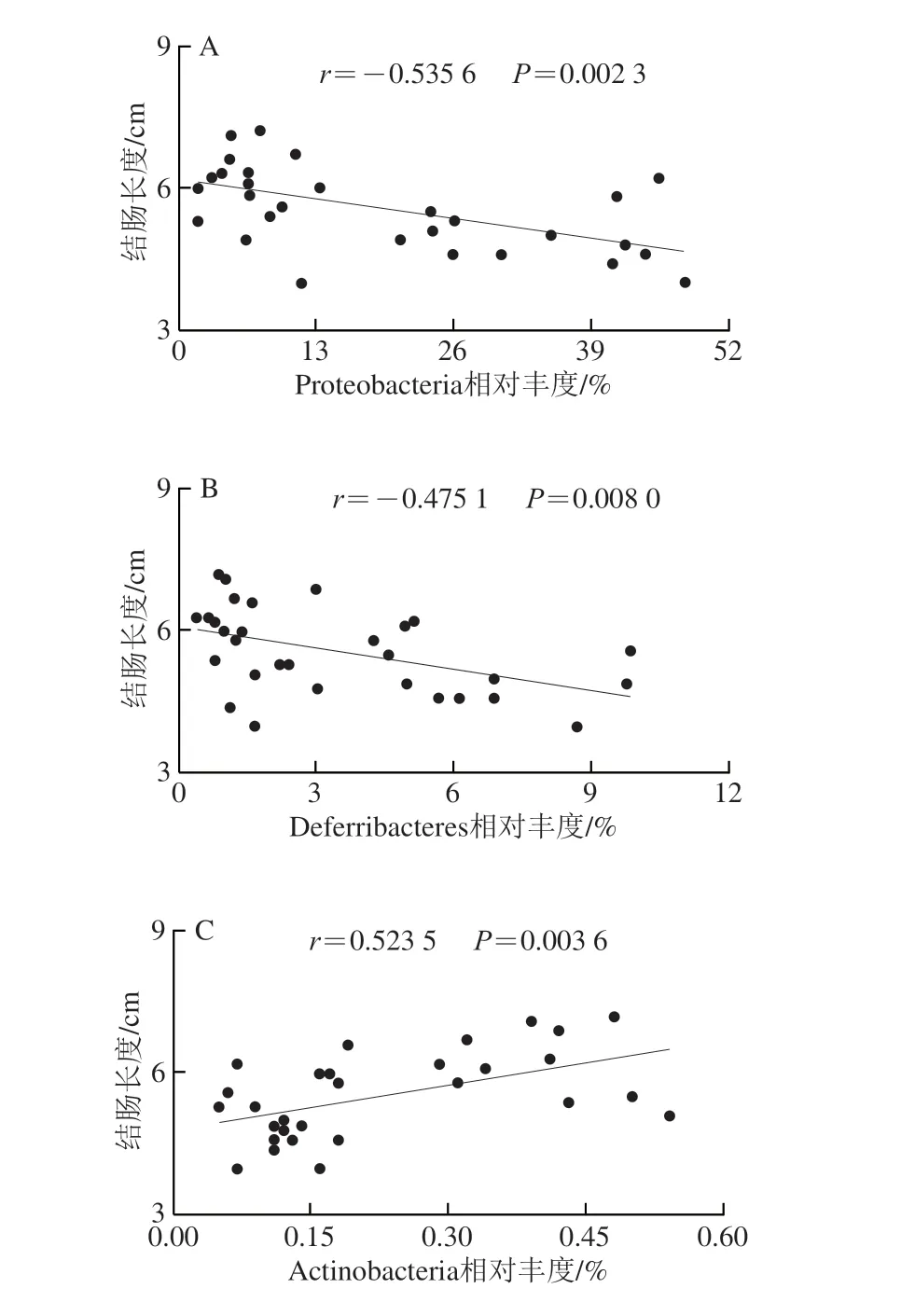
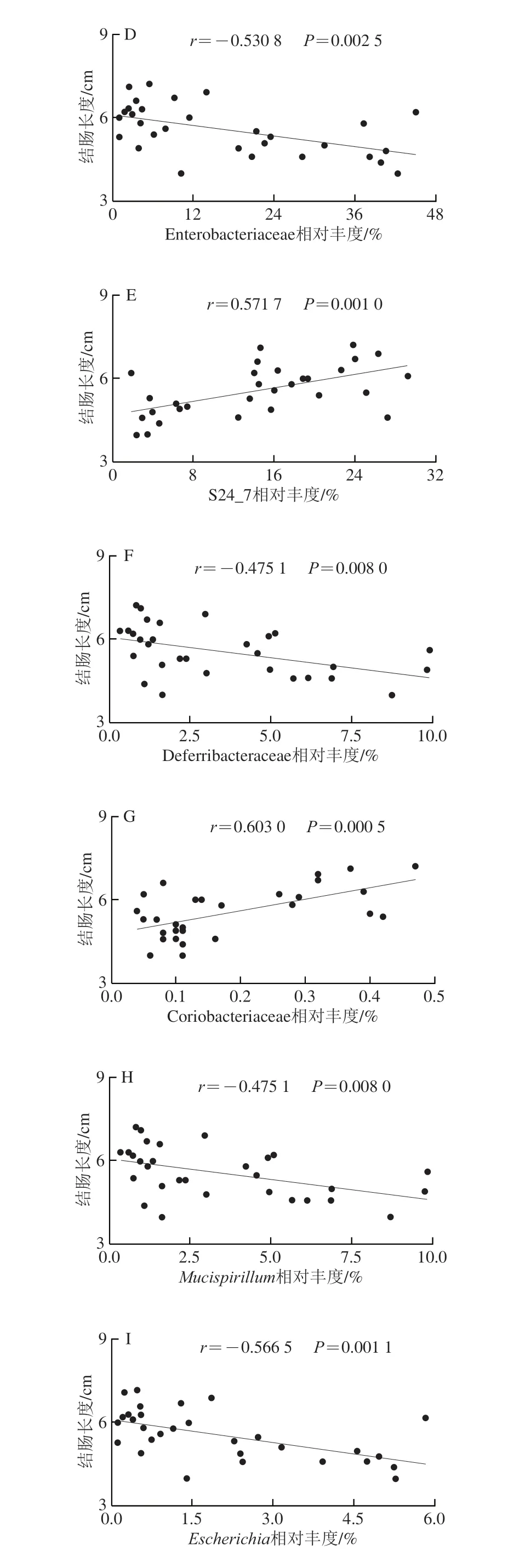
图6 特定菌群与结肠长度的相关性分析Fig.6 Correlation analysis between specific gut microbiota and colon length
2.6 陈年武夷岩茶多酚类物质含量与结肠炎小鼠炎症水平的相关性分析
如图7所示,茶多酚质量分数、儿茶素总质量分数及6 种儿茶素组分(EGCG、EGC、ECG、EC、GCG、DL-C)质量分数均与结肠中IL-6含量呈现显著负相关(P<0.05),与血清中TNF-α、IL-1β质量浓度以及结肠中IL-1β含量呈现极显著负相关(P<0.01);TFs质量分数与血清中IL-6质量浓度、结肠中IL-1β含量呈现显著负相关(P<0.05),与结肠中IL-6、TNF-α含量以及血清中IL-1β质量浓度呈现极显著负相关(P<0.01);TRs质量分数与血清中IL-6质量浓度呈现显著负相关(P<0.05),与结肠中IL-6含量、血清TNF-α质量浓度、血清IL-1β质量浓度、结肠IL-1β含量呈现极显著负相关(P<0.01);TB质量分数与结肠中IL-6、TNF-α含量呈现极显著负相关(P<0.01)。综上,TRs是与结肠炎小鼠炎症水平相关性最明显的功能成分。
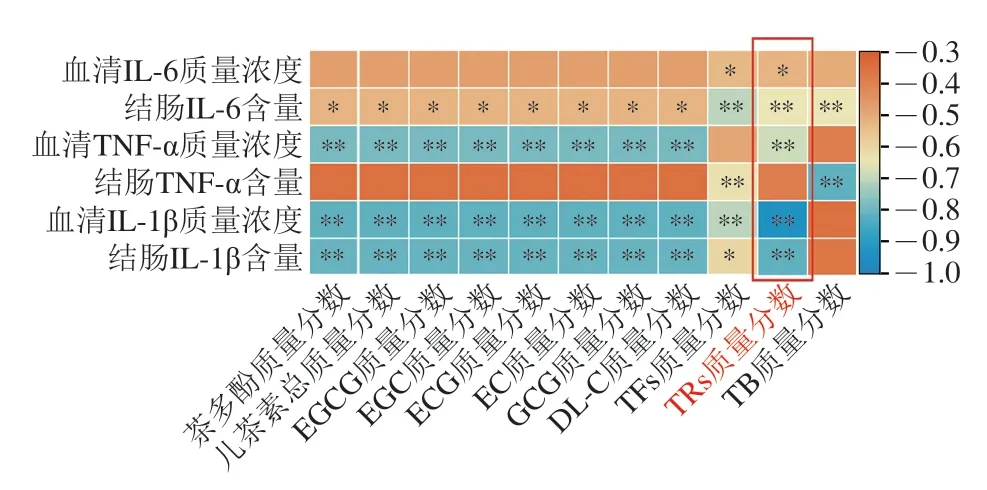
图7 陈年武夷岩茶多酚类物质含量与结肠炎小鼠炎症水平的相关性分析Fig.7 Correlation analysis between polyphenol contents of aged Wuyi rock tea and serum and colonic inflammation in mice with DSS-induced colitis
3 讨论
UC因其在世界范围内的高流行率而广为人知。本研究采用DSS诱导小鼠结肠炎模型模拟临床UC,在3% DSS造模7 d后,DSS组小鼠粪便呈水样并便血,表明造模成功[7]。本实验结果发现虽然陈年武夷岩茶(2001年、2011年)干预无法直接阻止结肠炎的发生,但是能够不同程度减轻相关损伤,表明武夷岩茶可以作为一种有效的饮食策略缓解结肠炎。
近年来,关于茶叶中的多酚物质在消炎、抗氧化等方面已有大量文献报道[26]。有研究表明,茶叶中的活性成分EGCG对DSS诱导小鼠结肠炎有明显改善作用,而临床试验进一步验证了EGCG可以缓解结肠炎患者的症状[27-28],因此,EGCG被认为是茶叶缓解DSS诱导小鼠结肠炎的主要功能成分。本实验结果表明,随着存储时间的延长,儿茶素总质量分数及6 种儿茶素组分(EGCG、EGC、ECG、EC、GCG、DL-C)质量分数均明显降低,TB质量分数明显增加。传统观点将茶叶的抗氧化消炎等作用主要归因于以EGCG为代表的多酚类物质[29],而茶叶随着贮存时间的延长,EGCG等多酚物质含量及多酚总量会发生明显下降,从理论上分析,其抗氧化消炎活性也会发生明显下降。但从本研究各个指标结果综合来看,陈年武夷岩茶(2011年)和非陈年武夷岩茶(2020年)对DSS诱导的小鼠结肠炎的缓解作用无明显差别,即经过10 年的贮存,其抗氧化消炎能力无明显变化,出现这种矛盾的原因可能是EGCG等儿茶素的适当氧化聚合产物也具有很好的消炎抗氧化功能。Wu Ximing等[30]也得到了与本实验相似的结果,其发现在缓解胰岛素敏感性方面,EGCG部分氧化聚合产物的效果甚至优于EGCG。这也提示,由EGCG等儿茶素适当氧化聚合而成的多酚物质可能在陈茶抗氧化消炎功能中发挥着关键作用。与此同时,本实验还发现陈年武夷岩茶(2001年)在缓解DSS诱导的小鼠结肠炎的体质量减轻、腹泻、结肠损伤以及炎症因子水平增加方面,与陈年武夷岩茶(2001年)和非陈年武夷岩茶(2020年)有一些差距。这可能是因为EGCG等儿茶素的适当氧化聚合产物虽然具有很好的消炎抗氧化功能,但随着其进一步的氧化聚合,其抗氧化性会逐步减弱乃至消失,因而无法弥补由EGCG等功能成分含量减少导致的消炎抗氧化活性减弱。研究表明,EGCG等小分子质量多酚会发生氧化聚合先转变为TFs,而TFs再进一步氧化得到TRs乃至TB[31]。本实验中陈年武夷岩茶(2011年)组的TFs含量和TRs含量均高于另外一种年份的陈年武夷岩茶(2001年)和非陈年武夷岩茶(2020年)。陈年武夷岩茶多酚类物质含量与结肠炎小鼠炎症水平的相关性分析表明,TRs是与结肠炎小鼠炎症水平相关性最明显的功能成分,因而推测这种潜在功能成分可能属于TRs。下一步将分离纯化武夷岩茶中的TRs,并将其按分子质量分成不同组分,在同一标准下进行EGCG、中等分子质量TRs及高分子质量TRs的抗氧化消炎活性研究。
腹泻情况、疾病活动指数以及结肠病理切片是评估DSS诱导小鼠结肠炎的典型指标,能客观准确地反映疾病的发展情况[7]。本实验结果表明,陈年武夷岩茶干预可以显著缓解腹泻、便血以及疾病活动情况(图1),这表明陈年武夷岩茶有助于维护肠道的正常功能。结肠病理学切片及组织学评分表明DSS会导致结肠的正常结构受到破坏,而陈年武夷岩茶干预能够明显缓解结肠肠道黏膜损坏、隐窝损坏以及炎性细胞浸润,维持正常结肠形态(图2)。Huang Yina等[32]采用3% DSS诱导小鼠结肠炎,并利用茶叶提取物进行干预,结果发现茶叶提取物显著降低了结肠炎小鼠的疾病活动指数,抑制了结肠黏膜结构损伤和炎症细胞浸润,本实验发现陈年武夷岩茶也具有相同的效果。在正常的机体中,血清中的促炎因子和抗炎因子处于平衡状态,而DSS处理小鼠的血清中促炎因子往往过表达,破坏了正常机体的平衡[33]。因此,降低血清中促炎因子水平是缓解结肠炎的重要途径。最近的研究表明,降低IL-1β、IL-6和TNF-α的表达可以明显缓解DSS诱导的小鼠结肠炎症状[34]。在本研究中,DSS造模后小鼠结肠的炎性细胞浸润增加(图2B),血清中炎症因子IL-6、IL-1β和TNF-α水平增加(图3),而陈年武夷岩茶干预显著改善了这一现象。
据研究,人类肠道中的微生物数量大约为1014个,是人体内细胞数量的10 倍左右,包括共生菌、益生菌和病原菌,它们发挥着营养吸收、宿主防御和免疫发育等功能[35-36]。肠道菌群的平衡可以被生物体内的侵入性抗原、免疫系统的激活和炎症因子的产生破坏[37]。在门水平上,陈年武夷岩茶干预逆转了DSS诱导的Proteobacteria、Verrucomicrobia相对丰度的变化(图5A)。大多数Proteobacteria被认为是有害细菌,在结肠炎患者体内富集[38]。到目前为止,Akkermansia是已知存在于人类肠道中唯一的Verrucommicrobia细菌属,约占人体主要微生物群落总数的3%~5%[39-40]。虽然Akkermansia的发现只有短短十多年,但它已成为学术界的“明星菌”,在IBD、癌症、糖尿病等多种疾病的发展中扮演着重要角色[41]。在本研究中,陈年武夷岩茶干预逆转了DSS诱导的结肠炎小鼠中Akkermansia相对丰度的降低(图5C),因此,Akkermansia可能是陈年武夷岩茶缓解DSS诱导小鼠结肠炎的关键。
结肠属于大肠,其主要功能是吸收水分、贮存和辅助排便[42]。有文献报道当结肠过短时,易引起肠道功能紊乱、菌群失调及免疫失调,影响肠道正常吸收以及产生炎症因子,从而引发腹泻、腹胀及产生炎症反应[43]。据统计,经手术切除部分结肠的患者中约有25%~50%的人群会出现不同程度的腹泻。因此,结肠长度与腹泻、炎症因子过表达和肠道菌群失调密切相关[44]。本实验利用了斯皮尔曼相关性分析进一步研究了特定细菌群相对丰度与结肠长度之间的相关性,研究表明结肠长度与Proteobacteria(r=-0.535 6;P=0.002 3)、Enterobacteriaceae(r=-0.530 8;P=0.002 5)和Escherichia(r=-0.566 5;P=0.001 1)的相对丰度呈显著负相关。Escherichia是变形菌门(Proteobacteria)、肠杆菌科(Enterobacteriaceae)中的典型菌属,它能够通过产生脂多糖从而在炎症的发生、发展中起重要作用[45]。在科、属水平上,DSS诱导的结肠炎小鼠中的Enterobacteriaceae、Escherichia的相对丰度较Control组明显增加,而陈年武夷岩茶干预组小鼠中的相对丰度明显低于Control组(图5B、C)。因此,陈年武夷岩茶对DSS诱导结肠炎的缓解作用可能是通过降低Escherichia的相对丰度来实现的。
综上所述,陈年武夷岩茶均具有缓解DSS诱导小鼠结肠炎的作用,其中陈年武夷岩茶(2011年)干预效果优于陈年武夷岩茶(2001年),这可能是因为EGCG等儿茶素适当氧化产生了消炎抗氧化性更好的TRs。此外,陈年武夷岩茶能够通过调节肠道中Escherichia和Akkermansia等微生物的相对丰度,维护肠道稳态,对DSS诱导的结肠炎小鼠的体质量减轻、腹泻、结肠长度缩短、黏膜损坏及隐窝损坏、炎性细胞浸润和血清炎症因子过表达等状况起到缓解作用。
