韭菜黄酮的提取和纯化及体外抗氧化活性研究
2023-08-10弓欣彤金继航尹国友
孙 婕,弓欣彤,金继航,尹国友
(河南城建学院 生命科学与工程学院,平顶山 467036)
韭菜,俗称起阳草、长生韭等,是一种药食两用、多年生耐寒植物,与洋葱、大蒜等同属百合科[1]。早在西周时代,周人已开始食用韭菜[2],韭菜中含有丰富的蛋白质、糖类、维生素、矿物质等营养物质,具有很高的食用价值[3]。因其具有抗氧化[4-5]、抗菌杀虫、抗凝血、温肾助阳、润肠通便等功能,被广泛应用于医疗医药、食品、农业等行业[6]。
黄酮类化合物是一种具有不同酚类结构的天然物质,多见于水果、蔬菜、谷物、根、茎、花、茶和酒中[7]。虽然黄酮类化合物通常被认为是非营养物质,但它们对健康有好处,如预防冠心病[8],对癌细胞具有细胞毒性作用[9-10],改善神经系统疾病[11]、哮喘、高血压、精神分裂症和勃起功能障碍[12],且具有抗炎抗菌[13]、抗氧化[14-15]、抗衰老[16]、降血脂、降血糖[17]等作用。黄酮类化合物目前已成为国内外开发利用研究的热点。
韭菜中含有丰富的黄酮类化合物[18-20],早在1980年就有学者从韭菜叶中分离出9种乙酰化的黄酮醇[21]。在韭菜黄酮提取工艺方面有些科研工作者进行了一些研究[22-24],这些研究初步探讨了韭菜黄酮的提取工艺和抗氧化(如羟基自由基的清除效果),并没有对韭菜黄酮进行纯化条件分析和进一步验证其抗氧化效果。为扩大韭菜的应用范围,有必要进行深入研究。
1 材料与方法
1.1 材料与试剂
韭菜:平顶山平丰种业有限公司;大孔树脂D101、X-5、D4020、AB-8、DM301、DA201:郑州和成新材料科技有限公司;芦丁:北京索莱宝科技有限公司;DPPH、ABTS:国药集团化学试剂有限公司;水杨酸:天津市北辰方正试剂厂;硫酸亚铁:天津市致远化学试剂有限公司。其他试剂均为分析纯。
1.2 仪器与设备
YZ-180D超声波清洗器:上海越众仪器设备有限公司;G10S紫外可见分光光度计:美国赛默飞世尔科技公司;RE-52A旋转蒸发仪:上海亚荣生化仪器厂;SCIENTZ-18N/A真空冷冻干燥机:宁波新芝生物科技股份有限公司;HH-1恒温水浴锅:杭州恒仪仪表科技有限公司。
1.3 试验方法
1.3.1 韭菜预处理
韭菜洗净、沥干水分、烘干、粉碎、过筛(80目),备用。
1.3.2 韭菜黄酮提取工艺
参考刘华等[23]的方法并稍作修改。准确称量韭菜粉20 g,在乙醇浓度为80%、超声温度为35 ℃、超声时间为15 min、料液比为125(g/mL)的条件下,超声辅助提取韭菜中的黄酮,提取液真空抽滤后用等体积的石油醚进行多次萃取除杂,然后将滤液放入旋转蒸发仪蒸发,最后将液体进行真空冷冻干燥,获得韭菜黄酮粗提粉末。
1.3.3 芦丁标准曲线的绘制
准确称取15 mg芦丁标准品,加入少量无水乙醇溶解并转移至10 mL容量瓶内,加入80%的乙醇溶液至刻度,摇匀定容,即为标准溶液。用移液枪移取上述芦丁标准溶液(1.5 mg/mL)0、0.5、1.0、1.5、2.0、2.5 mL于6支10 mL容量瓶中,加入1 mL pH=4.8的醋酸-醋酸钠溶液,再加入2 mL 0.1 moL/L的氯化铝溶液,摇匀,各容量瓶内加入80%乙醇溶液定容,摇匀,40 ℃水浴放置12 min。以第1管为空白管,在407 nm处测定溶液的吸光度,其值设为纵坐标,芦丁标准品浓度为横坐标绘制标准曲线,得到线性回归方程。
1.3.4 韭菜黄酮含量测定及得率计算
将韭菜黄酮粉末准确称量5 mg,超声溶解,并用80%乙醇溶液定容于10 mL容量瓶内;准确量取1 mL溶液,按照1.3.3的方法测定黄酮含量。
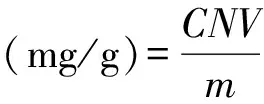
式中:C为按照标准曲线计算出的黄酮浓度,g/mL;N为稀释倍数;V为待测液体积,mL;m为样品质量,g。
1.3.5 韭菜黄酮粗提液纯化
(1)大孔树脂预处理。
将大孔吸附树脂浸泡在95%的乙醇中24 h,用蒸馏水冲洗大孔吸附树脂3~4次至无乙醇味且冲洗液中无浑浊;后浸泡在1 mol/L HCl溶液中6 h,用蒸馏水冲洗至pH=7.0;再浸泡在1 mol/L NaOH溶液中6 h,后用蒸馏水冲洗至pH=7.0。
(2)树脂的筛选。
将 6种处理过的大孔树脂(D101、X-5、D4020、AB-8、DM301、DA201)各准备5 g,置于锥形瓶中,分别加入同浓度的样品液50 mL,置于恒温摇床内(25 ℃,120 r·min-1,24 h);再测量滤液中黄酮的含量(吸光度),计算各树脂吸附率。取上述吸附好的树脂,用蒸馏水洗净至无浑浊,放于锥形瓶内,加入50 mL 60%的乙醇溶液,后继续置于摇床内;取上述滤液测量吸光度,计算各树脂解吸率。
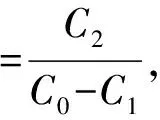
式中:C0为样品液中黄酮浓度,mg/mL;C1为样品液洗脱后液体中黄酮浓度,mg/mL;C2为洗脱液中黄酮浓度,mg/mL。
(3)纯化最佳条件的筛选。
参考李红等[25]的方案并稍作修改。
①上样浓度:固定流速2 BV/h,分别在100 mL浓度为0.1 mg/mL、0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL的样品液条件下收集各流出液,计算吸附率。
②上样速度:分别以不同流速(1 BV/h、2 BV/h、3 BV/h、4 BV/h、5 BV/h)加入100 mL浓度为1.0 mg/mL的样品液,收集流出液,计算吸附率。
③上样体积:固定流速2 BV/h,加入100 mL浓度为1.0 mg/mL的样品液,每10 mL液体收集1管,直至结束,计算吸附率。
④洗脱浓度:固定流速2 BV/h,加入50 mL浓度为1.0 mg/mL的样品液,收集流出液,计算吸附浓度。加入100 mL不同纯度(40%、50%、60%、70%、80%)的乙醇溶液进行洗脱,收集洗脱液,计算解吸率。
⑤洗脱速度:固定流速2 BV/h,加入50 mL浓度为1.0 mg/mL的样品液,收集流出液,计算吸附浓度。以不同流速(1 BV/h、2 BV/h、3 BV/h、4 BV/h、5 BV/h)加入100 mL纯度为60%乙醇溶液进行洗脱,收集洗脱液,计算解吸率。
⑥洗脱体积:固定流速2 BV/h,加入50 mL浓度为1.0 mg/mL的样品液,收集流出液,计算吸附浓度。固定流速3 BV/h,加入100 mL纯度为60%乙醇溶液的洗脱液进行洗脱,每10 mL溶液收集一次洗脱液,直至100 mL,计算解吸率。
⑦纯化样品黄酮含量测定:按照上述实验探究得出的纯化条件对韭菜黄酮粗提物进行纯化,冷冻干燥后对样品进行黄酮含量测定,计算纯化倍数。
1.3.6 体外抗氧化活性测定
(1)韭菜黄酮对DPPH自由基清除能力测定。
参考彭思琪等[26]的方法并稍作修改。样液震荡混匀,室温下避光反应30 min,在517 nm处测吸光值,计算DPPH 自由基清除率。
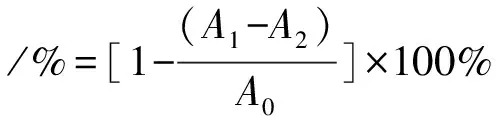
式中:A0为DPPH 溶液+无水乙醇混合后的吸光度;A1为韭菜总黄酮溶液+DPPH溶液吸光度;A2为韭菜总黄酮溶液+无水乙醇的吸光度。
(2)韭菜黄酮对ABTS自由基清除能力测定。
采用Li Zhang等[27]的方案,稍作修改并实验。取EP管加入0.2 mL 7.4 mmoL/L ABTS储备液、0.2 mL 2.6 mmoL/L K2S2O8储备液,黑暗处室温反应12 h。将反应后的溶液用95%的乙醇溶液稀释50倍(工作液)。取0.8 mL工作液和样液轻振混匀,静置反应6 min,在734 nm处测量吸光值,计算清除率。
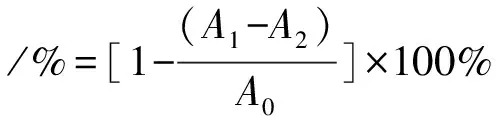
式中:A0为ABTS溶液+95%乙醇混合后的吸光度;A1为韭菜总黄酮溶液+ABTS溶液的吸光度;A2为韭菜总黄酮溶液+95%乙醇混合后的吸光度。
(3)韭菜黄酮对羟自由基清除能力测定。
采用王安娜等[28]的实验方案,并稍作修改进行试验。在试管中依次加入1 mL 9 mmoL/L硫酸亚铁、1 mL 9 mmoL/L乙醇-水杨酸、1 mL 8.8 mmoL/L H2O2、12 mL蒸馏水,缓慢摇匀,37 ℃恒温水浴反应15 min,在510 nm处测量其吸光值,蒸馏水作为对照。
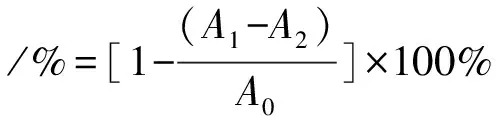
式中:A0为乙醇-水杨酸溶液和无水乙醇混合后的吸光度;A1为乙醇-水杨酸溶液和各浓度样品液混合后的吸光度;A2为各浓度样品液和蒸馏水混合后的吸光度。
2 结果与分析
2.1 标准曲线绘制
图1为芦丁标准曲线,线性回归方程:y=0.617x-0.005 4,R2=0.999 1。结果表明,黄酮含量在0~2.5 mg/mL范围内,线性良好,可用于韭菜黄酮定量测定。
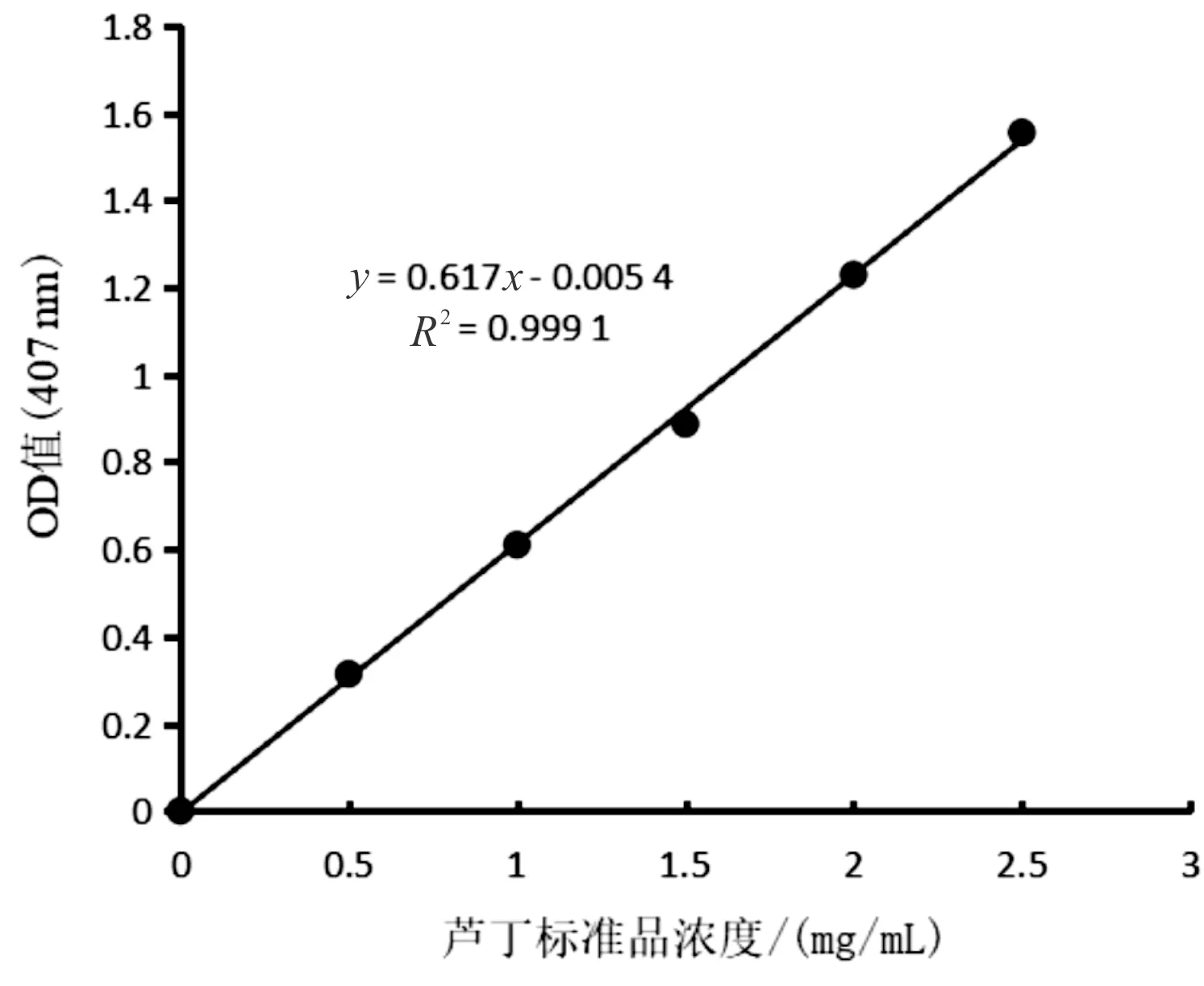
图1 芦丁标准曲线
2.2 韭菜黄酮得率
根据韭菜黄酮的提取制备方法,进行3次提取。每次提取称韭菜粉末10 g,经超声醇提、真空过滤、旋转浓缩、冷冻干燥后,获得韭菜黄酮粗提物。3次提取平均得率为24.8%。韭菜粗黄酮含量为106.67±17.62 mg/g,纯度为10.67%。
2.3 树脂的筛选
表1为不同树脂对韭菜黄酮的吸附和解吸结果。由表1可知,吸附率:AB-8>DM101>X-5>DM301>D4020>DA-201,解吸率:AB-8>DM101>DM301>X-5>DA-201>D4020。在6种树脂中,AB-8的吸附率和解吸率均远高于其它5种树脂,故AB-8型树脂为纯化韭菜黄酮的最佳树脂,与李金等[29]的研究结果一致。
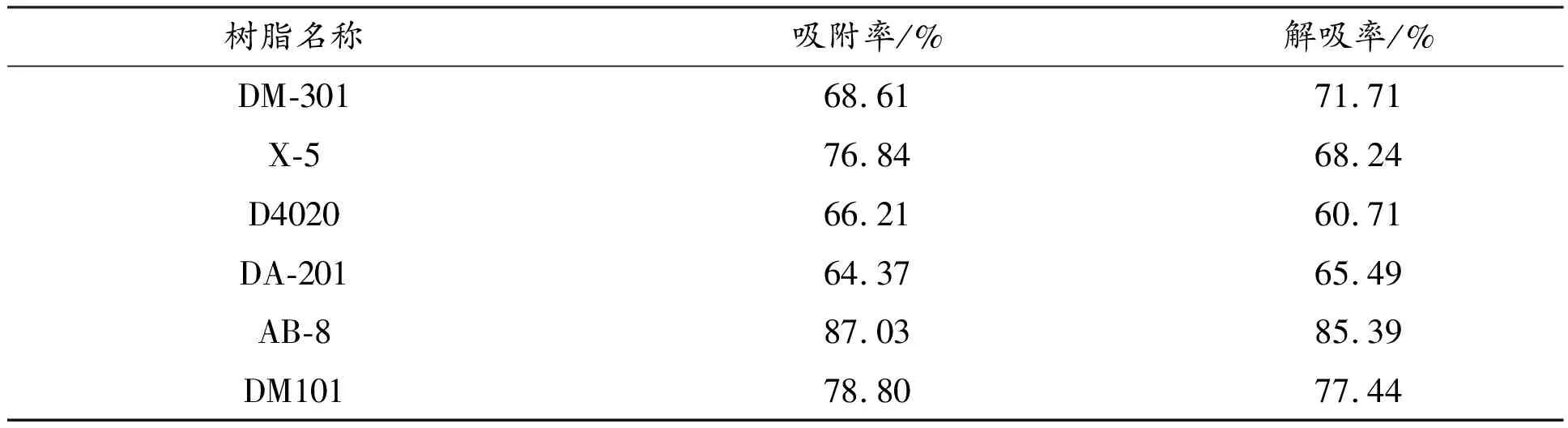
表1 不同树脂对韭菜黄酮的吸附和解吸结果
2.4 纯化的最佳条件筛选
2.4.1 上样浓度
由图2可知,随着上样浓度的增加,AB-8大孔树脂的韭菜黄酮吸附量也随之上升,但韭菜黄酮的吸附率却随之降低。说明在一定的范围内,上样浓度越大,AB-8大孔树脂的传质速率越慢越容易饱和,从而吸附率随之降低。但上样浓度过低会导致树脂效能的浪费[30],因此综合吸附率和吸附量等因素,上样浓度选择1 mg/mL时为最佳浓度。
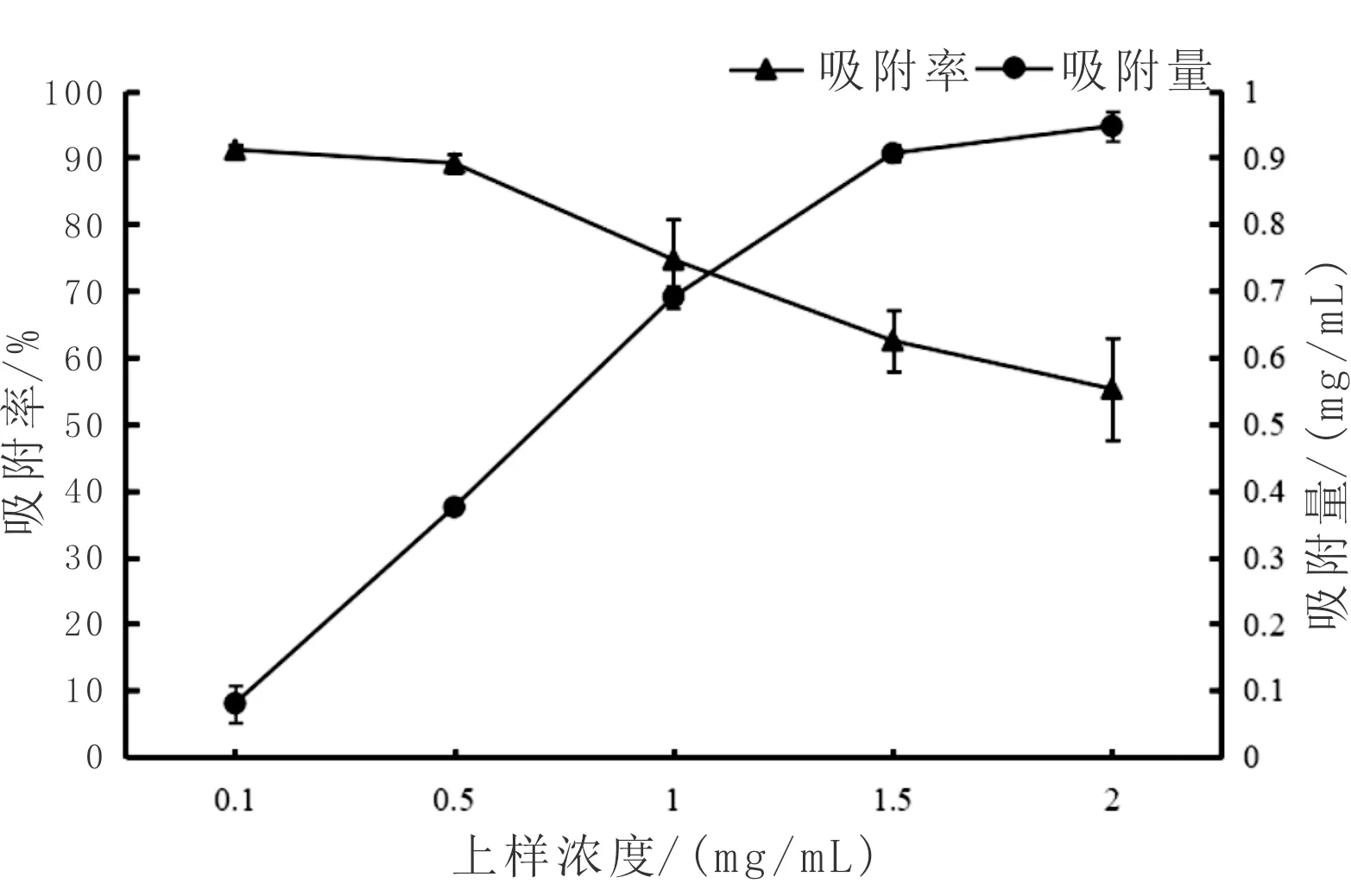
图2 上样浓度对韭菜黄酮吸附效果影响
2.4.2 上样速度
由图3可知,随着上样流速的增加,AB-8大孔树脂对韭菜黄酮的吸附率逐渐降低。在流速较低时AB-8大孔树脂对韭菜黄酮的吸附效果比流速高时好,但流速太慢会增加洗脱时间,综合考虑,2 BV/h 的上样流速是最佳流速。
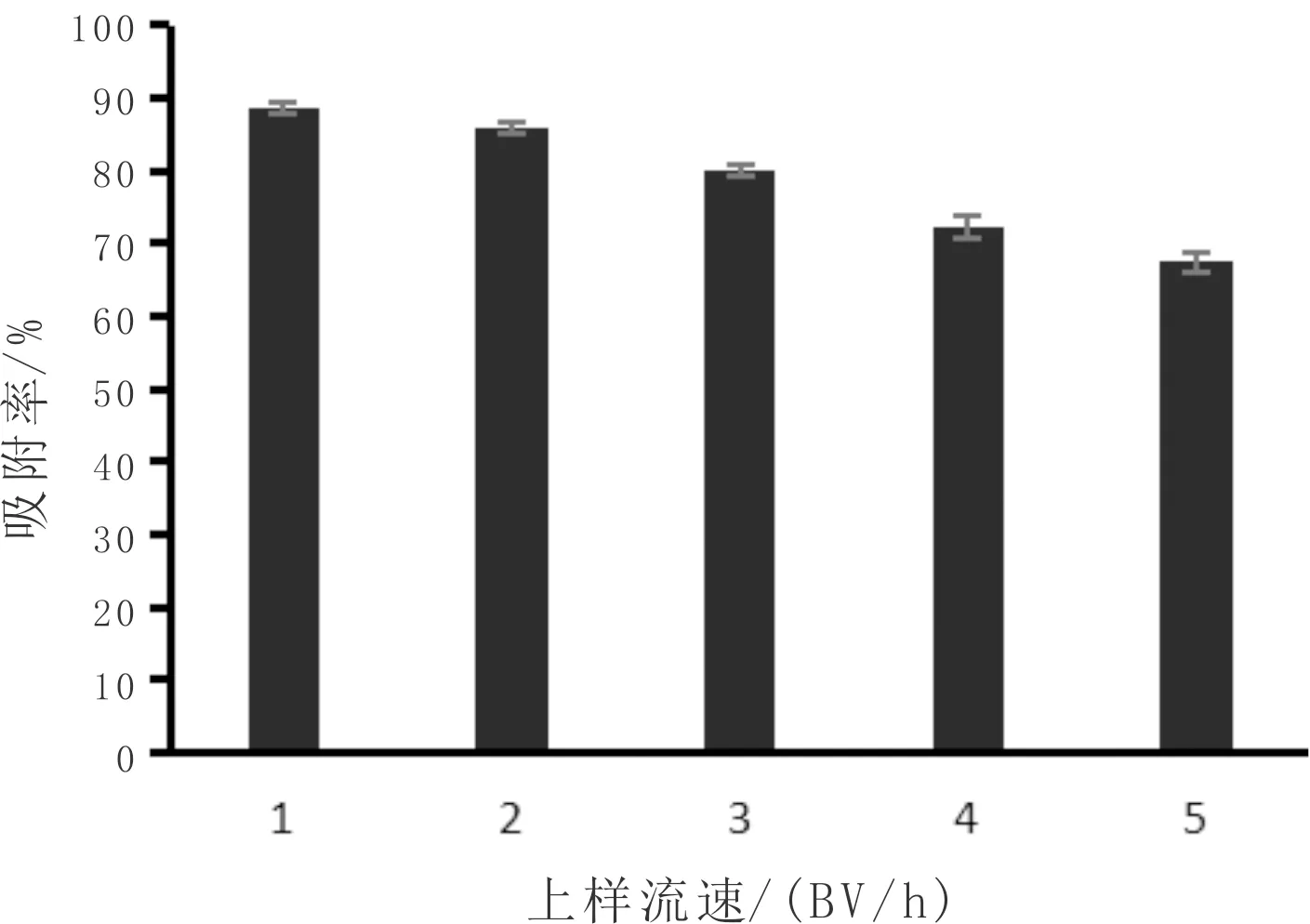
图3 上样流速对韭菜黄酮吸附效果影响
2.4.3 上样体积
如图4所示,AB-8大孔树脂对韭菜黄酮的吸附效率随上样体积的增加而降低。当上样体积较大时,大孔树脂的比表面积较大,更易于饱和;而上样体积小时,树脂的利用率降低。因此50 mL的上样体积为最佳上样体积。与姚林娜等[31]的实验结果相比,本实验的最佳上样体积较小。
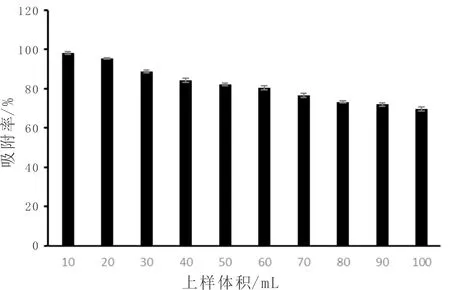
图4 上样体积对韭菜黄酮吸附效果影响
2.4.4 洗脱浓度
如图5所示,韭菜黄酮的洗脱率随乙醇体积分数的增大,呈先升高后降低的趋势;当乙醇体积分数为60%时,韭菜黄酮的洗脱率达到了84.96%。乙醇体积分数过小有可能解析不完全,体积分数过大又会导致杂质的大量析出[32],综合考虑,60%的乙醇溶液为最佳洗脱浓度。
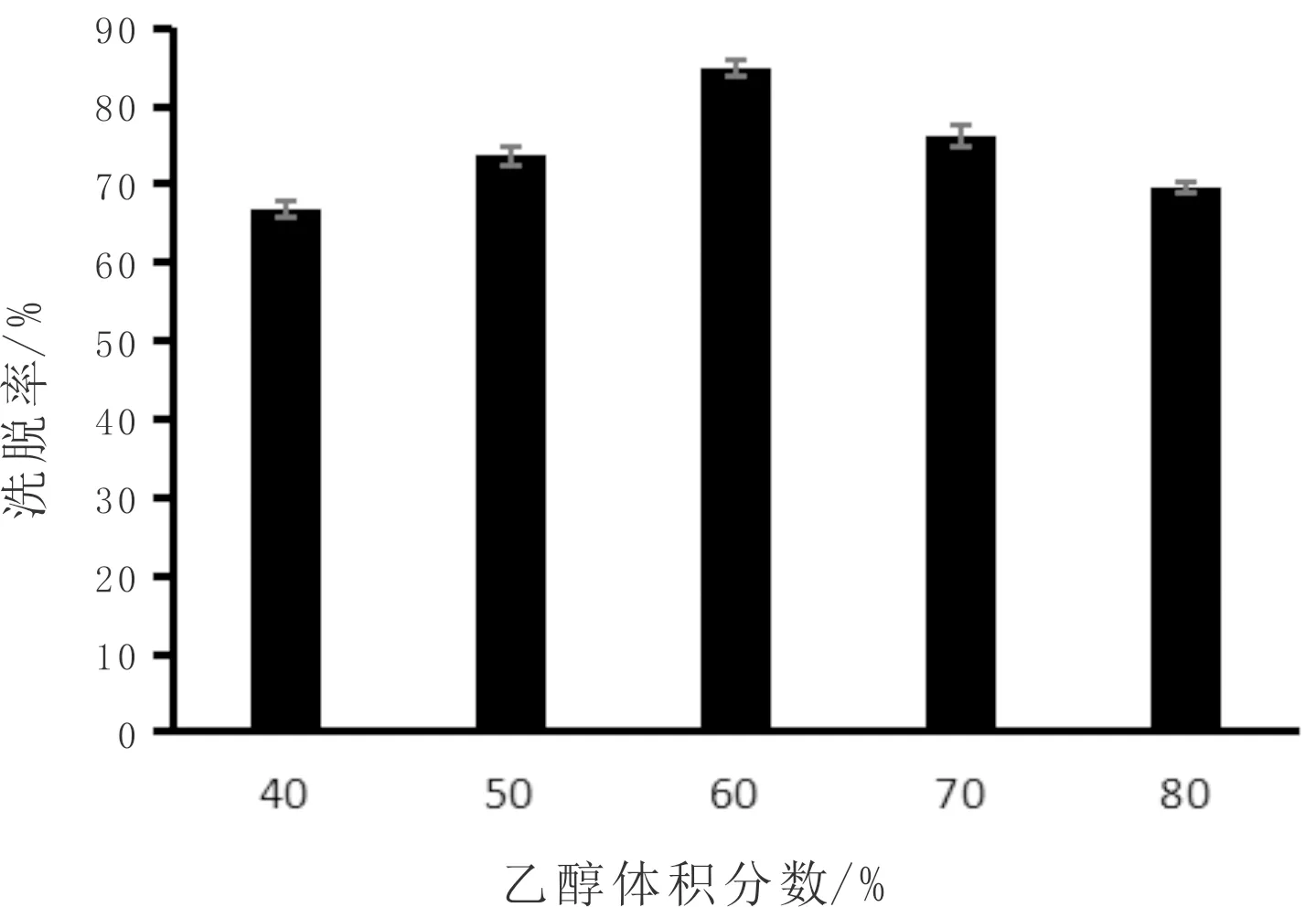
图5 洗脱浓度对韭菜黄酮解吸效果影响
2.4.5 洗脱速度
由图6可知,韭菜黄酮的洗脱率随洗脱速度的增加呈先增大后降低的趋势,从1 BV/h增加到3 BV/h时,韭菜黄酮的洗脱率增长至86.61%,增加洗脱液流速后洗脱率随之降低。故选3 BV/h的洗脱流速为最佳洗脱速度。

图6 洗脱流速对韭菜黄酮解吸效果影响
2.4.6 洗脱体积
如图7所示,韭菜黄酮的洗脱率在洗脱体积为10~20 mL时,随洗脱液的体积增加而增大,在30~100 mL时随洗脱液体积增加而减小。在洗脱体积达到70 mL时,其后洗脱率则几乎不发生变化,且总洗脱率达到94.58%。综合因素考虑,70 mL洗脱体积为最佳洗脱体积。
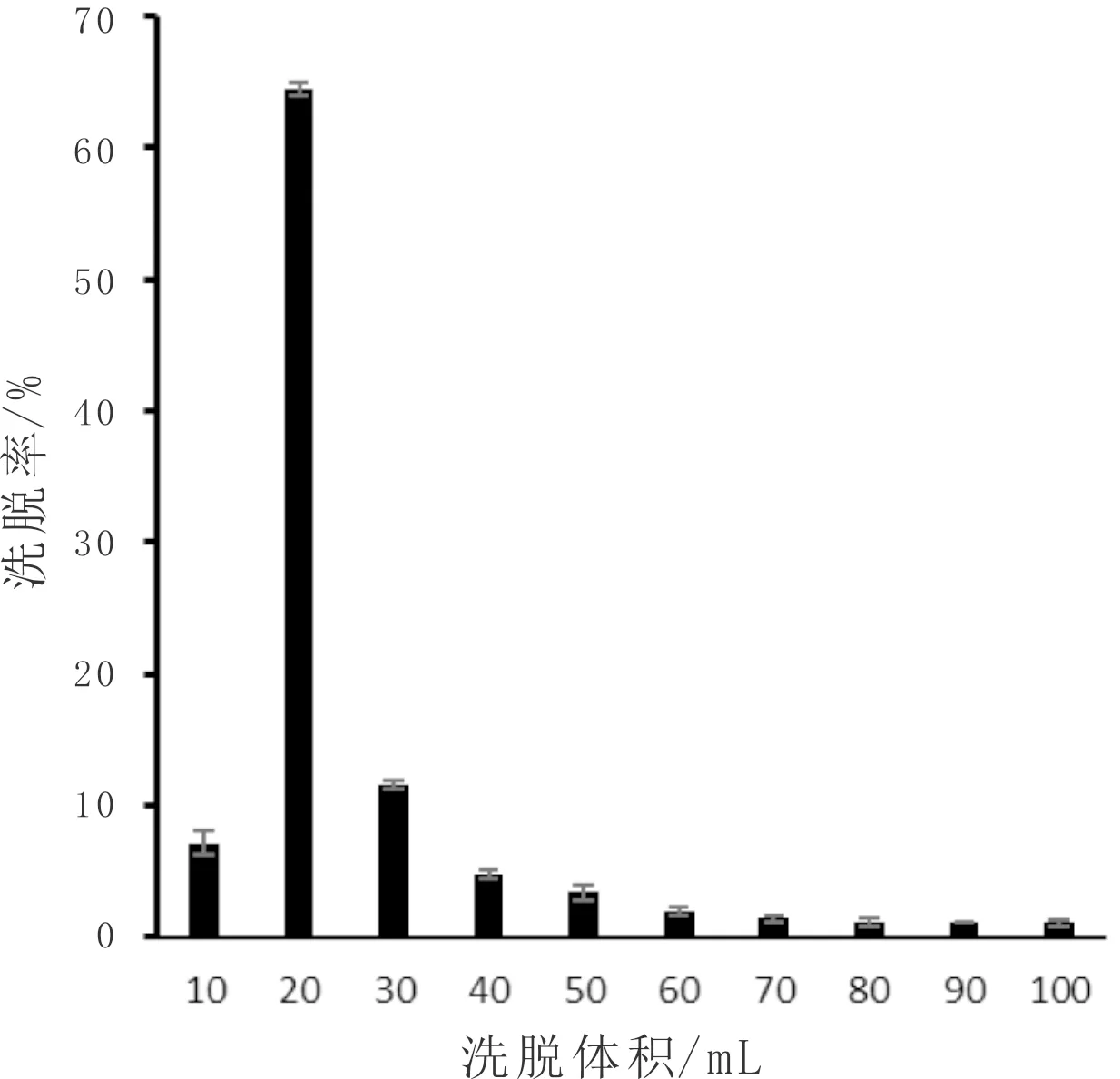
图7 洗脱体积对韭菜黄酮解吸效果影响
2.4.7 纯化样品黄酮含量测定
韭菜黄酮纯化后样品测定结果见表2,纯化后韭菜黄酮含量测定值为638.33±35.73 mg/g。纯化倍数为5.97倍。
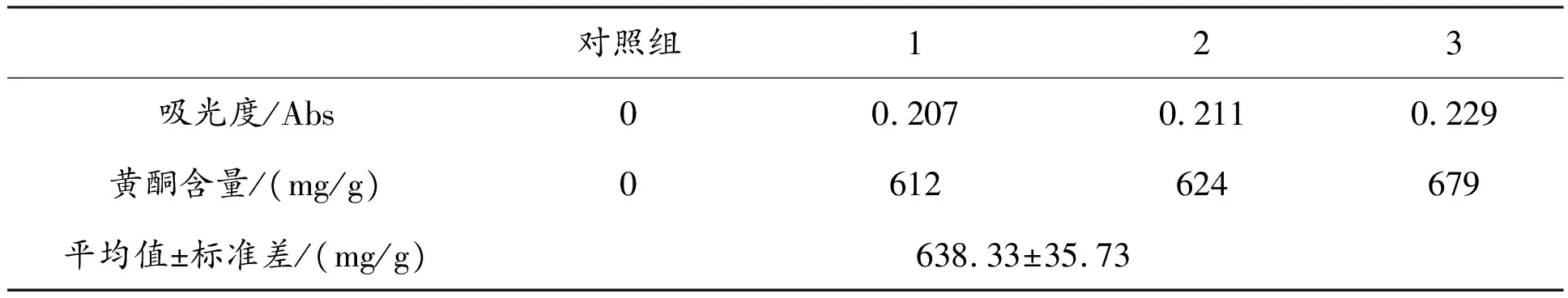
表2 韭菜黄酮(纯化后)测定值
2.5 体外抗氧化活性实验
2.5.1 DPPH清除实验
如图8所示,在测试浓度范围内,3种物质对DPPH自由基的清除率均随浓度的增加而增大。韭菜黄酮粗提物、韭菜黄酮纯化物和VC对DPPH自由基的半抑制浓度(IC50)分别为0.682 mg/mL、0.384 mg/mL、0.09 mg/mL,即对DPPH·清除率由高到低为:VC>韭菜黄酮纯化物>韭菜黄酮粗提物。结果表明韭菜黄酮粗提物和韭菜黄酮纯化物均有明显的清除效果。
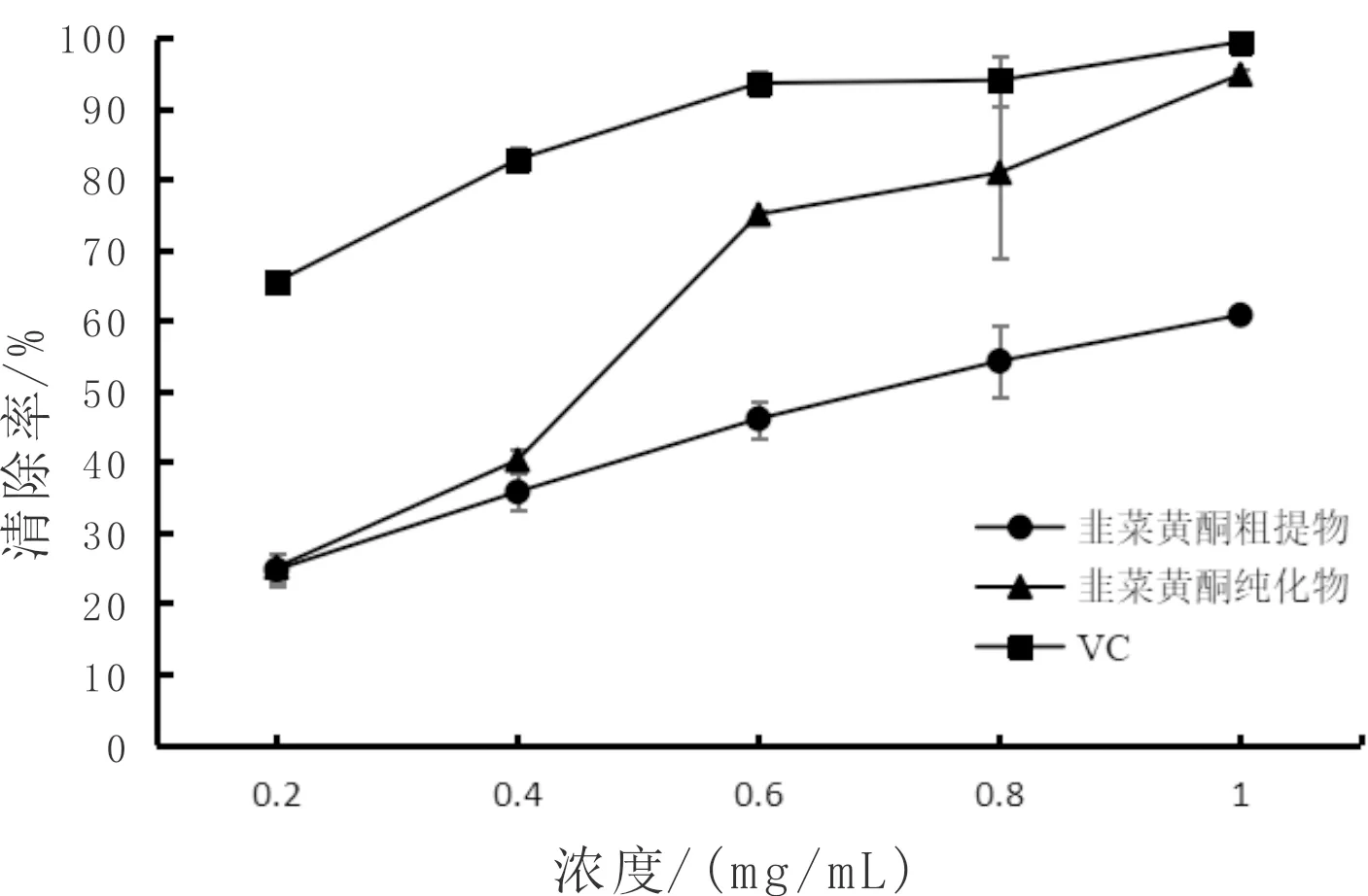
图8 韭菜黄酮对DPPH自由基的清除能力
2.5.2 ABTS清除实验
由图9可知,在浓度为0.2~1.0 mg/mL的范围内,样品浓度较低时,韭菜黄酮粗提物和韭菜黄酮纯化物相较VC对ABTS·清除能力较低,3种物质对自由基清除率均与自身浓度呈正相关。韭菜黄酮粗提物、韭菜黄酮纯化物和VC对ABTS自由基的半抑制浓度(IC50)依次为0.646 mg/mL、0.381 mg/mL、0.129 mg/mL,综合上述数据可知,韭菜黄酮对ABTS自由基清除能力较强,呈线性相关。
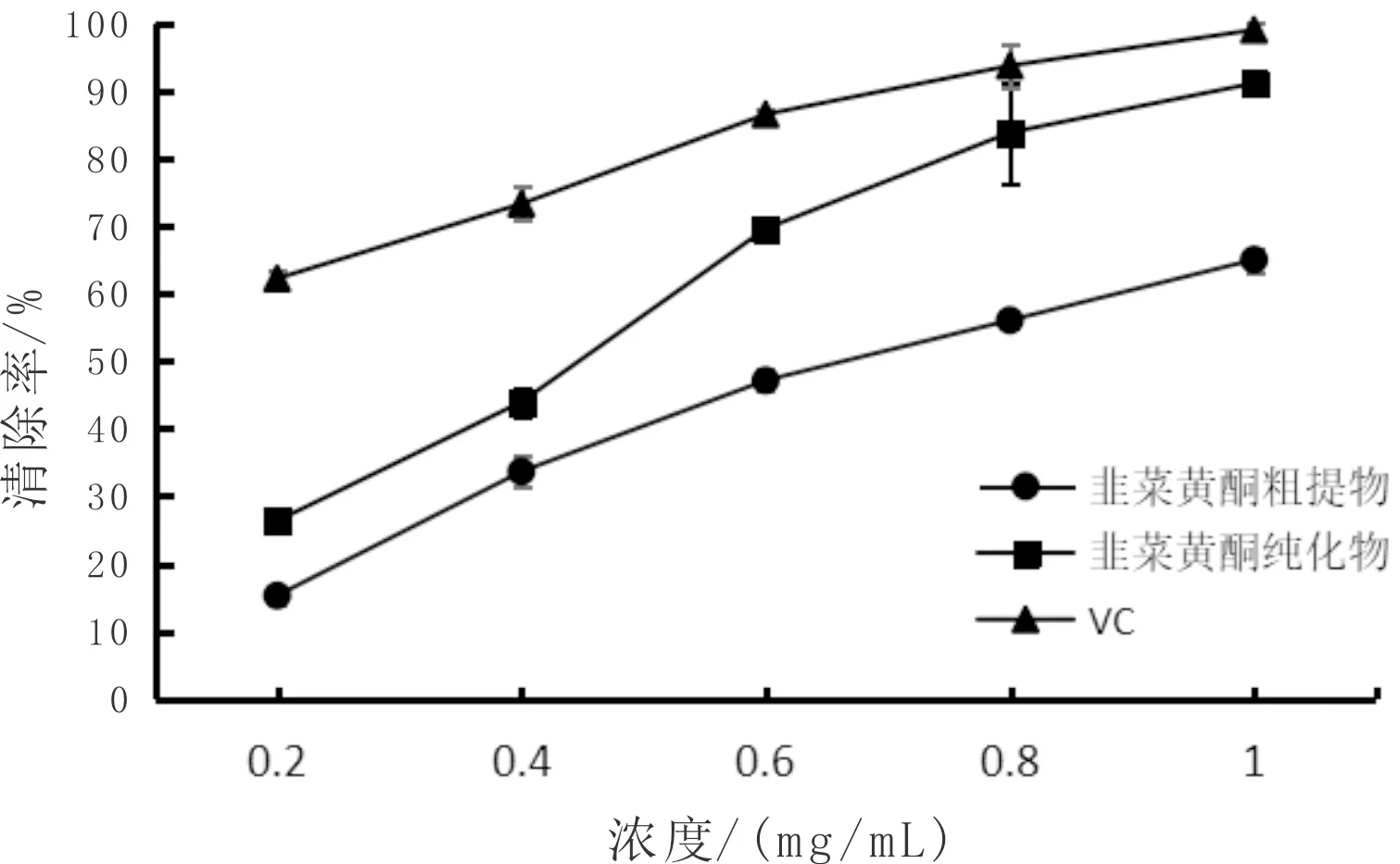
图9 韭菜黄酮对ABTS自由基的清除能力
2.5.3 羟基自由基清除实验
如图10所示,随样品浓度的增加,韭菜黄酮粗提物、韭菜黄酮纯化物对羟基自由基的清除率均增加。在浓度为1.0 mg/mL时,韭菜黄酮粗提物、大孔树脂纯化物、VC对羟基自由基的清除率分别为61.92%、85.78%、99.76%。韭菜黄酮粗提物、韭菜黄酮纯化物和VC对·OH的半抑制浓度(IC50)分别为0.655 mg/mL、0.432 mg/mL、0.075 mg/mL。对羟基自由基的清除率能力依次为VC>韭菜黄酮纯化物>韭菜黄酮粗提物。
3 结论
本文采用超声辅助醇提取韭菜的黄酮成分,在乙醇浓度为80%、料液比为125(g/mL)、超声功率为260 W、超声温度为35 ℃、超声45 min时,韭菜粗黄酮的得率为24.8%。考察了D101、X-5、D4020、AB-8、DM301和DA201等6种树脂对韭菜黄酮的吸附率及解吸率的影响,发现AB-8型树脂效果最好;最佳纯化条件:样品浓度为1 mg/mL,上样速度为2 BV/h,上样体积为50 mL,洗脱液乙醇浓度为60%、洗脱速度为 3 BV/h、洗脱体积为70 mL。在此条件下,AB-8型树脂总洗脱率达94.58%。在0.2~1.0 mg/mL的浓度范围时,3种自由基清除效率随韭菜黄酮浓度的增加而增加。
