滨海含水层咸-淡水过渡带反硝化性能与控制因素研究
2023-08-10王云郑西来曹敏李磊宋晓冉林晓宇郭凯
王云,郑西来,2,3*,曹敏,李磊,宋晓冉,林晓宇,郭凯
1.中国海洋大学环境科学与工程学院,山东 青岛 266100;2.中国海洋大学/山东省环境地质工程重点实验室,山东 青岛 266100;3.中国海洋大学/海洋环境与生态教育部重点实验室,山东 青岛 266100;4.青岛市水文中心,山东 青岛 266101;5.诸城市建筑业发展中心,山东 诸城 262200
地下水作为重要的供水水源之一,在人类社会和经济的发展中发挥着重要作用。目前地下水硝酸盐污染问题已经是一个世界性的难题,中国约有50%的地区浅层地下水存在一定程度的硝酸盐污染问题,且地下水本身循环更新慢,一旦受到污染则难以处理,此外,硝酸盐污染问题还与人类健康和生态系统密切相关,故硝酸盐污染问题正日益受到人们广泛关注(王恒,2018;Tokachanov et al.,2020)。
位于海陆交界处的滨海地区是连接陆地和大洋生态系统的纽带,滨海含水层咸淡水过渡带也是一个养分动态高度变化、生物地球化学反应复杂的关键地区(Anschutz et al.,2009)。沿海地区对淡水的需求常会加剧海水向滨海含水层的渗透,当海水入侵滨海含水层时,地下水与海水自由连接,使地下水的盐度升高,而富含高浓度硝酸盐的地下水会流入海洋,影响河口和海洋的生物地球化学过程和初级生产,发生富营养化等环境问题(William et al.,2003)。之前的研究通常认为滨海咸淡水过渡带缺乏有机质和其它活性物质,生物地球化学反应难以发生,然而近期研究表明,海水受潮汐和波浪作用渗入含水层为地下水提供氧气和有机物,不仅会促进有机物降解和养分循环,还可以为反硝化微生物提供充足的电子供体,为滨海含水层反硝化过程提供良好的环境(Boudreau et al.,2001;Gao et al.,2012;Huettel et al.,2014;Marchant et al.,2014;张耀中等,2015)。因此,研究滨海含水层地下水反硝化对沿海生物化学过程和生态环境具有重要意义。
考虑到现实环境的复杂性,环境因素对滨海含水层反硝化的影响是不可忽视的。影响滨海含水层反硝化的主要环境因素包括pH、温度、盐度、DOC和DO 等(Tesoriero et al.,2000;Kana et al.,2006;Anschutz et al.,2009)。由于地下水是一个缓冲体系,pH 变化不大,另外,研究区地下含水层温度稳定,在19 ℃左右,故不考虑pH 和温度的影响。相反,受波浪和潮汐影响,滨海含水层咸淡水过渡带的盐度并非均一不变,而盐度往往会影响反硝化微生物的降解作用;反硝化微生物为典型的异养型微生物且多属于兼性细菌,O2含量会制约微生物的繁殖和活性,而在缺氧状态下微生物需要有机碳源作为稳定的电子供体来提供能量,所以DOC 和DO 也是影响滨海反硝化的重要环境因素(胡玲珍等,2003;常永凯,2021)。国内外对于滨海含水层中的反硝化行为展开了多方面的数值研究,例如Claudette et al.(2008)通过数值模拟研究了缺氧地下水与含氧海水相遇时的反硝化现象;Heiss et al.(2014)和Beck et al.(2017)在进行滨海含水层剖面地下水运动和溶质运移数值模拟时考虑了DOC、O2、NO3−之间的生物地球化学反应,取得了较好的模拟效果;Sun et al.(2021)在数值模拟截渗工程对NO3−积累过程时把反硝化参数作为定值。但是值得注意的是,研究者们并未将盐度梯度对滨海反硝化的影响考虑在内,因此,深入探讨C/N、盐度和DO 对硝酸盐反硝化作用的影响对于滨海地下水污染评价和防治具有重要的科学意义。
响应曲面法指将体系的响应值作为一个或者多个因素的函数模型,可以将各因素对响应值的影响用图形直观地表示出来(李济源等,2022)。Box-Behnken(BBD)试验设计是响应曲面法中常用的设计方法,在因素影响试验中应用广泛,可通过较少次数的试验很好地拟合因素水平少于5 个的情况,并得到完整直观的效果,建立各因素对响应值的数学拟合模型(蒋征等,2015)。本研究结合现场调查取样,测定研究区地下水样品理化性质,并在室内构建硝酸盐去除试验,对DO、pH、NO3−、DOC 和微生物群落进行分析,同时采用BBD 设计试验,考察关键环境因素及其交互作用对滨海硝酸盐去除的影响。
1 材料与方法
1.1 供试材料
本研究采样地点选择在受海水上溯影响的青岛市大沽河下游含水层(见图1),地理坐标为36°27'N,120°12'E。研究区属于北暖温带季风气候区,多年平均气温为12.5 ℃,年均降水量为616.7 mm,多集中在6-9 月,其降水量超过了全年降水量的70%。研究区潜水含水层由第四系冲洪积中粗砂组成,平均厚度为5.2 m,厚度最大可达15.0 m,宽度为5.0-7.0 km。该区地下水主要由降水和河流入渗及灌溉回归水补给,地下水以径流和人工开采排泄,总体径流方向从南向北。
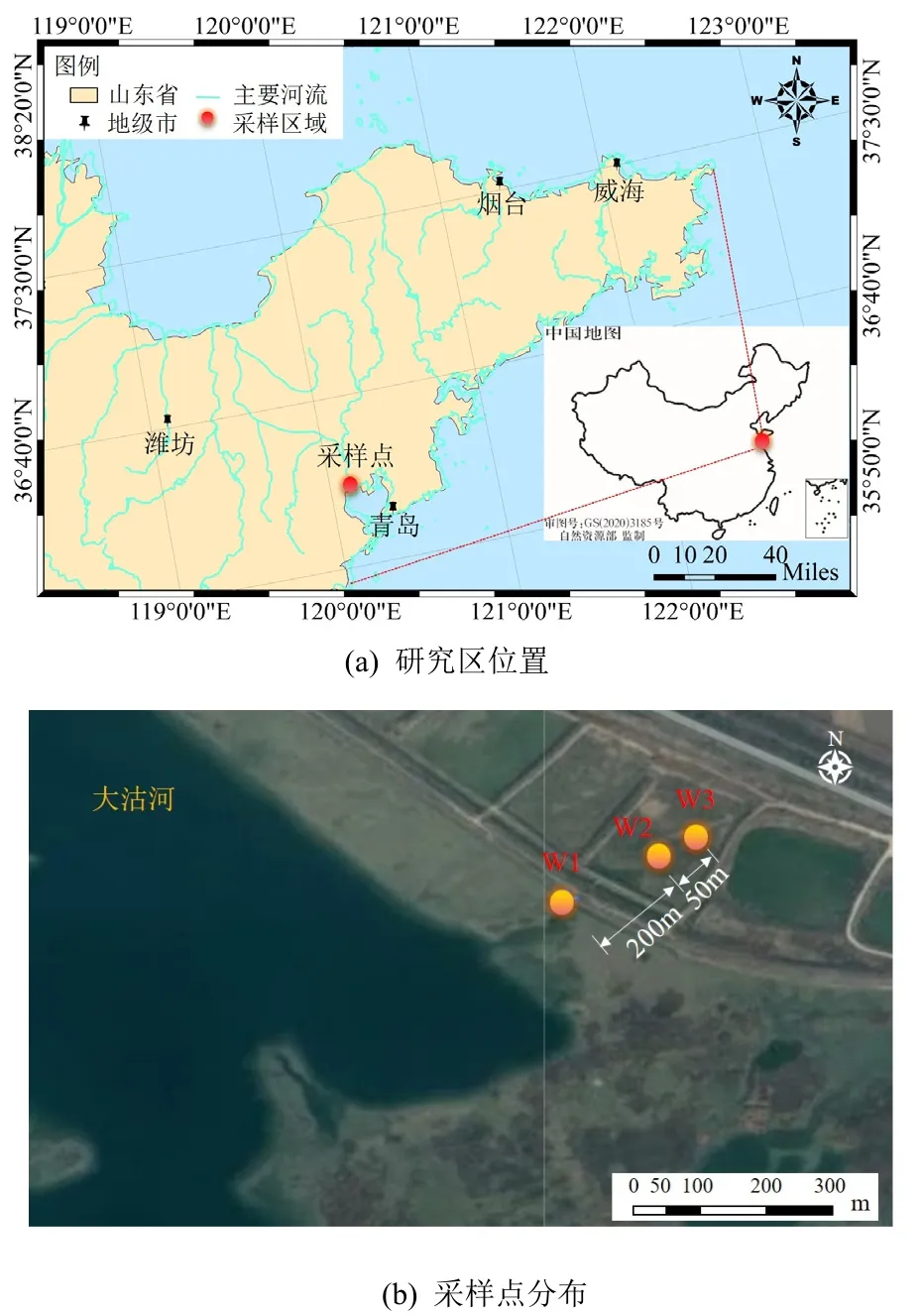
图1 研究区域位置与采样点分布图Figure 1 Location and sampling point distribution of the study area
本研究在大沽河东岸、垂直于河流方向设置3个采样点(W1、W2、W3),于2021 年10 月在研究区进行了地下水和含水介质的现场采样,每个样品均有3 份平行样品。
1.2 试验方法
1.2.1 理化性质测定
(1)使用便携式哈希水质测定仪(美国HACH,HQ30D),原位测定水样的DO、pH 和盐度。
(2)在现场条件下采用研究区未过滤的地下水样品,利用紫外分光光度仪(澳大利亚ONICO,2800 UV/VIS)测定NO3−-N 含量,利用TOC 分析仪(日本岛津,TOC-Vcpn)测定DOC 含量;使用阴/阳离子色谱仪(美国戴安,ICS-3000/2100)测定地下水中主要阴、阳离子成分。
1.2.2 硝酸盐去除试验
为了研究咸淡水过渡带硝酸盐的去除过程,本研究进行了室内条件下的培养和去除试验。
(1)在现场收集研究区含水介质,在室内采用配制的地下水样和现场的含水介质进行试验。
(2)在离心管中按照1꞉5 的比例添加含水介质和地下水样品,各参数初始时刻值模拟现场环境,在恒温19 ℃的黑暗条件下培养0、1、2、3、4、6、8、10、12、14 d 后,分别测定NO3−-N、DOC、DO、pH,并对第0、2、14 天的微生物群落结构进行表征。
1.2.3 BBD 试验设计与分析
(1)利用Design-Expert 12.0 软件设计试验。BBD 试验设计如表1 所示。C/N(表征ρ(C)/ρ(N),即ρ(DOC)/ρ(NO3−-N))、EC(表征盐度)和DO 的取值范围根据本区现场监测数据(表2)和其他地区文献数据确定,中间值的设定通过Design-Expert 12.0 软件设计得出(Beck et al.,2017;Kim et al.,2017;聂家琴,2018);分别调节培养体系C/N、EC 和DO的初始浓度为表1 设定值;重复3 次中心点检验试验的重复性及模型的合理性。

表1 BBD 试验设计Table 1 BBD experimental design
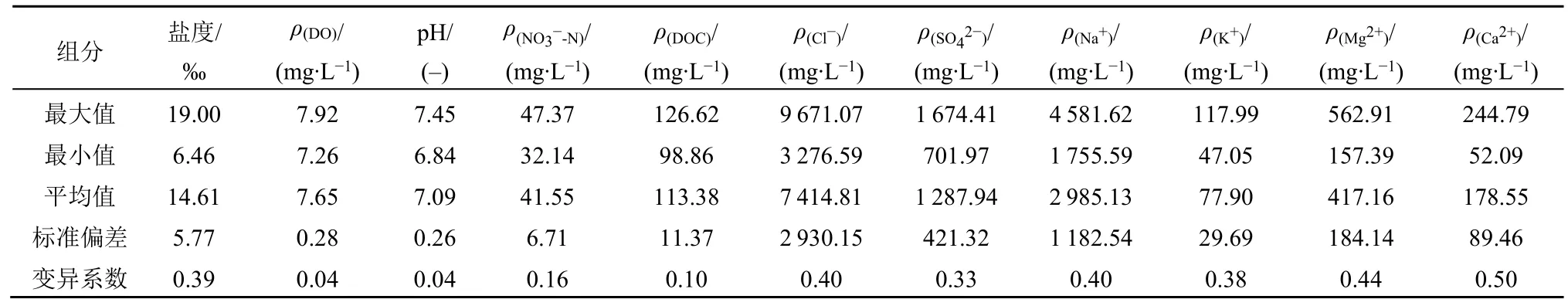
表2 研究区地下水化学组成和性质统计表Table 2 Statistics of groundwater water chemistry results in the study area
(2)根据设计的17 组试验,按1.2.1 的方法分别测定初始时刻和最终时刻的硝态氮浓度,计算硝态氮去除率,输入Design-Expert 12.0 软件进行响应曲面分析。
2 结果与讨论
2.1 研究区水文地球化学特征
研究区地下水样化学组成见表2。研究区受侧向咸水入侵的影响,平均盐度(14.6‰)普遍高于一般的地下水(0.3‰),这是由于下游海水在涨潮时沿河道上溯,咸水通过含水层裂口进入含水层;pH值范围为6.8-7.5,变异系数小,属于弱酸—弱碱性环境;因为本研究取样点较浅、靠近地下水位附近,所以DO 值范围在7.3-7.9 mg·L−1之间(Kim et al.,2017)。研究区地下水NO3−-N 浓度变化范围为32.1-47.4 mg·L−1,均值为41.6 mg·L−1,高于国家饮用水卫生标准中硝酸盐(以N 计)20 mg·L−1的限制,因此研究区存在硝酸盐污染问题;研究区DOC 含量较高,均值为113.4 mg·L−1,可以在一定程度上为反硝化提供电子供体。
研究区主要阳离子浓度整体表现为Na+>Mg2+>Ca2+>K+,其中Na++Mg2+占比较大,约占阳离子总量的93.0%;主要阴离子浓度表现为Cl−>SO42−,Cl−浓度是SO42−浓度的5.8 倍,其占阴离子浓度总量的85.2%,Cl−浓度较高,体现出海水入侵的特征。研究区各离子的变异系数均小于1.0,离子分布均匀(见表2)。Gopinath et al.(2019)对传统Piper 图进行了优化,将海水入侵的类型从淡水到保守混合水分成了7 个不同的标准,图2 是利用优化的Piper 图解法对W1-W3 地下水样品化学类型进行的分类图。结果表明,Na++K+含量大于Ca2++Mg2+含量,即水样碱金属离子含量大于碱土金属离子含量,Na++K+的当量百分数在80.0%以上,水化学类型为Cl-Na 型或Cl-K 型。3 个点的地下水样品均分布在保守混合水区域,即离子交换和矿物的沉淀-溶解反应较弱,3 个点的水质类型相似,水力联系密切。
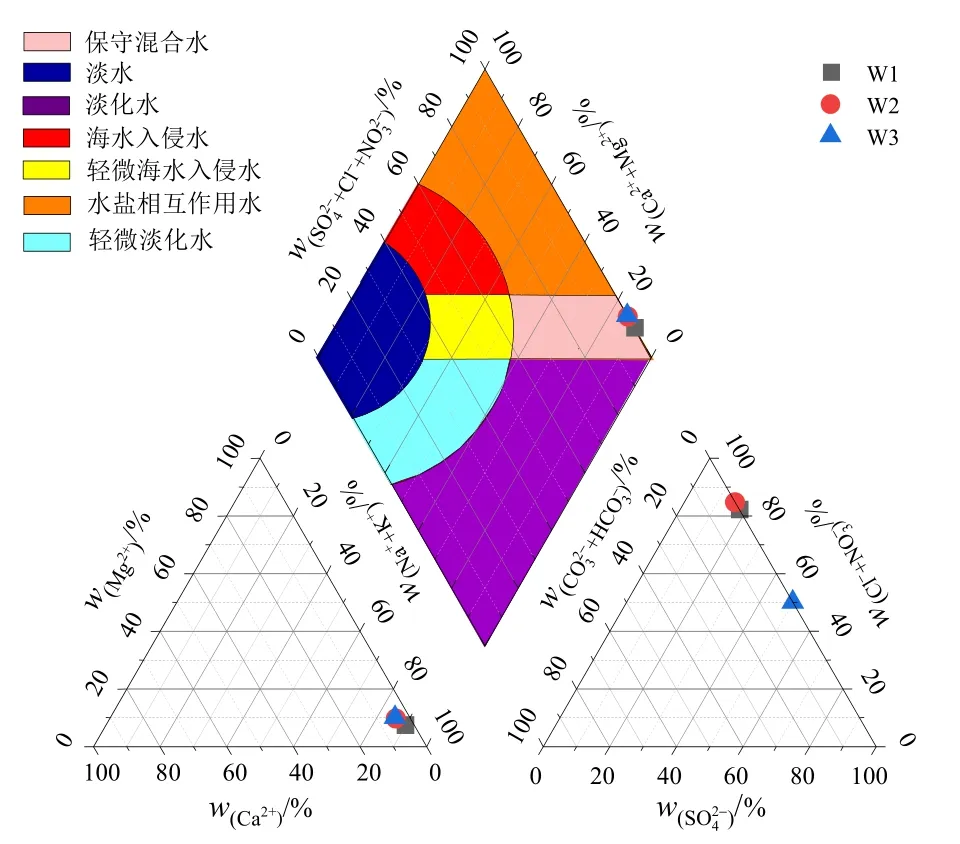
图2 研究区地下水样品水化学分类图Figure 2 Hydrochemical classification diagram of groundwater samples in the study area
2.2 现场条件下硝酸盐的去除行为
2.2.1 硝酸盐去除的动力学
培养体系化学因素变化趋势如图3 所示。由图3a 可以看出,在试验前期,DO 呈下降趋势,W1-W3 处的DO 浓度在第2-3 天达到最低(5.1、5.5、3.9 mg·L−1)。在培养试验的第3-14 天,DO 先上升后下降至平稳,这是由于在反应初期微生物会优先利用DO 进行有氧呼吸造成DO 迅速下降,反应中后期微生物可能死亡,生物需氧量下降(杨龙元,1998)。因为反应体系中存在大量不同种类的需氧微生物群落,在反应前2 天,W3 微生物的种类(Simpson 指数、Shannon 指数)和丰度(Ace 指数、Chao1 指数)明显高于W1 和W2,W1 和W2 微生物种类和丰度相差不大(见表3),所以W3 体系中微生物对O2的消耗更多更快。
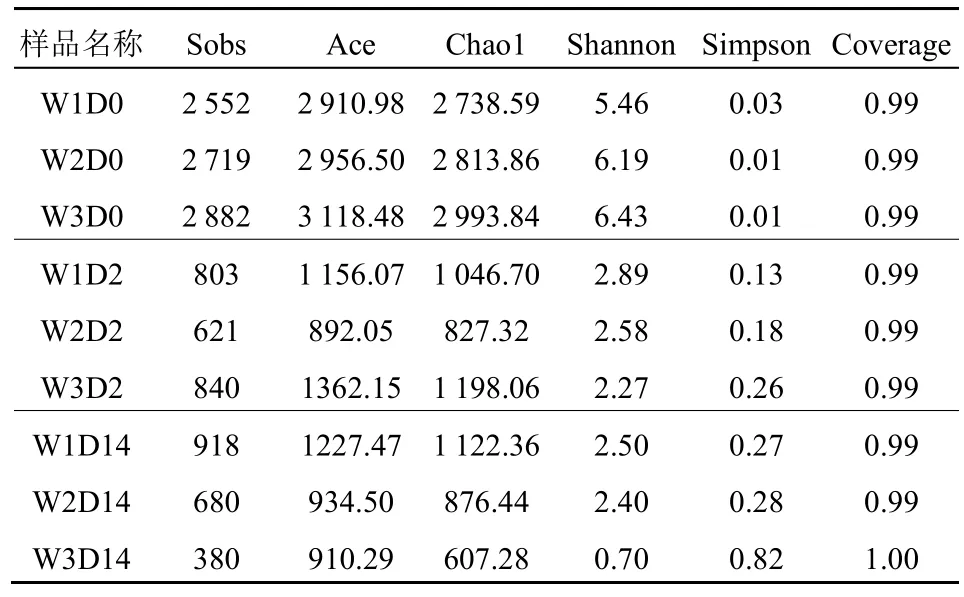
表3 微生物群落多样性分析成果表Table 3 Table of microbial community diversity analysis results

图3 培养实验溶解氧、pH、硝态氮浓度及溶解性有机碳浓度变化曲线图Figure 3 Change plots of dissolved oxygen, pH, nitrate nitrogen concentration and dissolved organic carbon concentration in culture experiments
如图3b,W1-W3 点的pH 值变化趋势为先下降(6.8、6.3、6.4)后又上升至7.0 左右,因为在反应初期,反硝化菌将有机碳源转化为丙酮酸(C3H4O3)等小分子有机酸,同时产生酸性CO2,但是反硝化过程产生的碱度(OH−)不足以中和有机质分解生成的H+,所以pH 值略有下降,随着反应的进行,反硝化过程产生的碱性物质会逐渐中和有机质分解产生的酸性物质,同时,反硝化微生物的大量繁殖也会消耗大量小分子有机酸,使得体系的pH 值升高并维持在中性环境(Riuett et al.,2008)。W1-W3 体系中分解有机碳产生酸性物质的微生物种类和含量的不同是造成各自体系pH 值变化差异的主要原因。
由图3c 可得,整个培养周期内W1-W3 点硝态氮浓度在第0-3 天呈下降趋势,W1 点在第4-14 天硝态氮浓度基本保持在5.0 mg·L−1左右,而W2-W3 点在第8-14 天硝态氮浓度略有上升。由图3d 可得,W1-W3 点DOC 浓度先分别下降至67.7、131.4、138.7 mg·L−1,随后呈基本平稳的趋势。因为随着反应的进行,微生物在O2作用下迅速进行有氧呼吸,DOC 逐步氧化分解作为反硝化的电子供体,为反硝化菌提供能量还原硝酸盐,所以反应的前3 天硝酸盐和DOC 的含量逐步下降。W2-W3点硝态氮浓度在试验后期升高的原因可能是反硝化微生物减少所致,故反硝化速率降低,硝态氮浓度升高;同时,反硝化菌受到硝态氮浓度升高的冲击,平衡状态被打破,反硝化微生物对碳源的利用能力降低,导致DOC 平衡被打破,DOC 浓度略有上升且呈波动状态(孙昭玥等,2021)。
2.2.2 微生物群落结构变化
W1-W3 点培养试验第0、2、14 天时的微生物群落多样性如表3 所示。Sobs 指数越高,表示实际观测到的物种数量越多;Ace 指数和Chao1 指数在生态学中是一种度量物种丰富度的指标,其值越高代表群落物种越丰富;Simpson 指数和Shannon指数是用来估算样本中微生物多样性的指数,Simpson 值越大,说明微生物群落的多样性越低,而Shannon 值则反之;Coverage 是指样品文库的覆盖率,其值越高,则样品中序列没有被测出的概率越低。由表3 可得,随着培养实验的运行,Ace 指数和Chao1 指数明显下降,Shannon 指数明显降低,Simpson 指数则有所升高,说明微生物物种种类丰富度下降,多样性降低。
培养过程中微生物物种在门水平上的相对丰度如图4 所示,体系中A-Y 菌门的平均相对丰度占比49.7%-50.0%,表明研究区微生物种类复杂多样。第0 天时,W1、W2、W3 点均以变形菌门(Proteobacteria)为主,其相对含量分别为32.2%、36.3%和37.5%,其次相对含量较高的微生物是弯曲杆菌门(Campilobacterota,22.5%、1.4%、1.8%)、热脱硫杆菌门(Desulfobacterota,16.6%、6.6%、9.7%)、拟杆菌门(Bacteroidota,7.2%、6.3%、11.1%)、厚壁菌门(Firmicutes,4.8%、12.0%、7.2%)、绿弯菌门(Chloroflexi,3.9%、6.8%、9.2%)和放线菌门(Acidobacteriota,1.8%、9.8%、4.9%)。在第2-14 天,W1-W3 点变形菌门的相对丰度激增,第14 天时,其分别增加至91.7%、95.0%和98.2%,而其他细菌门类含量明显降低,这是因为大多数变形菌门细菌在兼性或专性厌氧环境以异养或自养方式生活,有机碳源为微生物的生长提供电子,且碳源的分解为变形菌门提供了适合的生存环境(Xu et al.,2017)。
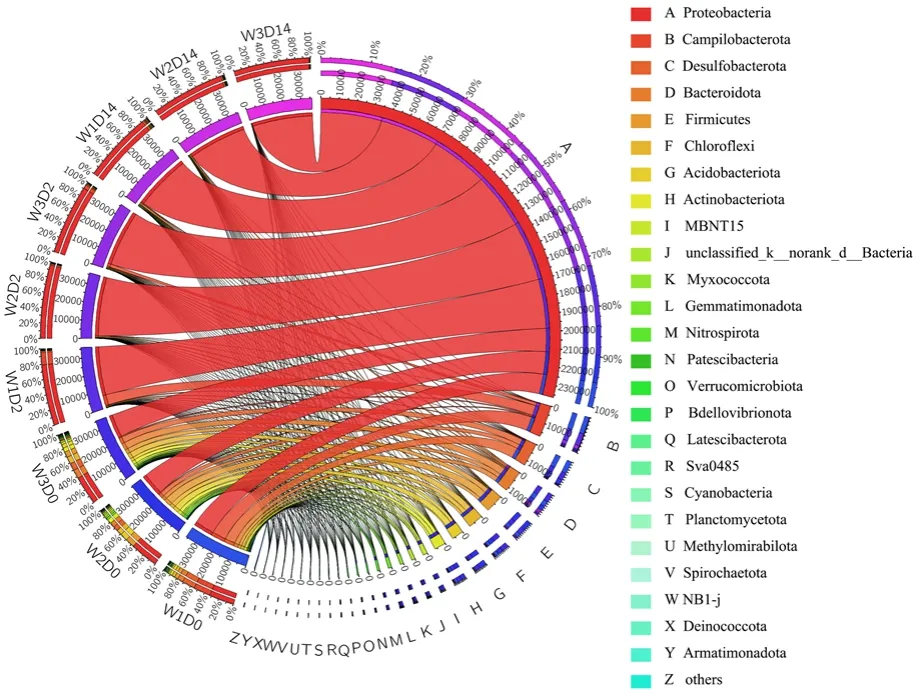
图4 微生物物种在门水平上的相对丰度Figure 4 The relative abundance of microbial species at the phylum level
培养试验微生物物种在属水平上的相对丰度如图5 所示。在反应开始时,W1-W3 点微生物菌属的种类最多,但大部分菌属的丰度较低,且微生物菌属种类差异较大。当培养试验进行到第2-14天时,冷单胞菌属(Psychromonas)、弧形菌属(Vibrio)和假单胞菌属(Pseudomonas)的相对丰度位列前三,其中,与反硝化有关的假单胞菌属相对丰度明显增加,最高相对丰度达到了25.0%,它是一种化能异养菌(有的属是兼性化能自养,利用H2或CO2为能源),也是一种好氧反硝化菌,可以将硝酸盐作为最终电子受体,这也是培养试验过程中硝酸盐可在DO 含量较高条件下去除的原因;W1、W2、W3 的假单胞菌属在第14 天时的相对丰度(18.1%、15.1%、6.2%)低于第2 天(16.0%、25.0%、1.6%),所以其反硝化速率降低,可进一步解释试验后期硝态氮浓度的上升。冷单胞菌属的相对丰度在培养试验后期达到了93.9%,这种原产极地的菌属可抵御极端寒冷环境,一般在−15.0-20.0 ℃之间最适宜生长(普通细菌适应生长温度为25.0-40.0 ℃),并且该菌属化能有机营养,好氧或微好氧生长,硝酸盐还原阴性,所以冷单胞菌属在体系中大量繁殖,但是无法去除硝酸盐。弧形菌属是一种需要Na+才能正常生长的水生细菌,大多数为化能异养的革兰氏阴性菌,弧菌属氧化酶能够将硝酸盐还原为亚硝酸盐(张晓华等,2018)。同时弧形菌属可发酵有机碳产酸,而W1-W3 点弧形菌属的丰度在反应过程中存在差异,在第2 天时,弧形菌属相对丰度:W2 (32.6%)>W3 (16.4%)>W1 (3.2%),所以pH(W2)低于pH(W1)、pH(W3)。此外,芽孢杆菌纲中的芽胞杆菌属(Bacillus,相对丰度约为0.3%)也是一种具有反硝化功能的好氧反硝化菌(张晓华等,2018);γ-变形菌纲中的福格斯氏菌属(Vogesella,相对丰度约为1.6%-7.1%)在碳源分解中起到重要作用(辛苑等,2022)。
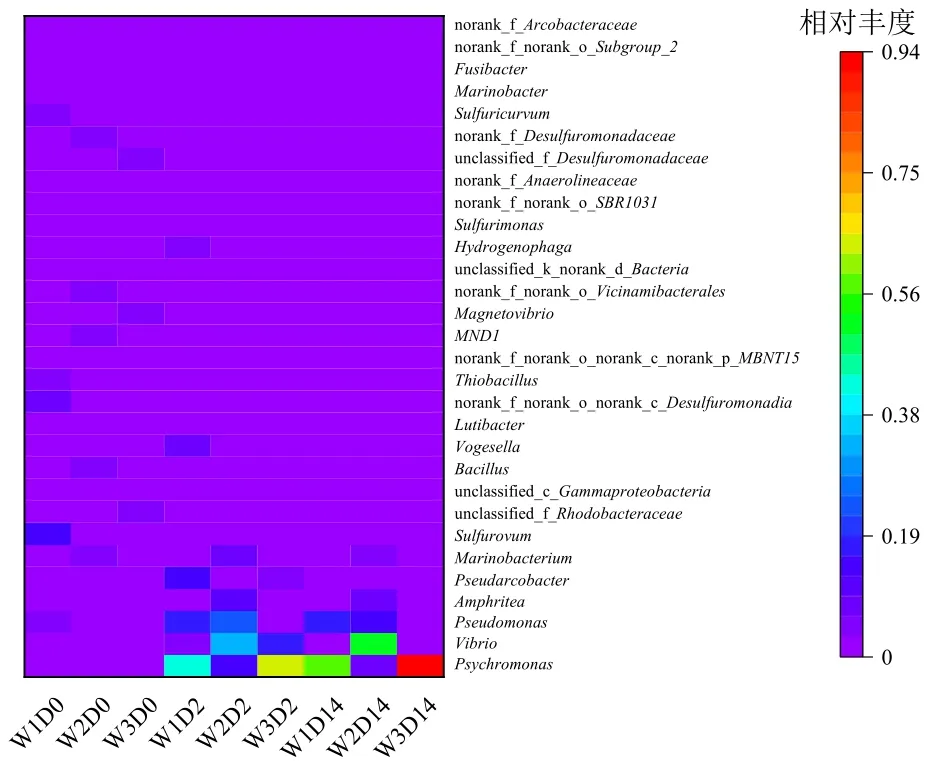
图5 微生物物种在属水平上的相对丰度Figure 5 The relative abundance of microbial species at the genus level
由此可见,研究区微生物种类丰富,优势菌属多为化能异养菌,可利用体系中的有机碳源。好氧反硝化菌可将O2作为电子受体,有机碳分解菌也可进行有氧呼吸,在二者的协同作用下O2被消耗,同时有机碳分解菌为反硝化提供电子供体,在假单胞菌属和芽胞杆菌属等好氧反硝化菌的作用下,反硝化进程开始,硝酸盐在第2-3 天降至最低水平;另外,有机碳分解菌的缺乏可能不能引起足量碳源的分解,造成反硝化进程中电子供体不足,这可能是体系脱氮效果不完全和生物需氧量降低的原因。
2.3 环境因子对硝酸盐去除的交互作用
2.3.1 ANOVA 分析
本研究选择C/N,EC 和DO 3 个环境因素,研究其对硝态氮去除率的交互作用。利用Design-Expert 12.0 对数据进行响应曲面分析,得到二次多元回归模型方程:
式中:
A——C/N;
B——EC,mS·cm−1;
C——DO,mg·L−1;
DAB——A、B交互项;
EAC——A、C交互项;
FBC——B、C交互项。该模型的校正系数r2为0.997,修正系数radj2为0.993,说明该模型因变量和自变量之间相关性较强,两者差异小于0.2,模型构建合理。
环境因素对硝态氮去除模型的回归结果分析如表4 所示,模型极显著,拟合度好(F=246.3,P<0.000 1),能够很好地表达各环境因素对硝态氮去除率的影响;A、B、C和A2对硝态氮去除率的影响显著(P<0.05);根据F值,各环境因子的单独影响大小依次为A>B>C;失拟误差(P=0.157)不显著,即其他不相关因素对响应值影响很小;变异系数(C.V.值)为2.4%<10%,表明实验的可信度和精确度高;精密度(Adeq Precision)为44.2>4.0,表明实验的准确性较高。

表4 回归结果分析表Table 4 Analysis of regression results
2.3.2 硝态氮去除率的响应曲面分析
利用三维响应曲面分析影响因素C/N、EC、DO对滨海含水层硝酸盐去除的交互作用,结果见图6。

图6 环境因子交互作用下硝态氮去除率变化曲面图Figure 6 Surface plot of nitrate removal rate under interaction of environmental factors
如图6a,当EC 为17.5 mS·cm−1时,随着C/N的升高,硝态氮去除率呈现先上升后下降趋势。当C/N 为2.0-26.0 时,硝态氮去除率逐步上升,后去除率趋于平缓,并有降低趋势。有机碳越充分,C/N越高,反硝化越明显,硝态氮去除率越高。但是,当环境中有机碳含量过高时,碳源就会“过剩”,硝态氮可利用性则成为限制反硝化的主要因素,微生物会消耗部分NO3−作为氮源,而作为反硝化电子受体的NO3−用量就会相对减少(杜华超,2015;常永凯,2021)。由图6a 底部映射图可得,硝态氮去除率随着EC 的升高而降低,并且EC 对硝态氮去除率的影响相对于C/N 的影响较小。
如图6b,当DO 为5.0 mg·L−1时,随着C/N 的升高,硝态氮去除率呈先上升后下降趋势;当C/N为2.0-40.0 时,硝态氮去除率显著升高;当C/N 为40.0-50.0 时,硝态氮去除率的下降趋势较为平缓。C/N 对硝态氮去除性能的影响较DO 更大,两因素交互作用不显著,因为研究区以好氧反硝化为主,并且在一定范围内反硝化过程对DO 不够敏感,只有DO 降低至某一阈值时反硝化速率才会大幅改变(李平等,2005)。
如图6c,硝态氮去除率的最佳EC 范围为5.0-13.0 mS·cm−1,并且随着EC 的升高,硝态氮去除率呈下降趋势,两者呈现一定的负相关性。一方面,EC 会抑制反硝化微生物的群落结构;另一方面,硝化反应需要氨氮作为反应基质,但EC 会影响沉积物对氨氮的吸附量,因为EC 越高,沉积物对氨氮的吸附能力越弱,影响硝化过程,进而影响反硝化反应(Boynton et al.,1985;林贤彪,2018)。DO 升高,硝态氮去除率稍有降低,但是DO 对硝态氮去除率的影响没有EC 显著,这也与表3 的回归结果分析一致。
3 结论
(1)研究区DO 含量高,pH 呈弱酸—弱碱环境,存在地下水硝酸盐污染问题和咸水入侵特征,DOC 含量充足,可为反硝化提供一定的碳源,地下水为Cl-Na 型或Cl-K 型保守型混合水。
(2)微生物培养试验结果表明,好氧反硝化微生物和有机碳降解微生物是影响研究区反硝化进程的关键生物因素,研究区NO3−的降解主要以好氧反硝化为主,有机碳降解菌可以分解DOC 为反硝化菌提供碳源和能量,且有机碳降解微生物的种类和丰度可能会影响脱氮性能。
(3)根据响应曲面试验和ANOVA 分析,拟合模型可信且拟合度好,C/N、EC 和DO 对硝态氮去除率影响显著,随着C/N 的增加,硝态氮去除率先快速升高,后增速变小;随着EC 的增加,硝态氮去除率呈下降趋势;随着DO 的增加,硝态氮去除率稍有下降,影响程度大小依次为:C/N>EC>DO。
