白细胞介素-35对肝细胞癌患者CD4+CD25+CD127dim/-调节性T细胞的调控作用
2023-08-10李连香奚逢瑜薛敬东叶苗青杨跃青段降龙
李 彧 李连香 奚逢瑜 薛敬东 叶苗青 杨跃青 党 珊 张 鸿 段降龙 高 瑛
近5年我国肝细胞癌(hepatocellular carcinoma,HCC)发生例数占全球42.5%,根据2020年报道,我国HCC发病率居所有恶性肿瘤第5位,死亡率居第2位[1]。以抗程序性死亡受体-1(programmed death-1,PD-1)抗体及抗PD-L1抗体为代表的免疫检查点分子抑制剂的发现为HCC治疗提供了新的思路[2],进一步说明免疫因素在HCC发生发展中的发挥重要作用。以细胞因子和免疫细胞构成的复杂免疫网络参与了HCC发病,白细胞介素-35(interleukin-35,IL-35)是一种新发现的细胞因子,属于IL-12细胞因子家族成员,是由EB病毒诱导基因3(Epstein-Barr virus-induced gene 3,EBI3)和IL-12p35构成的异源二聚体,主要由调节性T细胞(regulatory T cells,Treg)分泌,并可正反馈促进Treg功能,在肝脏疾病中发挥重要的免疫调控作用[3]。但IL-35对HCC患者Treg的调控作用尚未见相关报道。因此,本研究拟以HCC患者为研究对象,观察HCC患者IL-35的表达和Treg的比例,利用体外细胞培养体系,观察外源性IL-35对HCC患者Treg活性的调控效应。
1 材料与方法
1.1 研究对象
入组2018年12月至2019年6月在陕西省人民医院和陕西省中医医院就诊的HCC患者。入组标准:①年龄18~65岁;②取得知情同意;③诊断符合《原发性肝癌诊疗规范(2019年版)》[4]的标准;④未接受过手术、化疗、放疗、介入、靶向或免疫治疗。排除标准:①合并其他恶性肿瘤;②合并心脏、肝脏、肾脏等重要器官系统功能衰竭或严重感染;③合并自身免疫性疾病;④妊娠及哺乳期妇女。入组同时期年龄和性别匹配的健康志愿者作为正常对照(normal control,NC)。本研究方案已通过陕西省人民医院和陕西省中医医院伦理委员会审批,所有志愿者均签署知情同意书。
1.2 研究方法
1.2.1 血浆和外周血单个核细胞(peripheral blood mononuclear cells,PBMC)分离 采集EDTA抗凝外周血20 ml,1000 r/min离心10 min后采集上层血浆冻存于-80 ℃备用。下层血细胞使用人淋巴细胞分离液(北京索莱宝科技有限公司)、采用密度梯度离心法分离PBMC,冻存于液氮中备用。
1.2.2 CD4+CD25+CD127dim/-Treg纯化 使用人CD4+CD25+CD127dim/-调节性T细胞纯化试剂盒II(德国美天旎公司)纯化Treg。取107个PBMC,加入10 μl CD4+CD25+CD127dim/-T细胞生物素抗体鸡尾酒(包含生物素标记的抗人CD8、抗人CD19、抗人CD123和抗人CD127),混匀、孵育、洗涤后加入LD分离柱,收集穿过分离柱的未标记细胞即为CD4+CD127dim/-细胞。纯化的CD4+CD127dim/-细胞加入10 μl CD25 Microbeads,混匀、孵育、洗涤后加入LD分离柱,收集未穿过分离柱的标记细胞即为CD4+CD25+CD127dim/-Treg。
1.2.3 细胞刺激培养 所有HCC患者的PBMC(105个)加入重组人IL-35(美国Peprotech公司;终浓度1 ng/ml)[5-6]刺激培养24 h后收集细胞和培养上清。随机选择19例HCC患者纯化的CD4+CD25+CD127dim/-Treg加入重组人IL-35(终浓度1 ng/ml)刺激培养24 h,洗涤2次去除外源性IL-35,然后取104个刺激后的CD4+CD25+CD127dim/-Treg,与105个自体PBMC共培养系统,48 h后收集细胞和培养上清。
1.2.4 流式细胞术检测CD4+CD25+CD127dim/-Treg比例 将PBMC转入FACS管中,PBS洗涤2次,加入抗人CD3-PerCP、抗人CD4-FITC、抗人CD25-APC、抗人CD127-PE(均购自美国BD公司),于4 ℃避光孵育30 min,使用FACS Calibur流式细胞仪进行检测。
1.2.5 实时荧光定量PCR法检测EBI3、IL-12p35、PD-1、T细胞免疫球蛋白和黏蛋白结构域蛋白-3(T cell immunoglobulin and mucin domain-containing protein 3,TIM-3)、淋巴细胞活化基因3(lymphocyte-activation gene-3,LAG-3)mRNA相对表达量 提取细胞总RNA,将1 μg总RNA反转录为cDNA。使用PrimeScript RT Reagent Kit(Perfect Real Time)(宝日医生物技术有限公司)进行反转录,反转录反应体系:5×PrimeScript Buffer (for Real Time) 2 μl、PrimeScript RT Enzyme Mix I 0.5 μl、Oligo dT Primer (50 μM) 0.5 μl、Random 6 mers (50 μM) 0.5 μl、总RNA 1 μg,加入RNase Free水调整总体积至10 μl。反转录条件:37 ℃ 15 min、85 ℃ 5 s。使用TB Green Premix实时定量PCR试剂盒(宝日医生物技术有限公司)进行实时定量PCR,实时荧光定量PCR体系:TB Green Premix Ex Taq II (Tli RNaseH Plus) (2×) 10 μl、PCR上游引物 (10 μM) 0.8 μl、PCR下游引物 (10 μM) 0.8 μl、ROX Reference Dye (50×) 0.4 μl、RT反应液 2 μl,灭菌水 6 μl。实时定量PCR反应条件:预变性:95 ℃ 30 s 1个循环,PCR反应 95 ℃ 5 s、60 ℃ 30 s 40个循环。PCR引物参考既往发表文献[7,8]合成。
1.2.6 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)法检测血浆IL-35水平和培养上清中干扰素-γ(interferon-γ,IFN-γ)、IL-10、IL-35水平 使用武汉华美生物公司商品化ELISA试剂盒进行检测,操作按说明书进行。将100 μl样品和标准品加入包被的ELISA平板中,室温孵育90 min后,弃液体甩干后加入100 μl生物素标记的抗体工作液,室温孵育60 min,洗板后加入100 μl辣根过氧化物酶结合工作液,室温孵育30 min,洗板后加入TMB底物溶液90 μl,室温孵育15 min后加入终止液50 μl。450 nm波长处读取吸光度,通过绘制标准曲线计算样本中细胞因子水平。
1.2.7 细胞计数试剂盒-8(Cell Counting Kit-8,CCK-8)法检测细胞增殖 使用CCK-8试剂盒(武汉碧云天公司)进行细胞增殖检测,在培养的最后的4 h向培养液中加入10% CCK-8溶液,培养结束后在450 nm波长处读取吸光度,通过已知细胞数量的吸光度值绘制标准曲线,计算样本中的细胞数量。
1.3 统计学处理
应用SPSS 23.0软件进行数据统计分析。首先对计量资料进行正态性检验,所有计量资料均符合正态分布,采用均数±标准差表示,计量资料的组间比较采用t检验或配对t检验,相关性分析采用Pearson相关性分析,计数资料的组间比较采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 HCC患者和NC的一般资料比较
本研究共入组51例HCC患者和25例NC,一般资料见表1。

表1 HCC患者和NC一般资料比较
2.2 CD4+CD25+CD127dim/-Treg比例和IL-35在HCC患者中的变化
通过前向角光散射(forward scatter,FSC)和侧向角光散射(side scatter,SSC)去除碎片和死亡细胞,在以CD3+CD4+T细胞门内,检测CD25+CD127dim/-细胞(图1)。HCC组CD4+CD25+CD127dim/-Treg比例显著高于NC组。HCC组血浆IL-35水平显著高于NC组。HCC组PBMC中EBI3和IL-12p35 mRNA相对表达量均显著高于NC组,见表2。HCC组中CD4+CD25+CD127dim/-Treg比例与血浆IL-35水平呈显著正相关(γ=0.400,P=0.0036,图2)。
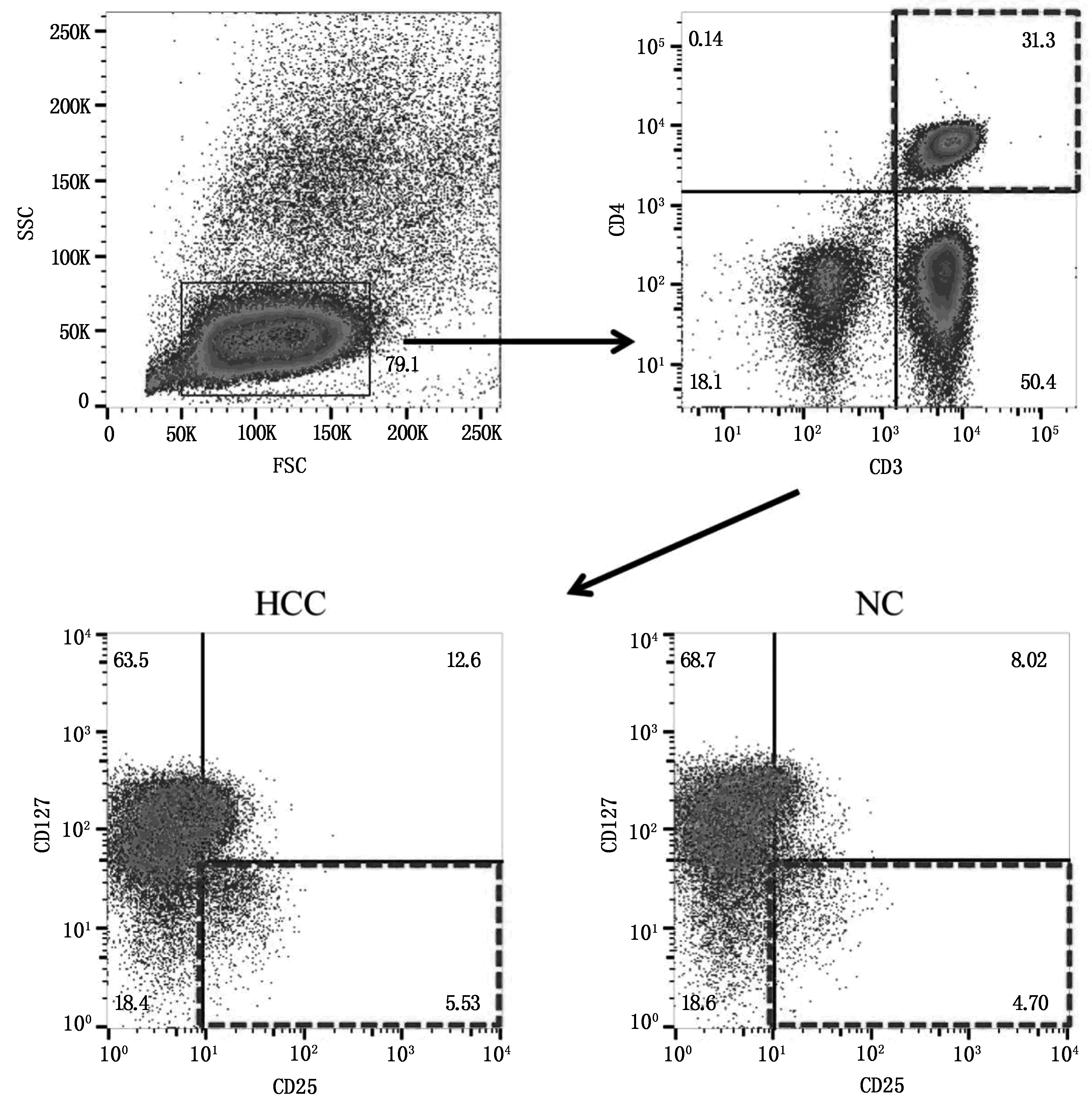
图1 HCC组和NC组PBMC中CD4+CD25+CD127dim/-Treg典型流式检测散点图
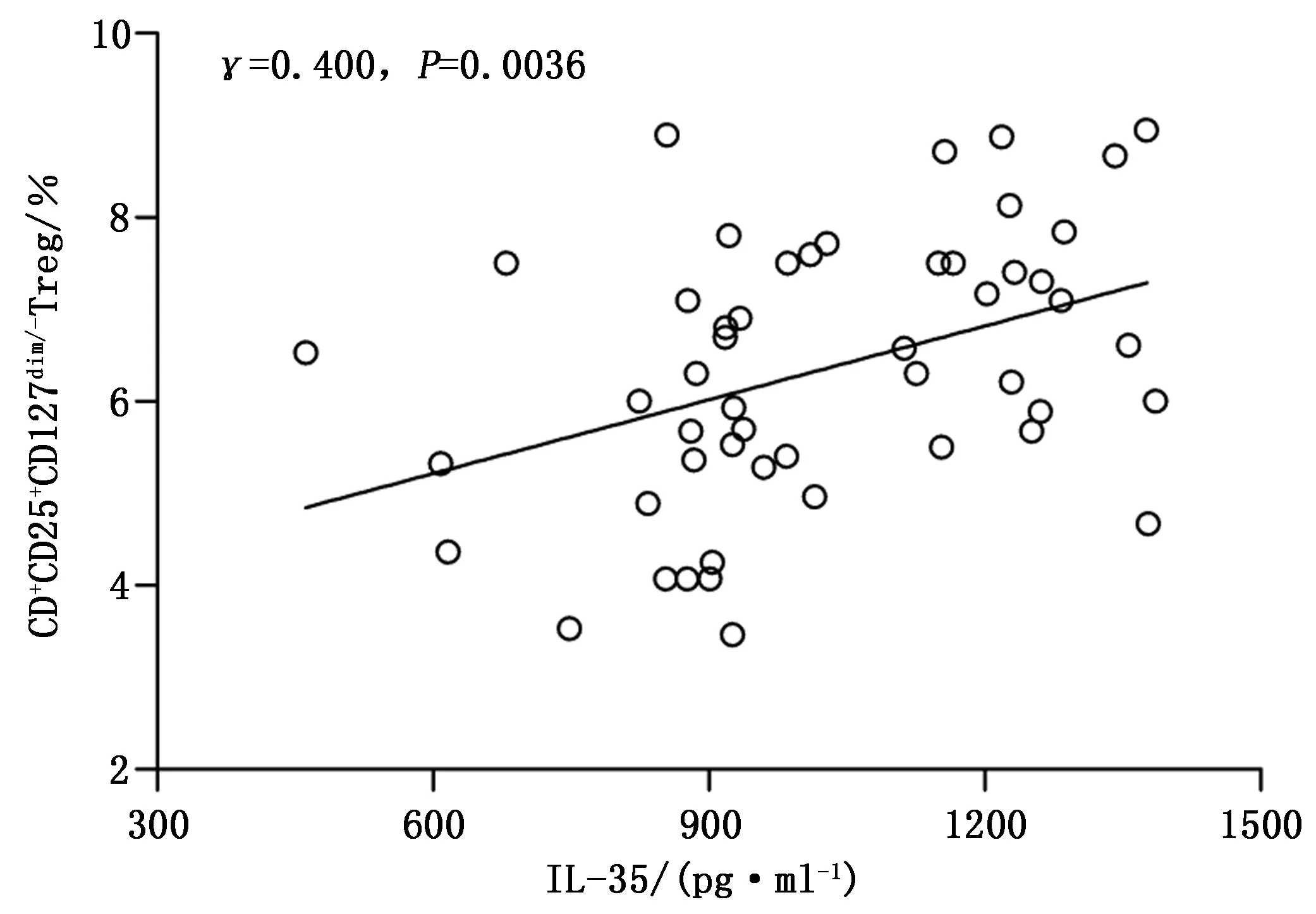
图2 HCC组CD4+CD25+CD127dim/-Treg比例与血浆IL-35水平相关性分析
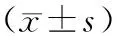
表2 HCC组和对照组血浆IL-35和PBMC中EBI3、IL-12p35 mRNA相对表达量比较
2.3 IL-35对HCC患者CD4+CD25+CD127dim/-Treg比例和EBI3、IL-12p35 mRNA相对表达量的影响
51例HCC患者分离的PBMC使用重组人IL-35刺激培养24 h后,CD4+CD25+CD127dim/-Treg比例较无IL-35刺激时升高。PBMC中EBI3和IL-12p35 mRNA相对表达量经IL-35刺激后较无IL-35刺激显著升高,见表3。
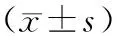
表3 IL-35对HCC患者PBMC中CD4+CD25+CD127dim/-Treg比例和EBI3、IL-12p35 mRNA相对表达量的影响
2.4 IL-35对HCC患者CD4+CD25+CD127dim/-Treg中免疫检查点受体、诱导细胞增殖和细胞因子分泌的影响
19例HCC患者纯化的CD4+CD25+CD127dim/-Treg经IL-35刺激后,免疫检查点受体PD-1、TIM-3和LAG-3 mRNA水平均升高,其抑制自体PBMC增殖的能力增强,共培养系统中细胞数量减少。在共培养上清中,IFN-γ分泌水平在经IL-35刺激的Treg中显著降低,而IL-10和IL-35分泌水平在经IL-35刺激的Treg中显著升高,见表4。
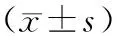
表4 IL-35对HCC患者CD4+CD25+CD127dim/-Treg免疫检查点受体、诱导细胞增殖和细胞因子分泌的影响
3 讨论
IL-35在肿瘤疾病过程中主要发挥抑制抗肿瘤免疫应答的作用。抑制小鼠肿瘤微环境中IL-35表达可增强T细胞增殖、增加T细胞效应功能和抗原提呈活性、抑制免疫检查点受体(包括:PD-1、TIM-3和LAG-3),降低T细胞功能衰竭[9]。但IL-35的表达变化在不同肿瘤中却存在差异。IL-35在乳腺癌[10]、前列腺癌[11]、急性髓系白血病[12]、结直肠癌[13]患者外周血中的水平升高,但是,在非小细胞肺癌患者外周血IL-35水平与健康对照者比较无明显变化,仅在肿瘤微环境中的浸润水平较未发生肿瘤的肺部显著升高[14]。本研究所发现的HCC患者血浆IL-35水平升高的结果与既往报道一致[6,15]。同时,本研究从转录水平证实HCC患者PBMC中IL-35组成亚基EBI3和IL-12p35 mRNA相对表达量均显著升高,与血浆蛋白表达水平一致。由于Treg是IL-35的主要来源,本研究进一步对CD4+CD25+CD127dim/-Treg在HCC患者的水平进行了分析,与既往的研究结果一致[16],HCC患者外周血Treg比例较对照者显著升高。更为重要的是,HCC患者血浆IL-35水平与CD4+CD25+CD127dim/-Treg比例呈显著正相关,进一步说明CD4+CD25+CD127dim/-Treg是HCC患者IL-35的主要来源之一,参与HCC的发病过程。
IL-35在肝脏疾病过程中发挥重要的免疫调控作用。在慢性乙型肝炎和慢性丙型肝炎感染过程中,IL-35在增强调节性Treg免疫抑制活性的同时可抑制效应性Th17细胞功能,也可抑制CD8+T细胞毒性作用,从而抑制病毒性肝炎诱导的肝脏炎症应答,发挥免疫抑制功能[5,17-18]。在慢加急性肝衰竭和HCC疾病过程中,IL-35主要促进免疫检查点分子的表达,降低细胞毒性分子表达,从而抑制CD8+T细胞的抗肿瘤效应[6,19]。但有关IL-35对HCC患者Treg功能调控的研究罕见报道。在呼吸机相关肺炎中的研究发现,外源性IL-35对刺激患者支气管肺泡灌洗液纯化的Treg可增强其免疫抑制活性,主要表现为细胞增殖减弱、抑制性细胞因子分泌增强、促炎因子分泌较少[20]。本研究亦发现,外源性IL-35可促进HCC患者PBMC中CD4+CD25+CD127dim/-Treg的比例,也可增加IL-35亚基EBI3和IL-12p35 mRNA水平,提示IL-35可增强Treg比例和IL-35表达,对Treg发挥正反馈作用,这与在结肠癌中的发现一致[21]。更为重要的是,外源性IL-35也可调控HCC患者Treg的免疫抑制功能,IL-35可促进HCC患者Treg中免疫检查点受体的表达[22],抑制PBMC增殖以及分泌抑制性细胞因子的能力均增强,IFN-γ分泌水平降低,以上结果均提示IL-35可通过增强Treg的免疫抑制活性参与HCC免疫发病,促进HCC疾病进展。
综上所述,HCC患者外周血中存在升高表达的IL-35和CD4+CD25+CD127dim/-Treg,Treg作为IL-35的主要来源,在HCC疾病过程中可能发挥正反馈作用,促进Treg的增殖和活性,进一步诱导HCC疾病中的免疫耐受,促进HCC疾病进展。
