PD-1抑制剂联合高剂量照射对肺癌小鼠的抑瘤作用及对其免疫系统的影响
2023-08-10刘瀚文
刘瀚文 王 旸 杨 峥
肺癌是目前最常见的恶性肿瘤之一,发病率约14.6%,死亡率19.4%,占癌症死亡1/3,居恶性肿瘤第一位[1]。非小细胞肺癌占肺癌85%,大部分患者确诊时已属于中晚期,传统的单一癌症治疗方式如手术治疗、放化疗对于晚期非小细胞肺癌效果不佳,整体生存率极低[2]。因此,不断开发综合治疗方案,对提高患者生存率和改善患者生活质量有重大意义。肿瘤免疫治疗是近年癌症治疗最有效的方法之一,解除肿瘤对免疫系统的屏蔽功能,激活免疫系统识别肿瘤细胞,对肿瘤细胞进行攻击,该疗法称为免疫检查点抑制剂疗法(immune checkpoint inhibitor,ICB),程序性死亡因子1(programmed death-1,PD-1)就是活化的T细胞表面高度表达的免疫检查点分子[3]。免疫治疗虽具有优势,但对很多癌症响应率不高,为了提高免疫检查点抑制剂的抗肿瘤作用,很多研究将免疫疗法与其他治疗方法联合应用,并取得一定成效[4]。因此,本研究旨在通过建立肺癌荷瘤小鼠模型,探讨PD-1抑制剂联合高剂量照射对肺癌荷瘤小鼠肿瘤生的抑制作用,为临床治疗肺癌提供参考依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 50只3~4周龄SPF级雄性C57BL/6小鼠,体质量15~22 g,动物来源:济南朋悦实验动物繁育有限公司,合格证号:SCXK(鲁)2019-0003。所有小鼠饲养于相同饲养环境(温度20 ℃~24 ℃,湿度50%~60%),自由饮水和摄食饲养7 d,定期更换垫料,保持良好通风。小鼠Lewis肺癌细胞株购于中国科学院典型培养物保藏中心(中国科学院上海生命院细胞库)。
1.1.2 药品、主要试剂和仪器 PD-1抑制剂(纯度98.48%,北京百奥莱博科技有限公司,批号:M04606,);白细胞介素-2(interleukin-2,IL-2)、干扰素γ(interferon,IFN-γ)、肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)ELISA试剂盒(上海酶联生物科技有限公司);兔抗β-actin多克隆抗体、PD-1、程序性细胞死亡配体1(programmed cell death ligand,PD-L1)多克隆抗体、山羊抗兔二抗IgG(北京奥博森生物技术有限公司);细胞培养基、胰蛋白酶消化液、胎牛血清(北京索莱宝科技有限公司)。
1.2 方法
1.2.1 细胞培养 于含有10%胎牛血清的细胞培养基培养小鼠Lewis肺癌细胞,置于5% CO2培养箱37 ℃恒温培养,待细胞生长至80%融合度时,加入0.25%胰蛋白酶-EDTA消化液消化传代,消化终止后,使用PBS缓冲液吹打混匀,配置成1×107个/ml的细胞悬液。
1.2.2 造模、分组与给药 选取40只小鼠建立肺癌荷瘤小鼠模型,将配置好的小鼠Lewis肺癌细胞悬液接种于小鼠右腋下0.2 ml,接种后7 d观察小鼠皮下,若接种部位出现米粒大小硬物块即为造模成功[5]。将造模成功小鼠随机分为模型组、PD-1抑制剂组、高剂量照射组、联合组(PD-1抑制剂联合高剂量照射),各10只,另设对照组10只,不接种Lewis肺癌细胞。PD-1抑制剂组和联合组小鼠腹腔注射2 mg/ml的PD-1抑制剂100 μL,对照组及模型组注射等量PBS,各组给药1次/d,连续注射14 d;末日给药后,高剂量照射组和联合组小鼠肿瘤部位接受单次剂量10 Gy的电离照射。
1.3 检测指标
1.3.1 标本采集 各组小鼠给药前和末次治疗后称重,末次给药后禁食24 h,腹腔注射3%戊巴比妥钠麻醉,开腹,经腹主动脉采集血液,静置30 min,于4 ℃下3000 r/min,r=12 cm高速离心机离心15 min,分离血清,-20 ℃保存。脱颈法处死小鼠,剥离小鼠瘤体并进行称重,摘取小鼠胸腺、脾脏进行称重,将小鼠瘤体使用预冷的生理盐水冲洗后,剪取部分肿瘤组织装入无菌冻存管内,-80 ℃保存备用,其余肿瘤组织置入4%多聚甲醛液固定24 h备用。
1.3.2 血清IFN-γ、IL-2、TNF-α水平检测 通过ELISA法检测小鼠血清中IFN-γ、IL-2、TNF-α浓度,取出ELISA试剂盒室温下复温30 min,按照说明书操作,依次加入待测样品100 μL(各组小鼠血清样本)、一抗、二抗、显色液50 μL、终止液,以空白孔调零作对照,于450 nm波长处检测各孔光密度值,根据标准品梯度浓度与对应光密度值构建标准曲线,代入待测样品OD值并计算各样本浓度。
1.3.3 抑瘤率计算 记录各组小鼠瘤体质量并计算平均值,按照公式计算肿瘤生长抑制率,肿瘤生长抑制率(%)=(模型组小鼠平均肿瘤质量-治疗组小鼠平均肿瘤质量)/模型组小鼠平均肿瘤质量×100%。
1.3.4 脏器指数计算 将摘取的胸腺和脾脏组织放入PBS中反复冲洗,去除表面血污,滤纸吸干表面水分,进行称重并计算胸腺指数与脾脏指数。胸腺指数=胸腺质量(mg)/体质量(g);脾脏指数=脾脏质量(mg)/体质量(g)。
1.3.5 肿瘤组织HE染色 取出经4%多聚甲醛固定后的肿瘤组织,梯度酒精溶液脱水,二甲苯透明。石蜡中包埋、切片(5 μm)。将切片放入二甲苯、无水乙醇、梯度酒精溶液进行脱蜡复水,切片置于苏木素液10 min,流水冲洗1 min,1%盐酸分化30 s,返蓝后流水浸泡15 min,0.5%伊红染液浸泡2 min,流水冲洗5 min,梯度酒精溶液再次脱水透明,使用中性树脂封固。干燥后于光学显微镜下观察组织病理变化,镜下拍照。
1.3.6 PD-1、PD-L1 mRNA表达 Trizol法提取肿瘤组织总RNA,按照RNA提取试剂盒说明书操作提取总RNA,检测RNA浓度及纯度后。PrimeScriptTM1st Strand cDNA Synthesis反转录试剂盒合成cDNA,配制PCR反应体系20 μL:上、下游引物各0.5 μL,Reddy Mix PCR Master Mix 10.6 μL,DNA template 0.4 μL,cDNA 2 μL,RNase free ddH2O 6 μL。反应条件为95 ℃ 25 s,56 ℃ 35 s,72 ℃ 65 s下进行40个循环。取样本CT值平均数,以目的基因相对内参的表达量计算各样本之间基因表达差异,2-△△CT计算各样本基因的表达相对量。反应引物序列设计为PD-1-F:5′-GCACCCCAAGGCAAAAATCG-3′、PD-1-R:5′-CAATACAGGGATACCCACTAGGG-3′;PD-L1-F:5′-TAGTGGG-TATCCCTGTATTGCTG-3′、PD-L1-R:5′-CTTCTCTCGT-CCCTGGAAGTC-3′;β-actin-F:5′-GGCTGTATTCCCCT-CCATCG-3′、β-actin-R:5′-CCAGTTGGTAACAATGCCATGT-3′。
1.3.7 PD-1、PD-L1蛋白表达 将肿瘤组织加入400 μL裂解液,充分接触细胞,等待细胞完全裂解,将悬液在4 ℃下12000 rpm,r=12 cm离心机离心5 min,收集上清液。使用BCA蛋白浓度试剂盒,配制好BCA工作液,测定蛋白浓度。按照蛋白上样量40 μL,加入配制好的10%蛋白分离胶与5%蛋白浓缩胶,恒压80 V电泳30 min,恒压120 V电泳90 min至溴酚蓝指示剂到达底部即停。调整电流为260 mA,转至PDVF膜上,使用TBST冲洗后,加入5%脱脂牛奶摇床封闭2 h,丢弃封闭液再加入1∶1000稀释一抗,4 ℃过夜,TBST清洗PDVF膜10 min,加入1∶2000稀释二抗,室温封闭60 min,TBST清洗,滴加发光液放入凝胶图像分析仪进行显影,保存图像,以β-actin为内参,观察并分析条带上相应的蛋白表达量。
1.4 统计学分析
2 结果
2.1 体质量比较
治疗前,各组小鼠体质量比较,差异无统计学意义(P>0.05)。与治疗前比较,治疗后对照组、PD-1抑制剂组、高剂量照射组和联合组小鼠体质量升高(P<0.05)。治疗后与对照组比较,模型组小鼠体质量降低(P<0.05)。与模型组比较,PD-1抑制剂组、高剂量照射组和联合组小鼠体质量均升高(P<0.05)。与PD-1抑制剂组和高剂量照射组比较,联合组小鼠体质量升高(P<0.05),见表1。
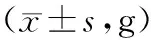
表1 各组小鼠体质量比较
2.2 血清IFN-γ、IL-2、TNF-α水平检测
与对照组比较,模型组小鼠血清中IFN-γ、IL-2、TNF-α水平降低(P<0.05)。与模型组比较,PD-1抑制剂组、高剂量照射组和联合组小鼠血清中IFN-γ、IL-2、TNF-α水平均升高(P<0.05)。与PD-1抑制剂组和高剂量照射组比较,联合组小鼠血清中IFN-γ、IL-2、TNF-α水平升高(P<0.05),见表2。
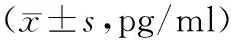
表2 各组小鼠血清IFN-γ、IL-2、TNF-α水平比较
2.3 肿瘤生长抑制率比较
与模型组比较,PD-1抑制剂组、高剂量照射组和联合组小鼠瘤质量降低,肿瘤生长抑制率升高(P<0.05)。与PD-1抑制剂组和高剂量照射组比较,联合组小鼠瘤质量降低,肿瘤生长抑制率升高(P<0.05),见表3。
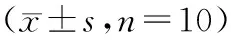
表3 各组小鼠瘤质量与抑瘤率的比较
2.4 脏器指数比较
与对照组比较,模型组小鼠胸腺指数和脾脏指数均降低(P<0.05)。与模型组比较,PD-1抑制剂组、高剂量照射组和联合组小鼠胸腺指数和脾脏指数均升高(P<0.05)。与PD-1抑制剂组和高剂量照射组比较,联合组小鼠胸腺指数和脾脏指数升高(P<0.05),见表4。
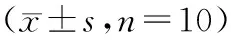
表4 各组小鼠胸腺指数和脾脏指数的比较
2.5 肿瘤组织HE染色比较
结果显示,模型组小鼠肿瘤组织细胞结构清晰、排列紊乱但紧密,细胞核分裂现象较多,细胞生长旺盛,坏死现象较少,免疫细胞浸润现象较少,整体未见明显坏死区域;PD-1抑制剂组、高剂量照射组和联合组小鼠肿瘤组织细胞排列松散无序,细胞密度降低,细胞核分裂现象较少,核仁固缩,细胞坏死现象较多,免疫细胞浸润现象明显增多,整体可见明显坏死区域。
2.6 PD-1、PD-L1 mRNA水平比较
与模型组比较,PD-1抑制剂组、高剂量照射组和联合组小鼠肿瘤组织PD-1、PD-L1 mRNA表达水平降低(P<0.05)。与PD-1抑制剂组和高剂量照射组比较,联合组小鼠肿瘤组织PD-1、PD-L1 mRNA表达水平降低(P<0.05),见表5。
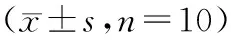
表5 各组小鼠PD-1、PD-L1 mRNA水平比较
2.7 PD-1、PD-L1蛋白水平比较
与模型组比较,PD-1抑制剂组、高剂量照射组和联合组小鼠肿瘤组织PD-1、PD-L1蛋白表达水平降低(P<0.05)。与PD-1抑制剂组和高剂量照射组比较,联合组小鼠肿瘤组织PD-1、PD-L1蛋白表达水平降低(P<0.05),见表6,图1。

A为模型组,B为PD-1抑制剂组,C为高剂量照射组,D为联合组。图1 肿瘤组织蛋白检测
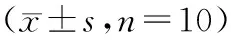
表6 各组小鼠PD-1、PD-L1蛋白水平比较
3 讨论
肺癌的发病机制较为复杂,研究表明,多数患者病因与空气污染程度、职业环境、吸烟和遗传因素相关,肺癌具有发病快、易转移、高复发率等特点,病死率远高于其他恶性肿瘤疾病,延长患者生命时长和生活质量是治疗难题[6-7]。临床工作中,放射疗法和近年提出的免疫疗法都取得较大进展,但均具有一定局限性[8]。因此,联合免疫疗法和放射治疗多途径治疗癌症,开发新的治疗方案刻不容缓[9]。
肿瘤的发生、发展和转移与机体自身的免疫功能失调和肿瘤微环境的改变密切相关,恶性肿瘤的疗法不应局限于除去瘤体,积极调动机体自身免疫系统,改变免疫微环境对抗肿瘤是治疗肿瘤的关键[10]。本研究通过动物实验,建立肺癌荷瘤小鼠模型,从分子机制上探讨PD-1抑制剂对荷瘤小鼠肿瘤生长的抑制作用及免疫功能的影响。结果显示,模型组小鼠肿瘤质量升高,体质量、胸腺指数、脾脏指数水平均降低,提示模型组小鼠肿瘤组织生长迅速,小鼠免疫功能失调,机体损伤严重,肺癌荷瘤模型建立成功。在给予PD-1抑制剂和高剂量照射治疗后小鼠均表现肿瘤质量降低,体质量、肿瘤生长抑制率、胸腺指数、脾脏指数水平均升高,以联合组效果最佳。说明治疗组小鼠免疫功能失调现象得到改善,且抑制肿瘤生长。此外,肿瘤组织HE染色结果也表明肿瘤细胞受到攻击,出现大量细胞坏死,细胞分裂现象较少,免疫微环境得到调节,进一步验证PD-1抑制剂和高剂量照射对肿瘤生长均有抑制作用。
PD-1作为诱导型蛋白,在未活化的T细胞中几乎不表达,而活化的T细胞中会有大量PD-1诱导表达,PD-1具有调控T细胞抑制信号功能,是免疫系统进行应答和调节免疫功能建立耐受的重要因子。其配体PD-L1通过EGFR、MAPK或PI3K/Akt等多种通路激活,受到转录因子调节及免疫微环境中IFN-γ因子刺激可以在肿瘤细胞中高度表达,当肿瘤细胞表面的PD-1与PD-L1结合后,会诱导肿瘤特异性T细胞对肿瘤抗原无反应或者诱导肿瘤特异性T细胞凋亡,使肿瘤细胞逃脱免疫系统的攻击[11]。通过PD-1抑制剂阻断其结合可以恢复肿瘤特异性T细胞对肿瘤细胞的免疫抑制能力,从而达到抗肿瘤效果[12]。在本研究中,模型组小鼠IFN-γ、IL-2、TNF-α降低,PD-1、PD-L1 mRNA和蛋白表达水平均升高,表明模型组小鼠PD-1/PD-L1信号通路被激活后,机体免疫功能失调,促进肿瘤生长。与模型组比较,PD-1抑制剂和高剂量照射治疗的小鼠均表现IFN-γ、IL-2、TNF-α水平升高,PD-1、PD-L1 mRNA和蛋白表达水平均降低,可见PD-1抑制剂能够有效抑制PD-1/PD-L1信号通路,提高免疫细胞攻击肿瘤细胞,调节小鼠免疫功能,对小鼠肿瘤生长有明显的抑制作用。
综上所述,PD-1抑制剂对肺癌荷瘤小鼠肿瘤生长有一定的抑制作用,联合高剂量照射可以提高疗效,可能是通过抑制PD-1/PD-L1信号通路发挥作用,为临床治疗肺癌提供实验依据。
