ADRB1和ACE基因多态性与左心室肥厚的相关性研究
2023-08-09张毅顾铭霞
张毅 顾铭霞
(1.南通大学附属医院心血管内科,江苏 南通 226006;2.南京市中心医院心血管内科,江苏 南京 211800)
原发性高血压(essential hypertension,EH)是中国最常见的慢性疾病之一,左心室肥厚(left ventricular hypertrophy,LVH)是一系列心脑血管事件如心力衰竭、心律失常、脑卒中及猝死等的独立危险因素[1]。据统计在中国中老年EH患者中近半数合并LVH,合并LVH患者心脑血管疾病发病率及死亡率显著增加。尽管EH是LVH的重要危险因素,但单纯控制血压不足以使心肌肥厚得到逆转,且部分LVH可出现在EH之前,可见心肌肥厚的产生涉及除血压以外的其他致病因素。研究表明遗传因素对左心室质量有显著影响[2],约占非血压因素的60%。近年随着基因芯片技术、分子遗传学技术的快速发展,识别LVH易感基因的研究受到广泛关注。交感神经系统、肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)是LVH发生发展的重要通路,调控这两个系统的关键基因是β1肾上腺素受体(β1-adrenergic receptor,ADRB1)基因和血管紧张素转换酶(angiotensin converting enzyme,ACE)基因。
ADRB1基因定位于染色体10q24-q26,于1987年从人体胎盘互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)文库中克隆出,主要由3个部分组成:86 bp的5’非翻译区、900 bp的3’非翻译区和447个氨基酸残基组成的蛋白质开放阅读框。ADRB1是一种G蛋白耦联受体,在人体心肌细胞膜中大量表达[3]。目前研究较多的ADRB1基因单核苷酸多态性位点是Arg389Gly,根据Arg389Gly多态性位点核苷酸序列G1165C点突变碱基的改变,可形成3种基因型:野生型/不敏感型(Gly/Gly,GG)、杂合型/中间敏感型(Arg/Gly,CG)及突变型/敏感型(Arg/Arg,CC)。
ACE基因位于第17号染色体17q23上,基因全长44 769 bp,包括26个外显子和25个内含子。ACE是一种羧基肽酶,广泛分布于全身各组织,以肺毛细血管内皮细胞分布最多[4]。目前对ACE基因多态性研究较多的是I/D多态性,由第16内含子中插入或缺失一段重复序列DNA片段所决定,可形成3种不同的基因型:均含有插入片段的基因型为插入型纯合子(II型),均含有缺失片段的基因型为缺失型纯合子(DD型),既含有插入片段又含有缺失片段的基因型为杂合子(ID型)。
目前国内外对ADRB1、ACE基因多态性与LVH的相关性研究众多,但结论各异,同时ADRB1基因与ACE基因协同作用在LVH发生发展过程中的影响国内外鲜有报道。本研究应用基因芯片技术检测LVH组与非LVH组ADRB1基因及ACE基因多态性位点,并分析各组的基因型及等位基因频率分布差异,同时通过基因多态性联合分析探究ADRB1、ACE基因相互作用与LVH的相关性。
1 对象与方法
1.1 研究对象
选取2020年1月—2021年1月南京市中心医院心内科住院病例,根据《中国高血压防治指南》(2018年修订版)EH最新诊断标准:在未使用降压药物的情况下,非同日3次测量诊室血压,收缩压≥140 mm Hg(1 mm Hg=0.133 3 kPa)和/或舒张压≥90 mm Hg;既往有EH病史,目前正在使用抗高血压药,虽血压<140/90 mm Hg,仍诊断为EH[5]。所有入选者排除继发性高血压、肥厚型心肌病、心脏瓣膜病、冠心病、充血性心力衰竭、糖尿病、先天性心脏病、严重肝肾疾病、脑卒中等。共入选EH患者80例(男性51例,女性29例),平均年龄为(72±12)岁。根据有无LVH,将EH患者分为EH伴LVH(LVH+)组33例(男性22例,女性11例),平均年龄为(75±11)岁;EH不伴LVH(LVH-)组47例(男性29例,女性18例),平均年龄为(70±13)岁。
1.2 研究方法
1.2.1 测定临床指标
所有入选患者均常规询问病史并进行全面体格检查,测量身高、体重,计算体重指数(body mass index,BMI)[BMI(kg/m2)=体重/身高2]。血压测量以静坐休息15 min后,3次坐位右上臂血压的平均值作为最终血压值。禁食10 h以上,于次日清晨采空腹血进行生化分析,内容包括:空腹血糖(fasting blood glucose,FBG)、肝肾功能、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和甘油三酯(triglyceride,TG)水平。
1.2.2 LVH的测定
对所有入选者进行心脏超声检查,连续测量3个心动周期左心室舒张末期内径(left ventricular internal diastolic dimension,LVIDd)、室间隔厚度(interventricular septum thickness,IVST)及左心室后壁厚度(left ventricular posterior wall thickness,LVPWT),取其平均值。体表面积(body surface area,BSA)采用Stevenson公式计算:BSA(m2)=0.006 1×身高+0.012 8×体重-0.152 9。根据Devereux校正公式,计算左心室质量(left ventricular mass,LVM){LVM(g)=1.04×[(LVIDd+IVST+LVPWT)3-LVIDd3]×0.8+0.6}和左心室质量指数(left ventricular mass index,LVMI)[LVMI(g/m2)=LVM/BSA]。采用2018年欧洲高血压协会LVH的诊断标准[6]:男性LVMI≥115 g/m2、女性LVMI≥95 g/m2。
1.2.3 基因芯片分析流程
(1)DNA提取:取外周静脉血2 mL,乙二胺四乙酸抗凝,应用全血基因组DNA提取试剂盒法提取DNA。(2)检测流程:①准备反应液TaqManTMOpenArrayTMGenotyping Master Mix;②将反应液分别分装在96孔板中,每个反应孔3 μL;③按照96孔板排版信息将3 μL样本DNA、阳性对照品、阴性对照样本加入96孔板中,孔板封膜,瞬时离心5 s;④按照384孔板排版信息,使用12通道移液枪将5 μL的反应混合物从96孔板转移至384孔板,吸取前吹打混匀数次,封上铝膜,离心;⑤将制备好的384孔反应混合板在Accufill仪器上完成芯片加载;⑥仅触摸芯片边缘,轻轻地将加入样本的芯片放入印版压力机中,将lid(泡沫面朝下)放在位于压板机中的芯片上,确保盖子与芯片对齐,缺口端朝向序列号,且芯片和lid摆放到位,拉下手柄开始密封,状态指示灯将绿色闪烁20 s,然后变为稳定的绿色,表示芯片已密封完成,松开手柄,抓住外壳的边缘部分,从压力机上取下密封的芯片;⑦注射浸液,将浸入式液体注射器针头插入密封盒末端的注射口(填充口),倾斜外壳,然后缓慢持续地将芯片完全浸没,从lid的顶部和底部取下保护膜;⑧将密封好的芯片放入QuantStudio 12K芯片托架中,上机操作;⑨将结果保存并导入TaqMan® Genotyper Software进行分析。
1.3 统计学方法
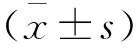
2 结果
2.1 LVH+组和LVH-组临床资料的比较
LVH+组的TC、LDL-C及血肌酐值与对照组相比差异有统计学意义(P<0.05);两组间的性别构成、年龄差异、BMI、FBG、HDL-C、肝功能及血压水平等无显著性差异(P>0.05)。见表1。
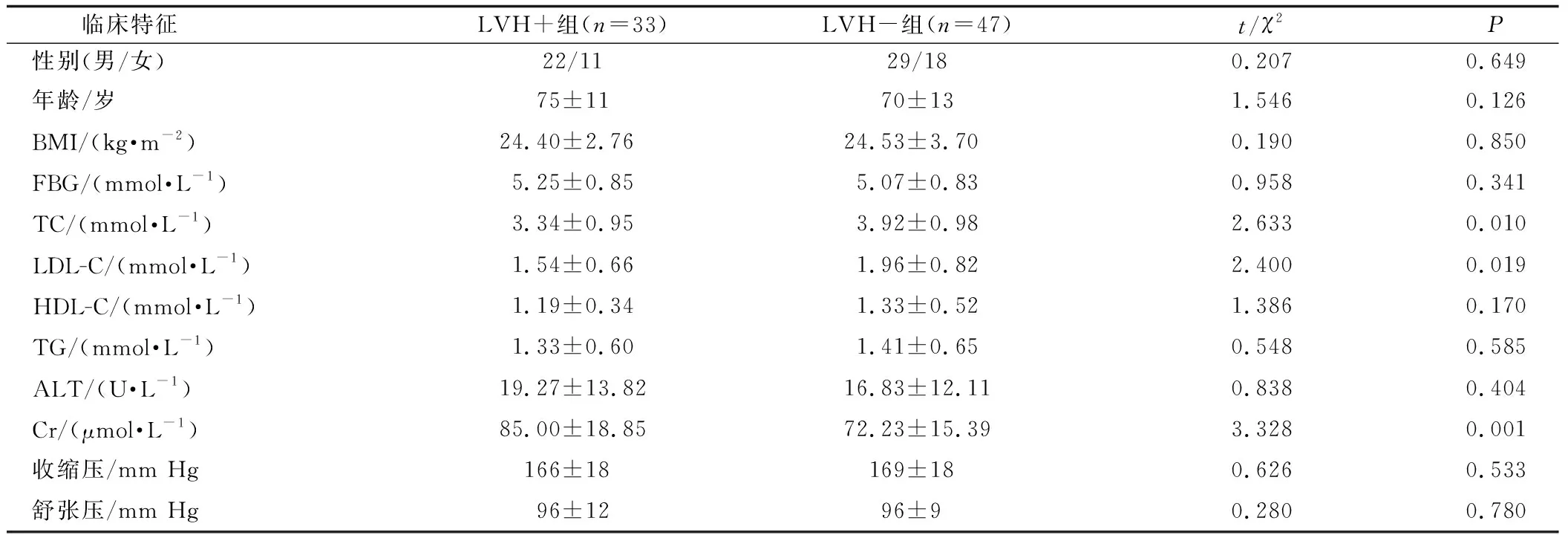
表1 临床资料比较
2.2 LVH+组和LVH-组ADRB1基因型和等位基因频率比较
对两组中各基因型分布作遗传平衡检测,均符合哈迪-温伯格定律。LVH+组与LVH-组ADRB1基因C/G多态性比较,基因型频率在两组间的分布差异有统计学意义(P<0.05);进行ADRB1基因型的两两比较,LVH+组CC基因型频率高于LVH-组,差异有统计学意义(P<0.05);两组C等位基因频率比较,LVH+组高于LVH-组(84.8% vs 70.2%),差异有统计学意义(P<0.05);这表明ADRB1基因C/G多态性C等位基因可能与EH患者LVH的发病存在相关性,是LVH发病的危险因素。见表2。

表2 ADRB1基因多态性比较
2.3 LVH+组和LVH-组ACE基因型和等位基因频率比较
对两组中各基因型分布作遗传平衡检测,均符合哈迪-温伯格定律。LVH+组与LVH-组ACE基因I/D多态性比较,基因型频率在两组间的分布差异有统计学意义(P<0.05);进行ACE基因型的两两比较,显示LVH+组ID基因型频率高于LVH-组,差异有统计学意义(P<0.05);两组D等位基因频率比较,LVH+组高于LVH-组(57.6% vs 38.3%),差异有统计学意义(P<0.05);这表明ACE基因I/D多态性D等位基因可能与EH患者LVH的发病存在相关性,是LVH发病的危险因素。见表3。
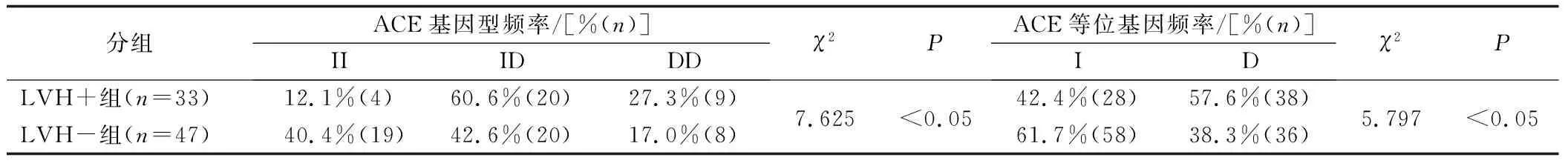
表3 ACE基因多态性比较
2.4 ADRB1及ACE基因多态性的联合分析
对LVH+组与LVH-组中ADRB1 CC基因型与ACE ID基因型的联合分析,显示联合基因型在两组中分布频率差异无统计学意义(P>0.05);这表明两种敏感基因型的联合作用与EH患者LVH的发病无明显相关性,两种基因间可能不存在协同作用。见表4。

表4 ADRB1 CC基因型与ACE ID基因型联合比较
3 讨论
EH患者发生心肌肥厚的原因包括多种血流动力学和非血流动力学因素,虽然血压升高是主要决定因素,但神经体液和遗传因素、肥胖、糖尿病等均可能参与心肌肥厚的发生发展。研究表明,交感神经系统兴奋后通过激活心肌细胞表达的β和α肾上腺素受体引起心肌肥厚;此外,交感神经兴奋释放的儿茶酚胺可促进心肌蛋白合成及间质胶原沉积而发生心肌纤维化,最终导致心肌肥厚。RAAS活性对EH患者LVH的发展和消退亦具有显著作用[7],其中血管紧张素Ⅱ是RAAS的关键效应因子,具有升高血压、收缩血管、促进细胞生长和血管生成、增强交感神经活性、促进醛固酮分泌及水钠潴留等作用。研究表明,在合并EH的动物模型中,血管紧张素Ⅱ作用于血管紧张素Ⅱ1型受体发挥增强炎症及氧化应激反应、促进细胞凋亡等作用,最终导致心肌肥厚和心肌纤维化[8]。此外,醛固酮水平升高也可导致心肌胶原蛋白合成增多、心肌间质纤维化,最终引起心肌肥厚[9]。ADRB1、ACE基因是交感神经系统和RAAS中关键的调控基因,二者基因多态性参与LVH的发生发展过程。
3.1 ADRB1基因与LVH的相关性
动物研究证实ADRB1基因C等位基因可增强β肾上腺素受体对激动剂刺激的反应,转染ADRB1基因C等位基因的细胞对激动剂刺激的活性大约是转染ADRB1基因G等位基因细胞的200%[10],提示C/G多态性位点具有功能上的重要性。另有研究[11]表明,对ADRBl的慢性刺激可导致转基因小鼠出现心肌肥厚和心力衰竭,在心力衰竭患者中表现为疾病进展。国内张永林等[12]选取EH伴心肌肥厚113例、EH不伴心肌肥厚114例及正常对照115例,研究ADRB1基因多态性对EH患者心肌肥厚的影响。结果表明ADRB1基因C/G多态性参与EH患者心肌肥厚的发生和肥厚程度的调节,C等位基因携带者发生心肌肥厚的风险更高且LVMI更大。
本研究对ADRB1基因C/G多态性进行检测,分析其在LVH+组与LVH-组中基因型及等位基因频率分布差异,结果显示LVH+组CC基因型分布频率明显高于LVH-组(P<0.05),LVH+组与LVH-组C等位基因频率分别为84.8%和70.2%,差异有统计学意义(P<0.05),提示C等位基因携带可能是导致EH患者发生LVH的危险因素。
3.2 ACE基因与LVH的相关性
国内外学者对ACE基因多态性与LVH关系研究基本一致,认为EH患者发生LVH与ACE DD基因型密切相关。Cosenso-Martin等[13]研究表明,DD基因型与较高的LVH患病率相关[II(13.0%)、ID(34.1%)、DD(46.5%),P<0.05],DD基因型携带者发病风险增加。Fajar等[14]进行的一项荟萃分析研究显示,ACE I/D的D等位基因和DD基因型与LVH的风险增加显著相关,I等位基因与LVH的风险降低相关,而II和ID基因型与LVH风险无关。Bahramali等[15]进行的一项病例对照研究,在合并射血分数保留的心力衰竭的EH患者中ACE D等位基因可能与LVH发生相关,提示EH患者射血分数保留的心力衰竭的发生与遗传因素有关,并可能成为该疾病未来的风险预测因子。
本研究发现,LVH+组与LVH-组间ACE基因各基因型分布频率差异具有统计学意义(P<0.05),ID基因型分布频率在LVH+组明显高于LVH-组;LVH+组与LVH-组D等位基因频率分别为57.6%和38.3%,差异有统计学意义(P<0.05),提示D等位基因可能是导致EH患者发生LVH的危险因素。但国外Lindpaintner等[16]研究显示ACE基因型与LVH患病率无关,携带DD、ID和II基因型受试者LVH患病率分别为15.6%、13.6%和15.6%,差异均无统计学意义。考虑因为Lindpaintner等[16]选择的研究对象是无心脏疾病的正常人群,笔者研究团队选择的是EH患者。此外,研究对象的种族、地域分布差异也可能是导致研究结果不一致的原因。
3.3 联合基因检测与EH及LVH的相关性
国内学者通过研究ACE、α-内收蛋白基因联合作用与LVH的关系,发现同时携带ACE D等位基因的患者LVMI与α-内收蛋白的基因型有关,TT基因型LVMI最大,从而证实了ACE基因及α-内收蛋白基因间存在联合作用。而国内外对ADRB1、ACE基因联合作用与LVH发生发展的相关性尚无报道,本实验对ADRB1与ACE基因的敏感基因型进行联合分析,结果显示ADRB1 CC基因型联合ACE ID基因型在LVH+组与LVH-组间分布频率无统计学差异,提示二者基因型的联合作用对LVH的发病可能不存在协同作用。
研究数据[17]表明,多种遗传变异对LVM都具有一定的效应,参与LVM的调控。易感基因联合作用可能导致LVH发病风险显著上升,加大疾病的诊治难度。考虑可能存在多个LVH相关的易感基因,这些基因可能单独或联合作用,还可能与传统易感因素共同作用增加LVH的危险性,因此研究这些相关基因多态性与LVH发生发展之间的关系具有重要意义。本研究未能证实ADRB1与ACE基因联合作用对LVH的影响,考虑可能存在其他混杂因素影响,同时本研究样本量较少,期待未来更大样本量的数据探讨基因多态性以及联合基因对LVH发生发展的影响,以利于识别EH患者LVH遗传基因的易感性及评估遗传风险,为EH患者LVH的防治提供理论依据。同时,及早对携带LVH易感基因的人群进行相关健康饮食和生活习惯宣教,可降低该类人群中LVH的发病率和死亡率。