胆囊结石患者发生意外胆囊癌的临床分析
2023-08-09潘治平孙旭岑峰严强
潘治平 孙旭 岑峰 严强
胆囊癌是胆道最常见的恶性肿瘤,也是消化系统第五大常见癌症[1-2],其全球发病率为2/100 000,而中国每年胆囊癌发生病例数超过50 000例,死亡人数超过40 000人[3-4]。胆囊癌患者的5年生存率低于5%,除生物学行为不良外,早期诊断率低也是预后不良的重要原因[5]。由于胆囊癌在疾病的早期和中期通常无症状,约50%~70%的胆囊癌是在择期胆囊切除术期间或之后偶然诊断的,约占所有胆囊切除术标本的0.7%[6]。这种在术前放射学检查中无法检测,而在手术病理检查时发现的胆囊癌定义为意外胆囊癌。有文献报道,许多意外胆囊癌患者术后仍有残余病灶;此外,部分患者初次手术时未进行R0切除,其存活率可能相对降低[7]。胆囊结石和慢性胆囊炎是胆囊恶性肿瘤形成的重要危险因素[8],两者可激活胆囊的自身修复机制,使黏膜细胞处于增生状态,从而加速“化生-异型增生-癌”这一过程[9]。本研究旨在分析胆囊结石患者发生意外胆囊癌的因素,现将结果报道如下。
1 对象和方法
1.1 对象收集2016年12月至2022年8月湖州市中心医院胆囊结石且择期行胆囊切除手术的患者8 010例。纳入标准:所有患者均经B超、CT等影像学检查确诊为胆囊结石,同时临床体征与症状检查均确诊为胆囊结石,符合胆囊切除手术适应证。排除标准:(1)合并肝癌或肝硬化;(2)存在手术禁忌证;(3)存在心、肝、肾等重要器官功能障碍;(4)具有严重的过敏史;(5)患有严重的血液性疾病、恶性肿瘤或内分泌系统疾病;(6)哺乳期或妊娠期妇女;(7)严重精神障碍。所有患者均行胆囊切除手术,其中术中或术后病理检查诊断胆囊癌患者33例(观察组),约占0.41%。根据术中或术后病理学检查诊断为胆囊结石伴胆囊炎的7 977例患者中,按1∶4比例随机抽取132例患者纳入对照组。本研究经本院医学伦理委员会审查通过。
1.2 方法
1.2.1 资料收集临床资料从门诊和住院病历中收集,主要包括人口统计学特征、实验室和影像学检查、基础疾病、手术信息、病理检查结果等。
1.2.2 治疗方法(1)所有患者术前均行超声或CT等影像学检查,均在全麻下进行胆囊切除手术,胆囊标本常规进行术中冷冻切片,由2位病理学副主任医师进行检查,意见不一致时,由科主任进行审核。(2)对于术中发现的意外胆囊癌,如果术中诊断明确,患者身体条件可以耐受,应根据术中冷冻切片病理检查结果实施胆囊癌根治术。手术切除范围主要包含肝脏的部分切除和区域淋巴结清扫。肝脏实质的切除范围应参照胆囊癌的根治指南[10],T1b期胆囊床肝实质楔形整块切除(距胆囊床至少2 cm),T2期行肝S4b+S5的联合肝段整块切除,T3期行半肝切除或扩大半肝切除。胆囊癌淋巴结清扫通常是指门静脉、肝十二指肠韧带、胆总管周围、肝门区域的淋巴结的清扫。(3)对于术后病理检查确诊的意外胆囊癌(一般常规病理确诊需要1周左右),术者应尽快联系家属,对前次手术的病理切片全面复诊,并进行二次术前检查评估。对Tis-T1a期的胆囊癌无需再次行手术治疗,单纯胆囊切除即可实现满意的预后;对≥T1b期的意外胆囊癌,需再次行根治性手术。再次手术的范围包括肝门、胰周淋巴结清扫和肝脏楔形切除或Ⅳb/Ⅴ段肝切除。胆囊切除术后行再次手术时间一般为4~8周。
1.3 观察指标
1.3.1 基础指标术前因素包括性别、年龄、BMI、是否合并基础疾病(糖尿病、高血压)、胆道结石。
1.3.2 血液学指标患者术前常规进行血液学检查,排除相关手术禁忌证。评估的血液学指标包括血清钠(Na+)、尿素氮(blood urea nitrogen,BUN)、肌酐(creati‐nine,Cr)、白蛋白(albumin,ALB)、TBil、DBil、ALT、AST、ALP、WBC、Hb、PLT、国际标准化比值(international nor‐malized ratio,INR)、PT、D-二聚体(D-dimer,D-D)、糖类抗原19-9(carbohydrate antigen19-9,CA19-9)。
1.4 统计学处理采用SPSS 26.0统计软件。正态分布的计量资料以表示,组间比较采用两独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验;计数资料以例(%)表示,组间比较采用χ2检验,等级资料组间比较采用非参数检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基础指标的比较观察组患者年龄、合并BMI、合并糖尿病比例均明显高于对照组,差异均有统计学意义(均P<0.05);但两组患者性别、合并高血压病、胆道结石比例比较差异均无统计学意义(均P>0.05),见表1。

表1 两组患者基础指标的比较
2.2 两组患者血液学指标的比较观察组患者ALB水平明显低于对照组,AST、ALP、D-D水平及CA19-9异常比例明显高于对照组,差异均有统计学意义(均P<0.05);但两组患者Na+、BUN、Cr、TBil、DBil、ALT、WBC、Hb、PLT、INR、PT指标比较差异均无统计学意义(均P>0.05),见表2。
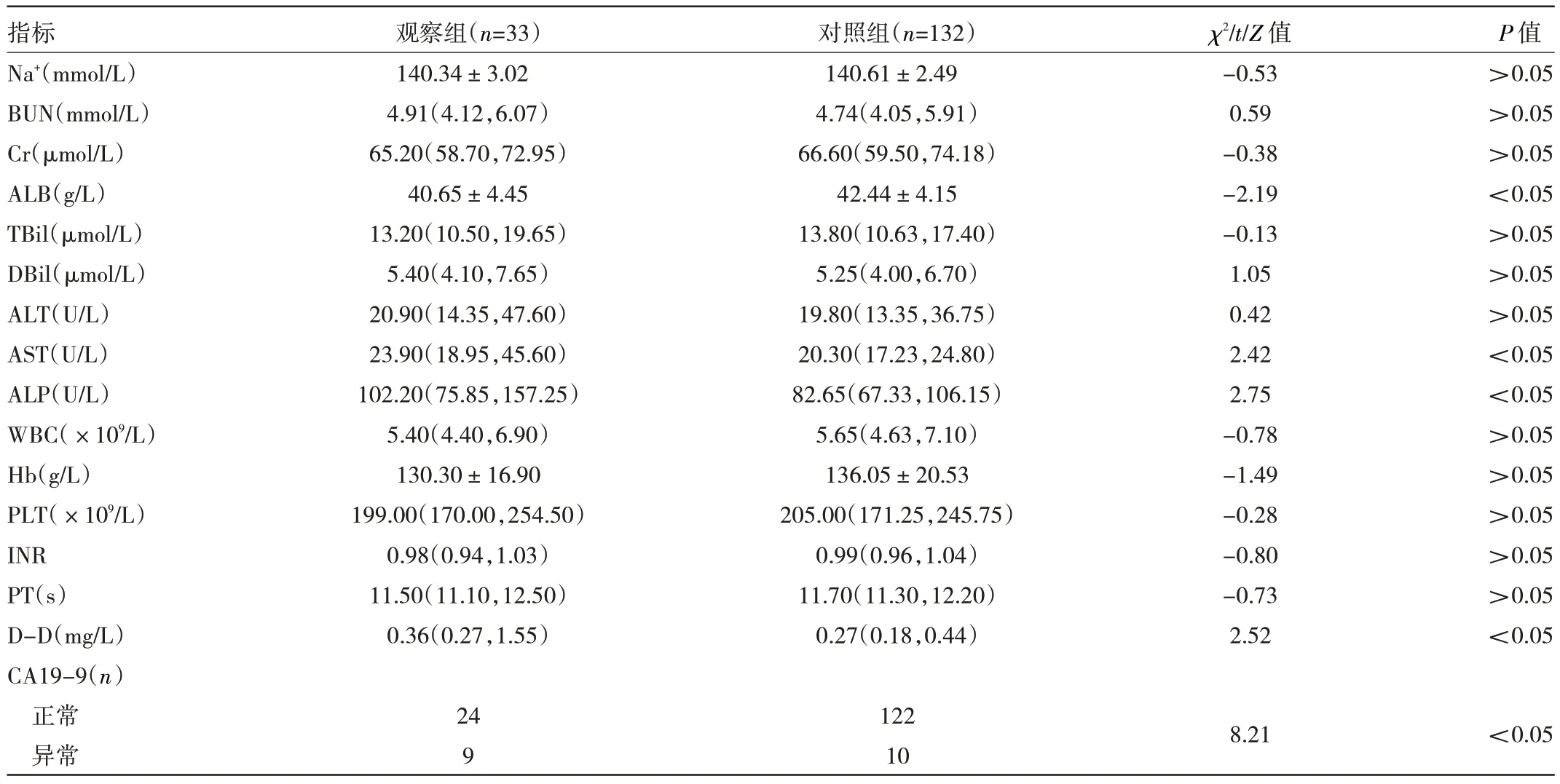
表2 两组患者血液学指标的比较
3 讨论
胆囊癌是一种侵袭性恶性肿瘤,预后较差[11]。由于特殊的解剖位置和非典型的临床症状,胆囊癌的早期诊断率和术前诊断率都不高。慢性细菌感染、原发性硬化性胆管炎、胰胆管异常连接以及胆囊息肉等因素与发生胆囊癌的高风险相关。然而,尽管存在理论上的危险因素,但只有三分之一的胆囊癌在术前被发现。目前指南建议在胆囊切除术后诊断T1b、T2和T3期的意外胆囊癌患者,需要再次切除部分肝组织和区域淋巴结,手术目的是实现R0切除。有研究发现,卡培他滨辅助治疗可改善肿瘤患者预后,但需进一步研究确定再切除术前新辅助化疗的作用[12]。
本研究中,意外胆囊癌和胆囊结石分别为33例(0.41%)和7 977例(99.59%)。评估两组患者基础指标发现,观察组患者年龄、BMI、合并糖尿病比例均明显更高。此前已有研究证实年龄可作为意外胆囊癌预测因子的相关报道,Pitt等[13]发现65岁或以上患者患意外胆囊癌的可能性是65岁以下患者的5.3倍,Koshenkov等[14]则发现65岁或以上患者患意外胆囊癌的可能性是65岁以下患者的10.6倍。而根据相关研究估算,每年有超过80万例新发癌症病例是由于高BMI和糖尿病组合造成的,这些因素增加了结直肠癌、乳腺癌、胆囊癌等6种特定部位癌症的风险[15]。高BMI、糖尿病和癌症之间联系的生物学机制包括高胰岛素血症、高血糖、慢性炎症和性激素活动失调。
超声和CT检查尽管可作为诊断胆囊癌的初步检查,但很难将胆囊癌与胆囊结石、萎缩性胆囊、息肉样胆囊癌和良性胆囊息肉相区分。本研究结果显示,观察组患者ALB水平明显低于对照组,但AST、ALP、D-D水平及CA19-9异常比例明显更高(均P<0.05)。ALP是反映营养和炎症状态的生物标志物,低蛋白血症是胆囊癌全身炎症反应的结果。营养不良和炎症抑制了肿瘤或周围细胞产生的ALB、IL-6的合成,刺激了CRP和Fib水平的升高。D-D是由纤溶酶介导的纤维蛋白降解产物,提示其激活止血和纤溶。肿瘤细胞可以通过产生促凝血因子来激活凝血系统,从而导致身体的高凝状态。由于促凝状态增强,纤溶系统随后被激活,因此纤维蛋白降解产物(包括D-D)在体内的表达明显增加。CA19-9是胆囊癌中最常用的肿瘤标志物,具有最高的灵敏度和相对较低的特异度。Kong等[16]研究认为,D-D和CA19-9两种生物标志物的联合诊断价值相对较高,可指导胆囊癌的早期检测。ALP水平升高一般预示着肝病、肝炎、胆道梗阻等,本研究中,ALP水平升高可能与疾病进程和胆囊炎的存在有关。Pitt等[13]同样发现,相较于良性胆囊疾病患者,意外胆囊癌组中ALP、AST升高的发生率明显更高。令人遗憾的是,尽管潜在的恶性肿瘤应始终存在差异,但ALP水平的升高(伴或不伴其他肝功能指标的升高)是非特异性的。
综上所述,早期胆囊癌难以诊断,临床医师通常忽略良性胆囊疾病患者中胆囊癌的存在,这导致意外胆囊癌的发病率较高。当胆囊结石患者年龄较大(>65岁)、BMI偏高、合并糖尿病,并且AST、ALP、D-D、CA19-9水平升高、ALB水平降低时,外科医师应怀疑意外胆囊癌的可能。术前有效识别意外胆囊癌风险较高的患者,可以让外科医师有更充分的准备来进行R0切除。
