滇重楼多糖对小鼠胃肠动力的影响
2023-08-09沙爱龙熊彬冰李媛媛张尚红王韵钦任盈盈梁婷
沙爱龙 熊彬冰 李媛媛 张尚红 王韵钦 任盈盈 梁婷
文章编号:1003?6180(2023) 03?0053?05
摘 要:通过比较正常小鼠與滇重楼多糖组小鼠胃排空率、小肠推进率、十二指肠收缩活动的差异,研究滇重楼多糖对小鼠胃肠动力的影响.实验结果表明,低剂量滇重楼多糖极显著促进小鼠胃排空率(P<0.01),中剂量极显著抑制小鼠胃排空率而促进其小肠推进率(P<0.01),高剂量极显著延缓小鼠胃排空率和小肠推进率(P<0.01).离体实验结果表明,滇重楼多糖低、中剂量组兴奋十二指肠收缩幅度,而高剂量组极显著抑制十二指肠收缩幅度(P<0.01).滇重楼多糖对小鼠胃肠动力具双向调节效应,且最适浓度位于中、高剂量间.
关键词:滇重楼多糖;离体肠;在体;胃肠动力
[ 中图分类号 ]TS202.3 [ 文献标志码 ] A
Effect of Paris polyphylla Polysaccharide on Gastrointestinal
Motility in Mice
SHA Ailonga*, XIONG Binbingb, LI Yuanyuana, ZHANG Shanghonga,
WANG Yunqina, REN Yingyinga, LIANG Tinga,
(Chongqing Three Gorges University a.School of Teacher Education; b. School of biology and food engineering, Chongqing 404120, China)
Abstract: By comparing the gastric emptying rate, intestinal motility and duodenum contractile activity between normal mice and Paris polyphylla Polysaccharides-treated mice, study the effect of Paris polyphylla Polysaccharide on gastrointestinal motility in mice. The results showed that the Paris polyphylla Polysaccharide in the low-dose group could significantly promote gastric emptying in mice (P<0.01), the medium-dose Paris polyphylla Polysaccharide could significantly delay gastric emptying while promote gastric emptying (P<0.01), and in the high-dose Paris polyphylla Polysaccharide gastric emptying and intestinal motility were delayed in mice (P<0.01). Ex-vivo study showed Paris polyphylla Polysaccharide in the low, medium-dose groups induced duodenum contractile action, while Paris polyphylla Polysaccharide in the high-dose groups induced significantly relexation (P<0.01). Paris polyphylla Polysaccharide directionlly regulated the gastrointestinal motility, and the optimal concentration was between medium and high dose.
Key words: Paris polyphylla Polysaccharide; intestine in vitro; in vivo; gastrointestinal motility
滇重楼[Paris polyphylla var.Yunnanensis(Franch.)Hand.-Mazz.]为百合科(Liliaceae)重楼属(Paris)多年生草本植物,主要分布于云南、四川、贵州等地.[1]百合科具重要的观赏、饲用、药用、食用价值,滇重楼为百合科一员[2],具有“消肿止痛、凉肝定惊、清热解毒”等功效,亦是云南白药、宫血宁等中成药的重要原料.[3]滇重楼多糖是滇重楼实体中的重要有效成分,作为一种天然的生物活性物质,其最大的优点是对细胞无毒副作用,在食药领域有着巨大的潜在应用前景.滇重楼多糖可作为保健食品添加剂,用于延缓衰老、抗氧化、增强人体免疫力,也可根据其不同的生物学活性制成保肝护肝、降血脂等新型药物.[4]目前关于滇重楼多糖在胃肠动力方面的研究尚未见报道.植物多糖可作为食品添加剂影响胃肠运动功能,如黄精多糖通过调节糖尿病鼠的肠道菌群而起到一定的改善病情的作用[5];麦冬、大蒜、知母等多糖可一定程度增加小鼠肠道益生菌的数量并改善肠道微生态菌群多样性,促进肠道益生菌的增殖.[6-8]本实验拟通过比较正常小鼠与滇重楼多糖组小鼠胃排空率、小肠推进率、十二指肠收缩活动的差异,研究滇重楼多糖对小鼠胃肠动力的影响,为进一步开发利用滇重楼提供实验依据.
1 材料与方法
1.1 实验动物
小鼠46只(18~22 g),雌雄不拘,购于湖南斯莱克景达实验动物有限公司.
1.2 试剂与仪器
滇重楼多糖(乐美天医学/德斯特生物公司生产,批号:DS0190911-170);高级蓝黑墨水(香型)购自贵州博士化工有限公司;BL-420F生物信号采集处理系统(成都泰盟软件有限公司);张力换能器(成都泰盟软件有限公司);HW-400E恒温平滑肌槽(成都泰盟科技有限公司);电子天平(上海民桥精密科学仪器有限公司).
乐氏液的制备.取9 g NaCl,0.42 g KCl,0.24 g CaCl2,0.2 g NaHCO3,1 g葡萄糖,加入1 000 mL蒸馏水.
1.3 实验方法
1.3.1 动物分组与给药方法
40只小鼠随机分为正常组和低、中、高剂量实验组,每组10只.低、中、高剂量实验组按0.2 mL/10 g的剂量灌胃100,200,400 mg/kg的滇重楼多糖;正常组灌胃等量生理盐水.连续灌胃15天,灌胃期间各组小鼠自由进食、饮水.
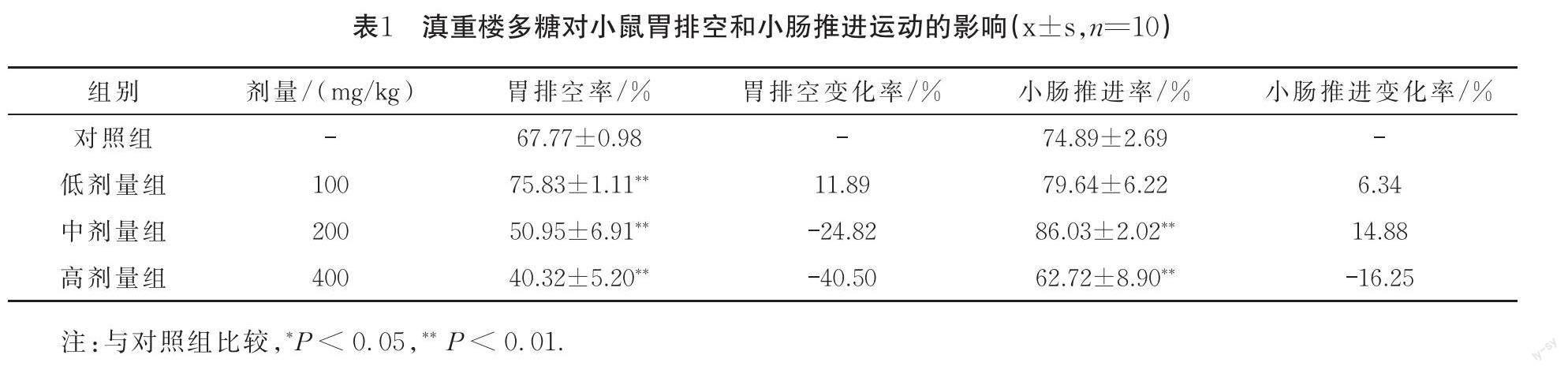
1.3.2 滇重楼多糖对小鼠胃排空和小肠推进运动的影响
末次给药前,各组小鼠禁食12 h.灌胃给药30 min后,每只再灌胃0.1 mL墨水,20 min后颈椎脱臼处死小鼠,迅速打开腹腔,结扎胃贲门和幽门,并在结扎处进行全胃切除,滤纸擦干称全重.沿胃大弯剪开胃体,洗去胃内容物,擦干称净重.取出小肠,测量小肠全长及幽门至蓝黑墨水推进的距离.计算胃排空率和小肠推进率及其变化率.胃排空率(%)=1-(胃全重-胃净重) /胃全重]×100%;小肠推进率 (%)=幽门至蓝黑墨水前端距离/小肠总长度×100%;胃排空/小肠推进变化率(%)=(实验组平均胃排空率或小肠推进率—对照组平均胃排空率或小肠推进率)/对照组平均胃排空率或小肠推进率×100%.
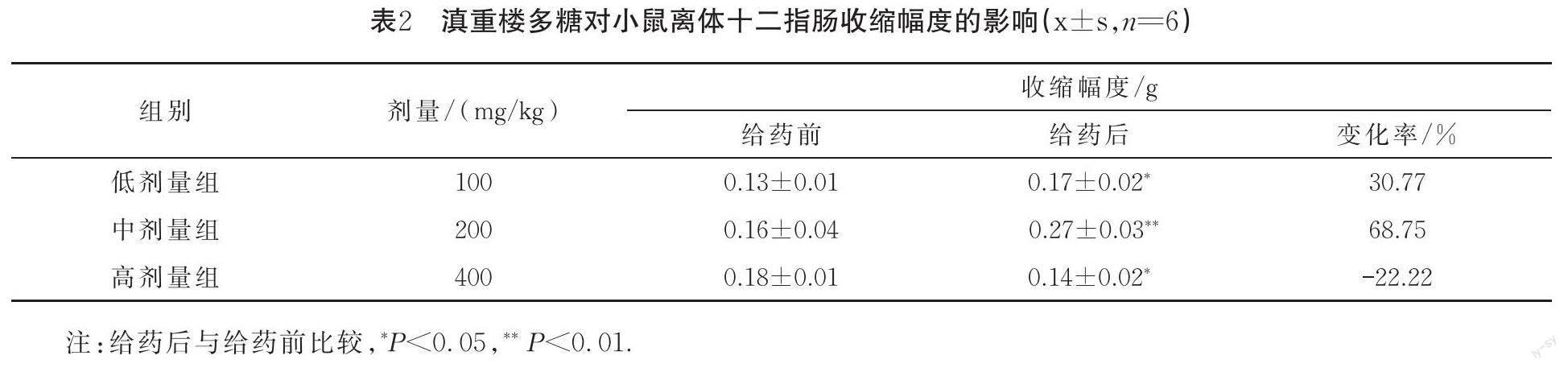
1.3.3 滇重楼多糖对小鼠离体十二指肠收缩活动的影响
另取小鼠6只,颈椎脱臼处死,迅速剖开腹腔取十二指肠,分离肠系膜,将离体肠置于乐氏液中反复洗净,制备2~3 cm肠段.两端穿线结扎,下端固定于恒温平滑肌槽试验管底端L型钩上,上端连于张力换能器弹性梁上.向恒温平滑肌槽内通气,调节速度为每秒钟出现1~2 个气泡.稳定10 min后,开始试验.先加入低剂量滇重楼多糖,记录观察后用乐氏液冲洗3次,待曲线恢复后依次加入中、高剂量滇重楼多糖.通过生物信号采集处理系统采集,记录肠段收缩曲线的变化,并计算收缩幅度和收缩频率变化率.收缩幅度变化率(%)=(加藥后平均收缩幅度—加药前平均收缩幅度)/加药前平均收缩幅度×100%;收缩频率变化率(%)=(加药后平均收缩频率—加药前平均收缩频率)/加药前平均收缩频率×100%.
1.3.4 数据统计及分析
数据以平均值±标准差表示,采用SPSS 19.0软件分析.组间数据采用t检验,P<0.05为统计学差异显著,P<0.01为统计学差异极显著.
2 实验结果
2.1 滇重楼多糖对小鼠胃排空和小肠推进运动的影响
与对照组比较,低剂量组滇重楼多糖有促进小鼠胃排空和小肠推进作用(胃排空作用P<0.01).中剂量组滇重楼多糖极显著抑制小鼠胃排空作用(P<0.01),但极显著促进小鼠小肠推进运动(P<0.01).高剂量组滇重楼多糖极显著抑制小鼠胃排空和小肠推进运动(P<0.01),且对于胃排空作用来说,高剂量组较中剂量组抑制效果更为明显,见表1.
2.2 滇重楼多糖对小鼠离体十二指肠收缩幅度的影响
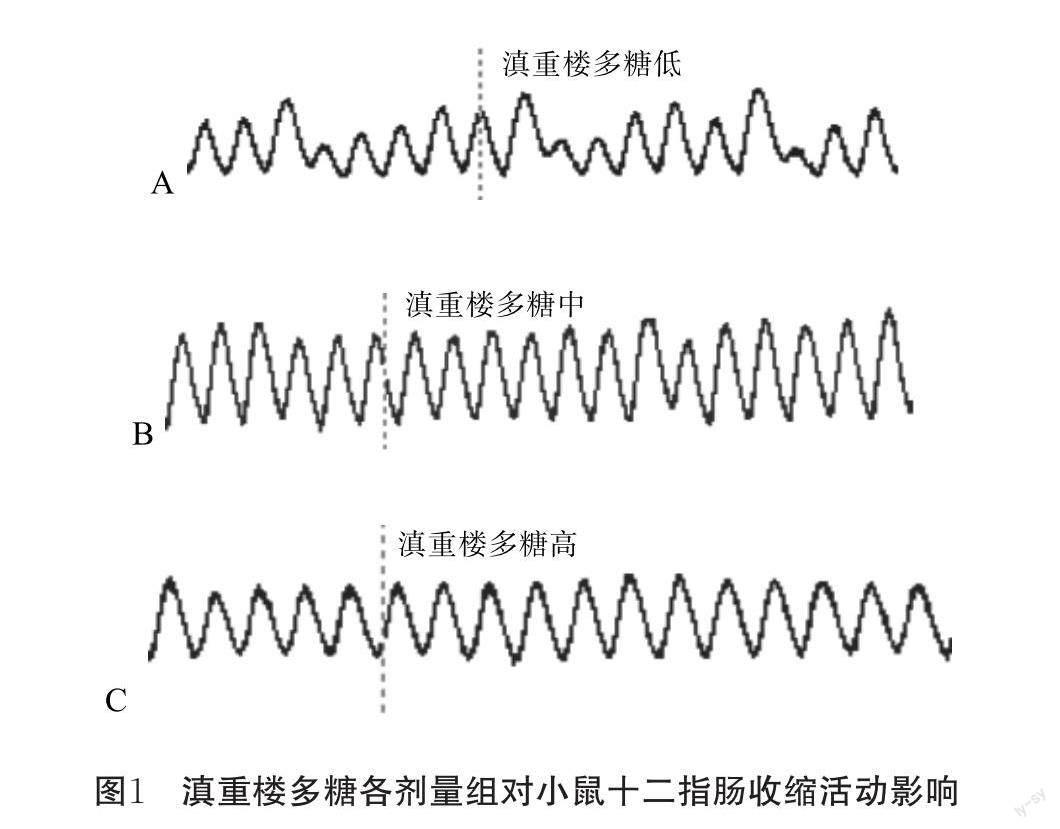
与给药前相比,低、中剂量组滇重楼多糖均能促进小鼠离体十二指肠收缩幅度(其中低剂量组P<0.05,中剂量组P<0.01),中剂量滇重楼多糖促进率高达68.75%.高剂量组滇重楼多糖呈显著抑制作用(P<0.05),见表2和图1.
2.3 滇重楼多糖对小鼠离体十二指肠收缩频率的影响
与给药前相比,低剂量组滇重楼多糖促进小鼠离体十二指肠收缩频率,而中、高剂量组呈抑制作用,但影响均不显著(P>0.05),见表3和图1.
3 讨论
研究结果表明,低剂量滇重楼多糖极显著促进小鼠胃排空,而高剂量明显延缓小鼠胃排空,抑制小肠推进,与于红珍[9]等研究蒙药肋柱花低、高剂量组对小鼠胃排空和小肠推进双向调节的影响结果相一致,说明滇重楼多糖对小鼠胃肠运动为双向效应.黄彦峰[10]等认为,低剂量滇重楼水提液促进小鼠小肠推进率而抑制其胃排空率.本研究表明,高剂量滇重楼水提液和多糖均能抑制小鼠小肠推进率和胃排空率,说明低剂量滇重楼多糖比其水提液对胃肠运动的促进作用更强,由此证实多糖是滇重楼中影响胃肠运动的主要有效成分.黄彦峰[10]等构建小鼠胃排空、小肠推进亢进及抑制急性模型,表明滇重楼水提液对胃肠运动功能影响与M胆碱能受体、肾上腺素能系统有关,推测多糖对其影响同样与自主神经介导的消化道内神经递质和受体有关,其具体机制有待进一步深入研究.
笔者认为,由于唾液淀粉酶、胰淀粉酶、双糖酶可将多糖消化为二糖或单糖,因而当滇重楼多糖到达小肠时发挥药效的药物剂量明显低于灌胃剂量,导致胃和小肠运动变化不同.因低剂量均促进胃肠运动,推测当中剂量多糖到达小肠后药物浓度大致与低剂量灌胃浓度相当;胃和小肠结构、机能状态存在一定差异,对滇重楼多糖具有不同的反应效果,导致二者影响程度和变化不同;滇重楼多糖影响生长抑素、胃泌素、胃动素等胃肠激素的分泌,从而影响胃排空.滇重楼多糖通过影响自主神经节后纤维末梢处胆碱能或肾上腺素能神经递质的释放,进而影响其与胃肠细胞膜上相应受体的结合而影响胃肠运动.
滇重楼多糖对小鼠离体十二指肠的收缩都有影响.各剂量组滇重楼多糖对离体肠收缩频率都有些许影响,但影响均不显著.对于收缩幅度而言,低、中剂量组的滇重楼多糖对其具有兴奋作用,而高剂量却具有抑制作用.小鼠离体十二指肠虽失去外来神经的支配,但其活动仍受肠神经系统调控,且小肠平滑肌的舒缩依赖于细胞内Ca2+剂量的变化.笔者推测滇重楼多糖可在一定程度上促进小肠平滑肌细胞出现去极化,引发细胞外Ca2+内流,从而促进十二指肠收缩.中剂量促进效果可高达68.75%,推测该剂量多糖可与小肠细胞膜上的受体结合激发胞内信号转导通路叠加进而产生代偿效应.代偿效应的作用逐渐被放大且足以弥补钙离子超负荷引起的损伤,进而使平滑肌呈现逐渐兴奋的状态.但当剂量增至高剂量时,推测钙稳态严重失调,代偿效应无法弥补其引起的损伤,因而此时十二指肠收缩呈抑制状态.这与王婧[11]等研究银杏叶提取物对小鼠离体小肠平滑肌收缩幅度的影响结果一致,进一步验证了滇重楼多糖对小鼠胃肠运动的双向效应.结合本实验,说明滇重楼多糖对胃肠运动的最适浓度很可能介于中、高浓度间.
综上,滇重楼多糖对小鼠胃肠运动具双向调节作用,且介于中高浓度间的药效可使胃肠运动既不过于兴奋也不过于抑制,具益生元效应.滇重楼多糖有望用于胃肠动力紊乱和功能性消化不良等疾病治疗药或保健品的研发.多糖作为药食同源佳物,通过提高肠道菌群的丰富度和多样性,改变菌群物种组成结构,进而达到改善胃肠功能的作用[5-7].多糖是由许多相同或不同的单糖通过糖苷键连接而成的化合物[12],滇重楼多糖亦是如此,主要含有葡萄糖、甘露糖、半乳糖、鼠李糖和阿拉伯糖[13],均有益于乳杆菌和双歧杆菌等益生菌的生长[14],推测滇重楼多糖可通过调节肠道菌群,从而介导胃肠动力.
参考文献
[1]孟巍,杜娟,陈涛.重楼的化学成分及其抗肿瘤机制[J].生命的化学,2020,40(1):70-74.
[2]李彪,巩红冬,刘汉成.甘肃省百合科饲用植物资源调查[J].牡丹江师范学院学报:自然科学版,2023(1):47-52.
[3]蔡艳妮.重楼多糖的化学修饰及体外活性研究[D].西安:陕西理工大学,2018.
[4]申世安.滇重楼多糖的分离纯化与结构鉴定及其生物活性研究[D].成都:四川农业大学,2017.
[5]楊明琛,袁梦欣,陆维,等.黄精多糖体外消化特性及对Ⅱ型糖尿病小鼠肠道菌群的调节作用[J].现代食品科技,2021,37(8):14-21.
[6]石林林,王源,冯怡.麦冬多糖MDG-1对膳食诱导肥胖模型小鼠肠道益生菌群多样性影响的研究[J].中国中药杂志,2015,40(4):716-721.
[7]张浩琪,魏华琳,刘宾,等.大蒜多糖对小鼠肠道微生态的益生元功能研究[J].中国微生态学杂志,2012,24(2):134-138.
[8]陈君诚.知母多糖的结构鉴定、降血糖机制及其对肠道菌群的影响[D].广州:华南理工大学,2021.
[9]于红珍,额尼荣贵,包特日格乐,等.蒙药肋柱花对小鼠胃肠动力双向调节功能的研究[J].中国临床药理学杂志,2022,38(17):2028-2033.
[10] 黄彦峰,何显教,晋玲,等.重楼水提液对小鼠胃肠运动功能的影响[J].医药导报,2014,33(4):442-445.
[11]王婧,潘盛武,杨盛昌.银杏叶提取物对小鼠离体小肠平滑肌收缩特性的影响[J].四川动物,2009,28(3):382-385.
[12]倪福太,庄妍.植物多糖研究进展[J].牡丹江师范学院学报:自然科学版,2010(4):34-36.
[13]王骞.中国西南地区滇重楼资源品质评价[D].大理:大理大学,2019.
[14]Sanders ME, Merenstein DJ, Reid G, et al. Probiotics and prebiotics in intestinal health and disease: from biology to the clinic [J]. Nat Rev Gastroenterol Hepatol. 2019, 16(10): 605-616.
编辑:琳莉
