医院新技术准入管理的个案研究
2023-08-08吴朝阳韩薇刘风和
吴朝阳 韩薇 刘风和
随着人口老龄化的发展,主动脉瓣狭窄已成为继冠心病、高血压后最常见的心脏疾病之一。经导管主动脉瓣置换术(transcatheter aortic valve implantation,TAVI)的出现为原本失去外科手术机会或外科手术风险较高的老年患者提供了一种有效的、创伤更小、恢复更快的治疗选择。TAVI作为外科主动脉瓣置换术的一种微创替代方法,已经成为近30年来心血管疾病领域突飞猛进的新技术。《医疗技术临床应用管理办法》[1]第十二条规定未纳入禁止类、限制类医疗技术名录的医疗技术,医疗机构可以根据自身功能定位、技术服务能力等条件自行决定开展。此类未纳入禁止和限制类的、具有国内引领性的医疗新技术准入管理一直是医疗机构新技术审查的难点,研究者通过对首都医科大学附属北京安贞医院经导管主动脉瓣置换术新技术准入历程进行回顾与介绍,梳理并分析准入过程中的关键节点及要点,并提出管理建议,期待对同类具有引领的新技术准入提供可参照的范本。
1 背景介绍
1.1 TAVI应用进展
据不完全统计,中国现有150万左右患有严重主动脉瓣狭窄,其中高危患者20万例,中危患者30万例。经导管主动脉瓣置换术的首例动物实验开展于1992年,随着动物实验的不断深入,经皮主动脉瓣膜置换术成功应用于人体。CRIBIER等[2]在2002 年12 月完成世界首例人体经皮主动脉瓣膜置换术。2019年美国纽约哥伦比亚大学医学中心的PARTNER Ⅲ研究[3]和有关美敦力公司的Evolut瓣膜的Evolut 研究[4]公布该术式的临床研究结果,研究表明对于低危主动脉瓣狭窄患者,TAVI 术式组在住院患者死亡率、并发症发生率等优于常规的开胸术式,正是基于以上循证医学证据,美国和欧洲的卫生行政管理部门将TAVI的适应证从2019年起开始扩展为可以在低危的主动脉狭窄患者上应用。2010 年10月上海复旦大学附属中山医院葛均波院士率先在国内开展TAVI手术[5],随后,由于瓣膜器材的限制,TAVI在国内没有得到很好的开展。随着医务和科研人员的深入研究,2012 年,我国国产瓣膜产品Venus A开始临床试验,该款瓣膜产品拥有国内首个自主知识产权,共完成7例患者入组;2015 年,中山大学的葛均波院士与浙江大学第二附属医院的王建安教授等共同组织相关领域专家编写了《经导管主动脉瓣置换术中国专家共识》[5]。2017 年,杭州启明医疗研发的经股动脉Venus A瓣膜产品和杰成医疗研发的经心尖J Valve瓣膜产品获得国家药监管理部门批准上市。2018年,中山医院的王春生教授等组织该领域的临床专家编写了《中国经导管主动脉瓣置入术(TAVI)多学科专家共识》[6]。长海医院的徐志云教授、陆方林教授等牵头开展的介入三尖瓣Lux瓣膜产品开始临床入组[6];阜外医院的胡盛寿教授、安贞医院的孟旭教授牵头的Mitral Stich 介入瓣膜产品开始临床试验[7]。2019 年,经股动脉途径的Vita flow 瓣膜产品获批上市;2022年中国心血管健康大会瓣膜中心年度总结会显示,2022年度截至11月份,全国已开展TAVI手术7 242例。
1.2 北京市新技术准入管理政策
在2009年国家卫生行政管理部门印发的医疗技术临床应用管理办法后,北京市公布了首批第二类临床应用医疗技术名录,合计21项,2012年制定了相关技术的管理规范,涉及16项,同年在北京市范围内开展医疗技术临床应用审核和登记工作。
2016年北京市卫生行政部门印发了《关于做好重点医疗技术临床应用有关管理工作的通知》[8],按照文件要求:《北京市重点医疗技术(2016版)》16项和国家卫健委公布的《限制临床应用的医疗技术(2015版)》作为北京市首批需要备案管理的限制类医疗技术目录。其中北京市作为备案管理的限制类医疗技术名录中,并不含经导管主动脉瓣置换术,根据《医疗技术临床应用管理办法》[9]第十二条规定未纳入禁止类技术和限制类技术目录的医疗技术,因此医院可以根据自身功能的定位、学科实力、技术能力等因素审核是否准予院内开展。
2 首都医科大学附属北京安贞医院经导管主动脉瓣置换术的准入过程
2.1 审查的内容
2017年3月8日,首都医科大学附属北京安贞医院心脏外科瓣膜诊疗中心向医务处提出了新技术临床应用申请(审查流程见图1 ),按照首都医科大学附属北京安贞医院卫生技术评估(HB-HTA)申请表要求,提交审查内容包括:该技术项目目前该项技术在国内外进行了临床试验、临床研究及是否获准临床应用的基本情况;涉及该技术的医疗器械、耗材的适应证和禁忌证;支持该项技术开展的重要的参考文献、循证医学证据的强度;国内外有关该技术的卫生监管部门技术评估情况的介绍;对有关该技术开展的伦理和对患者影响的评估;与治疗同种疾病的其他医疗技术比较(包括不限于风险、疗效、费用等方面);该技术的有关的诊疗指南及操作规范;目前开展科室及术者所具备技术服务力量(包括是否进行相关的学习及培训)、参与同类技术临床试验的情况、相关科室的人力配备和设施支持情况;否适用于当前医院的硬件配置;是否将影响医院的其他科室或部门;该项技术预见的风险评估及应急处理预案等内容。

图1 医院新技术准入管理流程图
2.2 医务处的形式审查
由医务处进行初步的形式审查,依据首都医科大学附属北京安贞医院医疗技术委员会工作制度,确认为新技术准入受理范围内,各项审查资料的完整性。
2.3 常设委员的职责
常设委员由医疗管理部门、护理管理部门、医院感染管理部门、物价管理部门、医保管理部门、器械管理部门负责人担任。主要对申请项目符合卫生行政法规、诊疗技术常规,涉及项目的技术监管政策要求、医护协作条件、相关专业人员支持、院感防控、涉及器械的消毒指导、涉及项目是否有现行的物价收费,医保政策的前置审查,确保在新技术应用期间依法依规。审查的意见在发放的医疗技术临床应用同意书中详细表述,作为今后该项技术日常监管依据。
2.4 专业委员的职责
由5名首都医科大学附属北京安贞医院相关临床专业主任医师(博导)、2名院外相关领域医师组成的评价小组,对医疗技术的临床应用有效性、可行性、安全性进行和议评估,对应急预案措施的完整性、科学性、及时性进行讨论和议评估;对患者知情同意书告知内容的语言通俗易懂、风险全面告知方面、替代诊疗方案讨论和议评估,拟应用新技术的病例适应证和禁忌证进行全面审查并出具书面评估意见,委员会秘书如实记录。
2.5 伦理委员会审查
伦理委员会对临床提请审查的新技术进行审核:审查要点包括以下内容:知情同意告知方面是否全面、控制风险方面是否合理、是否有相应的补偿、患者隐私保护方面、发生不良事件的责任赔偿方面。
2.6 审查后的管理
医疗技术委员会、伦理委员会经过和议做出了如下审查决定:该技术具有临床应用前景,从前期的临床试验及外院患者术后随访结果看,对于适应证范围内的患者临床获益明显,为了保障整个技术的安全开展,批复文件中要求,该技术的院内首位应用患者,需请院外有过经验的术者共同参与手术(参照会诊手续办理);术前知情同意过程请医务处、医院法律顾问全程参与、录像;为患者购买手术意外险;心内科介入专家共同参与手术以备应急处置;保障血液供应;护理、麻醉、超声等协作科室固定业务水平较高的人员共同参与手术;术中有可能应对不良事件的科室明确在岗并备班;手术后患者情况的评估及出院后的短期随访等病历资料一同提交医院质量安全委员会;自批准之日起1年内如需再次开展,同样需获得医院技术委员会审批;项目开展2年内,相关患者结局、并发症情况需定期提交医院质量安全委员会。项目开展至2022年底,累计完成手术853例,目前已经稳定在年均200余例,死亡率低于1%,器械成功置入率在90%以上,瓣周漏并发症小于30%。
3 讨论
3.1 新技术审查的经验及思考
本新技术的从申请到最终发放同意批复同意书历时52 d,其中常设委员召开讨论会4次、专业委员会会议讨论3次、伦理委员会讨论2次,最终形成的完成新技术审查的书面材料276页。其中审查的经验及要点包括以下几个方面:一是循证医学证据收集及评价,包括国内外最新的研究论文、专家共识、证据的等级;国内前期开展此类手术的情况、并发症的情况、随访结果;临床试验开展情况。二是TAVI手术的多学科协助,包括心内科、心外科、手术室、超声科、影像科、体外循环科、介入科、麻醉科、输血科,需要更加完善、细化不良事件的处置预案,保障术中的患者安全。三是手术患者的高度选择,病历资料一同由审查委员会审查,按照目前现有的指南、专家共识严格筛选适应证合适、手术耐受性良好、预后较好的患者。四是首都医科大学附属北京安贞医院TAVI的开展由一位副院长、一位中华医学会胸心外科分会学组组长共同负责,担任“总协调人”。医疗技术委员会专职秘书负责具体协调,根据常设委员会、专业委员会的意见,跟进协调,保障患者的术前、术中、术后随访等各个环节。
3.2 临床研究与临床应用的界限
与药物治疗不同,外科治疗具有侵入性、复杂性、个性化、与术者操作技能高度相关等特点[10]。因此不能简单参照评估药物的方法学框架评价外科的创新技术。有关外科研究进展的框架图有助于理解外科治疗的发展历程。
2007—2009年,由牛津大学组织相关领域专家发起并共同提出了“IDEAL 框架与建议”针对新的外科手术操作、有创医疗器械的干预措施建立全面、严谨的评价路径[11-12]。
IDEAL框架将外科干预的评价分为5个阶段,代表了从提出概念到技术验证再到广泛临床应用的全生命周期管理(见表1)。这5个阶段分别为:第1阶段是设计阶段,包括新技术的定义以及该新技术的必要性。第2阶段是开发阶段:包括该新技术的稳健性和可重复性。第3阶段是探索阶段,包括该新技术的适应证,收益人群,明确能否开展临床随机对照试验。第4阶段是评价阶段,与现有的治疗相比,该技术的有效性及安全性是否显著。第5阶段是长期随访阶段,该外科创新是否存在任何不良事件,其适应证或临床长期结局质量是否在未来发生变化。

表1 IDEAL框架内容概要表
经导管主动脉瓣置换术在国内开展已经近20年了,2019 年,Vita flow 瓣膜获批上市后,全国范围内心脏内外科医师累计完成TAVI 术式超过2万余例。这些新技术根据首都医科大学附属北京安贞医院的经验,一是如果手术用的器材未上市,应严格按照注册试验管理。二是如果手术用的器材已经上市,手术涉及的非物质层面的临床技术,应详细进行文献的回顾,国内外循证医学证据的搜集,查阅有关此类技术的卫生技术评估报告,医院应根据本专业在国内的学科定位,术者的经验能力,详尽评估项目开展的获益及风险。
3.3 具备新技术临床应用能力的医师审核
一项新技术的开展,具备临床应用能力的医师是关键,TAVI手术的开展需要多个相关学科临床专家共同参加[13],包括适应证的确定、患者的筛选、手术器械的选择、手术方式的选择、可能的并发症、围手术期管理、术后护理、术后康复、出院后随访等诸多环节,心脏团队成员的学术知识应不断更新。WEBB 等[14]报道进行瓣膜植入技术的学习曲线至少需要25 例的经验积累,植入成功率可以由78% 提高到96%。因此在新技术审查阶段,医院技术管理委员会应该严格审核医师的临床应用能力,在开展的前期要保证整个医疗团队的稳健性。如有人员变更,应对该技术的实施条件重新评估。
4 管理建议
4.1 省级层面规范临床研究向临床应用转化的管理
根据《医疗技术临床应用管理办法》,禁止开展临床应用安全性、有效性不确切或者存在伦理问题或者该技术已经被临床所淘汰或者未经临床研究充分论证的医疗技术。但是具体哪些技术属于禁止目录国家层面并未公布,上述条款仅是指导性原则,这对医院层面开展新技术造成了极大的难度[15]。尤其是针对那些拥有国家临床重点专科、学科,在各专业领域具有领导地位的医院,新技术准入的规范性与临床需求始终是现实存在的矛盾。一是建议应明确省内首次开展新技术的医疗机构、项目负责人资质,比如医疗机构应当拥该专业领域的国家临床重点专科,负责人应当具有至少担任国家一级学会专业委员会学组组长、副组长职务。二是本省范围内其他医疗机构拟开展该新项目应参加首批获批开展医疗机构的短期进修或者学习,或者外请首批医疗机构的术者参与手术,经过医师应用能力评价后可在本医疗机构开展。省级管理的重点应该是省内新技术首次临床应用的医院,其他医院随后有序开展,在开展过程中加强事中监管,注重管理体系建设,规范新技术审查工作[16-18]。
4.2 各专业协会定期公布具有临床应用前景的转化目录
应该充分利用各类专业协会(中华医学会、中国医师协会)各个专业委员会的学术领导地位,依据国家卫生行政部门的委托及本协会的章程,助力新技术的开展工作,开展医学科技转化决策论证,定期公布各专业领域具有临床应用前景的转化目录,指导、引导医疗机构开展新技术审查。
4.3 加强新技术准入与新增医疗服务收费项目的衔接
从整个医疗技术的发展周期看,临床研究一直为临床实践提供循证医学证据的支持,TAVI已经过了几十年的发展,随着术者操作技术水平和瓣膜介入产品的不断改进换代,新技术的临床应用效果取得了很大的进步, 器械植入的成功率越来越高,围手术期死亡、并发症显著下降。通过TAVI在北京市准入过程中的主要节点事件发现(见图2),2017年4月,首款经过NMPA认可的瓣膜系统获准上市;2018年11月,物价主管部门正式批复新增收费项目。在这期间,医疗机构是否可以开展该项技术,医务管理部门应秉持审慎态度,注重制度体系建设,既要严格审查管理规范,又不能采取“挂靠”等方式向患者违规收取手术费用,医院只能小规模开展临床应用[19]。
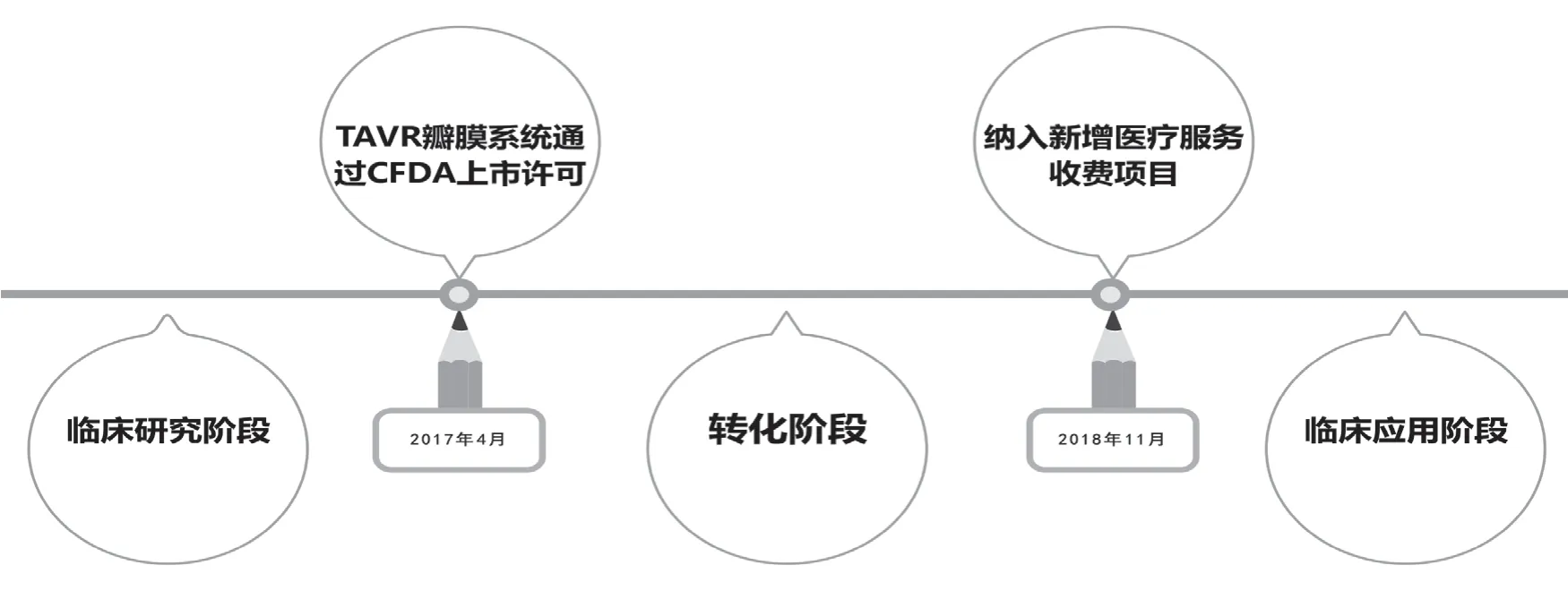
图2 北京市TAVI准入过程中的主要节点
综上所述,对于涉及新上市的器材产品的医疗新技术,更要尽早争取物价管理部门的支持,对具有临床应用前景的医疗新技术加快新增项目的物价审批,促进临床新技术的良性发展。
